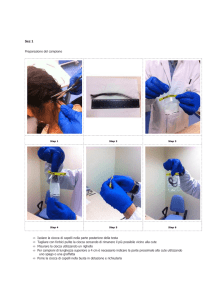
11
Questa nostra esperienza, iniziata il 27 giugno e
terminata l'8 luglio, è stata molto costruttiva. Durante
queste settimane abbiamo svolto il nostro stage nel
dipartimento di Chimica sotto la supervisione del nostro
tutor Davide Ravelli. Principalmente le nostre attività si
sono svolte nell'ambito della chimica verde (che in seguito
spiegheremo).
In due settimane abbiamo eseguito circa nove
esperimenti, durante l'esecuzione dei quali abbiamo
imparato molti aspetti interessanti dell'attività di
laboratorio. Ad esempio ci siamo divertite a preparare i
filtri a pieghe per filtrare i vari composti e abbiamo
imparato a conoscere la strumentazione tipica di un
laboratorio chimico.
Inoltre, è stato costruttivo osservare tutti quei fenomeni
strani che se non fosse stato per questo stage non
avremmo potuto osservare, come le varie trasformazioni
delle sostanze riguardanti il colore, il volume e la densità.
2
La Chimica Verde (in inglese Green Chemistry)
è un approccio etico fatto di criteri, di
priorità e di obiettivi, quindi a suo modo una
filosofia, che attinge dalla conoscenza
scientifica della chimica per guidare le
applicazioni di questa disciplina (ad iniziare da
quelle industriali) verso modalità sostenibili
dal punto di vista ambientale ed economico.
3
John C. Warner e di Paul Anastas tentarono di sistematizzare l’etica della
green chemistry, secondo 4 grandi idee fondanti:
1.
2.
3.
4.
Messa a punto di processi che massimizzino la quantità di materia
prima che entra a far parte del prodotto (quindi sprecare meno materie
prime e generare al tempo stesso meno sottoprodotti da smaltire;
ancora meglio se si riesce ad impiegare materie prime poco
trasformate, ovvero più grezze, come ad esempio nell’utilizzo del legno
nelle strutture edili e negli in oggetti domestici);
Impiego di sostanze chimiche (inclusi i solventi) sicure e “benigne” per
l’ambiente (o per lo meno ridurre l’impiego di quelle sostanze che
possono considerarsi giù implicitamente rischiose, anche senza
prevederne un impiego su larga scala);
Messa a punto di processi efficienti dal punto di vista energetico (un
po’ come i motori delle automobili di ultima generazione, che fanno più
chilometri con lo stesso litri di benzina);
La miglior forma di gestione dei reflui è quella in primo luogo di non
produrli (può apparire un’utopia, ma in alcuni casi è un obiettivo
perseguibile).
4
Sviscerando meglio questi 4 concetti fondanti, gli stessi Autori
hanno definito una lista di 12 principi “concreti”, in buona parte
criteri di azione, di orientamento e di priorità che, nel loro insieme,
costituiscono l’ossatura della green chemistry:
1)
2)
3)
4)
5)
6)
7)
La miglior forma di gestione dei reflui è quella in primo luogo di non
produrli;
I metodi di sintesi dovrebbero essere progettati per massimizzare
l’incorporazione di tutti i materiali utilizzati nel processo nel
prodotto finale;
Qualora sia possibile, le metodologie di sintesi dovrebbero essere
progettate in funzione dell’utilizzo e della generazione di sostanze
che abbiano poca o nessuna tossicità per la salute umana e
l’ambiente;
I prodotti chimici dovrebbero essere progettati per preservare
l’efficacia della loro funzione, riducendo nel contempo la loro
tossicità;
L’uso di sostanze ausiliarie (es. solventi, agenti di separazione, ecc)
deve essere reso non necessario ove possibile, ed innocuo quando
esse si rendono necessarie;
Il fabbisogno energetico di un processo deve essere studiato in
funzione del suo impatto ambientale ed economico e dev’essere
minimizzato. I metodi di sintesi dovrebbero essere condotti a
temperatura e pressione ambientali;
Le materie prime impiegate dovrebbe essere privilegiate, almeno
dove la cose risulti sia tecnicamente ed economicamente
praticabile;
5
8) L’impiego dei reagenti derivatizzanti (molto utilizzati nella sintesi
organica, come ad es. gruppi bloccanti, di protezione/de protezione,
modificatori temporanei) dovrebbe essere evitata quando possibile;
9) Privilegiare, dove possibile, i reagenti con azione catalitica piuttosto che
quelli richiesti in quantità stechiometrica (dosaggi sicuramente maggiori
e “a perdere”);
10) I prodotti chimici devono essere progettati e “disegnati” per degradarsi
in prodotti innocui al termine dello svolgimento della funzione per la quale
sono utilizzati, e non persistere nell’ambiente nella forma originaria (o
trasformandosi in altri prodotti pericolosi);
11) Dovranno essere sviluppate metodiche di analisi che consentano il
monitoraggio in tempo reale dei processi, con la possibilità del controllo
degli stessi “prima” che eventuali sostanze pericolose si siano formate (in
pratica una valutazione previsionale sulla base dell’insorgere di
condizioni favorevoli alla loro formazione), con correzione in feed-back
delle condizioni operative del processo medesimo;
12) Le sostanze utilizzate nei processi chimici (nonché lo stato e le condizioni
d’impiego) devono essere scelte minimizzando il potenziale rischio di
incidenti chimici, inclusi rilasci, esplosioni e fuoco.
6
Esperienza 1
Prima parte: spiegazione teorica
Questa esperienza prevede di effettuare una
reazione
di
condensazione
aldolica
tra
l’acetofenone e la para-metilbenzaldeide a dare il
derivato
α,b-insaturo
corrispondente.
Il
procedimento richiede l’utilizzo di una base
(NaOH), che è in grado di deprotonare
l’acetofenone. L’enolato risultante attacca il
carbonile della benzaldeide a dare così un aldolo,
che fornisce il prodotto finale in seguito a
disidratazione (vedi schema seguente).
O-
O
NaOH
O
+
O
H
O
O
- H2O
O-
OH
H2O
-OH-
7
Seconda parte: sperimentazione
Durante questa seconda parte abbiamo applicato ciò
che abbiamo appreso in precedenza.
•
APPARATO STRUMENTALE
Mortaio, pestello, imbuto hirsch, beuta, cartina
tornasole, essiccatore, piastra e ancoretta
magnetica.
•
SOSTANZE CHIMICHE
Pellets di idrossido di soda 0.18 g
O
para-metilbenzaldeide 0.5 g
acetofenone 0.5 g
etanolo 40 mL
NaOH
H
O
CH3CH2OH
carborundum 1 punta di spatola
acqua H2O
•
ABBIGLIAMENTO DI SICUREZZA
Guanti, occhiali, camice
8
Metodica sperimentale
•
•
Step 1
Sminuzzare finemente i pellets di NaOH; aggiungere la parametilbenzaldeide e l’acetofenone in un mortaio pulito, quindi aggiungere la
polvere di NaOH e miscelare per circa 5 minuti tutti i componenti.
Successivamente aggiungere una piccola quantità d’acqua nel mortaio per
aiutare nel trasferimento del prodotto giallo nell’imbuto hirsch.
•
•
Step 2
Lavare il prodotto con una piccola quantità d’acqua fino a quando il liquido
filtrato non appare più basico, controllando con una cartina indicatrice.
•
•
Step 3
Quando tutte le tracce di NaOH sono state rimosse, asciugare il prodotto
in un essiccatore.
•
•
Step 4
Dopo che il prodotto è stato essiccato, procedere con la cristallizzazione:
prendere una beuta e versarvi 40 mL di etanolo, il composto da
cristallizzare e una punta di spatola di carborundum. Porre la beuta sulla
piastra e portare il tutto ad ebollizione; dopodiché filtrare con filtro a
pieghe la soluzione risultante e raffreddare poi la beuta in una bacinella
con ghiaccio e attendere che il composto precipiti. In seguito filtrarlo su
imbuto büchner.
9
ESITO
Esano Acetato 8-2
Acetf
Param Acq m S pr
Pr ald
Rf = 0,62
Rf = 0,50
Rf = 0,42
•
Rf = 0,32
•
Rf = 0,00
•
L’esperimento è ben riuscito, grazie anche
al fatto che i pellets di soda sono stati
accuratamente polverizzati, facilitando
così la reazione. Da notare sono anche le
varie colorazioni riscontrate sulla cartina
indicatrice: da un blu intenso si è passati a
un verde tenue, a prova dal fatto che il
liquido filtrato è divenuto via via meno
basico. Inoltre si sono verificate anche
variazioni del peso del composto dalla
cristallizzazione
(1,48
g)
al
completamento dell’essiccazione (1,34 g).
Inoltre abbiamo effettuato anche l’analisi
via TLC dei vari passaggi. Le nostre analisi
di caratterizzazione effettuate tramite
TLC ci hanno fatto riscontrare che:
la para-metilbenzaldeide è meno polare
rispetto all’acetofenone (Rf più alto);
il prodotto grezzo non è puro ma contiene
tracce di para-metilbenzaldeide e tracce
di un composto incognito più polare di
quello principale, probabilmente l’aldolo
non disidratato;
il prodotto ricristallizzato risulta puro.
10
IMPRESSIONI
Questa esperienza è stata semplice, di veloce
esecuzione e non ha presentato particolari
problemi.
PERCHÉ É VERDE?
La reazione effettuata è una reazione solvent
free, vale a dire senza l’uso di solventi; inoltre
vi è un minimo rischio di incendio, esplosione o
di intossicazione, anche se bisogna comunque
prestare il massimo dell’attenzione e
prendere le giuste precauzioni nel maneggiare
le varie sostanze.
11
Esperienza 2
Prima parte: spiegazione teorica
Questa reazione è un processo fotochimico, in cui si ha la
formazione del benzopinacolo a partire dal benzofenone.
La reazione avviene tramite assorbimento di luce solare e
prevede l’intervento di intermedi radicalici.
O
hν, i-PrOH
2
CH3COOH
(traccia)
HO
Ph
Ph
OH
Ph
Ph
12
Seconda parte: sperimentazione
Durante questa seconda parte abbiamo applicato ciò che
abbiamo appreso in precedenza.
•
APPARATO STRUMENTALE
Provetta, contenitore in vetro pirex (papera), luce solare,
büchner.
•
SOSTANZE CHIMICHE
Benzofenone 2.5 g
isopropanolo 10 mL
1 goccia di acido acetico
•
O
OH
CH3COOH
ABBIGLIAMENTO DI SICUREZZA
Guanti, occhiali, camice
13
Metodica Sperimentale
•
•
•
•
Step 1
Mettere il benzofenone in un contenitore di vetro e
dissolverlo nell’isopropanolo, quindi aggiungere una goccia
di acido acetico.
Step 2
Esporre la miscela risultante alla luce solare, dopo averla
degasata con azoto e aver sigillato il tappo della papera
con una striscia di parafilm e alluminio.
Step 3
Dopo circa 5/6 ore, si inizia ad osservare la formazione
di cristalli bianchi lungo le pareti del contenitore. La
soluzione sarà conclusa dopo circa 4 o 5 giorni di
esposizione.
Step 4
Filtrare tramite büchner e recuperare il prodotto
ottenuto per la TLC e per la seconda parte
dell’esperienza.
14
ESITO
L’esperienza è riuscita perfettamente.
Nel corso dei giorni abbiamo riscontrato
l’aumento dei cristalli, i quali si sono
depositati soprattutto sul fondo e sulle
pareti della papera. Dalla TLC abbiamo
riscontrato che il benzofenone è meno
polare del benzopinacolo, il quale è
presente in tracce anche nelle acque madri
risultanti dalla filtrazione.
Composto
Eluente
RF
Acque madri
Esano acetato 7- 3
0. 71
Benzopinacolo
Esano acetato 7- 3
0. 71
Benzofenone
Esano acetato 7- 3
0. 78
15
IMPRESSIONI
Osservare
i
cambiamenti
della
sostanza contenuta nella papera nel
corso dei giorni, è stato utile per
comprendere meglio ciò che la luce
solare può fare e quindi quanto sia
una risorsa utile e indispensabile.
PERCHĖ Ė VERDE?
Questa reazione è verde per l’uso di
sostanze chimiche sicure e di
condizioni di reazione blande, per
l’uso di una fonte di energia
rinnovabile (energia solare) e il
composto ottenuto potrebbe essere
riutilizzato per un nuovo esperimento.
16
Esplosivo
Infiammabile
Corrosivo
Comburente
Gas sotto pressione
17
Nocivo e Irritante
Dannoso a lungo termine
Cancerogeno
Mutageno
Tossico per la
riproduzione
Dannoso per l’ambiente
Tossico
18
Ringraziamo tutti, in particolare il nostro tutor Davide
Ravelli, per aver reso questa esperienza interessante e
costruttiva e ancora più bella di quanto ci aspettassimo.
Siamo onorate di aver avuto questa opportunità.
Cordiali saluti
Dalla Valle Ambra
Carioti Denise
19
vetreria
Beuta
Essiccatore
Refrigerante a bolle
Pallone a 2
colli
Provetta
Pallone
Beaker
Imbuto
gocciolatore
Vetrino
d’orologio
21
Pipetta
graduata
Cilindretto
graduato
Pipetta
Pasteur
Büchner
Vial
22
Strumenti in ceramica
Imbuto Hirsh
Mortaio e pestello
23
Apparecchiature elettriche
Piastra magnetica
Mantello riscaldante
Sonicatore
Bagno ad olio
Rotavapor
Bilancia
24
Altro
Spatola
Ancoretta magnetica
Cartina tornasole
25