AGR-VET 2 - Il MUSCOLO COME ALIMENTO
Meccanismo della contrazione muscolare. Cambiamenti del muscolo dopo la morte
Docente Patrizia Cattaneo
Riferimenti bibliografici
Muscle as food, Bechtel, Academic Press, 1986 (3/91, 2091)
Meat and Meat products, Varnam & Sutherland, Chapman & Hall, 1995 (3/217, 3511)
Muscle Foods, eds. Kinsman, Kotula, Breidenstein, Chapman & Hall, 1994
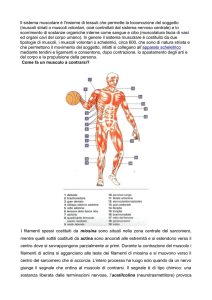
Meccanismo della contrazione muscolare
La cellula muscolare scheletrica è formata dalla fusione di singoli mioblasti. E’ una cellula
particolare poiché contiene molti nuclei ed ha un elaborato apparato citoscheletrico
specifico per la contrazione. La fibra muscolare contiene molti dei componenti trovati in
altri tipi cellulari e, in generale, questi organelli svolgono le stesse funzioni che svolgono
nelle altre cellule.
Ad esempio, i mitocondri utilizzano l'ossigeno ed altri substrati per produrre energia sotto
forma di adenosintrifosfato (ATP). Tuttavia, alcuni di questi organelli svolgono nella fibra
muscolare funzioni specializzate.
Il reticolo endoplasmatico è altamente specializzato per regolare le concentrazioni di ioni
calcio all'interno della fibra muscolare e, come risultato, esercita una forte influenza sul
controllo della contrazione muscolare. Nel muscolo questo organello prende il nome di
reticolo sarcoplasmatico.
La teoria dello slittamento dei filamenti spessi e sottili nel sarcomero è ora universalmente
accettata per spiegare la contrazione muscolare. Con la contrazione le bande I si
accorciano e i filamenti sottili si inseriscono tra i filamenti spessi delle bande A.
A produrre lo scorrimento dei filamenti è il ciclico attacco delle teste dei filamenti spessi
alle molecole di actina dei filamenti sottili, che sviluppa la tensione e la contrazione del
muscolo intero.
Quando è a riposo, il muscolo vivente di mammifero è liberamente estensibile poiché
questa interazione ciclica non avviene e le teste di miosina non sono combinate all'actina.
La concentrazione di ioni Ca nel fluido sarcoplasmatico è bassa.
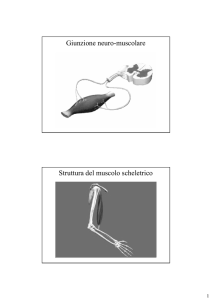
Nell'animale vivente la contrazione muscolare è innescata da una depolarizzazione della
membrana cellulare attraverso una stimolazione nervosa. La depolarizzazione si disperde
attraverso il sistema di tubuli T della fibra muscolare per indurre la depolarizzazione del
reticolo sarcoplasmatico.
Dal reticolo viene liberato nel sarcoplasma un flusso di ioni Calcio, aumentando la
concentrazione di ioni liberi di circa 1000 volte (da 5 x 10-8 M a 10-5 M).
La liberazione di ioni Calcio innesca la formazione di ponti tra i filamenti spessi e sottili
nella loro regione di sovrapposizione, in quanto il ricevimento di ioni Ca dal complesso
troponina, sui filamenti di tropomiosina, causa il movimento di questi filamenti verso il
centro dell’elica F-actina, permettendo alle teste rotanti della miosina l’accesso all’actina.
Attraverso la defosforilazione di ATP legato ai siti sulle teste delle molecole di miosina,
viene liberata energia libera per lo slittamento relativo dei filamenti sottili sui filamenti
spessi.
La formazione e il distacco dei ponti crociati si ripetono e continuano fino a che resta ATP,
o finchè il reticolo sarcoplasmatico riesce a recuperare gli ioni Ca liberati, mediante una
pompa ATP dipendente, attivata dall'aumento della concentrazione di Ca ioni nel
sarcoplasma.
Questa teoria della contrazione permette di spiegare come l'energia liberata dalla
defosforilazione di una molecola di ATP sia usata per creare un quantum di movimento a
Pagina 1 di 6, 29/10/03
livello del singolo legame a ponte e come la formazione dei ponti avvenga a seguito di
passaggi cinetici associati all'idrolisi dell'ATP.
La descrizione che segue dà una sequenza molto semplificata dei possibili stadi di
reazione nella interazione ciclica di actina (A) e miosina (M) a dare actomiosina (AM).
1. Si assume, come partenza della descrizione, che la miosina e l'actina siano legate da
un legame a ponte complesso AM, situazione dove tutto ATP è stato consumato
(questa situazione non c’è normalmente nel tessuto muscolare ma è facilmente
riproducibile in laboratorio). Una molecola di ATP si lega ad ogni testa di miosina (o
frammento S1);
2. Ciò causa la rottura del ponte tra actina e miosina: dissociazione della actomiosina: A+
M.ATP. La testa della miosina è attivata da ATP: cioè va incontro ad un cambio di
conformazione con variazione dell’angolo, da 45° a 90°, rispetto all'asse delle
molecole di miosina nel filamento.
3. L’ATP associato alla testa S1 viene idrolizzato a ADP e Fosfato inorganico (Pi):
entrambi restano associati alla testa S1, in un complesso ternario M.ADP.Pi. In questo
stadio di transizione la miosina è incapace di legarsi all’actina.
4. Variazione strutturale della Miosina dallo stato di transizione ad uno stato di capacità di
legame con Astina.
5. Legame M ad A e inizio di un nuovo tratto di contrazione dovuto all’aumento della
concentrazione di ioni Ca, che permette lo slittamento della tropomiosina dai siti di
legame della Miosina. Dopo la riassociazione di M e A l’angolo del legame a ponte è di
circa 90°; ADP e Pi sono ancora associati con il sito attivo di M. L’Energia che si libera
dall’idrolisi di ATP resta associata a M.
6. L’impulso di contrazione muove il filamento spesso relativamente al sottile. L’angolo
del legame varia da 90° a 45° e l’energia liberata dall’idrolisi di ATP viene utilizzata per
il movimento.
7. Al completamento del movimento, Pi si libera da M.
8. M va incontro ad un altro cambio di conformazione prima della liberazione di ADP.
9. Sostituzione di ADP con una nuova molecola di ATP e l’associazione di ATP ad AM
segna l’inizio di un nuovo ciclo di contrazione.
10. Dopo la morte, quando ATP è stato consumato, anche ADP può dissociarsi da AM,
che resta come complesso rigor.
Nel muscolo vivente ATP ha 2 importanti funzioni:
- fonte immediata e diretta di energia per il metabolismo cellulare
- azione diretta per la dissociazione dell'interazione actina-miosina
La concentrazione di ATP nel muscolo vivente varia tra 5 e 10 mM, secondo la specie e il
muscolo.
Nel muscolo vivente ATP può essere ottenuto sia dal metabolismo aerobio che da quello
anaerobio.
Il metabolismo aerobio comprende i processi della glicolisi e della respirazione (ciclo
dell'acido citrico e trasporto elettronico). Questo processo utilizza ossigeno ed è più
efficiente nella produzione di ATP che non il metabolismo anaerobio.
In condizioni aerobie:
(glicogeno)n + 9 ADP + 9Pi → (glicogeno)n-1 + 9ATP + 2 piruvato
2 piruvato + 30 ADP + 30 Pi → 6 CO2 + 30 ATP
La presenza in quantità sufficiente di ossigeno e di substrato, principalmente glucosio,
permette la produzione di ATP. Nella miofibrilla il glucosio è conservato come glicogeno.
Pagina 2 di 6, 29/10/03
Nel muscolo a riposo ATP è defosforilato lentamente a ADP, producendo energia libera
per le varie necessità metaboliche:
ATP → ADP + Pi
Cambiamenti nel muscolo dopo la morte
La biologia del muscolo scheletrico ed i processi che avvengono durante la conversione in
carne sono d'importanza critica per capire la qualità degli alimenti carnei.
Sono numerose le specie animali dalle quali si ottiene la carne, ma sebbene esistano
differenze specie-specifiche, le variazioni associate alla conversione del muscolo a carne
sono essenzialmente le stesse.
L'intero processo di macellazione del bestiame dura, nei moderni impianti, meno di un'ora.
L'insorgenza del rigor mortis varia tra 3 e 6 ore negli animali piccoli come il pollo e tra 24 e
36 nei grandi come il bovino.
Indipendentemente dalla specie, la morte è causata dall'incapacità di trasporto
dell'ossigeno nell'organismo e la morte avviene per anossia.
Alla sospensione dei normali processi vitali, molte delle reazioni biochimiche presenti
quando l’animale è in vita, mantengono un certo grado di attività.
Queste reazioni sono le responsabili dei profondi cambiamenti di qualità durante la
conservazione.
Per semplicità si può dividere il periodo postmortem in due stadi: postmortem pre-rigor e
postmortem post-rigor.
Periodo postmortem, pre-rigor
Dopo la morte i muscoli restano morbidi, pieghevoli, estensibili e restano "vivi", cioè
reagiscono agli stimoli, per un certo periodo fino a che il rigor mortis non si è stabilito.
Una lenta defosforilazione di ATP continua dopo l'abbattimento, ma ATP nella carcassa
sparirebbe nel giro di pochi minuti se non venisse rifornito attivamente.
Ci sono 2 fasi di rigenerazione di ATP che conducono a 2 fasi dello sviluppo del rigor. In
una prima fase di latenza, ATP è risintetizzato attraverso il creatin fosfato (presente nel
muscolo e fondamentale nei momenti di alta richiesta energetica, come ad esempio
l'esercizio intenso) e in minor quantità attraverso la glicolisi.
creatina-P + ADP → creatina + ATP
Durante questa fase i filamenti possono scorrere, così il muscolo è libero di estendersi e
può essere stimolato a contrarsi.
Finchè durano le riserve di creatinfosfato, la defosforilazione e la risintesi di ATP restano
bilanciate.
Dopo di che, la risintesi dipende solo dalla glicolisi anaerobia, che segna la seconda
fase, la rapida, di sviluppo del rigor. Il substrato della glicolisi è il glicogeno:
(glicogeno)n + 3 ADP + 3Pi → (glicogeno)n-1 + 3 ATP + 2 piruvato
2 piruvato → 2 lattato + 2H+ + 2 H2O
La diminuzione di ATP non è accoppiata ad un accumulo di ADP poiché questo è
convertito a AMP e ATP da una fosfotransferasi, la miochinasi,.
2 ADP → ATP + AMP
AMP è poi perso con una reazione rapida e irreversibile di deaminazione ad ammoniaca e
inosin-monofosfato, mediante l’enzima AMP deaminasi.
AMP → IMP + NH3
Poiché il metabolismo ossidativo cessa alla morte, la risintesi di ATP attraverso il
metabolismo anaerobio, meno efficiente, non riesce a lungo a tener fronte alla scissione.
Pagina 3 di 6, 29/10/03
Per cui nel giro di poco tempo la concentrazione di ATP inizia a scendere causando il
progressivo irrigidimento del muscolo; quando tutto ATP è finito, i ponti actina-miosina
sono tutti formati e il muscolo diventa inestensibile, rigido e inerte: si instaura il rigor
mortis.
In anaerobiosi il prodotto finale del glicogeno è l'acido lattico, che con l'arresto del circolo
dopo la morte, si accumula nel muscolo. Nell'animale macellato non affaticato e ben
nutrito, i depositi di glicogeno sono tali da produrre acido lattico in eccesso, mentre
nell'animale denutrito o stressato la concentrazione di glicogeno muscolare è bassa e la
glicolisi presto si arresta, insorge presto il rigor, c'è poca acidificazione e il pH non scende
a sufficienza.
Il rigor mortis può essere definito un processo che avviene durante il periodo di tempo
della glicolisi postmortem ed è caratterizzato dal progressivo irrigidimento del muscolo.
Se il rigor è accompagnato da contrazione, anche la formazione e la rottura dei ponti tra i
filamenti causa defosforilazione di ATP.
Condizioni che influenzano l'insorgenza del rigor
Il tempo di insorgenza del rigor varia considerevolmente anche in muscoli di animali a
riposo e ben alimentati, ad esempio in funzione della temperatura o della specie animale
o del muscolo stesso.
Il tipo di agonia e il trattamento dopo la morte hanno molta influenza.
Alla morte la temperatura del muscolo dell'animale da carne è al normale valore
fisiologico (38 - 40 °C); dopo il trattamento della carcassa, questa viene raffreddata in
cella a + 4°C. La velocità di raffreddamento influenzerà il grado di rallentamento delle
reazioni glicolitiche ed il periodo di insorgenza del rigor.
Il mantello o la presenza della pelle agiranno da isolanti del freddo, come ad esempio
negli ovocaprini e nei suini. Ne consegue un raffreddamento più lento e di conseguenza
una maggiore velocità di glicolisi. Il grasso sottocutaneo rallenterà il raffreddamento.
Ci sono variazioni nel raffreddamento anche tra gruppi muscolari secondo la loro
posizione: i muscoli più esterni avranno quindi un tasso di glicolisi più lento. Ad es. il m.
psoas major di bovino (muscolo profondo) refrigerato impiega 8 ore a sviluppare il rigor, il
m. longissimus (muscolo superficiale) 24 ore.
Variazioni postmortem post-rigor: frollatura
L'esatto punto al quale la conversione del muscolo in carne è completa è difficile da
stabilire, sebbene in genere si accetta che sia quando si stabilisce il rigor. Il ruolo
funzionale del muscolo non c'è più però l'attività metabolica del muscolo non è terminata.
Avvengono ancora molti processi biochimici ed alcuni di essi sono importanti per la qualità
del muscolo come alimento. La mancanza di Energia non permette la risintesi delle
proteine muscolari e quelle presenti iniziano a denaturare e a diventare sensibili agli
attacchi di proteasi endogene che portano all’intenerimento.
Da tempo è noto che la frollatura rende più tenere le carni. Durante questo periodo, che si
tiene a temperatura di -1/+2°C, si ha l’azione di enzimi litici sulle proteine muscolari.
Un evento molto importante è l’indebolimento o degradazione del disco Z, processo
primario nello sviluppo della tenerezza e visibile al microscopio come rotture fisiche.
L’indebolimento del disco Z rende la miofibrilla più suscettibile alla frammentazione.
Altri danni sulle proteine miofibrillari sono a carico della troponina T, che scompare, della
titina e della nebulina. Invece non ci sono danni a miosina e actina, nemmeno dopo
stoccaggio prolungato.
I danni subiti dalle proteine sarcoplasmatiche non incidono sulla tenerezza; la proteolisi a
carico delle proteine del connettivo non è evidente come nelle proteine miofibrillari.
Le proteasi coinvolte nella proteolisi delle miofibrille sono di due tipi: le calpaine, proteinasi
attivate dal calcio, e le catepsine dei lisosomi. Il grado di proteolisi è inferiore a quello che
Pagina 4 di 6, 29/10/03
ci si aspetterebbe visto il consistente intenerimento, ma i più piccoli cambiamenti
strutturali delle proteine provocano grandi alterazioni alle loro proprietà fisiche.
Le calpaine richiedono ioni calcio per la loro attività e hanno pH ottimale sopra 6, mentre
le catepsine sono attive a pH più bassi.
Secondo alcuni autori le calpaine sarebbero le responsabili dei danni alla linea Z, facendo
staccare i filamenti di actina che così collassano su quelli di miosina, rendendo il muscolo
nuovamente pieghevole: risoluzione del rigormortis.
Non si verifica dissociazione dell'actomiosina.
Collagene ed elastina non vengono denaturate, e nemmeno si verifica proteolisi, però il
collagene si rigonfia per rottura dei legami tra le catene polipeptidiche.
Si nota anche un aumento della beta-glucuronidasi, il che fa ipotizzare che i
mucoplisaccaridi della sostanza fondamentale contribuiscano alla tenerezza.
L'aumento della tenerezza è associato all'aumento di azoto solubile, dovuto alla
formazione di peptidi e aminoacidi derivanti dalla lisi delle proteine sarcoplasmatiche.
Lo sviluppo dell'aroma definitivo e della morbidezza si hanno in 2-4 giorni nella carne di
maiale e in 10-14 giorni nella carne bovina.
La proliferazione microbica può anche contribuire alla maturazione con enzimi esogeni,
che idrolizzano diverse proteine della carne.
Sapore e aroma della carne
Il sapore è la combinazione complessa degli attributi olfattivi e gustativi percepiti durante
la degustazione, che può essere influenzata da fattori tattili, termici, dolorifici e anche
estetici. Il sapore può essere influenzato dalla tessitura, temperatura e pH.
La parte attiva di una molecola del gusto o dell’odore si adatta ad una parte della struttura
proteica nei rispettivi recettori, alterando reazioni e dando luogo a sapori e odori
caratteristici. In condizioni ideali il senso dell’odorato è 10000 volte più sensibile di quello
del gusto.
La formazione del sapore e dell’aroma avviene durante la frollatura e dipende dall’azione
delle numerose proteasi endogene, i cui meccanismi anche rispetto all’intenerimento
durante la maturazione non sono ancora del tutto compresi.
Il sapore della carne cruda è molto tenue, di sangue. Lo sviluppo del gusto caratteristico
dipende dalla cottura, quando ha luogo un gran numero di reazioni chimiche tra i
numerosi composti non volatili della carne. Si formano centinaia di composti volatili, ma
probabilmente solo pochi hanno un ruolo significativo nel determinare sapore e aroma.
Sebbene il sapore caratteristico si sviluppi durante il riscaldamento, i precursori del sapore
sono già presenti nella carne cruda. I precursori derivano dai componenti presenti nel
muscolo: aromi derivanti dalla lipolisi e dall’ossidazione dei fosfolipidi, composti
idrosolubili non proteici anche derivanti da lisi proteica (aminoacidi, peptidi, H2S, NH3,),
dalla scissione di peptidi (anserina, carnosina), zuccheri riducenti (glucosio, glucosio 6-P,
ribosio), nucleotidi e dalla demolizione di ATP (ipoxantina, acido inosinico).
I precursori del sapore sono influenzati dall'andamento della glicolisi post-mortem.
Ci sono differenze dovute alla specie, che si evidenziano nei diversi sapori caratteristici
della carne cotta. Si ipotizza che l’effetto delle specie sul gusto derivi da diversità nella
composizione e nel metabolismo lipidico. Ciò appare incontestabilmente nella carne di
agnello e pollo, invece è meno chiaro per bovino e suino.
Il caratteristico sapore della carne d’agnello e montone, e anche della capra, è dovuto
agli acidi grassi ramificati derivanti dal metabolismo del rumine, non presenti in modo
significativo nel bovino, quello del pollo è stato attribuito ad aldeidi insature, prodotte
dall’ossidazione dell’acido linoleico, presente in alte concentrazioni nei trigliceridi.
Le carni di bovino hanno odore specie-specifico molto debole; le carni di suino, anche di
femmine e castrati, possono talvolta avere odore sgradevole di “verro”, dovuto a 2
composti chimici che hanno odore di urine e muschio.
Pagina 5 di 6, 29/10/03
La dieta può influenzare i precursori del gusto: mangimi inadatti o di scarsa qualità sono
stati spesso causa di difetti di gusto. E’ provato che è più facile causare sapori anomali
che migliorare il sapore della carne attraverso modificazioni della dieta.
Tipico esempio è l’uso di oli e farine di pesce che trasferiscono il proprio odore e sapore
alle carni, così come l’uso di rape conferisce odore definito di terra.
Nel bovino e agnello è stato dimostrato che animali alimentati con concentrati ad alta
energia danno carni di sapore superiore rispetto ad animali al pascolo; il motivo è dovuto
a variazioni nella composizione degli acidi grassi perché il foraggio contiene livelli
relativamente alti di acidi grassi di tipo Ω 3 ed il rapporto tra Ω 3 e Ω 6 è significativamente
più alto negli animali alimentati a foraggio che in quelli alimentati a concentrato. Le
differenze tra le due classi di insaturi consistono nella diversa posizione dei doppi legami
e l’ossidazione di questi diversi acidi grassi porta alla formazione di prodotti d’ossidazione
diversi, con effetto sul gusto.
Si sono ottenuti miglioramenti del sapore della carne di pollo con un'alimentazione ricca di
grano intero e accesso libero a vegetali verdi, ma non è stato ancora dimostrato che il
sapore migliore delle carni di polli allevati liberi sia dovuto al consumo di piante selvatiche.
Il tipo di grassi della dieta può influenzare la qualità dei grassi della carne degli animali
monogastrici, che possono incorporare acidi grassi dall’alimento nei depositi senza
apportarvi variazioni. La carne di cavallo ha odore tipico, definito di stucco, per l’alto
contenuto in acido linolenico.
Il sapore, che si evidenzia specialmente con la cottura, è associato al grasso
intramuscolare, per cui le linee animali a più alta % di grasso intramuscolare danno carni
più aromatiche.
L’età è un altro fattore che può influenzare l’odore: più l’animale è vecchio e più l’odore è
marcato, forse in relazione al contenuto in mioglobina, fosfolipidi, componenti solubili in
acqua e per il maggior grado di glicosidazione del collagene.
Pagina 6 di 6, 29/10/03