REAZIONI DI ADDIZIONE-ELIMINAZIONE DI
ALDEIDI E CHETONI
L’azoto nucleofilo dell’ammina
attacca il carbonio elettrofilo del
chetone
Come potremmo rendere questa
reazione più “facile”?
Emiamminale
La velocità della reazione però non continua ad aumentare con il decrescere
del pH. Perchè?
Ci chiediamo ora che cosa succede all’emiamminale che si è formato…
Altri reagenti possono
dare reazioni simili?
Immina; è il prodotto finale della reazione
Idrazina
Idrazone
Idrossilammina
Ma anche:
Ossima
Immine, idrazoni ed ossime possono essere idrolizzate
Per rigenerare il composto carbonilico di partenza
Un idrazone (X=NH2)
Che cosa può spostare l’equilibrio
verso l’idrolisi?
Una immina può essere ridotta ad ammina con un riducente come un idruro.
Idruri che si possono usare sono il NaBH4 o il LiAlH4
La formazione di legami imminici gioca un ruolo importante
nella stabilizzazione di proteine……
La catena laterale di una
lisina viene ossidata
Si forma un’aldeide
Reticolazione
Che cosa succede se invece di far reagire con un aldeide o
un chetone un’ ammina primaria usiamo una secondaria?
Emiamminale
Enammina
Questa formula limite di una enammina da conto del carettere basico o
nucleofilo dell’atomo di carbonio in a
Enammina si protona a ione imminio
Enammina funge da nucleofilo e attacca un alogenuro alchilico
Quest’ultima reazione costituisce un ottimo metodo per alchilare
in alfa un chetone in condizioni molto blande
Come vedremo in seguito l’alchilazione diretta in alfa di un chetone non è
una reazione così semplice
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI
ACIDI CARBOSSILICI E LORO DERIVATI
NOMENCLATURA
Acido benzoico
esanammide
Un estere
benzammide
2-etilesanammide
fenilbutanoato
N-etilesanammide
isopropilbenzoato
metlciclopentancarbossilato
Un gruppo acilico è quello che resta di un acido carbossilico
o di un suo derivato quando si toglie la parte che contiene
l’eteroatomo
Gruppo benzoilico o benzolile
pentanoile
formile
acetile
Un nucleofilo si addiziona al carbonio carbonilico di un derivato di un acido
carbossilico (come nel caso di aldeidi e chetoni) per dare un intermedio
tetraedrico che però può eliminare il gruppo legato all’eteroatomo
Questa reazione è tanto più
veloce tanto migliore è Xcome gruppo uscente
La situazione è molto diversa rispetto a quella che si verifica con aldeidi e chetoni
Il quadro della reattività
Un cloruro acilico
Una anidride
Un tioestere
Un estere
Una ammide
Reattività decrescente rispetto all’addizione nucleofila
Basicità crescente
Reattività decrescente rispetto all’eliminazione del gruppo uscente
Basicità crescente (con concomitante diminuzione crescente delle proprietà di gruppo uscente)
Come mai mancano gli acidi carbossilici?
In un acido carbossilico il sito elettrofilo principale è il
protone che quindi reagirà per primo
In presenza di catalisi acida però…..
In un acido carbossilico neutro il
protone è il sito elettrofilo principale
mentre in un acido carbossilico
proronato il sito elettrofilo è il carbonio
carbonilico
Questo è un metodo semplice
per sintetizzare esteri
Un lattone è un estere ciclico
Un β lattone
un γ lattone
un δ lattone
La formazione di un lattone dal corrispondete idrossiacido avviene
molto facilmente in presenza di tracce di acido
I cloruri degli acidi sono molto importanti perchè permettono di
sintetizzare molto facilmente tutti i derivati (perchè Cl- è un
ottimo gruppo uscente!)
I cloruri degli acidi si ottengono per reazione con cloruro di tionile
A partire dai cloruri si ottengono facilmente sia esteri che ammidi
Ammide 1°
ammide 2°
ammide 3°
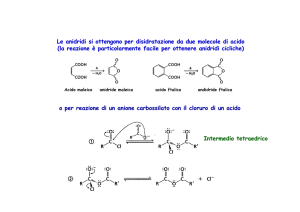
Le anidridi si ottengono per disidratazione da due molecole di acido
(la reazione è particolarmente facile per ottenere anidridi cicliche)
Acido maleico
anidride maleica
acido ftalico
andidride ftalica
o per reazione di un anione carbossilato con il cloruro di un acido
Intermedio tetraedrico
Da una anidride si possono ottenere sia esteri che ammidi
Intermedio tetraedrico
Acido acetico
pentilacetato (un estere)
Provate ora a sintetizzare un’ammide a partire da una anidride….
Ovviamente un estere può reagire con un altro alcol per dare una
reazione di transesterificazione in presenza di un acido
Per questa ragione non è mai una buona
idea conservare un estere in un solvente
alcolico
Sulla base di quanto abbiamo visto fino ad ora siete in grado di anticipare se
un’ammide può essere sintetizzata a partire da un estere?
Non servono due equivalenti di ammina perché non si libera un acido
Sulla base di quanto visto nella tabella delle
reattività come si comporterà un tioestere?
I tioesteri sono quasi tanto reattivi quanto le
anidridi e i cloruri degli acidi e sono usati in ambito
biochimico come un “equivalenti sintetici” di un
cloruro di un acido
Effetti induttivi
Effetti di risonanza
La presenza di due gruppi
elettronegativi rende l’atomo di
carbonio altamente elettrofilico
Minore contributo
all’ibrido di risonanza
Tioesteri in sistemi biologici
Molti passaggi
Piruvato
Molti passaggi
acetil coenzima A
Coenzima A
il tioestere di un acido grasso
(n è di solito 15)
Biosintesi dei fosfolipidi (formazione di esteri in sistemi biologici)
Sito attivo dell’enzima
diidrossiacetone fosfato
aciltransferasi
Diidrossiacetone
fosfato
Tioestere (CoA
CoA-SH)
SH)
di un acido grasso
Intermedio tetraedrico
Formazione dell’estere
Molti passaggi
Molti passaggi
Triacil glicerolo (un grasso)
Diacil glicerolo fosfato
ESERCIZIO
In laboratorio i tioesteri si preparano per reazione di un acilcloruro e tioli. Sulla base
delle vostre conoscenze riguardo la formazione degli esteri proponete un meccanismo
ragionevole per la sintesi del propiltioacetato a partire dall’acetil cloruro e l’1propantiolo
La conversione dei derivati degli acidi carbossilici in acidi carbossilici: idrolisi
(ambiente basico)
Dopo l’idrolisi basica bisogna trattare
con acido per ottenere l’acido
carbossilico dal carbossilato
Questa reazione si chiama “saponificazione” perchè è un modo per convertire gli
esteri degli acidi grassi in carbossilati degli acidi a catena lunga (saponi)
Idrolisi di ammidi in ambiente basico
(è una reazione molto più lenta di quella di un estere!)
Questa specie è una base forte e
quindi un cattivo gruppo uscente
L’idrolisi basica di cloruri e anidridi è invece una reazione molto veloce
(perché?)
L’idrolisi dei derivati degli acidi carbossilici può essere condotta anche
in ambiente acido
Il processo è esattamente
l’opposto della sintesi acido
catalizzata degli esteri.
Per spostare l’equilibrio a destra
si effettua la reazione in
presenza di acqua
L’idrolisi di ammidi in ambiente acido è più veloce della reazione in
ambiente basico. Perché?
Il carbonio carbonilico non è un buon
elettrofilo perchè la formula di risonanza
più importante non ha una carica positiva
su quell’atomo
La protonazione lo trasforma in una
specie più elettrofila
Come catalizza un enzima l’idrolisi di un legame ammidico (di una
proteina)?
istidina
serina
Vi sono vari gruppi
funzionali nel sito
catalitico dell’enzima
Acido aspartico
Enzima
Il trucco è la
stabilizzazione dello stato
di transizione mediante
legami ad H
L’enzima Chimotripsina (una proteasi serinica)
è un esempio specifico
Legame scissile
Questo è il suo
substrato
Successivamente l’OH di una serina funge da
nucleofilo
Prima si forma il complesso Enzima-Substrato
Per arrivare all’intermedio tetraedrico
Un gruppo protonato (un imidazolo) funge da
acido e trasferisce un protone all’N peptidico
trasformandolo in un buon gruppo uscente;
Il prodotto che si ottiene è un estere della
serina (non è ancora il prodotto di idrolisi)
Nuovo peptide N-terminale
La vera idrolisi avviene in questa serie di passaggi;
Questa volta a reagire è un estere! E’ una reazione
più facile dell’idrolisi di una ammide.
Intermedio tetraedrico
Ancora una volta è un imidazolo protonato
a facilitare l’uscita del gruppo uscente
Come si sintetizza un peptide in laboratorio?
= dicicloesilcarbodiimmide
Nella sintesi posso usare
un ammino acido senza
precauzioni?
1. Un ammino acido
possiede sia un gruppo
carbossilico che una
ammina;
2. Bisogna “proteggerli” a
turno;
3. Bisogna “liberarli”
quando si vuole farli
reagire
= dicicloesilurea