Enzimi
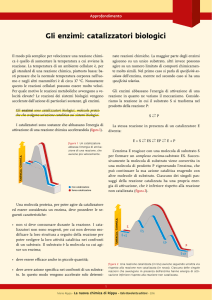
Nelle cellule, ad una temperatura di soli 37°C, avvengono reazioni (di ossidazione, di idrolisi, di
sintesi, etc,) a velocità straordinarie, che richiederebbero temperature e pressioni elevate.
Queste reazioni avvengono in tempi relativamente brevi e in condizioni blande grazie a molecole
proteiche dette enzimi, ovvero, catalizzatori biologici altamente specifici. Gli enzimi sono stati
individuati per la prima volta nelle cellule dei lieviti ( in greco”zime”) e si è visto in seguito che
mantengono le loro proprietà anche dopo estrazione dalle cellule, in cui sono sempre presenti in
piccole quantità. Hanno elevato potere catalitico (sono in grado di aumentare fino a 1016 volte la
velocità di reazione, molto più dei catalizzatori chimici); ogni enzima ha una propria capacità
catalitica, espressa dal numero di turnover cioè dal numero di molecole di substrato convertite in
prodotto, in un secondo, da ogni molecola di enzima nelle condizioni ottimali. La sostanza chimica
sulla quale l’enzima opera è detta substrato.
Hanno anche elevata specificità, cioè la capacità di riconoscere un solo substrato o un gruppo
ristretto di substrati simili. Esistono enzimi con specificità assoluta che reagiscono con un solo
composto, alcuni come la lattatodeidrogenasi reagiscono con un solo enantiomero; altri manifestano
una specificità relativa che può essere di gruppo funzionale o di legame o di reazione.
Nomenclatura:
In passato gli enzimi noti erano pochi e il nome derivava dalla loro struttura di proteina es. Pepsina.
Successivamente si aggiunse la desinenza –asi al substrato sul quale l’enzima opera, es. ureasi.
In seguito, aumentando il numero degli enzimi noti, si formulò un termine che tiene conto non solo
del substrato sul quale l’enzima opera, ma anche del tipo di reazione chimica che catalizza, es.
lattato deidrogenasi.
Nel 1961 la IUB(International Union of Biochemistry) ha adottato una nomenclatura sistematica,
usata soprattutto nelle pubblicazioni scientifiche. Il nuovo sistema divide gli enzimi in 6 classi
principali a loro volta divise in sottoclassi in base al tipo di reazione. Le sottoclassi sono a loro
volta suddivise in sotto-sottoclassi che a loro volta elencano i singoli enzimi.
Ogni enzima è individuato da quattro numeri, dei quali il primo indica la reazione in cui l’enzima è
specializzato cioè la classe, il secondo indica la sottoclasse, il terzo la sotto-sottoclasse e l’ultimo è
il numero progressivo dell’enzima
Il significato del primo numero è spiegato dalla tabella seguente:
N°
1
2
3
4
5
6
Classe
Ossidoreduttasi
Trasferasi
Idrolasi
Liasi
Isomerasi
Ligasi
Tipo di reazione catalizzata
Reazioni di ossidoriduzione in cui si scambiano O2-, H+ e/o eTrasferimento di gruppi funzionali
Rottura di vari legami ad opera di acqua
Rottura non idrolitica né ossidativa di vari legami
Formazione di isomeri
Reazioni di condensazione di due molecole che si combinano a spese di
energia sotto forma di ATP
Abbiamo in tal modo per ogni enzima : un nome proposto, in genere breve e adatto all’uso comune
(es. Glucochinasi); un nome sistematico che identifica la reazione (es. La glucochinasi si chiama
ATP:D-glucosio 6-fosfato transferasi) e un numero di classificazione usato per le pubblicazioni
scientifiche internazionali. Il numero di classificazione IUB(EC) per la glucochinasi è 2.7.1.10
dove : 2 è la classe, 7 la sottoclasse, 1 è la sotto-sottoclasse e 10 è il numero progressivo assegnato a
ciascun enzima nelle sotto-sottoclassi.
Altro esempio:
nome d’uso: esocinasi
1
CODICE: 2 7 1 1
2 l’enzima trasferisce gruppi
7 l’enzima trasferisce un gruppo fosforico
1 l’enzima trasferisce un gruppo fosforico ad un gruppo ricevente –OH
1 l’enzima trasferisce un gruppo fosforico ad un gruppo ricevente –OH di un esoso
Struttura:
Gli enzimi sono costituiti da una o più proteine globulari ad alta massa molecolare. Talvolta
svolgono la loro attività tal quali, in molti casi sono inattivi senza la presenza di parti a bassa massa
molecolare dette cofattori che sono solitamente ioni metallici come Fe2+, Zn2+, Mg 2+ oppure
molecole organiche dette coenzimi come: il NAD+, il FAD, l’ATP o il CoASH. I coenzimi
agiscono su molti substrati allo stesso modo ma è l’unione con l’enzima a renderli specifici per un
determinato substrato; inoltre è a livello del cofattore che avviene la reazione catalizzata
dall’enzima; è anche interessante notare che le formule delle vitamine in molti casi o coincidono
con quelle dei coenzimi o ne fanno parte. I coenzimi sono in numero limitato rispetto agli enzimi,
che sono invece numerosissimi.
La molecola proteica si chiama apoenzima ed insieme al cofattore costituiscono la molecola
proteica coniugata detta oloenzima.
APOENZIMA
OLOENZIMA
IONI MEn+
COFATTORE
COENZIMI
Cinetica Enzimatica
Essa studia : - la velocità di trasformazione di un substrato
- la velocità di produzione di cellule microbiche, in quanto la crescita e la
moltiplicazione delle cellule è conseguenza di molteplici reazioni enzimatiche.
E’ una cinetica che si può determinare solo in forma empirica poiché gli enzimi sono per lo più
sistemi complessi; inoltre esprimere la concentrazione di una soluzione enzimatica come Molarità
non è corretto perché :
- gli enzimi , essendo proteine, hanno un peso molecolare molto grande ( alcune migliaia di Dalton )
e difficile da determinare anche con le tecniche utilizzate per le macromolecole biologiche.
- gli enzimi commerciali raramente sono puri ma spesso contaminati da altre proteine .
Di conseguenza la quantità di enzima contenuto in un campione o in un prodotto commerciale è
espressa in unità internazionali (U.I.) .
U.I. = quantità di enzima che catalizza la trasformazione di una µmole di substrato in 1 minuto a
25°C e a pH ottimale.
La concentrazione in enzima di un campione o prodotto commerciale è espressa come attività
specifica .
Attività specifica = numero di U.I. dell’enzima contenute in 1 mg. di proteina. L’attività specifica è
quindi una misura della purezza del campione, più è alta maggiore è la purezza.
2
Perché la determinazione dell’attività specifica sia significativa è necessario che tutto l’enzima
presente sia saturo, perché solo in queste condizioni la velocità di reazione ( n° di µmoli di prodotto
/min.) è direttamente proporzionale alla concentrazione dell’enzima. Pertanto si lavora con il
metodo detto determinazione del punto finale ( end point) che consiste nel far reagire una soluzione
di enzima con un eccesso di substrato, dopo un tempo prefissato si blocca la reazione e si misura la
concentrazione del prodotto.
Lo studio della cinetica enzimatica fornisce indirettamente informazioni sul meccanismo della
reazione catalizzata, nonché sulla specificità e sulla struttura dell'enzima.
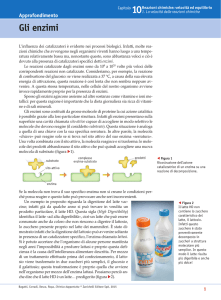
Velocità delle reazioni enzimatiche:
La funzione di un enzima è quella di catalizzatore: abbassa l’energia di attivazione della reazione
aumentandone così la velocità.
Come si può MISURARE la VELOCITA’ di una reazione enzimatica?
E’ necessario costruire un diagramma [S]/t (vedi fig. 1) oppure [P]/t (vedi fig. 2), oppure
[S]consumato/t (vedi fig.3)
E’ spesso preferibile o più facile misurare l’incremento di P piuttosto che il decremento di S.
La velocità dipende da numerosi fattori chimico-fisici quali:
α) Concentrazione del substrato
β) Concentrazione dell’enzima.
γ ) pH dell’ambiente di reazione.
δ) Temperatura.
ε) Forze fluide
3
(α)Concentrazione
del substrato
(α)
Supponiamo di porre nel pallone di reazione una certa quantità di Enzima, una certa quantità di
Substrato (S1), di impostare le condizioni ottimali di T e pH e di misurare la quantità di Prodotto a
intervalli regolari. Noteremo che la quantità di prodotto formatosi diminuisce (cioè diminuisce la
velocità di reazione); ciò avviene a causa di diversi fattori, la diminuzione del substrato, la
variazione delle condizioni iniziali di pH o di T, la comparsa della reazione inversa .. Se si ripete l’
esperienza con quantità diverse di substrato (S2, S3..) si ottiene sempre lo stesso andamento ma
perché i diversi valori di v siano confrontabili è necessario misurarli sempre a tempi vicini a t
iniziale, cioè quando v = k [E] ed è di ordine 0 rispetto a S.
Diagrammando le velocità iniziali rispetto a [S] e tenendo [E] costante il chimico tedesco Leonor
Michaelis e la sua assistente Maud Menten scoprirono che, per buona parte degli enzimi, si otteneva
la curva rappresentata in fig. 4 in cui sono riconoscibili 3 zone.
Nella zona 1 si ha un largo eccesso di E rispetto al S e quindi v = K[S]
Nella zona 2,di ordine misto, si ha v = K[S][E]
Nella zona 3 si ha un largo eccesso di S rispetto a E e quindi v = K[E]
Per spiegare questo andamento iperbolico, ben diverso da quello di una reazione chimica,
MICHAELIS e MENTEN nel 1913 proposero un modello di funzionamento degli enzimi
esprimibile così:
veloce
lento
S + E --------> ES --------> E + P
<------cioè E ed S reagiscono formando un complesso ES che successivamente si scinde in E e P. Il
complesso ES ( la cui esistenza è stata provata con osservazioni al microscopio elettronico, studi di
diffrattometria ai raggi x....) nasce quando una molecola di S si lega in zone particolari sulla
superficie della molecola dell’enzima dette SITI ATTIVI. Quando tutti i siti attivi sono occupati
l’enzima si dice “saturo”. La saturazione di tutti i siti attivi comporta che l’enzima lavori al
massimo delle sue capacità e che quindi si raggiunga la velocità massima (zona 3).
v
v
v max
½ v max
1
Fig. 4
2
3
[S]
Fig. 5
KM
[S]
Come si può vedere dal grafico la velocità di reazione sale meno rapidamente della concentrazione
del substrato, fino a raggiungere un valore costante dello velocità massima Vmax, in queste
condizioni tutti i siti attivi sono saturati e quindi un aumento del substrato non può accrescere la
velocità di reazione.
Le dimensioni della molecola enzimatica sono solitamente molto superiori a quelle della molecola
del substrato e solo alcune regioni dell’enzima sono direttamente interessate all’attività catalitica,
queste regioni sono dette siti attivi. La forma dei siti attivi è determinata dalla struttura terziaria
della proteina.
4
SUBSTRATO
ENZIMA
SITO ATTIVO
Struttura del funzionamento enzima-substrato
Il sito attivo è una regione interna di un enzima tridimensionalmente definita, relativamente piccola
rispetto alla proteina e dove si trovano quegli amminoacidi che interagiscono direttamente con il
substrato. I legami che uniscono il substrato al cofattore o direttamente alle catene laterali possono
essere: forze di Van der Waals, legami a H, legami salini o anche repulsioni elettrostatiche o
idrofobiche. Comunque essi siano producono un cambiamento nella struttura del substrato in
prodotto che non avendo più affinità per il sito attivo si stacca con facilità.
Vi sono vari modelli interpretativi dell’interazione fra enzima e substrato, il più semplice viene
descritto nel modo seguente: l’enzima si lega al substrato formando un complesso enzima-substrato,
successivamente il substrato si trasforma in prodotto lasciando libero l’enzima pronto per una nuova
catalisi.
E + S E-S E + P
Dove: E è l’enzima, S è il substrato e P è il prodotto.
(Il simbolo si deve intendere come doppia freccia, cioè simbolo dell’equilibrio chimico)
Vi sono due teorie sul riconoscimento enzima-substrato, il modello di Fischer o chiave-serratura e
il modello dell’adattamento indotto.
Modello di Fischer o chiave-serratura:
L’enzima ha una configurazione rigida perfettamente complementare a quella del substrato e quindi
il riconoscimento è altamente specifico.
Modello dell’adattamento indotto:
L’avvicinamento del substrato all’enzima modifica la struttura e migliora la reciproca aderenza. A
catalisi avvenuta l’enzima riacquista la conformazione iniziale.
In ogni caso gli enzimi hanno la capacità di riconoscere un solo substrato o un gruppo ristretto di
substrati simili; alcuni enzimi essendo altamente asimmetrici riconoscono come substrato solo una
fra le due forme enantiomere. Questa caratteristica viene detta specificità di substrato ed è
comune a tutti gli enzimi
Nel 1913 Michaelis e Menten formularono un’equazione sulla dipendenza della velocità di
reazione dalla concentrazione del substrato, che prendeva origine dal modello da essi proposto:
v1
v3
E + S ------> ES ------> E + P
<-----v2
Trovarono un’equazione che descrive la curva v\[S] , e che viene detta
equazione di Michaelis-Menten
5
Vmax[S]
__________
V=
KM + [S]
Vedere fig.5.
La costante di Michaelis, indicata con KM, corrisponde alla concentrazione di substrato alla quale la
velocità di reazione è pari a metà della velocità massima.Di solito Km ha valori molto bassi (da 10-6
moli/l per il lisozima a 10-2 moli/l per βglucosidasi ) quindi affinché si realizzi la situazione
migliore cioè v = Vmax è necessario che [S] sia 50,100 volte maggiore di Km cioè che [S] sia
compreso tra 10-1 e 10-3 M.
Valori piccoli di KM indicano che è sufficiente una bassa concentrazione di substrato per
raggiungere metà della velocità massima ovvero l’enzima ha una grande affinità con il substrato.
Viceversa valori alti indicano che l’enzima ha bassa affinità per il substrato.
Dal punto di vista matematico:
1) Se la concentrazione del substrato è elevata, KM si trascura:
V=
Vmax[S]
__________
= Vmax
[S]
Reazione di ordine zero dove la velocità di reazione non è influenzata dalla concentrazione del
reagente (S). Parte della curva ad alta concentrazione di [S] .
2) Se la concentrazione del substrato è bassa allora [S] si trascura al denominatore, perciò:
V=
Vmax[S]
__________
KM
Reazione di primo ordine dove la velocità di reazione è influenzata dalla concentrazione del
substrato. Descrive la parte iniziale della curva.
3) Nel caso in cui V=Vmax/2:
Vmax
______
2
=
Vmax[S]
___________
KM+[S]
1
[S]
= _________
2 Km+[S]
___
2[S] = KM + [S]
2[S] – [S] = KM
6
KM = [S]
Linearizzazione di Lineweaver – Burk o metodo dei doppi reciproci:
Con questo metodo è possibile trasformare la curva della velocità in una retta tramite un processo
matematico:
Vmax[S]
__________
V=
KM+[S]
Si scrive l’equazione in forma inversa:
1
__
=
V
KM+[S]
____________
Vmax[S]
Si può anche scrivere nel seguente modo:
1
KM 1
[S]
= _______ ____ + ___________
V Vmax [S]
Vmax[S]
__
1
KM 1
1
= ________ ____ + _______
V Vmax [S]
Vmax
__
eq. Lineweaver e Burk
è necessario sapere l’eq. e il grafico di L.B
1
Per disegnare la retta si ricercano le intersezioni sugli assi, quindi se y = 0 cioè
____
=0
V
0=
KM 1
_______ ___
1
+
Vmax [S]
_______
Vmax
1
0 = KM _____ + 1
[S]
1
-1 = KM
_____
[S]
1
1
_____ = - ______
[S]
KM
7
1/V
1//Vma
-1/KM
1/[S]
Fig. 6
Se x = 0 cioè
1
1
1
_____
_____
_______
= 0 allora
[S]
=
V
VMAX
Questo viene fatto poiché i due valori KM e VMAX sono molto importanti per definire le funzionalità
di un enzima, ed è opportuno conoscerli con la miglior accuratezza possibile. Ricavarli dalla curva
di Michaelis-Menten non è semplice, mentre ricavare le intersezioni sugli assi di una retta risulta
molto più semplice.
(β)
β) Concentrazione dell’enzima:
v
All’aumentare della concentrazione dell’enzima aumenta anche
la velocità della reazione enzimatica, come si nota dalla fig.7
fig. 7
[E]
(γ) pH dell’ambiente di reazione:
Le variazioni di pH modificano la dissociazione dei residui amminoacilici del sito attivo variandone
la forma e la dissociazione dei gruppi funzionali del substrato, cambiando il suo riconoscimento con
il sito attivo.
In genere l’intervallo ottimale dell’enzima è compreso tra 4 e 9, vedi fig.8, al di fuori si denatura.
Ci sono però dei casi in cui l’enzima lavora bene anche a valori estremi di pH, ad es. la pepsina ha
un pH ottimale di 1
v
v
A
B
C
pH
Fig.8
ottimale
pH
pH
Fig. 9
Nella fig.9 è rappresentato l’andamento della velocità in funzione del pH per tre diversi enzimi:
A = pepsina B = papaina C = colinesterasi
8
(δ)
δ) Temperatura:
Come in tutte le reazioni un aumento di temperatura provoca un aumento esponenziale della
velocità di reazione, tuttavia questo avviene fino ad un certo valore, dopo il quale la proteina si
denatura. A questo punto l’attività enzimatica è compromessa e la velocità di reazione decresce in
modo drastico
[Note: Questa capacità viene utilizzata nell’industria alimentare, infatti le basse temperature sono
sfruttate nella refrigerazione e nel congelamento per rallentare i processi di maturazione mentre
nei processi di pastorizzazione e sterilizzazione l’uso di alte temperature permette di distruggere
parzialmente o completamente gli enzimi responsabili delle alterazioni.]
A
Fig. 10
A = curva di denaturazione
B = curva di attivazione
v
B
0°
T
60°
ottimale
Temperatura
Forze fluide.
Questo problema nasce solo per gli enzimi utilizzati industrialmente che vengono mantenuti in
agitazione in grandi reattori. In questi casi si è notato che la disattivazione, per effetti di turbolenza,
è direttamente proporzionale al prodotto v.t dove v è la velocità di flusso e t è il tempo.
Ovviamente per gli enzimi “in vivo” non esistono problemi di turbolenze.
Inibitori:
Esistono dei composti chimici in grado di rallentare o impedire la velocità di reazione enzimatica.
Essi possono agire in maniera reversibile e irreversibile.
Inibizione irreversibile:
Le molecole dell’inibitore si legano in modo irreversibile ai residui del sito attivo formando un
composto stabile. Il substrato non più interagire con l’enzima. Un esempio di inibitori sono i metalli
pesanti come Ag+, Hg2+, Pb2+che formano legami stabili con i gruppi –SH della cisteina.
Inibizione reversibile:
Può essere di due tipi: competitiva e non competitiva.
Inibizione reversibile competitiva:
Le molecole di substrato e di inibitore sono simili e competono per legarsi reversibilmente al sito
attivo catalitico.
E + S + I → E-S → E +P
→ E-I → non reagisce
9
Il grado di inibizione dipende dal rapporto tra le concentrazioni del S e dell’I; infatti la velocità di
reazione aumenta con la concentrazione del substrato, proprio perché le molecole di quest’ultimo
vanno ad occupare i siti attivi che non sono più disponibili per le molecole dell’inibitore.
Fig.11
Fig.12
Nella fig. 12 si può notare che la presenza dell’inibitore fa aumentare la pendenza della retta
corrispondente ad una Km apparente maggiore della Km reale. Apparentemente diminuisce l’affinità
dell’enzima con il substrato, perché i siti attivi sono parzialmente occupati dall’inibitore; la vmax
invece non viene alterata perché comunque i siti attivi sono tutti occupati o dal substrato o dall’
inibitore. Tramite la retta di L.B è possibile studiare se una sostanza funge da inibitore competitivo;
infatti è sufficiente ripetere più esperienze con quantità crescenti della sostanza in esame, riportare i
dati sul diagramma 1/v / 1/[S] e controllare se la pendenza aumenta con l’aumentare della quantità
della sostanza in esame. Inoltre se l’inibitore è competitivo l’entità dell’inibizione regredisce con
l’aumentare della concentrazione del substrato.
Sull’inibizione competitiva si basa l’azione dei sulfamidici i quali competono con l’acido p-ammino
benzoico nella sintesi dell’acido folico per i microrganismi.
10
[Note: Ad esempio in ambito medico l’intervento che consiste nella somministrazione di grandi
quantità di etanolo alle persone avvelenate da metanolo è basato su questo principio, in quanto vi è
la trasformazione del metanolo in formaldeide ad opera dell’enzima alcol deidrogenasi presente
nel fegato. Se vi è presente etanolo in forte eccesso questo prende il posto del metanolo
trasformandosi in acetaldeide, è meno tossica della formaldeide.]
Inibizione reversibile non competitiva:
Le molecole dell’inibitore vanno a legarsi in un sito differente dal sito attivo o con l’enzima libero
o con il complesso ES ma comunque in una zona diversa dal sito attivo detta “ sito allosterico”. In
entrambi i casi la presenza dell’inibitore nel sito allosterico deforma il sito attivo diminuendone
l’efficacia. La velocità della reazione viene diminuita, mentre non viene modificata la Km perché il
sito attivo non viene occupato dall’inibitore. Il modello proposto per queste sostanze è :
E + S → ES → E + P
+
+
I
I
↓
↓
EI + S → ESI
sia il complesso EI che il complesso ESI non sono più attivi ma
la loro formazione è reversibile. Fig. 13
Fig.14
11
Osservando la fig.14 si nota che in presenza dell’inibitore la Km non viene modificata perché il sito
attivo non è occupato da I mentre viene diminuita la vmax perché l’efficienza dell’enzima è
rallentata.
Anche in questo caso è possibile determinare se una sostanza agisce da inibitore non competitivo
riportando sul diagramma i valori di diverse esperienze con quantità crescenti del presunto inibitore;
inoltre l’inibizione non regredisce con l’aumentare della concentrazione del substrato.
Inibizione reversibile acompetitiva :
Le molecole dell’inibitore sono in grado di legarsi al complesso ES ma non all’enzima libero.
Rispondono al seguente modello :
E + S → ES → E + P
← +
I
↓↑
ESI
L’inibitore fa diminuire la vmax sottraendo parte del complesso ES dirottandola verso la formazione
del complesso ESI. Inoltre diminuendo ES diminuisce anche Km .
Dalla fig.15 si può notare che sia Km che vmax vengono modificate ed è anche possibile stabilire se
una sostanza agisce da inibitore acompetitivo.
12
V
1/V
+
inibitore
Vma
+
inibitore
1/Vma
K
Fig.15
[S
]
1/K
1/[S
]
Enzimi allosterici:
Se il legame di una molecola di substrato (o di altro legante) con l' enzima induce cambiamenti strutturali tali
da alterare le affinità dei siti vacanti, la curva di v / [S] non seguirà più la cinetica di Michaelis-Menten e
l'enzima sarà classificato come allosterico. Generalmente, ma non sempre, gli enzimi allosterici hanno delle
curve v/[S] di tipo sigmoidale.
Se il legame di una molecola di substrato (o di altro legante) facilita il legarsi di ulteriori molecole di
substrato come conseguenza di una aumentata affinità dei siti vacanti si parla di EFFETTO COOPERATIVO
POSITIVO.
I vantaggi potenziali di una risposta sigmoidale si possono constatare comparando tra loro una iperbolica
con una sigmoidale. Fig. 16
13
Dal grafico di fig. 16 si può ricavare che, nel caso della risposta iperbolica, il rapporto [ S0,9] / [ S0,1]
= 81; ciò vuol dire che per passare da un decimo della Vmax ai nove decimi della Vmax, la
concentrazione di substrato deve incrementare di ben 81 volte. Nel caso della curva sigmoidale
riportata in figura il rapporto [ S0,9] / [ S0,1] = 4,4; ciò significa che in questo caso è sufficiente un
incremento molto minore della concentrazione del substrato per passare da Vmax = 0,1 a Vmax =
0,9. In altri termini la risposta sigmoídale agisce come un interruttore e le variazioni della velocità,
per valori intermedi di velocità, appaiono più sensibili a variazioni di [S].
Gli enzimi allosterici sono costituiti da proteine a struttura quaternaria suddivisi in più subunità
dove oltre al sito attivo sono presenti uno o più siti differenti dove si inseriscono dei modulatori che
possono essere sia positivi che negativi. A riguardo vi sono due teorie, quella di Monod e quella di
Koshland. Entrambe ammettono che le subunità possano esistere in due conformazioni, T (Tesa,
cioè poco affine al substrato) e R (Rilassata, cioè molto affine al substrato)
Modello di Monod:
Secondo il modello di Monod l’entrata del substrato nel sito attivo per adattamento indotto modifica
la sua struttura riuscendo a favorire così l’entrata della seconda molecola di substrato più
facilmente. I modulatori positivi si inseriscono nei siti allosterici stabilizzando la forma del
complesso enzima-substrato nella forma rilasciata. I modulatori negativi invece ponendosi nei siti
allosterici ne stabilizzano la forma tesa impedendo l’entrata del substrato.
Questo è possibile in quanto gli enzimi sono formati da poche subunità simmetriche, ogni subunità
ospita un solo sito attivo e quindi un cambiamento di una subunità comporta il un identico
cambiamento delle subunità simmetriche.
Modello di Koshland:
Il modello di Koshland prevede l’esistenza di forme ibride intermedie, le quali si formerebbero
mano a mano che il substrato viene fissato effettuando un passaggio graduale da una struttura
all’altra. In ogni caso l’entrata della prima molecola di substrato facilita l’entrata delle altre
molecole.
Gli enzimi allosterici regolano le reazioni irreversibili dei processi metabolici.
Vedi fig. 17 nella pagina successiva
Esempio di enzima
Alcol deidrogenasi: difesa primaria del fegato
contro l’alcol. Alti livelli dell’enzima alcol
deidrogenasi nel fegato e nello stomaco
riescono a smaltire circa un bicchierino di
superalcolico ogni ora. L’alcol viene
trasformato in acetaldeide, una molecola più
tossica che poi viene convertita rapidamente
in acetato che invece è facilmente utilizzato
dalle cellule. Il nostro corpo produce almeno
nove forme diverse di alcol deidrogenasi,
ognuna con proprietà leggermente diverse e la
maggior parte di queste si trovano nel fegato.
Ogni enzima è composto da due sub unità.
L’etanolo non è l’unico substrato di questi
enzimi, che possono anche modificare il
retinolo, gli steroidi e gli acidi grassi.
14
Sito attivo
Sito attivo
Substato
Substato
Forma tesa
dell’enzima
Sito
allosterico
Sito
allosterico
Forma tesa
dell’enzima
Modulatori
positivi
Substato
Modulatori
negativi
Fig. 17
15
MECCANISMI DI REGOLAZIONE DELL’ATTIVITA’ ENZIMATICA
L’attività biochimica di tutte le cellule dipende quasi esclusivamente dall’azione degli enzimi che,
con le loro straordinarie proprietà catalitiche e con la loro capacità di regolare le reazioni
intracellulari, hanno il controllo e la coordinazione di tutti i processi metabolici.
Il patrimonio enzimatico è contenuto nei geni di ogni cellula, ma nessuna cellula trascrive
contemporaneamente tutti i suoi geni ( probabilmente meno della metà ); inoltre il numero di enzimi
prodotti varia in base alle necessità per evitare sprechi e funzionamenti disordinati.
Vi sono enzimi che devono intervenire rapidamente, per tempi brevi e con ritmi irregolari per
esempio gli enzimi coinvolti nel processo di coagulazione del sangue o gli enzimi dell’apparato
digerente; poiché produrre un enzima non è né semplice né rapido la cellula ha messo a punto
alcuni sistemi di regolazione dell’attività enzimatica volti a risolvere il problema di avere gli enzimi
pronti quando servono senza sprecare troppo materiale ed energia per sintetizzarli tutti .
I meccanismi di controllo possono:
1- far variare la sintesi e quindi la quantità di proteine enzimatiche o non enzimatiche prodotte,
cioè la loro concentrazione cellulare
2 - modificare l’attività di una proteina enzimatica già presente nella cellula.
Nel primo caso, cioè la regolazione della sintesi proteica, tutte le tappe metaboliche che conducono
dal gene alla proteina ( trascrizione, post-trascrizione, traduzione ) sono punti di controllo. Vi sono
ad esempio enzimi costitutivi, sempre necessari e sempre prodotti ed enzimi inducibili la cui sintesi
è attivata dalla presenza del substrato (es. operone lac)
Il controllo della sintesi di enzimi avviene, per i procarioti, soprattutto a livello della trascrizione e
nella fase iniziale; tutto ciò evita la sintesi di intermedi, ad esempio mRNA, non necessari.
Per gli eucarioti la regolazione può avvenire sia a livello della post-trascrizione, sia a livello della
traduzione ma i meccanismi non sono ancora del tutto noti.
Nel secondo caso senza toccare le quantità relative degli enzimi si può, aumentando l’attività di
alcuni o diminuendo quella di altri, adattare le diverse reazioni enzimatiche alle variazioni
ambientali. Questo tipo di controllo, uguale sia nei procarioti che negli eucarioti, è molto più rapido
di quello relativo alla sintesi enzimatica e permette di regolare istante per istante il flusso
metabolico di ogni cellula. Può avvenire per:
a) modifiche covalenti ( strutturali) degli enzimi effettuate durante la post-traduzione
b) associazione reversibile di attivatori o inibitori con enzimi a struttura III
modulatori positivi o negativi con enzimi a struttura IV.
Controllo mediante modifiche covalenti delle proteine enzimatiche.
Queste modifiche possono essere permanenti o reversibili.
Le modifiche permanenti avvengono su enzimi che vengono sintetizzati in forme inattive
( zimogeni o proenzimi) che per idrolisi di uno o più legami peptidici perdono un frammento della
catena proteica e si trasformano nella forma attiva. Vengono regolati con questo sistema gli enzimi
digestivi, in particolare le proteasi ( endopeptidasi e esopeptidasi ) e gli enzimi della coagulazione
del sangue ( ad esempio la protrombina ).
Fra le modifiche reversibili vi è la fosforilazione e la adenilazione.
Controllo mediante associazioni reversibili agli enzimi.
L’attività enzimatica dipende da vari fattori, pH, temperatura, concentrazione dell’enzima,
concentrazione del substrato; esaminandola in funzione della concentrazione del substrato possiamo
dividere gli enzimi in due categorie:
enzimi che seguono la cinetica di Michaelis e Menten, tutti a struttura terziaria
enzimi che seguono la cinetica di tipo cooperativo, tutti a struttura quaternaria.
16
Questi ultimi sono detti enzimi allosterici perché oltre al sito catalitico posto su ogni subunità,
recano anche uno o più siti diversi nei quali si inseriscono modulatori positivi e negativi.
Il controllo mediante gli enzimi allosterici è particolarmente importante e frequente perché la
capacità di risposta agli stimoli è molto veloce ( effetto cooperativo ) e perché i modulatori possono
avere una struttura molto diversa da quella del substrato o del prodotto.
Nella cellula questi enzimi agiscono su alcune tappe metaboliche che funzionano da veri punti di
controllo di un intero processo; in tal caso sono detti enzimi chiave regolatori e operano su una
tappa di solito irreversibile e tra le prime del processo per evitare inutili accumuli di intermedi.
Importante è anche l’aggregazione di molti enzimi che catalizzano in successione una sequenza di
reazioni tutte fra loro correlate; si tratta di sistemi multienzimatici in cui il prodotto di una reazione
è il substrato per quella successiva. Se un solo enzima del complesso ha una elevata Km questo
regolerà l’attività di tutti gli altri enzimi.
Un altro importante esempio di regolazione allosterica è l’inibizione retroattiva o retroinibizione o
feed-back nella quale lo stesso prodotto finale P di una sequenza metabolica inibisce l’azione del
primo enzima della sequenza stessa; in questo modo le cellule interrompono la produzione del
composto finale quando esso è già presente in concentrazione sufficiente e la riprendono quando la
sua concentrazione è troppo bassa.
E1 ↓
E2
E3
A --------------> B -----------> C -----------> P
↑
<------------- <------------
Un ottimo esempio è nella glicolisi la via metabolica comune a tutti gli esseri viventi con cui il
glucosio viene degradato fino ad acido piruvico.
17