Meccanismi
di patogenesi batterica:
esotossine
G. Di Bonaventura
Università di ChietiChieti-Pescara
Azione patogena dei batteri
mediata da fattori di virulenza
• Produzione di tossine (tossinogenesi)
– esotossine (principalmente Gram+)
– endotossine (LPS) (solo Gram-)
Esotossine: principali caratteristiche
• Sostanze proteiche (PM: 10-900 kDa) sintetizzate in forma solubile
dai batteri, in particolar modo dai Gram+
• Spesso controllate da geni extracromosomici (plasmidi)
• Vengono escrete nel mezzo circostante, ma rilasciate anche in
seguito a lisi cellulare
• Si legano a specifici recettori cellulari (specificità cellulare)
risultando tossiche o letali per le cellule dell’ospite
• Elevata tossicità (anche per ingestione) per gli animali: dose minima
letale 1-5 µg (appena 2x10-5 µg per la tossina botulinica)
• La natura proteica le rende altamente antigeniche (immunogene),
stimolando così la formazione di antitossina neutralizzante
• Apirogene
• Convertite (mediante trattamento con formalina, acidi, calore) a
tossoidi o anatossine
Sull’inibizione delle tossine batteriche si basa la risposta immunitaria attiva,
caratteristica dei principali vaccini antibatterici
Le tossine batteriche sono, infatti, il principale bersaglio della sieroprofilassi
Costituenti dei principali vaccini antibatterici (vaccino antitetanico, antidifterico e
antipertosse) sono le anatossine o tossoidi, esotossine alle quali è stato
artificialmente eliminato il potere tossico preservandone le proprietà
antigeniche (immunogene)
Esotossine: classificazione
•
Specificità di bersaglio (tropismo cellulare):
–
–
–
•
tossine neurotrope: agiscono a livello del sistema nervoso
centrale o periferico (tossina tetanica e botulinica)
enterotossine: agiscono sulla mucosa intestinale (tossina
colerica, enterotossine di E. coli)
tossine pantrope: diffusione dei recettori cellulari (tossina
difterica, tossina pertossica, tossina di Shiga)
Meccanismo di azione:
–
–
–
superantigeni (tossine tipo I)
esotossine che danneggiano le membrane della cellula ospite
(tossine tipo II)
tossine A-B ed altre tossine che interferiscono con le funzioni
della cellula ospite (tossine tipo III)
Esotossine di tipo I
Superantigeni
Attivazione linfociti T4:
“Presentazione” dell’antigene
1. Antigeni esogeni (batteri, virus, miceti, protozoi)
vengono fagocitati da antigen-presenting cells (APC:
macrofagi, cellule dendritiche, linfociti B) all’interno
di un fagosoma.
2. Il fagosoma si fonde con il lisosoma.
3. Degradazione proteasica degli antigeni a peptidi.
4. Molecole MHC-II vengono sintetizzate nel reticolo
endoplasmico e trasportate verso il complesso di
Golgi. Legame della catena Ii alle molecole MHC-II
(per evitare che peptidi per MHC-I si leghino a MHCII).
5-6.Il complesso MHC-II / Ii chain viene trasferito nel
complesso di Golgi all’interno di vescicole.
7. Le vescicole si fondono con il fagolisosoma
contenente peptidi. La catena Ii viene rimossa ed i
peptidi sono liberi di legarsi al MHC-II.
8. Il complesso MHCII-peptide viene trasportato alla
membrana citoplasmatica dove si ancora.
9. Il complesso peptide/MHC-II può essere riconosciuto
da un linfocita T4 mediante T-cell receptor (TCR) e
CD4 aventi forma complementare.
“Presentazione” dell’antigene
I superantigeni sono proteine batteriche ad azione
toxin-like che attivano le cellule T CD4+ legandosi
aspecificamente (senza presenza di Ag specifico) al
T cell receptor (TCR) ed al complesso maggiore di
istocompatibilità di classe II (MHC-II) dei macrofagi.
L’interazione aspecifica APC-linfocita T mediata dal
superantigene si traduce nella attivazione e
proliferazione delle cellule T e nell’attivazione dei
macrofagi con rilascio di elevate dosi di diverse
citochine: dapprima IL-2 (febbre, nausea, vomito,
diarrea) che, a sua volta, stimola la sintesi di altre
citochine (IL-1, IL-8, TNF-α, PAF) coinvolte nella
patogenesi dello shock (danno endoteliale, CID,
insufficienza respiratoria)
Legame convenzionale
linfocita T4-antigene
Superantigene: legame aspecifico
Esempi di alcuni superantigeni
di origine microbica
Toxic shock syndrome toxin-1 (TSST-1), prodotta da alcuni
ceppi di S. aureus che causano la sindrome dello shock tossico
(febbre, rush, shock)
Enterotossine, prodotte da S. aureus; causano tossinfezione
alimentare (nausea, febbre, vomito, diarrea). La tossina stimola il
vago causando vomito incoercibile.
Tossina pirogenica, prodotta da ceppi invasivi di S. pyogenes
superantigeni associati a S. pyogenes potrebbero causare psoriasi
Heat-stable toxins (sta) di ceppi enterotossigenici di E. coli
Antigeni di M. tuberculosis, del virus rabbico e di HIV
possono essere considerati superantigeni
Esotossine di Tipo II
Tossine che agiscono a livello della
superficie cellulare
Le tossine emolitiche (emolisine o citolisine) sono enzimi che producono
pori nella membrana cellulare, digeriscono materiali cellulari, alterano la
composizione della membrana
Tossina esfoliativa (due varianti antigeniche: A , B), prodotta da S. aureus, causa il
clivaggio delle proteine di matrice extracellulare dello strato granuloso
dell’epidermide (sindorme della cute pseudo-ustionata)
Esotossina B, prodotta da ceppi invasivi di streptococchi β-emolitici di gruppo A
(Streptococcus pyogenes). Questa esotossina è una proteasi che degrada il tessuto
muscolare (miosite) o la guaina di rivestimento del muscolo (fascite necrotizzante).
Citolisine prodotte da Gram+
• Queste citolisine sono costituite in gran
parte da una sola subunità
• Agiscono formando un poro “a
biscotto” (proteico) nella membrana
cellulare bersaglio
• I pori annullano il gradiente Na+/K+
transmembrana, provocando una lisi
osmotica della cellula
• L’ingresso di Ca2+ extracellulare causa
un’attivazione della cellula bersaglio
• Esempi: listeriolisina (Listeria
monocytogenes), pneumolisina
(Streptococcus pneumoniae), tossina-a
(S. aureus)
Streptolisina O vs eritrociti di coniglio
Citolisine prodotte da Gram• Repeats-in-ToXin (RTX) family
E coli – emolisina alfa (HlyA)
P. vulgaris – emolisina
Pasteurella haemolytica - leucocidina
E. coli: HlyA
• Meccanismo di azione similare a quello delle
citolisine prodotte dai Gram+
• Agiscono formando un poro funzionale
transmembrana, sebbene la struttura
differisca da quella dei pori prodotti da
Gram+
Esotossine prodotte da Clostridium perfringens
Tossine ad effetto necrotizzante ed emolitico che, insieme alla
distensione del tessuto ad opera del gas prodotto dalla
fermentazione dei carboidrati, favoriscono la diffusione della
gangrena gassosa (mionecrosi). Possono essere inoltre
causa di una forma mista diarroico-dissenterica.
tossina alfa (lecitinasi): aumenta la permeabilità dei
capillari e delle cellule muscolari distruggendo la
lecitina presente nella membrana citoplasmatica.
Questo causa edema nella gangrena gassosa.
tossina kappa (collagenasi): causa la degradazione del
tessuto connettivale e muscolare, responsabile delle
lesioni molli della gangrena gassosa.
tossina mu (ialuronidasi): causa la rottura dei legami
intercellulari nel tessuto.
Esotossine prodotte da Clostridium difficile
Colite pseudomembranosa = sindrome dissenterica con crampi,
diarrea acquosa/sanguinolenta, febbre, leucocitosi
La Tossina A è una potente enterotossina che esercita
anche attivitità citolitica, danneggiando le cellule mucosali
intestinali, che in tal modo perdono il controllo del flusso
di H2O. Inoltre, esse richiamano e distruggono i
neutrofili, causando il rilascio degli enzimi lisosomiali
che potenziano il danno tessutale.
La Tossina B è una potente tossina citolitica.
Esotossine di Tipo III
Tossine “A-B” che interferiscono con le funzioni
della cellula ospite
Le tossine A-B sono proteine dimeriche, ossia composte da due parti:
componente A (active) e componente B (binding).
Sono prodotte sia dai batteri Gram-positivi che Gram-negativi e secrete
nell’ambiente esterno
Il componente B si lega al recettore superficiale della cellula ospite, così
determinando la specificità di bersaglio della tox.
• La tossina viene, quindi, traslocata attraverso
la membrana:
• per endocitosi: il componente A si separa
da B per migrare nel citoplasma;
• altre tossine A-B prevedono l’ingresso
nella cellula del solo componente A,
generalmente attraverso un poro di
membrana.
• La principale difesa dell’ospite nei confronti
delle tossine è rappresentata dalla produzione di
anticorpi anti-tossina (neutralizzanti). Una volta
legata dall’anticorpo, la tossina non potrà più
legarsi al recettore di superficie cellulare.
Esempi di tossine A-B
• Tossina difterica (Corynebacterium diptheriae)
• Tossina di Shiga (Shigella dysenteriae, E. coli enteroemorragici
EHEC)
• Tossina colerica (Vibrio cholerae)
• Tossina pertossica (Bordetella pertussis)
• Enterotossine (Clostridium perfringens, Bacillus cereus)
• Tossina carbonchiosa (Bacillus anthracis)
• Tossina tetanica o tetanospasmina (Clostridium tetani)
• Tossina botulinica (Clostridium botulinum)
Esotossine che interferiscono con le funzioni
della cellula ospite
Inibizione della sintesi proteica cellulare:
* tossina difterica (Corynebacterium dyptheriae)
* tossina di Shiga (Shigella dysenteriae)
* tossine Shiga-like (E. coli enteroemorragici)
* tossina A (Pseudomonas aeruginosa)
Tossina difterica
regione catalitica
• Prodotta da Corynebacterium
diphteriae per conversione lisogenica
(fago temperato β) del gene tox,
attivato da carenza di Fe.
• La tossina difterica (62 kDa)
presenta tre regioni distinte:
• B, lega il recettore (COO-)
• T, di traslocazione
• A, catalitica (NH3+)
regione di
traslocazione
regione che lega
il recettore
Meccanismo di azione della tossina difterica
1
3
Legame della tossina al recettore
mediante il sito B; clivaggio da
proteasi
Dopo acidificazione dell’endosoma,
la regione di traslocazione (T) si inserisce
nella membrana endosomiale
• La morte cellulare è causata
da un blocco della sintesi
proteica secondario alla ADPribosilazione di EF-2, fattore
necessario per la traslocazione
dal sito A al sito P della catena
nascente.
• Bersaglio della tossina sono
le cellule cardiache, nervose
e renali (tossina pantropa)
• La porzione “D" del vaccino
DTP contiene il tossoide
difterico per stimolare la
sintesi di Abs “neutralizzanti”,
ossia diretti verso il
componente B della tossina.
2
Internalizzazione tox per endocitosi
4
La regione catalitica (A) passa nel citosol
dove provoca ADP-ribosilazione di EF-2,
inattivandolo
1
2
3
4
Tossina di Shiga (e tossine Shiga-like)
•
•
•
•
•
Tossina A-B (struttura A-B5), prodotta da Shigella spp e
da E. coli enteroemorragici (E. coli O157:H7)
Si lega al globoside Gb3 di membrana
Introduzione della tox per endocitosi
Tox (frammento A1) con attività catalitica Nglicosidasica, che causa la degradazione di rRNA della
cellula ospite, prevenendo così l’adesione del tRNA
“carico” e, in tal modo, blocca la sintesi proteica
cellulare.
La tossina inoltre:
– potenzia il rilascio LPS-mediato di citochine quali IL1 e TNF-α
– danneggiando le pareti dei vasi ematici, sembra
essere responsabile della sindrome uremica
emolitica, complicanza della shigellosi e delle
infezioni da E. coli O157:H7
Esotossina A di P. aeruginosa
Tossina A-B: componente A (COO-), componente B (NH3+)
Meccanismo di azione similare a quello della tossina difterica
Esotossine che interferiscono con
le funzioni della cellula ospite
Alterazione del contenuto intracellulare
di
AMP- ciclico
(azione
catalitica ADP-ribosilante):
* tossina colerica
* tossina pertossica
* tossina termolabile di E. coli
Tossina colerica
• Prodotta da Vibrio cholerae
• Struttura A2-B5
• Il componente A, formato da due frazioni (A1, A2), è dotato di attività
ADP-ribosilante
• Il componente B, formato da 5 frazioni, lega il ganglioside GM1 presente
sulle cellule epiteliali dell’intestino tenue (enterotossina)
• Aumenta la concentrazione di AMPc, causando:
- liberazione di ioni sodio, potassio, bicarbonati
- perdita di liquidi (fino a 20 L/die acqua), diarrea e grave
disidratazione
• Batterio poco invasivo, patogenicità legata alla tossina.
Proteina G stimolatoria
Proteina G inibitoria
L’adenilato-ciclasi converte l’ATP in AMP-ciclico (cAMP), “secondo”
messaggero che attiva diversi geni e funzioni cellulari.
La funzione dell’adenilato-ciclasi è regolata da due proteine dette
proteine G (che legano il GTP): la proteina G stimolatoria (Gs) attiva
l’adenilato-ciclasi, la proteina G inibitoria (Gi) inibisce l’attivazione
dell’adenilato-ciclasi.
Proteina G stimolatoria
Proteina G inibitoria
La proteina G stimolatoria (Gs) è il bersaglio della
tossina colerica, che la immobilizza nello stato attivato,
causando un significativo (fino a 100 volte maggiore)
aumento della quantità intracellulare di cAMP
La tossina colerica
L’aumento di AMPc blocca il normale trasporto di Na+ dal lume intestinale verso il
torrente ematico e causa la fuoriuscita, verso il lume, di K+ e bicarbonati
Il movimento di ioni richiama H2O dal torrente circolatorio verso il lume intestinale,
causando diarrea e massiva perdita di liquidi (mortalità per disidratazione).
Tossina pertossica
• Prodotta da Bordetella pertussis
• Costituita da una subunità tossica S1 e 5
subunità di legame (da S2 a S5 + 2 subunità
S4).
• La S2 si lega al lattosilceramide. La S3 si lega
a recettori presenti sui fagociti causando un
aumento del CR3 sulla superficie cellulare.
• La porzione S1 della tossina ha attività ADPribosilante e si lega alla proteina Gi
(regolazione negativa dell’adenilato-ciclasi),
inibendola.
Proteina G stimolatoria
Proteina G inibitoria
La proteina G inibitoria (Gi) è il bersaglio della tossina della
pertosse. La Gi inattivata non è in grado di inibire l’adenilato
ciclasi, con conseguente aumento della quantità intracellulare
di cAMP
Tossina pertossica
effetti biologici
A seconda del tipo cellulare interessato, l’aumento
intracellulare di AMPc può causare:
- nell’epitelio respiratorio, l’aumento delle
secrezioni respiratorie e della produzione di
muco, caratteristiche dello stato parossistico della
pertosse (tosse, broncospasmo, dispnea);
- nei fagociti, riduzione della fagocitosi
(chemotassi, engulfment, killing);
- nel sangue, un’aumentata sensibilità all’istamina
e conseguente aumento della permeabilità
capillare, ipotensione e shock;
- nelle cellule nervose, può causare encefalopatia.
Esotossine che interferiscono con le
funzioni della cellula ospite
Alterazione del contenuto
intracellulare di AMP-ciclico
(azione enzimatica adenilato-ciclasica):
tossina di Bacillus anthracis
* Fattore I o edema factor di Bacillus anthracis: è una
adenilato ciclasi batterica che provoca aumento di
AMPc intracellulare
* Fattore II (protective antigen): componente B della
tossina
* Fattore III: metalloproteasi
Tossina carbonchiosa
Bacillus anthracis produce tre tossine (2 x A + 1 B):
- antigene protettivo (protective antigen, PA)
- fattore edematogeno (edema factor, EF)
- fattore letale (lethal factor, LF)
PA (83 kDa) funge da componente B, legandosi ai recettori e viene clivato da una
proteasi, scoprendo un sito di legame per LF e/o EF.
EF (componente A) è una adenilato-ciclasi che potenzia la sintesi di AMPc nella
cellula ospite, influenzando la fagocitosi ed inibendo la produzione di TNF e IL-6 da
parte dei monociti. Ciò è responsabile dell’alterazione delle difese dell’ospite e causa
un forte edema (accumulo di liquidi negli spazi intercellulari), caratteristico
dell’antrace.
LF (componente A) è una proteasi che inibisce la chinasi-chinasi attivata da stimoli
mitogeni (MAPKK).
- A bassi livelli, LF inibisce il rilascio di citochine pro-infiammatorie IL-1, TNF-α e NO. Questo
può inizialmente ridurre la risposta immune nei confronti del microrganismo e della
tossina da esso prodotta.
- Ad alti livelli, invece, LF è citolitico per i macrofagi, causando il rilascio di IL-1, TNF- α e NO.
L’eccessivo rilascio di queste citochine può portare ad una massiva risposta infiammatoria
ed alla cascata dello shock, simile allo shock settico.
Principali gruppi di esotossine (classificate
per meccanismo d’azione)
Interferenza con il rilascio di
neurotrasmettitori (tossine neurotrope):
* tossina tetanica
* tossina botulinica
Tossina tetanica (tetanospasmina)
• Tossina neurotropa prodotta da Clostridium tetani
(a codificazione plasmidica)
• Sintetizzata come singola molecola (150 KDa),
viene quindi scissa da proteasi in due subunità
peptidiche:
- subunità leggera (catena A) e subunità
pesante (catena B) unite da un ponte S-S.
• La catena B si lega con l’estremità -COOH
terminale ad un recettore sulla superficie dei
neuroni (ganglioside GM2).
• La catena A, una zinco-endopeptidasi, viene
internalizzata e risale dalle terminazioni
periferiche al SNC tramite trasporto assonale
retrogrado.
Tossina tetanica: meccanismo di azione
A-B. La trasmissione nervosa è regolata dall’equilibrio tra
neurotrasmettitori eccitatori ed inibitori.
C. I neurotrasmettitori inibitori (GABA, glicina) prevengono la
depolarizzazione della membrana postsinaptica e la conduzione del
segnale elettrico.
D. La tetanospasmina non interferisce con la produzione del GABA o
della glicina, ma con il loro rilascio (attività presinaptica). In assenza
di neurotrasmettitori inibitori, l’eccitazione degli assoni non è
contrastata, causando la simultanea contrazione dei muscoli flessori
ed estensori (paralisi spastica, morte per insufficienza respiratoria)
Rilascio muscolare per
azione dei neuroni inibenti
Meccanismo di azione
della tetanospasmina
La componente "T" del vaccino DTP consiste nel tossoide tetanico, che
stimola la produzione di anticorpi neutralizzanti, ossia diretti verso il
componente B della tossina. Una volta legata dall’anticorpo, la esotossina
non sarà più in grado di legarsi ai recettori cellulari di superficie.
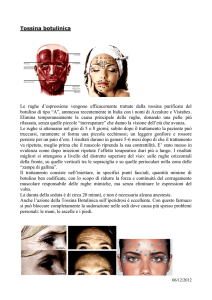
Tossina botulinica
Contrazione muscolare
mediata da acetilcolina
Meccanismo di azione
della tossina botulinica
• Clostridium botulinum produce una endopeptidasi che blocca il rilascio
di acetilcolina a livello della giunzione neuromuscolare.
• La tossina botulinica scinde la sinaptobrevina interferendo con la
formazione delle vescicole sinaptiche.
• Il risultato è la paralisi flaccida: debolezza discendente bilaterale a
carico dei muscoli periferici, morte per paralisi dei muscoli respiratori.
tossina tetanica
vs
tossina botulinica
Enterotossine
Diversi batteri (Clostridium perfringens, Bacillus cereus) producono
esotossine che si legano alle cellule del piccolo intestino. La
maggior parte di queste tossine causa una ADP-ribosilazione delle
proteine della cellula ospite che modula la sintesi di molecole
regolatrici a struttura ciclica (cAMP, cGMP) nelle cellule della
mucosa intestinale.
Elevati livelli di cAMP e cGMP provocano la perdita di elettroliti e
di acqua, causando diarrea.
Invece, le enterotossine prodotte da Staphylococcus aureus e dai
ceppi enterotossigenici di Escherichia coli esibiscono un differente
meccanismo d’azione, funzionando da superantigeni.
Proprietà delle
tossine batteriche di
tipo A–B
Le endotossine batteriche
L’endotossina è il lipolisaccaride (LPS) che
costituisce il rivestimento esterno dei batteri
gram negativi
E’ prodotta quindi dai solo batteri gram
negativi
Confronto
n
Esotossine
u
Natura proteica
F
u
u
u
u
u
Termolabili
Immunogeni
Neutralizzabili da
anticorpi
Profili di azione molto
differenziati
Estrema potenza
Alcune attive per
ingestione
n
Endotossine
u Lipopolisa ccaridi
F Termostabili
u Immunogeni , ma non
neutralizzabil i da
anticorpi
u Profili di azione po co
differenziati
u Meno potenti
u Inattive per
ingestione
Le diverse attività
del lipopolisaccaride
Tossicità mediata
dell’endotossina
da P.R. Murray, K.S. Rosenthal, G.S. Kobayashi, M.A. Pfaller
Microbiologia
EDISES
SEPSI
Indica una risposta infiammatoria sistemica (SYRS, Systemic Inflammatory
Response Syndrome) sostenuta da gravi infezioni (principalmente da gram
negativi) in organi o apparati (polmoni, addome, vie urinarie). E’ caratterizzata dalla
massiccia produzione di elevate quantità di fattori infiammatori (PGs,TNFs, IL1,
IL6, IL8, IL12).
Le citochine proinfiammatorie innescano:
• alterazione degli endoteli vascolari con collasso ipotensivo (sepsi ipotensiva)
•la cascata della coagulazione con la formazione di diffuse coagulazioni intravasali
(DIC: disseminated intravascular coagulation)
•estesi fatti emorragici con la grave compromissione di diversi organi (Shock
settico) ed effetti fatali per il paziente
SHOCK SETTICO
Termine utilizzato per raggruppare una serie di eventi fisiopatologici che portano al
collasso del sistema circolatorio causando il quadro clinico della sindrome da
insufficienza multipla di organi (MOFS) che può provocare la morte del paziente