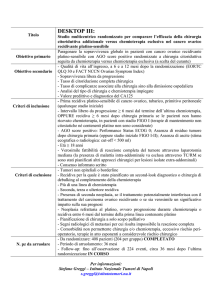
Protocollo TCGM AIEOP 2004
1. 0 BACKGROUND
I tumori a cellule germinali maligni (TCGM) dell’età pediatrica sono tumori
rari: rappresentano infatti circa il 3% di tutte le neoplasie maligne diagnosticate in
tale fascia di età, con ampie variazioni di frequenza in base all’intervallo di età
considerato. Sono fra le neoplasie solide più aggressive e hanno un tempo di
raddoppiamento di circa 20 giorni, molto simile a quello dei linfomi non Hodgkin ad
alto grado.
L’utilizzo di un approccio multidisciplinare e, soprattutto, dei moderni schemi
chemioterapici ha completamente rivoluzionato la prognosi di queste malattie, sia
nell’adulto che nel bambino, permettendo di ottenere percentuali di sopravvivenza
variabili dall’80 al 100%. Gli ottimi risultati nella cura di questa patologia non
vengono tuttavia ottenuti facilmente, ma solo grazie all’impiego di mezzi
diagnostici e terapeutici idonei.
1.1 Generalità
I TCGM presentano una tipica distribuzione bimodale con un picco intorno ai
2 e ai 20 anni di età; sono in genere tumori voluminosi, a localizzazione gonadica
o extragonadica (regione sacro-coccigea, retroperitoneo, mediastino, SNC, faccia,
collo, utero e vagina). La prima, tipica dei TCGM dell’adulto, è più frequente nei
bambini e negli adolescenti, mentre la sede extragonadica è caratteristica dei
neonati e dei bambini di età < 3 anni. Questa distinzione non riguarda solo la
sede, ma anche i tipi istologici e l’andamento clinico della malattia, rendendo la
neoplasia nell’adolescente assimilabile a quella dell’adulto (1, 2, 3).
Tra le diverse possibili sedi di insorgenza, la regione sacro-coccigea, seguita
dall’ovaio, costituiscono i siti di più frequente interessamento, mentre la
localizzazione testicolare, nel bambino prepubere, è di più raro riscontro.
Dal punto di vista istologico (capitolo 11.0),
i TCGM sono un gruppo
eterogeneo di tumori. Di recente, sotto gli auspici della WHO (World Health
Organization), l’American Force Institute of Pathology (AFIP) e i principali Centri
anatomo-patologici a livello mondiale hanno adottato una nuova classificazione
istologica (4). Questa si basa sulla teoria istogenetica secondo cui tutti i diversi tipi
morfologici di tumori a cellule germinali derivano da cellule germinali neoplastiche
che differenziano secondo varie direzioni. Tale classificazione differisce da quella
1
Protocollo TCGM AIEOP 2004
proposta dal British Testicular Tumor Panel (BTTP) secondo la quale le neoplasie
germinali vanno distinte in due categorie: a) seminoma/disgerminoma (di
derivazione dalle cellule germinali); b) teratoma (originato da blastomeri embrionali
sfuggiti al controllo degli organizzatori nel corso dello sviluppo). Dal punto di vista
pratico distinguiamo:
i tumori a cellule germinali maligni non germinomatosi (TCGMNG); carcinoma
embrionale – CE; tumore del seno endodermico o del sacco vitellino o yolk
sac tumor – TSE; coriocarcinoma; teratoma con componente maligna
sarcomatosa o carcinomatosa; forme miste, nelle quali diverse componenti
sono presenti nello stesso tumore;
i germinomi (la terminologia più specifica distingue: seminoma se a
localizzazione testicolare, disgerminoma se a localizzazione ovarica,
germinoma quando è localizzato al SNC o al mediastino).
I TCGMNG tendono a metastatizzare per via linfatica ed ematica, soprattutto ai
polmoni;
i
germinomi
hanno
una
prognosi
migliore,
metastatizzano
prevalentemente per via linfatica e le metastasi ematogene sono rare. In generale
i germinomi hanno una prognosi migliore rispetto i TCGM non germinomatosi.
Al di sotto dei 4 anni i TCGM sono rappresentati quasi esclusivamente da
tumori del seno endodermico, puri o associati a teratoma;
nel paziente
adolescente l’istologia include tutte le varianti, spesso combinate tra loro, come
accade nella popolazione adulta.
I teratomi (maturi e immaturi) con marker tumorali nei limiti di norma, non
sono inclusi nei TCGM, e vengono trattati in un addendum a parte (addendum 7)
Si intendono fornire linee guida di trattamento.
1.2 Marker
Nella maggioranza dei casi, nel siero di
pazienti affetti da TCGM sono
dosabili uno o due marker tumorali: α-fetoproteina (αFP) e β-subunit of Human
Chorionic Gonadotropin (βHCG).
L’ αFP è normalmente elevata durante la vita fetale e diminuisce
progressivamente dopo la nascita, raggiungendo valori normali dopo l’8° mese di
vita (addendum 1) l’emivita plasmatica è di 5 giorni. La βHCG ha una emivita
plasmatica di circa 24-36 ore.
2
Protocollo TCGM AIEOP 2004
Nei TCGM non germinomatosi αFP e/o βHCG sono elevate in maniera
patologica nel 90% dei casi.
L’ αFP è aumentata nel 90% dei TSE, nel 70% dei
CE.
La presenza di valori patologici dei marcatori circolanti (soprattutto αFP) in
teratomi (maturi e/o immaturi) indica la presenza di microfocolai di tessuto
maligno, rappresentati nella maggioranza dei casi da microfocolai di TSE.
La βHCG è sempre elevata nel coriocarcinoma, e nel 70% dei TCGM in
generale (1,2). Nei TCGM germinomatosi invece un aumento della βHCG,
solitamente non molto importante, è rilevabile solo nel 30% dei casi, tanto che
questi tumori sono anche definiti non secernenti.
La semplice determinazione dei marker può essere altamente orientativa per
porre diagnosi di TCGM e va comunque fatta sempre prima di ogni procedura
terapeutica. Tempi di dimezzamento più lunghi rispetto alla loro emivita e la
persistenza di valori patologici dopo un intervento chirurgico sono segni indiretti,
ma obiettivi di presenza di metastasi (malattia occulta) e/o di chirurgia non
radicale.
La lattato deidrogenasi (LDH) rappresenta un marker aspecifico: livelli elevati
sono correlati con la massa del tumore (metastasi). La risposta ai trattamenti si
accompagna a progressiva riduzione del valore del marker (5).
1.3 Fattori prognostici
Dopo il netto miglioramento della prognosi grazie ai moderni schemi
chemioterapici, la ricerca di fattori prognostici è risultata fondamentale per
permettere di identificare i gruppi di pazienti che possono giovarsi di terapie più
aggressive e i gruppi che invece possono ridurre od omettere la chemioterapia
adiuvante.
L’International Germ Cell Cancer Collaborative Group (IGCCCG) (5) ha
messo a punto per la popolazione adulta un “prognostic factor-based staging
system” per l’identificazione dei pazienti a rischio e per una successiva migliore
pianificazione terapeutica.
Fattori prognostici negativi sono:
l’istologia (tumori non germinomatosi rispetto ai germinomi)
la sede del tumore primitivo (sede extragonadica versus gonadi)
la presenza di metastasi viscerali, diverse da quelle polmonari
3
Protocollo TCGM AIEOP 2004
Anche i valori dei marker (αFP, βHCG e LDH) hanno un ruolo fondamentale nella
suddivisione delle diverse categorie di pazienti.
Sempre in ambito di studi condotti nella popolazione adulta all’interno della
malattia localizzata e completamente asportata (Stadio I), sono stati ricercati fattori
prognostici che permettessero di identificare i gruppi a più alto rischio di ricaduta.
Nei TCGM non germinomatosi localizzati al testicolo, in assenza di metastasi a
distanza, la presenza di invasione vascolare peritumorale e di carcinoma
embrionale aumenta il rischio di ricaduta di malattia (6, 7). Nei tumori gonadici
femminili delle pazienti adulte, la malattia confinata all’ovaio e completamente
asportata non riceve ulteriori trattamenti solo nel caso di disgerminoma. Per ogni
altra istologia viene spesso consigliata la chemioterapia adiuvante (8, 9, 10).
Le conoscenze relative ai tumori germinali in età pediatrica, in termini di
fattori prognostici, sono nettamente minori per svariati motivi: esiguità numerica
delle casistiche, maggiore eterogeneità della malattia, difficoltà nel comparare i
risultati degli studi per la minore standardizzazione della patologia (sistemi diversi
di stadiazione, differenti indicazioni chemioterapiche, esclusione/inclusione
variabile dei teratomi immaturi in studi non recenti).
Dall’analisi multivariata condotta dai ricercatori francesi della Société
Française d’Oncologie Pédiatrique (SFOP) su un gruppo di 81 pazienti affetti da
TCGM secernenti, con malattia localizzata o metastasi linfonodali (sono esclusi
dall’analisi i tumori localizzati e completamente asportati e i casi con metastasi a
distanza), emerge che l’αFP rappresenta il fattore prognostico fondamentale
seguito dalla sede del tumore e dallo Stadio della malattia (11). Vengono pertanto
identificate 3 categorie a rischio suddivise in base a:
valori di αFP
sede
stadio della neoplasia
Risultati analoghi vengono confermati in una casistica di 124 casi con
malattia localizzata (anche in questo studio sono esclusi i tumori localizzati e
completamente asportati) e metastatica dai ricercatori dell’United Kingdom
Children’s Cancer Study Group (UKCCSG II) (12) : come per la SFOP, l’αFP si
conferma fattore prognostico più importante seguito dalla sede del tumore e
successivamente dallo Stadio. In genere, nelle diverse casistiche il valore limite di
αFP che identifica il gruppo a prognosi severa è > 10.000 ng/ml.
4
Protocollo TCGM AIEOP 2004
La βHCG, a differenza degli adulti, non sembra rivestire alcun significato
prognostico: va tuttavia segnalata l’esiguità numerica dei tumori secernenti βHCG
in entrambi i gruppi. L’unica discrepanza tra i 2 studi è rappresentata dalla sede
sacro-coccigea, che rappresenta per la SFOP una sede a cattiva prognosi, mentre
è considerata a buona prognosi per l’UKCCSG. Anche i ricercatori tedeschi
(MAKEI)
concordano
nel
ritenere
la
localizzazione
sacro-coccigea,
indipendentemente dalle dimensioni del tumore e dall’estensione nell’osso, dalla
presenza o meno di metastasi e dal valore del marker, come categoria ad alto
rischio (13, 14).
Il precedente protocollo AIEOP conferma il fattore prognostico indipendente
della sede extragonadica (15).
1.4 Chirurgia
La chirurgia rappresenta uno dei più importanti atti terapeutici nei TCGM (3,
16, 17). Attualmente, in ambito pediatrico (SFOP, POG, UKCCSG) la chirurgia
costituisce l’unica procedura terapeutica nella malattia confinata all’organo di
origine, asportata in maniera completa (Stadio I), indipendentemente dalla sede
della malattia (fa eccezione il gruppo tedesco MAKEI che somministra
chemioterapia in caso di tumori sacrococcigei, Stadio I). La chirurgia è
fondamentale, infine, per l’asportazione di lesioni residue post-chemioterapia,
siano esse metastasi o residui del tumore primitivo (18, 19).
1.5 Chemioterapia
L’introduzione del Cisplatino ha completamente rivoluzionato la prognosi dei
TCGM, rendendoli guaribili in un’elevata percentuale di casi. Numerosi studi
randomizzati e non condotti prevalentemente su pazienti adulti hanno mostrato
una maggiore efficacia del Cisplatino rispetto ad altri farmaci, e in particolare nei
confronti del Carboplatino (20-25).
Al momento attuale il regime chemioterapico di riferimento per TCGM
dell’adulto è rappresentato dall’associazione del Cisplatino con l’Etoposide e la
Bleomicina (PEB), somministrato per un massimo di 4 cicli (20, 21). Alcuni
ricercatori hanno focalizzato la loro attenzione sul ruolo svolto dalla Bleomicina,
soprattutto in considerazione della sua tossicità, ma importanti studi randomizzati,
condotti sempre su pazienti adulti, hanno dimostrato l’importanza di questo
farmaco (26-29).
5
Protocollo TCGM AIEOP 2004
Anche nella realtà pediatrica il Cisplatino è il farmaco più utilizzato in
associazione ad altri farmaci (PVB e PEI del gruppo SFOP, PEB del POG/CCG,
PE e PEI
del MAKEI), mentre i ricercatori inglesi hanno somministrato il
Carboplatino in combinazione (JEB) (12, 30), per evitare la tossicità renale e
neurosensoriale del Cisplatino, ottenendo comunque un EFS dell’87%. Tale dato è
stato confermato da un recente studio nordamericano (31). E’ stato finora eseguito
un unico studio comparativo nei TCG pediatrici che ha confermato la maggiore
attività del cisplatino rispetto al carboplatino (32).
Il gruppo POG ha effettuato uno studio pilota randomizzato per i pazienti
pediatrici considerati ad alto rischio, confrontando lo schema PEB con il Cisplatino
a dosi convenzionali (20 mg /m2 per 5 gg) versus alte dosi (40 mg/m2 per 5 gg).
Risultati preliminari con un EFS a 3 anni mostrano una differenza a favore delle
alte dosi di Cisplatino, ma con una maggiore tossicità neurosensoriale,
ematopoietica e renale (33, 34).
1.6 Radioterapia
La radioterapia rappresenta un’efficace arma terapeutica per i germinomi.
Per la occasionalità della malattia nei bambini e soprattutto per le sequele
iatrogene, in considerazione della disponibilità di una valida alternativa
terapeutica, la radioterapia viene utilizzata solo in casi selezionati.
1.7 Precedenti Studi Italiani
1.7.1 Protocollo AIEOP TCG 91
E’ il primo studio cooperativo italiano sui tumori a cellule germinali in età
pediatrica (15). Il trattamento è stato differenziato secondo la sede (testicolare ed
extratesticolare) e l’istologia (teratoma maturo, immaturo, tumori germinali maligni
non seminomatosi e seminomi). La stadiazione adottata è stata quella della SFOP
modificata: unica per tutte le sedi (gonadiche ed extragonadiche) e suddivisa in 4
stadi di malattia.
Nel protocollo sono stati arruolati in 8 anni 95 pazienti con TCGM maligni, di
cui 14 tumori seminomatosi (TCGMS) e 81 non seminomatosi (TCGMNS) così
suddivisi per sedi: 59 gonadici, di cui 23 ovaio con età mediana 129 mesi (range
1-177) e 36 testicolo con età mediana 18 mesi (range 1-190); 36 extragonadici, di
cui 30 sacro-coccigei con età mediana 17 mesi (range 1-166), 1 retroperitoneo, 2
6
Protocollo TCGM AIEOP 2004
mediastino, 1 faccia e 1 vulva. Inoltre, sono stati registrati 21 teratomi immaturi e
114 teratomi maturi.
1.7.1.1 Trattamento
TCGMNG
tumori testicolari Stadio I: sola sorveglianza, dopo l’asportazione chirurgica
tumori in altre sedi, stadi I-IV, tumori testicolari Stadio I, con mancata
negativizzazione dei marker:
trattamento combinato con chirurgia e
chemioterapia con modalità diversificate in rapporto allo Stadio e alla risposta
terapeutica. Schema Chemioterapico: Carboplatino mg 400/m2/die, gg 1, 2;
Etoposide mg 150/m2/die gg 1,2; Actinomicina-D mg 1,5 /m2/die g 21;
Ifosfamide mg 3000/m2/die gg 21,22; Vincristina mg 1,5/m2/die g 21.
TCGMG
Stadio I: sorveglianza dopo chirurgia
Stadio II: chirurgia + radioterapia
stadi III-IV: trattamento uguale a quello delle forme non seminomatose.
In
31 pazienti è stata eseguita all’esordio solo terapia chirurgica con
resezione completa della massa; una paziente è stata trattata con radioterapia,
dopo la chirurgia completa; 63 pazienti sono stati trattati all’esordio con
chemioterapia e con l’asportazione completa della massa in 14 di essi,
asportazione con residuo microscopico in 7, con residuo macroscopico in 20; in 22
è stata eseguita solo biopsia. Chirurgia post chemioterapia è stata eseguita in 19
pazienti (completa in 10, parziale in 9).
1.7.1.2 Risultati
Tre pazienti sono deceduti per sepsi durante le prime fasi del trattamento; 2
non hanno risposto e 20 pazienti sono recidivati: 9 sono in II remissione, 1 è vivo
con malattia, 12 sono deceduti per progressione di malattia.
Tutti i pazienti in cui si è ottenuta resezione completa della massa o del
residuo post chemioterapia sono rimasti in remissione completa. La sopravvivenza
globale è stata dell’81.5% e la sopravvivenza libera da eventi del 71.4%, con una
mediana di osservazione di 48 mesi.
Dall’analisi dei risultati è stato rilevato che: a) l’asportazione completa della
neoplasia all’esordio o in chirurgia differita costituisce un indice prognostico
7
Protocollo TCGM AIEOP 2004
favorevole; b) la localizzazione gonadica presenta, anche in caso di malattia
asportata in maniera incompleta o solo biopsiata, un decorso favorevole.
All’analisi
unifattoriale
sono
risultate
differenze
significative
per
la
sopravvivenza relativamente allo Stadio (I,II,IIIa vs IIIb, IIIc; IV: p<0,005) e ai valori
di αFP (10000 ng/ml vs >10000 ng/ml, p< 0,001). All’analisi multifattoriale il fattore
prognostico indipendente è risultato essere la sede del tumore primitivo (sede
gonadica vs extragonadica p< 0,001). Il gruppo a prognosi severa è rappresentato
dalla malattia extragonadica asportata in maniera incompleta.
Dai dati riportati si evince che i risultati del trattamento delle forme
extragonadiche sono inferiori a quelli di altre casistiche pediatriche recenti.
E’ possibile che l’utilizzo iniziale di uno schema a 2 farmaci invece che a 3 e
l’alternanza di cicli CE e IVA non abbia permesso una ottimale intensità di
trattamento delle forme a maggiore rischio, pur con la somministrazione di derivati
del platino, ritenuti i farmaci più efficaci nel trattamento dei TCGM.
1.7.2 Protocollo TCGM 98
Dei 20 pazienti finora registrati nel protocollo, 7 avevano tumore testicolare, 6
ovarico, 6 sacro-coccigeo (1 retroperitoneale).
1.7.3
Esperienza dell’Istituto Nazionale Tumori
Costituisce una esperienza monoistituzionale, evolutasi nel corso degli anni e
mutuata, adattandola al bambino, dall’approccio ai TCGM dell’adulto: da
sottolineare la differenza “epidemiologica” fra la casistica AIEOP, che include una
maggior percentuale di bambini piccoli e con malattia nella sede sfavorevole extragonadica, rispetto a quella dell’Istituto che ha caratteristiche più simili a quelle
dell’adulto.
Attualmente la sola sorveglianza, senza alcuna terapia adiuvante, viene
utilizzata per i bambini affetti da TCGM del testicolo, dell’ovaio e in sedi
extragonadiche, con malattia confinata all’organo di origine, completamente
asportata e con marker negativizzati.
La chemioterapia adottata nel corso di questi ultimi anni è lo schema PEB,
modificata rispetto allo standard, omettendo una somministrazione di Bleomicina
(giorni 2 e 15, omesso giorno 9), per ridurre il rischio di tossicità polmonare.
Ancora
più
recentemente
si
è
deciso
di
modificare
il
programma
di
somministrazione classico, suddiviso in 5 giorni, riducendolo a 4 giorni. La scelta
8
Protocollo TCGM AIEOP 2004
dello schema PEB è stato motivato dalla sua dimostrata superiorità nel paziente
adulto rispetto ad altre combinazioni chemioterapiche, con una tossicità acuta e
tardiva non rilevante.
Nessuno dei bambini e adolescenti trattati nel corso di
questi anni presso la divisione di Pediatria dell’Istituto Nazionale Tumori è
deceduto per motivi connessi al trattamento chemioterapico. Nel corso degli anni il
numero di cicli somministrato è andato progressivamente diminuendo, fino ad
arrivare attualmente ad un massimo di 4 cicli.
Sono stati osservati nel corso di circa 20 anni: 109 tumori gonadici (80
testicolari, di cui nessun seminoma, e 29 ovarici) e 15 extragonadici. Dei 29 tumori
ovarici 11 erano stadi III e 3 stadi IV secondo la classificazione FIGO: 4 pazienti
sono progredite durante il trattamento e una è ricaduta a pochi mesi dal termine
delle cure. Tutte e 5 le pazienti sono decedute per malattia: l’ EFS e OS sono
81.8%, con un follow-up mediano di 112 mesi (35).
Degli 80 tumori testicolari 31 erano Stadio clinico I: 6 sono ricaduti e tutti
sono stati resi liberi da malattia (EFS 80.6% e OS 100% a 69 mesi di FU mediano)
(36). I rimanenti 49 casi sono costituiti da pazienti con metastasi linfonodali al
retroperitoneo
o
con
metastasi
a
distanza:
3
sono
deceduti
per
recidiva/progressione di malattia, 1 per sepsi in corso di HD-CT, dopo
progressione durante la chemioterapia di prima linea, e 2 ragazzi sono morti
senza evidenza di malattia, per incidente stradale. DFS e OS a 60 mesi sono
rispettivamente 90% e 89.2 %.
Tra i 15 bambini con malattia extragonadica sono stati osservati 6 tumori
sacro-coccigei, 3 mediastinici, 4 retroperitoneali, 1 tumore a partenza della vagina
e 1 massa connatale del palato molle: i decessi sono stati 3 per recidiva/
progressione di malattia (1 mediastino, 1 sacro-coccige e 1 massa del palato
molle).
9
Protocollo TCGM AIEOP 2004
2.0 RAZIONALE E PREMESSE TERAPEUTICHE
Nel razionale e nelle premesse terapeutiche del nuovo protocollo si è tenuto
conto dei risultati dei precedenti studi AIEOP, dell’esperienza dell’Istituto
Nazionale Tumori di Milano, delle esperienze dei principali gruppi cooperativi
pediatrici, riassumibili come segue:
−
la scelta della stadiazione messa a punto dal Pediatric Oncology Group
(POG) è dovuta ad una migliore aderenza alle problematiche pediatriche,
soprattutto nei confronti delle neoplasie ovariche, e a una uniformità di vedute
nei confronti delle diverse sedi (gonadiche ed extragonadiche). La
stadiazione è stata modificata aggiungendo lo Stadio metastatico occulto,
caratterizzato dalla assenza di malattia documentabile radiologicamente ma
con marcatore/i presente/i a valori patologici.
−
la scelta dello schema PEB è stato motivato dai numerosi dati scientifici che
ne hanno dimostrato l’efficacia nei TCGM (20-29, 32, 33). Considerando che
esistono diversi regimi PEB, lo schema utilizzato è stato ottenuto mediando
l’esperienza dell’Istituto Nazionale Tumori di Milano con quella dei gruppi
cooperativi pediatrici internazionali. Quattro cicli di chemioterapia PEB sono
considerati il “gold standard” per i pazienti adulti ad alto rischio con tumori
germinali non seminomatosi (5). Non è ancora così ben chiaramente definito
il numero massimo di cicli chemioterapici da somministrare in ambito
pediatrico, soprattutto per la maggiore eterogeneità della neoplasia. Tuttavia,
i recenti studi sono indirizzati verso una minore durata del trattamento a
favore di una maggiore intensità di dose, anche in considerazione del tempo
di raddoppiamento dei TCGM. Pertanto, nel presente protocollo il trattamento
chemioterapico di prima linea viene modulato in base alla sede e allo Stadio
della malattia, prevedendo comunque un massimo di 4 cicli di chemioterapia.
−
la scelta di sospendere il trattamento chemioterapico nei pazienti operati in
maniera completa dopo chemioterapia di prima linea e chirurgia sul residuo/i
tumorale/i, pur con componente tumorale maligna (CTM) all’esame istologico,
e nei pazienti con chirurgia incompleta senza CTM,
è stata effettuata
analizzando i dati della letteratura. Tali dati tuttavia non forniscono delle linee
guida, mancando risultati scientifici certi a favore o contro ulteriore
chemioterapia. I pazienti con CTM nel residuo asportato, se mantenuti in
sorveglianza, hanno un maggiore rischio di ricaduta rispetto al gruppo trattato
10
Protocollo TCGM AIEOP 2004
con ulteriore chemioterapia, ma la sopravvivenza globale dei due gruppi è
uguale (17). In linea anche con le scelte di altri protocolli pediatrici, si è
preferito privilegiare una riduzione del carico terapeutico e di optare per la
sorveglianza.
−
la scelta dello schema ICE nei pazienti resistenti o ricaduti dopo
chemioterapia di prima linea è stata motivata dalla riconosciuta attività
dell’Ifosfamide e del Carboplatino (28, 30, 31, 37) nei TCGM, anche in
considerazione dalla minore nefro e ototossicità di quest’ultimo rispetto il
Cisplatino.
−
la chemioterapia ad alte dosi è considerata una valida opzione nei pazienti
adulti refrattari al Cisplatino (38-42).
−
la ricerca di fattori prognostici che possono influenzare le future scelte
terapeutiche è fortemente influenzata dalle maggiori acquisizioni disponibili
nella letteratura dei TCGM dei pazienti adulti.
In particolare:
1)
la presenza di invasione vascolare, valutata dal patologo, e di carcinoma
embrionale nel primitivo testicolare Stadio clinico I nelle casistiche di giovani
adulti aumenta la probabilità (dal 20 al 50%) (6, 7) di metastasi ai linfonodi
retroperitoneali. Tale informazione è relativa al solo tumore testicolare
dell’adulto e dell’adolescente, mentre non sono disponibili dati analoghi per la
malattia a localizzazione ovarica o extragonadica e in particolare nei TCGM
pediatrici.
2)
nei tumori testicolari metastatici dell’adulto i valori della βHCG e/o della αFP
e/o dell’LDH permettono di identificare 3 diverse categorie di rischio (5).
L’analisi di 2 casistiche pediatriche (SFOP e UKCCSG) non ha mostrato
alcuna influenza significativa della βHCG, a differenza della αFP, che riveste
un significato prognostico sfavorevole. Non esistono inoltre informazioni
comparabili nei bambini, circa il valore prognostico dell’LDH.
3)
all’interno del gruppo di pazienti con metastasi e primitivo testicolare, le
metastasi polmonari e
ai linfonodi distanti rappresentano un fattore
prognostico favorevole rispetto le altre sedi metastatiche (osso, SNC, fegato)
(5). Non esistono dati analoghi nelle casistiche pediatriche.
11
Protocollo TCGM AIEOP 2004
3.0 OBIETTIVI
3.1 Obiettivi primari specifici del corrente studio
non effettuare chemioterapia complementare alla chirurgia nei pazienti con
Stadio I di malattia;
effettuare chemioterapia per un massimo di 4 cicli nei tumori gonadici Stadio
II, III e IV;
effettuare chemioterapia per 4 cicli nei tumore extragonadici Stadio II, III e
IV, nel tentativo di migliorare la sopravvivenza rispetto il precedente studio
AIEOP TCG-91;
sospendere le cure ai pazienti operati in maniera completa al termine della
chemioterapia, indipendentemente dalla presenza di CTM all’esame
istologico, e ai pazienti operati in maniera incompleta ma senza CTM
all’esame istologico.
3.2 Obiettivi secondari :
valutare prospetticamente l’impatto prognostico della invasione vascolare
peritumorale e/o della presenza di aree di carcinoma embrionale nel tumore
primitivo dei pazienti di Stadio I;
valutare prospetticamente l’impatto prognostico della βHCG e dell’LDH nello
Stadio II, III e IV;
valutare
prospetticamente
l’impatto
prognostico
delle
metastasi
non
polmonari e non linfonodali nello Stadio IV;
valutare le sequele iatrogene sul midollo emopoietico, sulla funzionalità
renale e uditiva, sull’apparato respiratorio e sulla fertilità dello schema PEB,
somministrato per un massimo di 4 cicli;
valutare le percentuali di risposta allo schema ICE, prima della terapia
mieloablativa, nei pazienti resistenti e nei ricaduti dopo prima linea;
valutare l’efficacia di un programma di chemioterapia ad alte dosi sequenziali
con autotrapianto di progenitori ematopoietici circolanti (PEC), nei pazienti
resistenti e nei ricaduti entro 6 mesi dal termine della chemioterapia di prima
linea.
12
Protocollo TCGM AIEOP 2004
3.3 Altri obiettivi
incrementare l’arruolamento dei pazienti in Italia;
raccogliere i dati clinici e patologici dei tumori germinali (maligni e non) in età
pediatrica;
creare una banca di campioni biologici per eventuali studi molecolari e di
citogenetica.
13
Protocollo TCGM AIEOP 2004
4.0 REGISTRAZIONE ED ELEGGIBILITA’ DEI PAZIENTI
E' richiesto che i Centri partecipanti allo studio:
registrino tutti i pazienti con diagnosi di TCG maligno e non (teratoma maturo
e immaturo), indipendentemente dall’età;
forniscano materiale diagnostico per la revisione centralizzata e per gli studi
biologici correlati;
inviino all’Ufficio Operativo dell’Istituto Nazionale Tumori (responsabile Sig.ra
Pinuccia Valagussa), le schede per la raccolta dati nei tempi previsti.
Tutti i Centri partecipanti dovranno inoltre ottenere l'autorizzazione del loro
Comitato Etico e il consenso informato del paziente (o tutore dello stesso)
4.1 Criteri di eleggibilità
età inferiore ai 18 anni
consenso informato
diagnosi istologica di tumore a cellule germinali maligno extracranico
diagnosi istologica di teratoma (maturo e/o immaturo), ma con valori
patologici di αFP e/o βHCG, attestanti la presenza di microfocolai di tessuto
maligno e/o con localizzazioni metastatiche e/o con CTM carcinomatosa o
sarcomatosa
ricaduta maligna di teratoma (maturo e/o immaturo), provata istologicamente
o mediante valori patologici di αFP e/o βHCG.
La diagnosi clinica basata sui reperti radiologici e sui valori patologici per età dell’
αFP e/o βHCG è accettata solo nei casi in cui la procedura anestesiologica risulti
pericolosa per il paziente o le condizioni cliniche impongano un trattamento
chemioterapico d’urgenza.
14
Protocollo TCGM AIEOP 2004
4.2 Criteri di esclusione
precedente trattamento chemio-radioterapico. L’intervento chirurgico, anche
se eseguito presso un centro non partecipante e anche se non aderente alle
linee guida del protocollo, non costituisce un criterio di esclusione
TCGM intracranici
importante disfunzione di organo, tale da indurre a modificare nei tempi e
nelle dosi la somministrazione chemioterapica (questi pazienti verranno
registrati )
TCGM come secondo tumore
I pazienti di età superiore ai 18 anni trattati secondo le indicazioni del protocollo,
su indicazioni del Centro di afferenza, verranno registrati, ma valutati a parte.
Si richiede anche la registrazione dei seguenti casi:
pazienti con gonadi disgenetiche rimosse profilatticamente e al cui esame
istologico sia stata fatta diagnosi di neoplasia germinale in situ.
15
Protocollo TCGM AIEOP 2004
5.0 ITER TERAPEUTICO
5.1 Chirurgia alla diagnosi
Rimane, quando possibile, il primo e fondamentale momento terapeutico in
tutti i pazienti. Gli obiettivi della chirurgia sono:
l’asportazione radicale del tumore primitivo; la ricerca della radicalità non
deve però comportare interventi demolitivi;
l’accertamento della estensione della malattia e il prelievo di materiale
bioptico nei casi in cui ci si accorga solo al tavolo operatorio della
impossibilità di una chirurgia non radicale (vedi direttive chirurgiche);
nei casi in cui le indagini radiologiche escludano una exeresi radicale, è
indicato l’accertamento istologico tramite biopsia a cielo aperto. Si tratta di un
intervento
chirurgico
di
minima,
condotto
esclusivamente
a
scopo
diagnostico, che può essere condotto anche con tecniche miniinvasive.
5.2 Chemioterapia primaria
E’ prevista nelle seguenti situazioni:
impossibilità ad effettuare una chirurgia radicale;
rischio di una chirurgia demolitiva;
Stadio IV di malattia (eccetto per i primitivi testicolari, nei quali si raccomanda
sempre la rimozione del tumore);
Prima di effettuare la chemioterapia primaria si richiede l’accertamento
istologico. La diagnosi è sufficiente mediante marker (αFP e/o βHCG) solo nei casi
in cui la procedura anestesiologica risulti pericolosa per il paziente o le condizioni
cliniche impongano un trattamento chemioterapico di urgenza. I valori dei marker,
in questi casi specifici, verranno discussi con i coordinatori del protocollo.
Il trattamento preoperatorio consiste di tre farmaci (PEB), da continuare al
massimo per 4 cicli, al termine dei quali è prevista la chirurgia sul tumore primitivo
e/o sulle sedi metastatiche residue. Una valutazione iniziale della risposta verrà
eseguita dopo 2 cicli di trattamento: nei casi con mancata risposta o progressione
si passerà alla terapia di 2° linea.
5.3 Chirurgia differita
Ha i seguenti obiettivi:
16
Protocollo TCGM AIEOP 2004
asportazione radicale del tumore primitivo o e/o delle sedi metastatiche. In
questi casi è da tenere in considerazione anche la chirurgia demolitivi;
la tecnica chirurgica raccomandata è descritta nel paragrafo relativo.
5.4 Trattamento postoperatorio
Tiene conto di 2 fattori:
sede del tumore primitivo
stadio
Le dosi e i tempi di somministrazione dei farmaci sono descritti nel paragrafo
relativo.
5.5 Persistenza di tessuto patologico, con marker negativi, al termine del
programma terapeutico
Per i pazienti con marker negativi e persistenza di massa residua al termine
del programma chemioterapico è prevista la chirurgia. In base all’ esame
istologico del residuo si procederà come segue:
chirurgia completa senza CTM all’EI: sorveglianza
chirurgia completa con CTM all’EI: sorveglianza
chirurgia incompleta con CTM all’EI: terapia di 2° linea
chirurgia incompleta senza CTM EI: sorveglianza
17
Protocollo TCGM AIEOP 2004
6.0 DEFINIZIONE DI STADIO
6.1 Ovaio
Stadiazione POG/CCG
Stadio I: malattia limitata all’ovaio (alle ovaie) e completamente asportato;
washing peritoneale negativo per cellule maligne. Nessuna evidenza clinica,
radiologica o istologica di malattia estesa oltre l’ovaio/e; marker tumorali
normalizzati dopo la chirurgia secondo la loro emivita; la presenza di
“gliomatosis peritonei” non altera lo Stadio;
Stadio II: malattia microscopica residua o positività linfonodale <2 cm
(misurazione del patologo); washing peritoneale negativo per cellule maligne;
marker tumorali positivi o negativi; la presenza di “gliomatosis peritonei” non
altera lo Stadio;
Stadio III: interessamento linfonodale >2cm (misurazione del patologo);
malattia macroscopica residua o sola biopsia; coinvolgimento dei visceri per
contiguità (omento, intestino,vescica); washing peritoneale positivo per
cellule maligne; marker tumorali positivi o negativi;
Stadio IV: metastasi a distanza, marker positivi o negativi;
metastatico occulto: Stadio I ma con marker tumorali persistentemente
positivi dopo la chirurgia radicale.
6.2 Testicolo
Stadiazione POG/CCG
Stadio I: tumore limitato al testicolo e completamente rimosso tramite
orchiectomia per via inguinotomica; marker negativi o normalizzati durante il
decorso postoperatorio, secondo la loro emivita plasmatica; linfonodi
retroperitoneali negativi all’imaging; esame istologico negativo per neoplasia
nel tessuto di radicalizzazione inguino-scrotale nei casi di orchiectomia
transcrotale;
Stadio II: orchiectomia eseguita per via trans-scrotale con rottura del tumore;
malattia microscopica nello scroto o nel cordone spermatico; interessamento
dei linfonodi retroperitoneali all’imaging (<2 cm); esame istologico positivo
per neoplasia nel tessuto di radicalizzazione inguino-scrotale nei casi di
orchiectomia transcrotale; marker positivi o negativi;
18
Protocollo TCGM AIEOP 2004
Stadio III: interessamento dei linfonodi retroperitoneali > 2cm all’imaging;
marker positivi o negativi;
Stadio IV: presenza di metastasi a distanza; marker positivi o negativi.
metastatico occulto: Stadio I ma con marker tumorali persistentemente
positivi dopo la chirurgia radicale.
6.3 Malattia extragonadica
Stadiazione POG/CCG
Stadio
I:
resezione
microscopicamente
completa
del
tumore
con
coccigectomia nel caso di tumore sacro-coccigeo; margini tumorali negativi;
marker negativi o normalizzati secondo la loro emivita plasmatica
Stadio II: residui microscopici, linfonodi negativi, marker tumorali positivi o
negativi;
Stadio III: residuo macroscopico o solo biopsia diagnostica; linfonodi regionali
positivi o negativi; marker positivi o negativi;
Stadio IV: metastasi a distanza ; marker positivi o negativi;
metastatico occulto: Stadio I ma con marker tumorali persistentemente
positivi dopo la chirurgia radicale.
NB: Nella malattia extragonadica l’interessamento dei linfonodi regionali
all’imaging o all’esame istologico, indipendentemente dall’entità dell’exeresi del
tumore primitivo e degli stessi, assegna il caso allo Stadio III.
19
Protocollo TCGM AIEOP 2004
7.0
PROGRAMMA CHEMIOTERAPICO E VALUTAZIONE TERAPEUTICA
7.1 Testicolo
Stadio I: sorveglianza
Stadio II: PEB per 3 cicli
Stadio III: PEB per 3 cicli ed eventuale chirurgia al termine, se residuo/i
Stadio IV e metastatico occulto: PEB per 4 cicli ed eventuale chirurgia al
termine, se residuo/i, ivi comprese le localizzazioni metastatiche al polmone o
al fegato
Per quanto riguarda i pazienti con chirurgia alla diagnosi inadeguata, si
propone di sottoporli a nuovo intervento chirurgico di radicalizzazione inguinoscrotale al più presto possibile (entro 6 settimane). In caso di presenza di tumore
nel tessuto asportato al momento della radicalizzazione (indipendentemente dalla
negatività dei margini di exeresi) il paziente viene considerato in Stadio II.
Diversamente da ciò, se l’esame istologico del tessuto asportato non dovesse
mostrare neoplasia, il paziente rimane assegnato allo Stadio I.
Allo stop terapia il paziente non deve avere segni radiologici di malattia né
marker tumorali patologici, anche nei casi in Stadio III e IV in cui all’esame
istologico del materiale asportato alla chirurgia post-chemioterapia si sia
documentata la presenza di CTM. Tuttavia i margini di resezione devono essere
liberi da infiltrazione tumorale (vedi anche paragrafo 5.5)
Nei casi in cui si abbiano dei dubbi circa la positività all’imaging dei linfonodi
retroperitoneali per neoplasie primitive del testicolo si raccomanda di contattare il
coordinatore dello studio (per una eventuale revisione centralizzata del material
radiologico) e di considerare l’opportunità di un accertamento istologico del
linfonodo sospetto. La positività o meno dei linfonodi regionali condiziona un
trattamento diverso.
7.2 Ovaio
Stadio I: sorveglianza
Stadio II: PEB per 3 cicli
Stadio III: PEB per 4 cicli e chirurgia al termine.
Stadio IV e metastatico occulto: PEB per 4 cicli ed eventuale chirurgia del/i
residui, ivi comprese le metastasi.
20
Protocollo TCGM AIEOP 2004
Nei casi in cui non ci si sia stata asportazione del tumore primitivo all’esordio,
al termine della chemioterapia si deve SEMPRE procedere all’asportazione
dell’ovaio coinvolto, indipendentemente dallo Stadio della malattia e anche nel
caso in cui tutte le indagini radiologiche e i marcatori tumorali risultino
normalizzati.
Nei casi di tumori ovarici bilaterali si consiglia di condividere la scelte
terapeutiche con il centro coordinatore e si procede come di seguito:
se il riscontro di coinvolgimento di entrambe le ovaie avviene durante la
seduta operatoria, si valuterà la possibilità di effettuare una biopsia bilaterale
o una ovarosalpingectomia monolaterale sulla sede più estesamente colpita
e una tumorectomia, conservando la parte sana dell’ovaio meno coinvolto.
Successivamente la paziente verrà trattata con chemioterapia secondo
schema PEB per 3-4 cicli e al termine di questa fase chemioterapica si
raccomanda SEMPRE l’asportazione dell’ovaio più coinvolto all’esordio e
una exeresi conservativa di quello meno coinvolto. Nel caso quest’ultimo si
presenti microscopicamente normale, si raccomanda la semplice biopsia
(vedi anche paragrafo 10.2.9a);
se il riscontro di coinvolgimento di entrambe le ovaie avviene tramite le
indagini radiologiche, si effettueranno 3-4 cicli di chemioterapia secondo
schema PEB, dopo aver effettuato accertamento bioptico su entrambe le
ovaie. Al termine è prevista la chirurgia (vedi paragrafo 10.2.9a), secondo le
direttive appena sopra riportate.
Allo stop terapia il paziente non deve avere segni radiologici di malattia né
marker tumorali patologici, anche nei casi in Stadio III e IV in cui all’esame
istologico del materiale asportato alla chirurgia post-chemioterapia si sia
documentata la presenza di CTM. Tuttavia i margini di resezione devono essere
liberi da infiltrazione tumorale (vedi anche paragrafo 5.5)
7.3 Malattia extragonadica
Stadio I extragonadici: sorveglianza
Stadio II extragonadici: PEB X 4 cicli
Stadio III-IV extragonadici e metastatico occulto: PEB X 4 cicli ed eventuale
chirurgia dei residui neoplastici al termine, ivi comprese le localizzazioni
metastatiche al polmone o al fegato
21
Protocollo TCGM AIEOP 2004
Si sottolinea l’importanza della radicalità chirurgica e della negatività per
neoplasia dei margini confermata dall’anatomo patologo, nella malattia giudicata
Stadio I. Nei casi dubbi o in cui dovessero mancare dettagliate informazioni al
riguardo, si raccomanda di assegnare il paziente allo Stadio II.
Nei tumori sacro-coccigei, in cui non si sia proceduto ad asportazione
del tumore primitivo all’esordio, al termine della chemioterapia si procederà
SEMPRE, indipendentemente dallo Stadio e anche nel caso in cui tutte le
indagini radiologiche e i marcatori tumorali risultino normalizzati, ad
asportazione della sede del tumore primitivo, includendo la coccigectomia;
Nei casi in cui sia documentata una remissione completa all’imaging e al
controllo dei marker tumorali e
qualora
l’asportazione del tumore primitivo
preveda una chirurgia demolitiva (es. localizzazione uterina) si procederà
comunque ad esplorazione chirurgia e a prelievi bioptici multipli.
Allo stop terapia il paziente non deve avere segni radiologici di malattia né
marker tumorali patologici, anche nei casi in Stadio III e IV in cui all’esame
istologico del materiale asportato alla chirurgia post-chemioterapia si sia
documentata la presenza di CTM. Tuttavia i margini di resezione devono essere
liberi da infiltrazione tumorale (vedi anche paragrafo 5.5)
7.4 Valutazione dello stato di malattia e della risposta terapeutica
Una valutazione clinica e radiologica dello stato di malattia deve essere
eseguita:
-
dopo la chirurgia iniziale
-
dopo 2 cicli di chemioterapia (prima del III ciclo)
-
al termine della chemioterapia
-
dopo la chirurgia differita e /o la chirurgia delle metastasi
Per facilitare il confronto si devono utilizzare le stesse indagini radiologiche
impiegate alla diagnosi. Nei TCGM non va utilizzato solamente il criterio
dimensionale per la valutazione della risposta, soprattutto nelle forme secernenti e
nei tumori che presentano anche una componente teratomatosa ma anche il
dosaggio serico dei marcatori tumorali.
22
Protocollo TCGM AIEOP 2004
8.0 CRITERI DI RISPOSTA
8.1 Definizione della risposta al termine della chemioterapia
Risposta completa (RC): mancanza di segni strumentali di malattia e
normalizzazione dei marker tumorali, secondo la loro emivita, della durata di
almeno 4 settimane;
Risposta parziale (RP): riduzione > 50% nella somma del prodotto dei due
diametri perpendicolari principali di tutte le lesioni misurabili, senza evidenza di
progressione o comparsa di nuove lesioni e/o declino dei marker tumorali, se
patologici alla diagnosi, secondo la loro emivita e con durata di almeno 4
settimane.
Mancata Risposta (MR): riduzione < 50% nella somma del prodotto dei due
diametri perpendicolari principali di tutte le lesioni misurabili, senza evidenza di
progressione o comparsa di nuove lesioni e/o declino dei marker tumorali, se
patologici alla diagnosi, inferiore alla loro emivita o invariati rispetto alla diagnosi,
della durata di almeno 4 settimane.
Progressione di malattia: aumento volumetrico> del 25% rispetto alla
misurazione iniziale del prodotto della misurazione iniziale dei due diametri
perpendicolari principali delle lesioni misurabili, e/o comparsa di nuove lesioni e/o
incremento dei livelli sierici dei marker.
Si sottolinea che la mancata regressione dimensionale della sede di malattia
accompagnata da normalizzazione dei marker tumorali non è da ritenersi
espressione di non risposta, residuando pressoché costantemente in queste
situazioni tessuto teratomatoso. E’ altresì noto che la componente teratomatosa
può addirittura aumentare volumetricamente, ovviamente con marker tumorali nei
limiti di norma: questa situazione viene definita “growing teratoma syndrome” (43)
e in questi casi l’unico approccio previsto è quello chirurgico.
8.2 Definizione dello stato di malattia alla fine del programma di terapia (dopo
chemioterapia e chirurgia differita)
Nessuna evidenza di malattia (NED)
−
reperto alla chirurgia differita (post-chemioterapia) di residuo costituito da
tessuto fibrotico o necrotico. Assenza di segni strumentali di malattia e
23
Protocollo TCGM AIEOP 2004
normalizzazione dei marker tumorali, secondo la loro emivita, della durata di
almeno 4 settimane (Remissione Completa patologica, RCp);
−
reperto alla chirurgia differita (post-chemioterapia) di residuo costituito da
teratoma (maturo e/o immaturo). Assenza di segni strumentali di malattia e
normalizzazione dei marker tumorali, secondo la loro emivita, della durata di
almeno 4 settimane;
−
reperto alla chirurgia differita (post-chemioterapia) di residuo costituito da
CTM e asportazione microscopicamente completa. Assenza di segni
strumentali di malattia e normalizzazione dei marker tumorali, secondo la loro
emivita, della durata di almeno 4 settimane.
Risposta parziale (RP)
-
reperto alla chirurgia differita di CTM nel residuo tumorale resecato in modo
incompleto e riduzione >50% nella somma del prodotto dei due diametri
perpendicolari principali di tutte le lesioni misurabili, senza evidenza di
progressione o comparsa di nuove lesioni e/o declino dei marker tumorali, se
patologici alla diagnosi, secondo la loro emivita e con durata di almeno 4
settimane.
Mancata Risposta (MR)
-
reperto alla chirurgia differita di CTM nel residuo tumorale resecato in modo
incompleto e riduzione <50% nella somma del prodotto dei due diametri
perpendicolari principali di tutte le lesioni misurabili, senza evidenza di
progressione o comparsa di nuove lesioni e/o declino dei marker tumorali, se
patologici alla diagnosi, inferiore alla loro emivita o invariati rispetto alla
diagnosi, della durata di almeno 4 settimane.
Progressione di malattia
-
aumento volumetrico > del 25% rispetto alla misurazione iniziale del prodotto
dei due diametri perpendicolari principali delle lesioni misurabili con reperto
alla chirurgia differita di CTM nel residuo tumorale resecato in modo
incompleto e/o comparsa di nuove lesioni e/o incremento dei livelli sierici dei
markers.
Rientrano in questo gruppo anche i casi con reperto alla chirurgia differita di
componente tumorale maligna nel residuo tumorale resecato in modo
incompleto".
24
Protocollo TCGM AIEOP 2004
8.3 Tempi di dimezzamento
Una negativizzazione dei marcatori avvenuta con tempi di dimezzamento
maggiori di quelli
normali (>2 giorni per la βHCG e >5 giorni per l’αFP) fa
sospettare che esista una neoplasia residua. Gli stessi limiti vanno tenuti in
considerazione nel valutare la risposta parziale, mancata risposta e progressione
di malattia. Più difficile è la determinazione del tempo di dimezzamento durante o
subito dopo la chemioterapia, in quanto durante la distruzione cellulare i valori
sierici di solito aumentano.
25
Protocollo TCGM AIEOP 2004
9.0 INDAGINI DIAGNOSTICHE E DI FOLLOW-UP
La diagnosi deve essere stabilita istologicamente. E’ prevista l’eccezione nel
caso di tumori secernenti (e quindi con marker al di fuori dei valori normali e
corretti secondo l’età del bambino) solo nei casi in cui la procedura
anestesiologica risulti pericolosa per il paziente o le condizioni cliniche impongano
un trattamento chemioterapico di urgenza.
Per l’accertamento bioptico sono
richiesti almeno 4 prelievi con tru cut e ago 14-16 G.
La determinazione dei marker tumorali (αFP, βHCG) richiede una
valutazione in termini assoluti. Nel caso siano attesi valori elevati si consiglia di
segnalarlo al proprio laboratorio per approntare le opportune diluizioni seriali dei
campioni da dosare.
9.1 Pre-chirurgia
esame obiettivo, peso e altezza del paziente, valutazione dello stato generale
e dello sviluppo puberale. Segnalazione di eventuali malformazioni congenite
marker sierologici: αFP, βHCG, LDH
gravindex nei soggetti femminili in età fertile
esame emocromocitometrico con formula e conta piastrine
azotemia, creatininemia, elettroliti, transaminasi, bilirubina, fosfatasi alcalina,
uricemia, esame urine
ECG
Rx torace nelle due proiezioni
TAC del torace se la Rx del torace è positiva e a discrezione del singolo
centro nel caso in cui la Rx del torace sia negativa
ecografia addome, pelvi e retroperitoneo
TAC addome superiore e inferiore con mdc, con attenta valutazione del
retroperitoneo
RMN della pelvi nel caso di TCGM dell’ovaio
esame audiometrico o potenziali evocati uditivi nei casi candidati a
chemioterapia
spirometria nei casi candidati a chemioterapia e se l’età del paziente lo
permette
26
Protocollo TCGM AIEOP 2004
NB L’esame elettivo per lo studio del retroperitoneo è la TAC con mdc; quello per
lo studio dell’ovaio è la RM con Gadolinium.
La TAC del Torace di routine, nei pazienti con Rx del torace negativo per
localizzazioni secondarie, verrà effettuata a discrezione del Centro Responsabile
Per la valutazione della funzionalità renale nei pazienti candidati a
chemioterapia, oltre ai valori di creatininemia e azotemia, si richiedono:
Na, K, Ca, Mg e fosforo sierici
equilibrio acido base
esame urine completo e valutazione su campione di urine di creatininuria,
proteinuria, Na, K e P, β2 migroblobulina e microalbumine
Si richiedono inoltre:
analisi cromosomica, nei casi in cui l’esame obiettivo o l’istologia del TCGM
possano
essere
suggestive
di
alterazioni
cromosomiche
(es.
gonadoblastoma, TCGM in gonadi disgenetiche)
scintigrafia ossea, nei casi sospetti per localizzazioni secondarie allo
scheletro
9.2 Indagini da eseguire in corso di trattamento
esame obiettivo e valutazione dello stato generale ad ogni ciclo terapeutico
esame emocromocitometrico
con formula e conta piastrine, azotemia,
creatininemia, elettroliti, transaminasi, bilirubina, fosfatasi alcalina, uricemia,
esame urine prima di ogni ciclo terapeutico
marker sierologici (αFP, βHCG, LDH) prima di ogni ciclo terapeutico e al
termine del programma chemioterapico
marker sierologici (αFP, βHCG, LDH) dopo ogni atto chirurgico e fino alla
normalizzazione dei valori, nei casi di valori patologici
TAC e/o RMN post-chirurgia della sede del tumore primitivo nel caso di
residuo, prima del primo ciclo terapeutico e dopo qualsiasi altro atto
chirurgico
RX torace in 2 proiezioni dopo 2 cicli terapeutici, quindi dopo l’ultimo ciclo.
ecografia addome, pelvi e retroperitoneo dopo 2 cicli terapeutici, quindi dopo
l’ultimo ciclo
TAC e /o RMN del tumore primitivo e/o delle localizzazioni secondarie dopo 2
cicli di chemioterapia, quindi dopo l’ultimo ciclo
27
Protocollo TCGM AIEOP 2004
9.3 Indagini da eseguire al termine del
trattamento chemioterapico per la
valutazione della funzionalità renale:
statura
creatinina sierica
azotemia
acido urico
Na, K, Ca, Mg e fosforo sierici
equilibrio acido base
fosfatasi alcalina
esame urine completo e valutazione su campione di urine di creatininuria,
proteinuria, Na, K e P, β2migroblobulina e microalbumine
9.4 Indagini da eseguire dopo la fine della terapia
I controlli che devono essere eseguiti in tutti i pazienti dopo il termine della
terapia, sono riportati nel seguente schema,considerando come momento di inizio
la data della diagnosi (compresi gli stadi I).
INDAGINI
1° anno
2° anno
3° anno
4° anno
5° anno
EO
ogni 2 mesi
ogni 3 mesi
ogni 4 mesi
annuale
annuale
LDH
ogni 2 mesi
ogni 3 mesi
ogni 4 mesi
annuale
annuale
αFP/βHCG♦
ogni mese
ogni 2-3 mesi
ogni 4 mesi
annuale
annuale
RX torace
ogni 2 mesi
ogni 3 mesi
ogni 4 mesi
annuale
annuale
Eco
retroperitoneo
e/oTAC
ogni 2 mesi
ogni 3 mesi
ogni 4 mesi
annuale
annuale
Eco±TAC±RMN°
tumore primitivo
e/o metastasi
ogni 2 mesi
ogni 3 mesi
ogni 4 mesi
annuale
annuale
♦ solo per i pazienti con tumore secernente e/o con teratoma come componente del tumore. Nei
casi non secernenti i marker andranno valutati ogni 6 mesi per i primi 2 anni, indi annualmente.
° la scelta di effettuare, oltre all’ecografia, la Tac o la Rmn è lasciata a discrezione di ogni centro
responsabile, in caso di sospetti o dubbi posti dall’esame ecografico.
28
Protocollo TCGM AIEOP 2004
Per la valutazione delle sequele iatrogene, solo per i pazienti sottoposti a
chemioterapia, si richiedono i seguenti esami:
INDAGINI
1° anno
2° anno
3° anno
4° anno
5° anno
Emocromo
ogni 4 mesi
ogni 6 mesi
annuale
annuale
annuale
Funzionalità
renale
ogni 4 mesi
ogni 6 mesi
annuale
annuale
annuale
Statura
annualmente per 5 anni
Creatinina sierica
annualmente per 5 anni
Azotemia
annualmente per 5 anni
Uricemia
annualmente per 5 anni
Na, K, Ca,Mg e P sierici
annualmente per 5 anni
Equilibrio acido base
annualmente per 5 anni
Fosfatasi alcalina
annualmente per 5 anni
Esame urine completo
annualmente per 5 anni
Valutazione su campione di proteinuria,
creatinuria, P, Na e K, β2microglobulina e
annualmente per 5 anni
microalbumine
Spirometria
Esame audiometrico o
potenziali evocati uditivi
annualmente per 5 anni
annualmente per 5 anni
29
Protocollo TCGM AIEOP 2004
10.0 DIRETTIVE CHIRURGICHE PER I TCGM
10.1 Terminologia
10.1.1 Exeresi radicale
E’ l’asportazione della neoplasia senza residui neppure microscopici. La
valutazione di radicalità microscopica è istologica. A tal fine è necessario
sottolineare che:
il pezzo asportato deve essere inviato “a fresco” (non fissato in formalina)
all’anatomopatologo, segnalando l’orientamento della massa e le zone in cui
l’exeresi è stata condotta ai limiti macroscopici della neoplasia;
devono essere eseguite biopsie multiple sul letto tumorale, per quanto
possibile, in particolare sulle sedi in cui la radicalità è risultata incerta;
non è da considerare radicale una exeresi eseguita seguendo la
pseudocapsula del tumore: si ritiene opportuno, quando possibile, asportare il
tumore con un margine di tessuto macroscopicamente sano;
il concetto di radicalità implica inoltre l’asportazione della massa senza
rottura.
NB:
l’exeresi
seguendo
la
pseudocapsula
è
accettata
nelle
forme
presumibilmente non maligne.
10.1.2 Exeresi mutilante
E’ da considerare mutilante l'exeresi chirurgica che comporti danni
anatomici, funzionali o estetici importanti, tali cioè da danneggiare in modo
significativo e permanente la qualità della vita. In considerazione delle sedi di più
frequente riscontro dei TCGM, gli interventi mutilanti che si possono ipotizzare
sono:
lesione del frenico
colonstomia o ileostomia definitive
derivazione urinaria definitiva
cistectomia
asportazione di entrambe le ovaie
asportazione della vagina e/o dell’utero.
La chirurgia demolitiva deve essere presa in considerazione soltanto in
chirurgia differita quando siano esaurite tutte le possibilità di trattamento.
30
Protocollo TCGM AIEOP 2004
10.1.3
Biopsia
E’ un intervento chirurgico di minima, condotto esclusivamente a scopo
diagnostico quando non sia fattibile l'exeresi radicale. Si raccomanda di effettuare
prelievi multipli e in zone solide. E’ preferibile limitare al minimo l’impiego
dell’elettrobisturi o non utilizzarlo affatto per possibili fenomeni di necrosi che
potrebbero influenzare la diagnosi. La biopsia può essere eseguita anche con
tecniche miniinvasive, o mediante tru-cut (14-16 G) sotto guida ecografica o a
cielo aperto. Il materiale asportato dovrà essere sufficiente per la tipizzazione
istologica e biologica della neoplasia e dovrà essere inviato a fresco
all’anatomopatologo. Se la biopsia viene praticata con tru-cut sono necessari
almeno 4 prelievi.
10.1.4 Exeresi con residui microscopici
E’ l’asportazione macroscopicamente radicale della neoplasia ma con residui
microscopici rivelati dall’esame istologico sui margini del pezzo asportato o sulle
biopsie del letto tumorale. Poiché la valutazione successiva e il trattamento dei
residui microscopici sono difficili, l'esecuzione di un'exeresi con residui
microscopici in chirurgia iniziale dovrebbe essere evitata. (In caso di residui
microscopici vedi paragrafo 10.2.1).
10.1.5 Exeresi con residui macroscopici
E’ l’asportazione del tumore con residui misurabili. In base ai risultati dei
precedenti protocolli se tale intervento viene condotto in chirurgia iniziale non
fornisce alcun vantaggio rispetto alla biopsia.
10.1.6 Reintervento precoce (primary reexcision)
E’ un reintervento allargato, ma non mutilante, condotto sul letto tumorale,
allo scopo di asportare residui minimi o microscopici (anche sospetti), al fine di
ottenere una radicalità istologica, prima di iniziare qualsiasi altro trattamento. Tale
intervento è considerato chirurgia iniziale se condotto il prima possibile e
comunque non oltre le 6 settimane dal primo intervento di exeresi.
10.2 Generalità
10.2.1 Chirurgia iniziale
31
Protocollo TCGM AIEOP 2004
Si definisce iniziale la chirurgia eseguita prima di altre terapie. L' intervento
chirurgico iniziale può essere eseguito:
a scopo terapeutico (exeresi radicale), quando in base alle indagini
strumentali sia ipotizzabile l’asportazione radicale della neoplasia (vedi criteri
di operabilità al paragrafo 10.2.3)
a scopo diagnostico (biopsia), nei casi in cui non sia prevedibile ottenere una
exeresi radicale. In casi di tumore mediastinico che determini una sindrome
mediastinica e in presenza di marker elevati, può essere iniziata la CT
omettendo la biopsia a causa dei rischi anestesiologici.
Se possibile, la valutazione istologica verrà eseguita successivamente.
L’exeresi iniziale con residui macroscopici o microscopici non fornisce migliori
garanzie di controllo locale nei confronti della semplice biopsia ed è pertanto da
evitare. Se i risultati istologici dimostrano la presenza di residui microscopici sui
margini di una resezione iniziale, è raccomandato un reintervento precoce (vedi
paragrafo 10.1.6).
In presenza di neoplasia con metastasi a distanza può essere asportata
inizialmente se ciò risulta non rischioso per il paziente e agevole tecnicamente (es.
massa ovarica di piccole dimensioni).
10.2.2 Esplorazione linfonodale
La biopsia dei linfonodi regionali è raccomandata nei casi in cui venga
effettuata l’exeresi del tumore; fanno eccezione a questa regola i TCGM del
testicolo, per i quali l'invasione linfonodale viene definita dall’imaging. Interventi di
asportazione dei linfonodi con intento di radicalità non sono indicati. Se si esegue
soltanto una biopsia del tumore primitivo l’esplorazione dei linfonodi regionali non
è richiesta.
10.2.3 Criteri di operabilità iniziale
La fattibilità dell'exeresi iniziale è definita sulla base dei dati di imaging che
possono identificare dei fattori che rendono improbabile l’asportazione radicale e
conservativa del tumore. Tali fattori dipendono dalla sede del tumore e dalle sue
caratteristiche (dimensioni, struttura, infiltrazione delle strutture circostanti). Si
ribadisce che di regola il tumore primitivo non va asportato se sono presenti i
fattori sottoelencati e/o metastasi a distanza. Fanno eccezione i tumori del
testicolo per la facilità della aggressione chirurgica. In caso di tumore ovarico e
32
Protocollo TCGM AIEOP 2004
riscontro intraoperatorio di metastasi addominali, è a discrezione del chirurgo
l’asportazione del tumore primitivo.
10.2.4 Fattori di rischio per un’asportazione incompleta del tumore
1) LEGATI ALLA SEDE
a) collo
b) torace
- coinvolgimento della carotide o della trachea
- infiltrazione del plesso brachiale
- compressione e/o infiltrazione della trachea o dei bronchi
- coinvolgimento dei vasi mediastinici e/o del nervo frenico
NB: in queste sedi può essere necessaria l'asportazione iniziale, anche non radicale, di tumori che
determinino grave dispnea
- estensione all'utero
- estensione alla vescica o ad altre strutture pelviche
- estensione ad entrambe le ovaie
NB : in caso di tumore bilaterale presumibilmente non maligno è accettata l’enucleazione salvo
reintervento precoce in caso di malignità all’esame istologico
c) ovaio:
d) retroperitoneo
e) sacro-coccige
- estensione ai reni
- coinvolgimento dei grossi vasi retroperitoneali (aorta, tripode, arterie
mesenteriche, vena cava, vasi renali)
- infiltrazione del retto o di altri organi pelvici
- estensione nel canale neurale
2) LEGATI ALLE CARATTERISTICHE DEL TUMORE
Quando le dimensioni, la struttura cistica o necrotica, l'infiltrazione delle strutture
circostanti rendono dubbia la fattibilità di un'exeresi radicale, soprattutto per TCG
extragonadici maligni, si consiglia di optare per la semplice biopsia iniziale.
10.2.6 Chirurgia differita
E' la chirurgia dei residui dopo chemioterapia. Scopo principale della
chirurgia differita è l'asportazione completa dei residui (secernenti o non
secernenti), ma può essere anche solo la biopsia.
La decisione dipende anche dalla negativizzazione o meno dei marker
tumorali. Il programma prevede al massimo 4 cicli di chemioterapia: se dopo 4 cicli
c’è ancora malattia evidente radiologicamente ma con marker negativizzati è
obbligatoria l’esplorazione chirurgica per l’asportazione del residuo se possibile o
in alternativa debulking o ampia biopsia. Se i marker risultano ancora a livelli
patologici dopo 4 cicli, contattare i centri coordinatori, per cambiare il trattamento
chemioterapico.
33
Protocollo TCGM AIEOP 2004
Nei pazienti in remissione clinica (radiologica e umorale) completa dopo
chemioterapia non è indicata la chirurgia differita. In generale la chirurgia differita
non è mutilante ma nei casi non responsivi alla chemioterapia sono indicati anche
interventi demolitivi. E’ importante che i pezzi operatori vengano inviati a fresco
all’anatomopatologo per individuare con sicurezza la maturazione o il viraggio
istologico della neoplasia. In chirurgia differita è raccomandata l’esplorazione dei
linfonodi regionali soprattutto se non biopsiati in chirurgia iniziale.
10.2.7 Chirurgia delle metastasi
L’asportazione delle metastasi è indicata quando queste persistono dopo i
cicli previsti di chemioterapia, se l’intervento è tecnicamente fattibile. In generale
l’intervento non dovrebbe essere mutilante, ma in caso di chemioresistenza e con
tumore primitivo controllato sono accettate asportazioni demolitive.
10.2.8 Sacro-coccige
Lo studio radiologico della neoplasia sia alla diagnosi sia dopo
chemioterapia ha particolare importanza in questa sede per definire i criteri di
operabilità. In caso di metastasi o
dubbio sulla fattibilità dell’exeresi radicale
iniziale di una neoplasia sicuramente maligna (es. infiltrazione del retto o di altri
organi pelvici, estensione nel canale neurale) e con marker positivi, è meglio
optare per la semplice biopsia secondo le regole generali e programmare una
chirurgia differita dopo chemioterapia.
E’ stato dimostrato che l’exeresi differita non peggiora la prognosi. Nei
neonati e nei lattanti i TCGM sono molto più frequentemente benigni che maligni
ed è opportuno eseguire esami istologici al congelatore anche ripetuti. Se i
congelatori dimostrano che si tratta di un tumore maligno è meglio rinunciare
all’exeresi ed eseguire la semplice biopsia secondo le direttive generali; se
orientano per lesione benigna è indicato continuare l’intervento per ottenere
l’asportazione almeno macroscopica della massa
L’accesso chirurgico in caso di exeresi, sia iniziale sia differita, può essere
o solo posteriore o combinato (posteriore e addominale attraverso una
laparotomia traversale sottombelicale): in tutti i casi è obbligatorio asportare tutto il
coccige possibilmente in blocco unico con il tumore ed eseguire biopsie multiple
sul letto tumorale a controllo della radicalità. Se viene eseguita una laparotomia è
34
Protocollo TCGM AIEOP 2004
necessario prelevare un campione di liquido peritoneale per citologia e ricercare
localizzazioni metastatiche intraaddominali soprattutto linfonodali.
Se l’exeresi avviene esclusivamente per via posteriore, si raccomanda la
biopsia dei linfonodi crurali; in caso di exeresi mediante approccio combinato si
consiglia il controllo bioptico anche dei linfonodi iliaci.
N.B. : Si sottolinea che in epoca neonatale la principale causa di mortalità dei
TCGM sacro-coccigei è lo shock emorragico da rottura del tumore. Tale
eventualità deve essere tenuta in considerazione in tutti i pazienti con TCGM
sacro-coccigeo e specialmente quando i dati ecografici prenatali dimostrano una
massa voluminosa e riccamente vascolarizzata. In questi casi può essere indicato
iniziare
l’intervento
con
una
laparotomia
urgente
al
fine
di
clampare
temporaneamente l’aorta distale o di legare l’arteria sacrale media.
10.2.9 Altre sedi
I TCGM raramente si localizzano al collo, al mediastino, al retroperitoneo:
per queste sedi le indicazioni chirurgiche seguono le direttive generali.
L’approccio iniziale in genere si limita a una biopsia diagnostica.
L’asportazione iniziale, anche non radicale, può essere richiesta per TCGM del
collo e del mediastino che provochino grave distress respiratorio.
10.2.9 a Ovaio
L’obiettivo è l’asportazione radicale del tumore con conservazione, ove
possibile, degli organi riproduttivi. In chirurgia iniziale la castrazione va evitata. In
generale la scelta fra exeresi iniziale o sola biopsia è possibile sulla base delle
indagini radiologiche preoperatorie.
se si decide di eseguire soltanto la biopsia, questa può essere fatta con una
piccola laparotomia, in laparoscopia o percutaneamente con tru-cut (sotto
guida ecografica). Non sono indicate manovre di staging intraoperatorie;
se il chirurgo decide per l’exeresi, può essere sufficiente una incisione di
Pfannestiel, o essere necessaria un'ampia laparotomia trasversale sulla base
delle dimensioni della massa. Non si consigliano laparotomie mediane.
Appena aperto il peritoneo, si raccoglie il liquido peritoneale eventualmente
presente oppure si esegue il lavaggio peritoneale per valutazione citologica.
Si procede con l’esplorazione dell’omento, di tutta la cavità peritoneale
35
Protocollo TCGM AIEOP 2004
(compreso il peritoneo sottodiaframmatico) e del fegato. Devono essere poi
valutati i visceri pelvici;
se il tumore è monolaterale e non chiaramente maligno all’obiettività
macroscopica e all’esame al congelatore, se ne raccomanda l’exeresi
conservativa con risparmio del tessuto ovarico sano;
se il tumore è monolaterale e chiaramente maligno, è indicata l’ovarosalpingectomia e le manovre di stadiazione devono essere completate
dall’omentectomia, dalla biopsia dei linfonodi retroperitoneali e di tutte le zone
sospette. La biopsia dell’ovaio controlaterale non è necessaria, se non in
presenza di aree sospette. In caso di presenza di noduli peritoneali
(gliomatosi?), sono indicate l’asportazione del tumore, se fattibile, e la biopsia
di almeno un nodulo;
in caso di tumore bilaterale non sicuramente maligno è indicata la
tumorectomia bilaterale. In caso di tumore bilaterale sicuramente maligno
due opzioni sono accettabili: l’annessiectomia del tumore più voluminoso con
tumorectomia o biopsia
controlaterale, oppure la semplice biopsia senza
exeresi dei tumori. L’ovariectomia bilaterale non è accettabile.
Può essere utile, prima della laparotomia, che il prelievo di liquido
peritoneale, l'esplorazione dell'addome superiore, l'omentectomia siano eseguiti
mediante laparoscopia. Il vantaggio di iniziare con la laparoscopia è di avere
ulteriori informazioni per decidere se tentare o no l'exeresi e inoltre di consentire
una laparotomia più contenuta.
La laparoscopia non è indicata per l'exeresi del tumore.
Può accadere che una neoplasia ovarica (maligna o non) si manifesti
inizialmente con un quadro di addome acuto (per esempio di torsione): si
raccomanda di evitare, in assenza di chiari segni di malignità, l’asportazione
dell’ovaio.
La chirurgia differita segue le indicazioni generali: è indicata solo in caso di
residui neoplastici anche sospetti (sono indicate l’esplorazione del cavo
peritoneale e la biopsia linfonodale se non eseguite in chirurgia iniziale). Tuttavia
l’ovaio sede della neoplasia non tolto all’esordio, va rimosso chirurgicamente.
Nel caso di coinvolgimento bilaterale di malattia, al termine del programma
chemioterapico, si raccomanda sempre l’asportazione dell’ovaio più coinvolto
all’esordio e una exeresi conservativa di quello meno coinvolto. Nel caso quest’
36
Protocollo TCGM AIEOP 2004
ultimo si presenti macroscopicamente normale, si raccomanda la semplice
biopsia.
Si sottolinea che eventuali interventi mutilanti (ad esempio isterectomia,
ovariectomia bilaterale, cistectomia, amputazione del retto) devono essere presi in
considerazione esclusivamente per le forme chemioresistenti alla fine del
programma terapeutico e comunque come ultima e inevitabile possibilità.
10.2.9 b Testicolo
Di regola è possibile l’asportazione radicale in chirurgia iniziale. L’approccio
chirurgico è esclusivamente inguinale:
clampaggio del funicolo all’anello inguinale interno prima di ogni altra
manovra;
biopsia ed esame istologico estemporaneo della massa (è necessario
programmare l’intervento in modo da disporre di tale indagine);
orchiectomia radicale con sezione del funicolo all’anello inguinale interno e
biopsia sulla trancia di sezione del funicolo. Se lo scroto appare infiltrato è
indicata l’emiscrotectomia;
se per una situazione d’ urgenza (ad esempio scroto acuto), o per un errore
diagnostico, l’approccio iniziale avviene per via scrotale e si conclude con
una biopsia o un orchiectomia, è necessario praticare un reintervento
precoce (vedi paragrafo 10.1.6) che comprenda l’emiscrotectomia e
l’orchidofunicolectomia alta. Un reintervento precoce è indicato anche nei
casi in cui sia stato eseguito un intervento per via inguinale non completo
(per es. per impossibilità di es. istologico estemporaneo). Il reintervento
determina una riduzione di Stadio solo se non viene evidenziata neoplasia
all'esame istologico del materiale asportato.
L’esplorazione chirurgica iniziale dei linfonodi retroperitoneali non è mai
indicata L’esplorazione chirurgica dei linfonodi crurali è necessaria quando lo
scroto è infiltrato.
Raramente è indicata la chirurgia differita del tumore primitivo. E’ necessaria
la linfoadenectomia retroperitoneale monolaterale in caso di metastasi linfonodali
retroperitoneali persistenti dopo chemioterapia.
NB: nel caso di TCGM testicolari non sicuramente maligni è indicata una exeresi
conservativa con risparmio del parenchima testicolare (tumorectomia) se
37
Protocollo TCGM AIEOP 2004
tecnicamente fattibile (dimensioni volume del tumore inferiore a 1/3 del testicolo e
non invasione dell’ilo testicolare). Se l’istologia definitiva dimostra la malignità
della lesione, è d’obbligo un reintervento precoce come sopra descritto.
38
Protocollo TCGM AIEOP 2004
11.0 ANATOMIA PATOLOGICA
11.1 Introduzione
La complessa ed eterogenea natura dei tumori a cellule germinali e le
controversie legate alla loro istogenesi sono all'origine della mancanza di unità
nelle classificazioni istopatologiche (44-46).
Prescindendo dalle controversie istogenetiche, la classificazione WHO ha il
pregio di una notevole chiarezza terminologica e rispecchia, nel caso dei tumori
misti,
l'intera
composizione
del
tumore,
fornendo
informazioni
sul
suo
comportamento biologico.
11.2 Classificazione WHO dei tumori germinali
11.2.1 Tumori di un solo tipo istologico
Seminoma/Disgerminoma
Carcinoma embrionale
Yolk sac tumor
Teratoma
Coriocarcinoma (puro)
Maturo
Immaturo
Con componente sarcomatosa o carcinomatosa
11.2.2 Tumori germinali misti
Carcinoma embrionale e teratoma maturo e/o immaturo
Yolk sac tumor e teratoma maturo/immaturo
Seminoma e teratoma
Seminoma e carcinoma embrionale
Coriocarcinoma e carcinoma embrionale
Coriocarcinoma e teratoma
Coriocarcinoma e seminoma
Ancora controverso è il problema riguardante il comportamento biologico dei
teratomi immaturi: mentre a livello ovarico l'immaturità è correlata ad un
comportamento aggressivo, nel testicolo l'immaturità non viene considerata indice
39
Protocollo TCGM AIEOP 2004
di un comportamento biologico sfavorevole. Per quanto riguarda i teratomi extragonadici essa viene correlata ad un comportamento biologico "indeterminato".
11.2.3 Sistemi di grading
Per i teratomi ovarici vengono universalmente applicati quelli di Thurlbeck e
Scully, modificato da Deher, e di Norris, entrambi basati sulla quantificazione del
tessuto immaturo sulle sezioni istologiche. Analogamente il grading proposto da
Gonzales e Crussi per i teratomi sacro-coccigei distingue 3 gradi in relazione alla
percentuale di tessuti immaturi nella superficie esaminata (45-48).
Grading istologico per i teratomi ovarici immaturi (Norris)
Grado
Tessuto immaturo
Neuroepitelio
0
Solo tess. maturi
Assente
1
+
Raro, non più di 1 LPF/sez.
2
++
Comune, non più di 3 LPF/sez.
3
+++
Prominente, 4 o più LPF/sez
Grading istologico per i teratomi sacro-coccigei (Gonzales-Crussi)
Grado 0:
solo tessuti maturi
Grado 1:
rari foci di tessuti immaturi
Grado 2:
moderata quantità di tessuti immaturi con qualche atipia
Grado 3.
grande quantità di tessuti immaturi con numerose mitosi ed evidenti
atipie
Si ritiene opportuno applicare i sistemi di grading dell'immaturità (Norris,
Gonzales-Crussi) non solo ai teratomi ovarici e sacro-coccigei ma anche a tutti
quelli di altre sedi che presentino aspetti di immaturità, al fine di evidenziare
eventuali correlazioni con il comportamento biologico.
40
Protocollo TCGM AIEOP 2004
11.4 Schema operativo
Il coordinatore del Protocollo a livello nazionale è:
Dr.ssa Renata Boldrini
Ospedale pediatrico Bambino Gesù IRCCS
Servizio di Anatomia Patologica
Piazza S. Onofrio 4, 00165 Roma
Il patologo locale invierà alla dr.ssa Boldrini:
a) la scheda
b) 1 sezione in ematossilina-eosina di prelievi rappresentativi
c) 1 blocchetto di inclusione o 10 sezioni in bianco dei prelievi stessi
d) prelievo di campioni per studi biologici: campioni di 0,5 cm da parti vitali della
neoplasia (meglio se differenti tra loro), che vanno congelati in azoto liquido,
conservati a – 80° e successivamente inviati in ghiaccio secco. Un campione
speculare adiacente a quello congelato viene fissato in formalina e avviato
allo studio istologico
e) prelievo di campioni di pochi mm di diametro da fissare in Karnovski per
esame ultrastrutturale.
Il Coordinatore avrà cura di far pervenire i vetrini significativi a mezzo posta ai
patologi del panel i quali invieranno la propria diagnosi al Centro di
Riferimento.
Verranno periodicamente tenute delle riunioni informative con la partecipazione
del responsabile del Panel.
Nella pagine seguenti si possono trovare le schede “operative” riassuntive
delle caratteristiche dei singoli istotipi, allo scopo di standardizzare la diagnosi
morfologica e immunoistochimica e per ricordare le caratteristiche biomolecolari
note.
41
Protocollo TCGM AIEOP 2004
z SEMINOMA/DISGERMINOMA
ESTENSIONE
organo di origine
infiltrazione capsula organo
strutture anatomiche adiacenti
linfonodi
PATTERN ISTOLOGICO
diffuso
interstiziale
QUOTA DI STROMA
≤ 10%
10-50%
≥ 50 %
LINFOCITI
scarsi
medi
numerosi
NECROSI
≤ 10%
10-50%
≥ 50 %
EMORRAGIA
≤ 10%
10-50%
≥ 50 %
CALCIFICAZIONI
assenti
presenti
GRANULOMI
assenti
presenti
CELLULE SINCIZIOTROFOBL
assenti
presenti
PLEOMORFISMO CELLULARE
assente
presente
METASTASI LINFONODALI
assenti
presenti
GONADE RESIDUA
normale
QUOTA MITOTICA X 10 HPF
disgenesia gonadica
gonadoblastoma
IGCNU
ISTOCHIMICA
PAS
42
Protocollo TCGM AIEOP 2004
IMMUNOISTOCHIMICA
PLAP
hCG
Citoker
c-kit
M2A lgG2a LCA
MICROSCOPIA ELETTRONICA
CITOGENETICA
i (12p)
43
Protocollo TCGM AIEOP 2004
z YOLK SAC TUMOR
ESTENSIONE
confinato all’organo
esteso oltre la capsula dell’organo
interessamento tessuti adiacenti
linfonodi
PATTERNS ISTOLOGICI
RETICOLARE O MICROCISTICO
MACROCISTICO
SENO ENDODERMICO
PAPILLARE
SOLIDO
GHIANDOLARE/ALVEOLARE
variante intestinale, variante endometrioide
MIXOMATOSO
SARCOMATOIDE
POLIVESCICOLARE VITELLINO
EPATOIDE
PARIETALE
MISTO CON ASPETTO PREVALENTE_______________________________
ASSOCIAZIONE CON ICGNU
assente
presente
METASTASI LINFONODALI
assenti
presenti
METASTASI PERITONEALI
assenti
presenti
ISTOCHIMICA
PAS diastasi
IMMUNOISTOCHIMICA
AFP
α1 antitripsina
citocheratine
CEA
Vimentina
PLAP
Laminina/collagene IV
MICROSCOPIA ELETTRONICA
CITOGENETICA
anomalie cromosomi 1p, 6q, 3q
44
Protocollo TCGM AIEOP 2004
z CARCINOMA EMBRIONALE
ESTENSIONE
confinato all’organo
esteso oltre la capsula dell’organo
interessamento dei tessuti adiacenti
linfonodi
PATTERNS ISTOLOGICI
SOLIDO
PAPILLARE/TUBULARE
PSEUDOENDODERMICO
“BISTRATIFICATO”
STROMA INDIFFERENZIATO
assente
presente
CELLULE SINCIZIOTROFOBL
assenti
presenti
CALCIFICAZIONI DISTROFICHE
assenti
presenti
INVASIONE VASCOLARE
assente
presente
ASSOCIAZIONE CON IGCNU
assente
presente
METASTASI LINFONODALI
assenti
presenti
IMMUNOISTOCHIMICA
Citocheratina (pancitocheratina,
citocheratina 8, 18, 19)
BerH2 (CD30)
PLAP
Anticorpo monoclinale 43-9F
MICROSCOPIA ELETTRONICA
CITOGENETICA
1(12p)
Del (12) (q13-q22)
45
Protocollo TCGM AIEOP 2004
z CORIOCARCINOMA
ESTENSIONE
confinato all’organo
esteso oltre la capsula
interessamento dei tessuti adiacenti
linfonodi
PERCENTUALE DI NECROSI
PERCENTUALE DI EMORRAGIA
INVASIONE DEI VASI
PERCENTUALE COMPONENTE CITOTROFOBLASTICA
QUOTA MITOTICA COMPONENTE CITOTROFOBLASTICA
PERCENTUALE COMPONENTE SINCIZIOTROFOBLASTICA
IMMUNOISTOCHIMICA:
hCG
HPL
SP1
PLAP
EMA
Citocheratine 7, 8, 18, 19
MICROSCOPIA ELETTRONICA
46
Protocollo TCGM AIEOP 2004
z TERATOMA
ESTENSIONE
confinato all’organo
esteso oltre la capsula
interessamento dei tessuti adiacenti
linfonodi
NUMERO STRATI EMBRIONALI
monofillico
difillico
a) teratoma maturo
cistico (cisti dermoide)
trifillico
solido
b) teratoma immaturo
tessuto neuroectodermico primitivo
blastema / tubuli primitivi
tessuto epatico
strutture ghiandolari
tessuto mesenchimale (fusocellulare, cartilagineo, osseo)
ESTENSIONE
focale
multifocale
GRADO
basso grado
diffuso
alto grado
GRADING TERATOMI IMMATURI OVAIO
grado 1
grado 2
grado 3
c) teratomi con componente maligna secondaria
carcinoma squamocellulare
adenocarcinoma
rabdomiosarcoma
altri sarcomi
d) teratoma monodermico
carcinoma
Pnet
47
Protocollo TCGM AIEOP 2004
e) teratoma fetiforme
f) cisti dermoide con tumore maligno secondario
IMMUNOCISTOCHIMICA
AFP
α1antitripsina
PLAP
CEA
Ferritina
NSE
S100
GFAP
Synptofisina
Vimentina
Astina
Desmina
P53
CITOGENETICA
48
Protocollo TCGM AIEOP 2004
z TUMORI A CELLULE GERMINALI MISTI
COMPOSIZIONE PERCENTUALE IN ORDINE DECRESCENTE
SEMINOMA/DISGERMINOMA
%____________
YOLK SAC TUMOR %________________
CARCINOMA EMBRIONALE % ___________
TERATOMA MATURO %____________
TERATOMA IMMATURO % ____________
CORIOCARCINOMA %____________
POLIEMBRIOMA
EMBRIOMA DIFFUSO
PANEL PATOLOGI
Rita Alaggio (Padova)
Paola Collini (Milano)
Ada Florena (Palermo)
Marina Gardiman (Padova)
Gaetano La Stilla (Bari)
Alessandra Linari (Torino)
Antonio Maiorana (Modena)
49
Protocollo TCGM AIEOP 2004
12.0 SCHEMA DI SOMMINISTRAZIONE DEI FARMACI
12.1 Direttive Generali
La chemioterapia è da iniziare il prima possibile e non oltre i 21 giorni dopo
l’intervento chirurgico. I cicli andranno ripetuti ogni 21 giorni;
il valore dei granulociti neutrofili il giorno dell’inizio di ogni ciclo terapeutico
deve essere almeno > 750 /mm3 e quello delle piastrine > a 100000/mm3;
é fortemente raccomandato l’impianto di un catetere venoso centrale per la
somministrazione della chemioterapia;
lo schema PEB può essere somministrato sia in regime ospedaliero che in
day hospital;
le indicazioni sulle dosi e i tempi di somministrazione dei farmaci sono
riportate nel successivo paragrafo. Viene comunque fornito anche lo schema
completo di terapia idroelettrolitica nell’Allegato 4 che può essere modificato,
a discrezione di ogni Centro Responsabile.
12.2 Schema PEB
Le dosi da utilizzare sono le seguenti:
Cisplatino 25 mg/m2/die iv in infusione di 15 minuti per 4 giorni
Etoposide 100 mg/m2/die iv in infusione di 1 ora per 4 giorni
Bleomicina 15 UI/m2/die iv in infusione di 1 ora il secondo giorno
Per i bambini di età inferiore ai 12 mesi sono previsti i seguenti dosaggi:
Cisplatino 0.8mg/Kg/die iv per 4 giorni
Etoposide 3mg/Kg/die iv per 4 giorni
Bleomicina 0.5UI/Kg/die iv il secondo giorno
Durante la somministrazione della chemioterapia monitorare giornalmente il
bilancio idrico e il peso del paziente.
In corrispondenza dell‘ultimo giorno di chemioterapia, controllare i seguenti valori
ematochimici:
esame emocromocitometrico con conta piastrine, azotemia, creatinina,
elettroliti, plasmatici con calcio e magnesio, LDH, AST, ALT, bilirubinemia,
esame urine.
50
Protocollo TCGM AIEOP 2004
12.3 Modulazione della tossicità
12.3.1 Tossicità ematologica
non è prevista una riduzione di dose dei farmaci per la tossicità ematologica;
al di sotto dei valori di riferimento indicati ( granulociti neutrofili > 750 /mm3,
piastrine > 100000/mm3) la terapia va rimandata al massimo di 2 settimane.
Dopo questo periodo somministrare il ciclo chemioterapico al dosaggio pieno
se granulociti neutrofili >500/mm3 e piastrine > 75000/mm3;
l’anemia da sola non è sufficiente per il rinvio del ciclo chemioterapico e deve
essere corretta tramite trasfusione.
12.3.2 Tossicità renale
Rappresenta la tossicità dose limitante del cisplatino. Il rialzo della creatinina
> 1.5 x il valore normale (> grado 1 secondo NCI-CTC), richiede il rinvio di una
settimana ciclo chemioterapico. Nel caso rimanga persistentemente elevata,
contattare i coordinatori dello studio.
12.3.3 Tossicità sul nervo acustico
La comparsa di tinnito (grado 2 secondo NCI-CTC) durante il programma
terapeutico impone l’esecuzione di un esame audiometrico. Nel caso di riduzione
dell’udito di grado >2 secondo UKCCSG Shortened listing of NCI-CTC (Allegato 2)
si raccomanda di contattare i coordinatori dello studio per l’eventuale sostituzione
del cisplatino con il carboplatino.
12.3.4 Altre tossicità
In caso di tossicità polmonare di grado >1 secondo NCI-CTC contattare i
coordinatori dello studio;
la comparsa di febbre, rash cutaneo, malessere dopo la somministrazione di
bleomicina, richiede
premedicazione con steroidi e paracetamolo ai cicli
successivi;
la comparsa di reazione allergica dopo la somministrazione di etoposide,
richiede premedicazione con antistaminici e steroidi, ai cicli successivi;
segnalare ai coordinatori dello studio
qualunque altra
tossicità non
ematologica di grado IV, per valutare l’eventuale sospensione/modificazione
delle dosi della chemioterapia.
51
Protocollo TCGM AIEOP 2004
12.3.5 Terapia di supporto
E’ obbligatoria la somministrazione di antiemetici secondo le modalià in
vigore nei singoli Centri. E’ comunque raccomandato l’utilizzo di 5HT3
antagonisti;
non è prevista la somministrazione routinaria di G-CSF. L’uso, in casi
selezionati è lasciato a discrezione di ogni Centro Responsabile;
altre eventuali complicanze, quali il trattamento della neutropenia febbrile e le
trasfusioni seguiranno le direttive già in uso nei singoli Centri.
52
Protocollo TCGM AIEOP 2004
13.0 TRATTAMENTO ALLA PROGRESSIONE O ALLA RICADUTA
13.1 Ricaduti dopo la sola chirurgia
La prognosi di questi pazienti è buona e le possibilità di guarigione con la
chemioterapia convenzionale sono elevate. Si raccomanda pertanto di effettuare
chemioterapia secondo schema PEB per 4 cicli ed eventuale chirurgia della
massa residua, ivi comprese le metastasi a distanza.
Nei casi senza marker tumorali patologici si consiglia di effettuare
l’accertamento istologico sulla sede della recidiva o, qualora tecnicamente fattibile,
anche l’asportazione della/e lesione/i sospette per escludere le forme in cui sia
presente la sola componente teratomatosa.
13.2 Ricaduti dopo 6 mesi dal termine del trattamento
Sono pazienti considerati ancora sensibili alla terapia con Platino e derivati e
le possibilità di remissione completa sono situate intorno al 50% con il 15-25% di
probabilità che essa sia duratura.
Si raccomanda di effettuare chemioterapia secondo schema ICE (Ifosfamide,
Carboplatino, Etoposide) per 3 cicli da effettuarsi ogni 28 giorni con raccolta di
progenitori ematopoietici circolanti CD34+ (PBSC), già dopo il primo ciclo, in
quantità sufficiente per 2 terapie mieloablative. Nell’impossibilità di effettuare una
raccolta di PBSC adeguata, si consiglia procedere ad espianto di midollo osseo,
secondo le indicazioni riportate successivamente.
Dopo i 3 cicli di chemioterapia secondo schema ICE, rivalutazione per
eventuale chirurgia della massa residua e/o delle metastasi:
- nel caso di remissione clinica completa o di asportazione chirurgica completa
anche in presenza di CTM all’esame istologico: ICE per 1 ulteriore ciclo e stop
terapia
- nel caso di remissione parziale, mancata risposta o chirurgia incompleta con
CTM all’esame istologico: chemioterapia mieloablativa con reinfusione di PBSC
(Thiotepa e Ciclofosfamide - TC alte dosi ).
Sarà valutata, caso per caso, la possibilità di effettuare una seconda
chemioterapia ad alte dosi.
13.3 Pazienti in progressione durante chemioterapia di prima linea (resistenti o
refrattari) e ricaduti entro 6 mesi dal termine del trattamento
53
Protocollo TCGM AIEOP 2004
Sono pazienti considerati a prognosi severa e pertanto meritevoli di un
approccio terapeutico più aggressivo (rientrano in questo gruppo anche i pazienti
ricaduti all’ osso e al SNC, indipendentemente dal tempo trascorso dal termine
della precedente chemioterapia).
Si raccomanda di effettuare chemioterapia secondo schema ICE (Ifosfamide,
Carboplatino, Etoposide) per
3 cicli da effettuarsi ogni 28 giorni, seguiti da
raccolta di progenitori ematopoietici circolanti CD34+ (PBSC), già dopo il primo
ciclo e in quantità sufficiente per 2 terapie mieloablative.
Successivamente questi pazienti sono candidati a chemioterapia mieloablativa
con reinfusione di PBSC (TC alte dosi). Al termine è comunque consigliabile
eventuale chirurgia della massa residua e/o delle metastasi.
La scelta dello schema ICE (Ifosfamide, Carboplatino, Etoposide) è stata
motivata dalla possibilità di usufruire di un farmaco attivo come l’Ifosfamide, non
utilizzato in 1° linea e di sostituire il Cisplatino con il Carboplatino, per ridurre la
tossicità renale e neurosensoriale.
La terapia ad alte dosi, seguita da reinfusione di cellule staminali
emopoietiche, è vantaggiosa per i pazienti nei quali sia stata raggiunta una
remissione clinica, come trattamento di consolidamento.
L’associazione Thiotepa e Ciclofosfamide è giustificata dalla provata azione
sinergica dei due farmaci alchilanti.
13.4 Schema di somministrazione dei farmaci
13.4.1 ICE
E’ consigliato l’impianto di un catetere venoso centrale prima di iniziare il
trattamento. I tre cicli ICE saranno somministrati in 5 giorni ogni 28 giorni quando i
valori dei granulociti neutrofili sono >1000/mm3 e quello delle piastrine > 100000/
mm3.
Le indicazioni sulle dosi e i tempi di somministrazione dei farmaci sono
riportate successivamente. Viene comunque fornito anche lo schema completo di
terapia idroelettrolitica dell’Allegato 4, che può essere modificato, a discrezione di
ogni Centro Responsabile.
54
Protocollo TCGM AIEOP 2004
Le dosi da utilizzare sono le seguenti:
Ifosfamide 1.8 g/m2/die in infusione e.v. per 3 ore nei giorni 1,2,3,4,5
Carboplatino 400 mg/m2 /die in infusione e.v. per 1 ora nei giorni 1,2
Etoposide 100 mg/m2 /die in infusione e.v. per 2-4 ore nei giorni 1,2,3,4,5
Idratazione (dal giorno 0 al giorno +6) secondo lo schema: SG 5% 3000
ml/m2/24 ore + NaCl 20 mEq/500 ml + KCl 10 mEq/500 ml + MESNA 1800 mg/m2
Il MESNA deve essere somministrato in bolo 30 minuti prima l’infusione di
Ifosfamide alla dose di 1000 mg/m2.
E’ obbligatoria la somministrazione di antiemetici, con modalità di
somministrazione e dosi a discrezione di ogni centro responsabile.
Per la mobilizzazione di cellule staminali emopoietiche (PBSC) si
raccomanda di utilizzare G-CSF alla dose di 5-10 mg/kg/die (a discrezione di ogni
centro responsabile) a distanza di 72 ore dall’infusione della chemioterapia, e
monitorare poi giornalmente il numero di CD34+ nel sangue periferico. La raccolta
può essere effettuata dal giorno in cui vi sono almeno 20 CD34+/μl di sangue
periferico.
Prima di iniziare e in corrispondenza dell’ultimo giorno di chemioterapia :
controllare i seguenti valori ematochimici: esame emocromocitometrico
con conta piastrinica, glicemia, azotemia, creatinina, uricemia, elettroliti
plasmatici (Ca, P, Mg, Na, K, Cl), LDH, GOT, GPT, γGT bilirubinemia,
fosfatasi alcalina, esame urine.
monitorare giornalmente il bilancio idrico.
13.4.2 TC ad alte dosi
Il ciclo TC ad alte dosi seguito da reinfusione di PBSC sarà somministrato in
5 giorni quando i valori dei granulociti neutrofili sono > 1000/mm3 e quello delle
piastrine > 100000/ mm3.
Le indicazioni sulle dosi e i tempi di somministrazione dei farmaci sono
riportate successivamente. Viene comunque fornito anche lo schema completo di
terapia idroelettrolitica nell’Allegato 4, che può essere modificato, a discrezione di
ogni Centro Responsabile.
Le dosi da utilizzare sono le seguenti:
Thiotepa 250 mg/m2/die in infusione e.v. di 4 ore nei giorni 1, 2, 3
Ciclofosfamide 60 mg/kg/die in infusione e.v. di 1 ora nei giorni 4, 5.
55
Protocollo TCGM AIEOP 2004
Prima di iniziare e durante la chemioterapia:
controllare i seguenti valori ematochimici: esame emocromocitometrico
con conta piastrinica, glicemia, azotemia, creatinina, uricemia, elettroliti
plasmatici (Ca, P, Mg, Na, K, Cl), LDH, GOT, GPT, γGT bilirubinemia,
fosfatasi alcalina, esame urine;
monitorare giornalmente il bilancio idrico e il peso del paziente.
Idratazione (dal giorno -8) secondo lo schema: SG 5% 3000 ml/m2/24 ore + NaCl
20 mEq/500 ml + KCl 10 mEq/500 ml + MESNA 1800 mg/m2
Il MESNA deve essere somministrato in bolo 30 minuti prima l’infusione di
Ciclofosfamide alla dose di 1000 mg/m2.
E’ obbligatoria la somministrazione di antiemetici, con modalità di
somministrazione e dosi a discrezione di ogni centro responsabile.
Le cellule staminali emopoietiche devono essere almeno 3x106/kg/CD34+ di
precursori emopoietici circolanti ottenuti mediante aferesi, oppure 3x108/kg/cellule
mononucleate ottenute da espianto di midollo osseo. La reinfusione va eseguita a
72 ore dal termine della chemioterapia (giorno 0).
La terapia di supporto, profilassi antimicotica, fattori di crescita, terapia
antibiotica ecc. avverranno a giudizio di ogni singolo Centro, utilizzando le linee
guida dell’AIEOP.
13.5 Raccolta di cellule emopoietiche staminali periferiche
Lo scopo della raccolta di PBSC è ottenere un numero sufficiente di
precursori emopoietici per permettere un rapido attecchimento emopoietico dopo
la terapia ad alte dosi.
L’obiettivo è raccogliere un numero di cellule CD34+ ≥ 3x106/kg. Se vengono
raccolte meno di 3x106/kg CD34+, si consiglia procedere ad espianto di midollo
osseo.
Si raccomanda di effettuare monitoraggio di CD34+ e aferesi in Centri con
esperienza nella raccolta di CSSP in bambini piccoli.
13.5.1Momenti per effettuare la aferesi
Il protocollo prevede la raccolta di PBSC a partire dal 1° ciclo ICE. Si
raccomanda di organizzare la logistica della raccolta con largo anticipo, in modo
56
Protocollo TCGM AIEOP 2004
da avere successivamente altri momenti a disposizione per poter effettuare
eventuali ulteriori aferesi.
Per la mobilizzazione si raccomanda di usare G-CSF alla dose di 510γg/kg/die (a discrezione del Centro Responsabile) a 72 ore dal termine
dell’infusione della chemioterapia, e monitorare poi giornalmente il numero di
CD34+ nel sangue. La raccolta può essere effettuata il giorno in cui vi sono
almeno 20 CD34+/μl di sangue periferico.
Se con le procedure aferetiche non si è raccolto il numero sufficiente di
cellule CD34+, o non si è riusciti a raccogliere affatto, è necessario procedere ad
espianto di midollo osseo (almeno 3x108cellule mononucleate/kg).
Accessi vascolari, procedure di raccolta, di criopreservazione e di reinfusione
PBSC sono codificate da ciascun Centro, in accordo con le regole della buona
pratica clinica.
Si raccomanda che tali procedure vengano effettuate presso un Centro con
competenza specifica per la raccolta di cellule staminali emopoietiche in ambito
oncologico e con adeguata esperienza nella esecuzione di leucoaferesi in bambini
piccoli.
57
Protocollo TCGM AIEOP 2004
14.0 INFORMAZIONI SUI FARMACI
14.1 Bleomicina
Antibiotico il cui meccanismo d’azione è determinato dal legame con il DNA e
la successiva rottura della doppia elica. E’ un farmaco fase-specifico e il suo
maggior effetto si esplica nelle fasi G2 e M del ciclo cellulare. La clearance del
farmaco è marcatamente rallentata in caso di alterata funzione renale. E’ escreta
dal fegato e dal rene.
Tossicità
acuta (entro 1-2 gg dalla somministrazione): anafilassi, iperpiressia,
ipotensione, nausea, vomito, rash cutaneo;
precoce (entro 2-3 settimane): iperpigmentazione cutanea, polmonite
interstiziale chimica, febbre, mucosite, rash cutaneo;
ritardata:
fibrosi polmonare. La comparsa di tossicità polmonare è dose
dipendente, con un rischio del 2% sino a dosi totali di 250 mg, che aumenta
progressivamente sino al 10% per dosaggi superiori. Il rischio di tossicità è
maggiore in presenza di patologie broncopolmonari preesistenti.
Formulazione:
disponibile in fiale da 15 UI (pari a 15 mg) come bleomicina solfato, sotto
forma di polvere liofilizzata. Il farmaco può essere somministrato anche
intramuscolo.
14.2 Cisplatino
Complesso di coordinazione del Platino, che ha un effetto citotossico
legandosi direttamente al DNA. L’inibizione della sintesi di DNA è verosimilmente
dovuta alla formazione di legami inter e intra-catene tra gruppi guanina-guanina.
Il farmaco ha un’azione sinergica con la radioterapia e altri farmaci
antiblastici.
Tossicità
acuta (1-2 giorni): nausea, vomito, sapore metallico, reazione anafilattica;
precoce (entro 2-3 settimane): anoressia, mielodepressione, ipomagnesemia,
disturbi elettrolitici, neuropatia periferica, nefrotossicità. Va ricordato che il
danno renale è cumulativo ed è solo parzialmente reversibile;
58
Protocollo TCGM AIEOP 2004
ritardata: ipoacusia alle alte frequenze (sopra i 2000 Hz). Sul piano clinico la
perdita di udito alle alte frequenze è irreversibile ed è correlata a dosi
cumulative > di 400 mg/m2.
14.3 Etoposide
Derivato semi-sintetico delle podofillotossine. Il farmaco forma un complesso
con le topoisomerasi II e il DNA, determinando rotture a livello della doppia e
singola elica. L’effetto principale si verifica nelle fasi S e G2 del ciclo cellulare.
L’emivita iniziale è di 1.5 ore, mentre quella terminale è di 4-11 ore. L’etoposide è
prevalentemente legato alle proteine plasmatiche (circa 95%), viene escreto
principalmente con le urine e la concentrazione massima nel plasma è
estremamente variabile da individuo a individuo.
Tossicità
acuta (entro 1-2 giorni dalla somministrazione): nausea, vomito, ipotensione,
anafilassi, febbre, rash cutaneo;
precoce (entro 2-3 settimane): mielodepressione, alopecia, diarrea, stomatite,
neuropatia periferica;
tardiva: leucemie secondarie.
14.4 Ifosfamide
Agente alchilante, si lega direttamente al DNA determinando sostituzioni di
basi, legami o rotture della doppia elica che alterano o inibiscono la replicazione
del DNA. Attivato mediante enzimi microsomiali epatici, viene eliminato nelle urine.
L’emivita di è di 7-15 ore.
Tossicità
Deve essere usato previa somministrazione di MESNA per prevenire la cistite
emorragica; è inoltre necessaria l’iperidratazione. La mielodepressione
è la
tossicità dose-limitante.
acuta (entro 1-2 giorni dalla somministrazione): nausea, vomito, cistite
emorragica, tossicità SNC (sonnolenza, sindrome confusionale, allucinazioni,
disorientamento) SIADH;
precoce (entro 2-3 settimane): mielodepressione, alopecia, nefrotossicità;
tardiva: infertilità.
59
Protocollo TCGM AIEOP 2004
14.5 Carboplatino
Derivato del Platino interagisce direttamente con il DNA inibendone la sintesi
attraverso la formazione di legami inter- e intra-catene. Esso determina inoltre
chelazione e legami con la membrana cellulare.
L’emivita è di 2,5-6 ore, almeno il 60-70% del farmaco viene eliminato
immodificato con le urine
Tossicità
acuta (entro 1-2 giorni dalla somministrazione): nausea, vomito, ipotensione,
febbre, rash cutaneo, orticaria;
precoce (entro 2-3 settimane): mielodepressione, nefrotossicità, disturbi
elettrolitici, alterazione della funzione epatica;
tardiva: nefrotossicità.
14.6 Thiotepa
Il trietilene-thiofosforamide è un derivato dell’etilenimide e agisce da
alchilante legandosi direttamente al DNA. Viene scarsamente assorbito a livello
gastrointestinale ed è metabolizzato a livello epatico. Il suo principale metabolita
(TEPA) possiede attività citotossica e nelle urine si ritrovano solo tracce di
farmaco immodificato e di TEPA. Il thiotepa ha un’emivita di eliminazione di 2-3
ore dal plasma; il TEPA di 15-18 ore.
Tossicità
acuta
(entro
1-2
giorni
dalla
somministrazione):
nausea,
vomito,
iperpigmentazione;
precoce (entro 1-2 settimane): mielodepressione, stomatite, cefalea, febbre,
neurotossicità;
tardiva: amenorrea e azoospermia, tumori iatrogeni.
14.7 Ciclofosfamide
Agente alchilante. E’ parzialmente assorbita dal tratto gastrointestinale, il
picco plasmatico viene raggiunto dopo un’ora dalla somministrazione e, nel fegato,
mediante enzimi microsomiali, viene metabolizzata a prodotti attivi; l’eliminazione
avviene per via renale.
L’emivita di eliminazione è di 3-10 ore. Il farmaco passa nel latte e in tutti i
liquidi extracellulari, tra cui il liquido sinoviale.
Tossicità
60
Protocollo TCGM AIEOP 2004
acuta (entro 1-2 giorni dalla somministrazione): nausea, vomito;
precoce (entro 2-3 settimane): mielodepressione, cistite emorragica, SIADH,
alopecia, iperpigmentazione;
tardiva: azoospermia, amenorrea, seconda neoplasia.
61
Protocollo TCGM AIEOP 2004
15.0 CONSIDERAZIONI METODOLOGICHE E STATISTICHE
I Centri che aderiscono al protocollo devono includere nello studio tutti i
pazienti che rispondono ai criteri di eleggibilità, identificati tra i soggetti in età
pediatrica che si presentano al centro per sospetta neoplasia germinale maligna.
Dopo che il paziente è stato ritenuto eleggibile per lo studio, li trattamento deve
essere eseguito come descritto nel protocollo.
Tutti i pazienti arruolati saranno considerati valutabili. Pertanto anche per i
pazienti nei quali vi sia stata o un’interruzione prematura o una deviazione del
trattamento previsto dal protocollo, dovranno essere sottoposti agli esami a tempi
di follow-up previsti.
Il presente è uno studio clinico multi-istituzionale prospettico osservazionale
che prevede approcci terapeutici diversi per ogni Stadio e/o presentazione di
malattia. Trattandosi di uno studio osservazionale saranno arruolati tutti i pazienti
eleggibili per un periodo di circa 5 anni. Una valutazione descrittiva della
sopravvivenza libera da malattia verrà condotta ad una mediana di osservazione
di 2 anni per i primi 50 casi arruolati allo studio. I risultati di tale analisi verranno
presentati al comitato di protocollo per una valutazione sulla prosecuzione del
trattamento.
Gli eventi temporali saranno stimati dalla data della diagnosi istologica
secondo il metodo non parametrico di Kaplan-Meier su tutta la popolazione
registrata in studio ed eleggibile. Per la sopravvivenza totale l’evento considerato
sarà la morte indipendentemente dalla causa; per la sopravvivenza libera da
progressione gli eventi considerati saranno la progressione di malattia e le
recidive. La rilevanza di potenziali fattori prognostici sarà valutata con modelli di
regressione.
Una valutazione della tossicità sarà pienamente possibile se si raggiungerà
una buona qualità delle informazioni inviate.
62
Protocollo TCGM AIEOP 2004
16.0 BIBLIOGRAFIA
1.
Cushing B, Perlman EJ, Marina NM, Castleberry RP. Germ cell tumors. In
Pizzo PA, Poplack DG, eds. Principles and Practice of Pediatric Oncology.
New York: Lippincott Williams & Wilkins 2002; 1091-1113.
2.
Pinkerton CR. Malignant germ cell tumors in childhood. Eur J Cancer
1997;33:895-901.
3.
Rescorla FJ. Pediatric germ cell tumors. Semin Surg Oncol 1999; 16:144158.
4.
Ulbright TM, Amin MB, Young RH. Germ cell tumors from Tumors of the
testis, Adnexa, Spermatic Cord and Scrotum. Atlas of Tumor Pathology AFIP
1999.
5.
International Germ Cell Cancer Collaborative Group: International Germ Cell
Classification: a prognostic factor-based staging system for metastatic germ
cell cancer. J Clin Oncol 1997; 15:594-603.
6.
Moriyama N, Daly JJ, Keating MA, et al. Vascular invasion as a
prognosticator of metastatic disease in nonseminomatous germ cell tumors of
the testis. Importance in "surveillance only" protocols. Cancer 1985; 56:24922498.
7.
Fung CY, Kalish LA, Brodsky GL, et al. Stage I nonseminomatous germ cell
testicular tumor. Prediction of metastatic potential by primary histopathology.
J Clin Oncol 1988; 6: 1467-1473.
8.
Dark GG, Bower M, Newlands ES et al. Surveillance policy for stage I ovarian
germ cell tumors. J Clin Oncol 1997; 15:620-624.
9.
Bonazzi C, Peccatori F, Colombo N et al. Pure ovarian immature teratoma, a
unique and curable disease: 10 years’ experience of 32 prospectively treated
patients. Obstet Gynecol 1994, 84:598-604.
10. Gershenson DM. Management of early ovarian cancers: germ cell and sex
cord-stromal tumors. Gynecol Oncol 1994; 55:62-72.
11. Baranzelli MC, Kramer A, Bouffet E et al. Prognostic factors in children with
localized malignant nonseminomatous germ cell tumors. J Clin Oncol 1999;
17: 1212-1218
63
Protocollo TCGM AIEOP 2004
12. Mann JR, Raafat F, Robinson K, et al.
The United Kingdom Children’s
Cancer Study Group’s second germ cell tumor study: carboplatin, etoposide,
and bleomycin are effective treatment for children with malignant extracranial
germ cell tumors, with acceptable toxicity. J Clin Oncol 2000; 15:3809-3818.
13. Gobel U, Schneider DT, Calaminus G et al. Germ-cell tumors in childhood
and adolescence. GPOH MAKEI and the MAHO study groups. Ann Oncol
2000; 11:263-271.
14. Calaminus G, Schneider DT, Bokkerink JP et al. Prognostic value of tumor
size, metastases, extension into bone, and increased tumor marker in
children with malignant sacrococcygeal germ cell tumors: A prospective
evaluation of 71 patients treated in the German Cooperative Protocols
Maligne Keimzelltumoren (MAKEI) 83/86 and MAKEI 89. J Clin Oncol 2003;
21:781-786.
15. Lo Curto M, Lumia F, Alaggio R, Cecchetto G, Almasio P, Indolfi P, Siracusa
F, Bagnulo S, De Bernardi B, De Laurentis T, Di Cataldo A, Tamaro P.
Malignant germ cell tumors in childhood: results of the first Italian cooperative
study "TCG 91". Med Pediatr Oncol 2003; 41:417-425.
16. Rescorla F, Billmire D, Stolar C et al. The effect of cisplatin dose and surgical
resection in children with malignant germ cell tumors at the sacrococcygeal
region: a pediatric intergroup trial (POG 9049/CCG 8882). J Pediatr Surg
2001; 36:12-17.
17. Billmire D, Vinocur C, Rescorla F et al. Malignant mediastinal germ cell
tumors: an intergroup study. J Pediatr Surg 2001; 36:18-24.
18. Fizazi K, Tjulandin S, Salvion R, et al. Viable malignant cells after primary
chemotherapy for disseminated nonseminomatous germ cell tumors:
Prognostic factors and role of postsurgery chemotherapy. Results from an
International Study Group. J Clin Oncol 2001; 19: 2647-2657.
19. Hendry WF, Norman AR, Dearnaley DP, et al. Metastatic nonseminomatous
germ cell tumors of the testis: results of elective and salvage surgery for
patients with residual retroperitoneal masses. Cancer 2002; 94: 1668-1676.
20. Nichols CR. Chemotherapy of disseminated germ cell tumors. Semin Urol
Oncol 2001; 19: 157-164.
64
Protocollo TCGM AIEOP 2004
21. Shelley MD, Burgon K, Mason MD. Treatment of testicular germ-cell cancer:
a Cochrane evidence-based systematic review. Cancer Treat Rev 2002;
28:237-253.
22. Bajorin DF, Sarasdy MF, Pfister DG et al. Randomized trial of etoposide and
cisplatin versus etoposide and carboplatin with good-risk germ cell tumors: a
multiinstitutional study. J Clin Oncol 1993; 11:598-606.
23. Bokemeyer C, Kohrmann O, Tischler J et al.Randomized trial of cisplatin,
etoposide and bleomycin (PEB) versus carboplatin, etoposide and Bleomycin
(CEB) for patients with “ good risk” metastatic non-seminomatous germ cell
tumors. Ann Oncol 1996; 7:1015-1021.
24. Mitchell PL, Al-Nasiri N, A’Hern R et al. Treatment of nondysgerminomatous
ovarian germ cell tumors: an analysis of 69 cases. Cancer 1999; 15:22322244.
25. Horwich A, Sleijfer DT, Fossa SD et al. Randomized trial of bleomycin,
etoposide and cisplatin compared with blemycin, etoposide and carboplatin in
good-prognosis
metastatic
non-seminomatous
germ
cell
cancer:
a
multiinstitutional medical Council/European Organization for Research and
Treatment of Cancer trial.J Clin Oncol 1997; 15:1844-1852.
26. Patte C, Baranzelli MC, Quintana E et al. Carboplatin (400 mg/m2) is not as
efficient as Cisplatinum (100 mg/m2) in childhood non metastatic non
seminomatous germ cell tumor (NSGCT). Experience of the SFOP. SIOP
XXVII, Med Ped Oncol 1995, abstr. o-47.
27. de Wit R, Stoter G, Kaye SB et al. Importance of bleomycin in combination
chemotherapy for good-prognosis testicular nonseminoma: a randomized
study of the European Organization for Research and Treatment of Cancer
Genitourinary Tract Cancer Cooperative Group. J Clin Oncol 1997; 15:18371843.
28. Loehrer PJ Sr, Johnson D, Elson P et al. Importance of bleomycin in
favourable-prognosis disseminated germ cell tumors: an Eastern Cooperative
Oncology Group trial. J Clin Oncol. 1995; 13:470-476.
65
Protocollo TCGM AIEOP 2004
29. de Wit R, Stoter G, Sleijfer DT et al. Four cycles of BEP vs four cycles of VIP
in patients with intermediate-prognosis metastatic testicular non-seminoma: a
randomized study of the EORTC Genitourinary Tract Cancer Cooperative
Group. European Organization for Research and Treatment of Cancer. Br J
Cancer 1998; 78:828-832.
30. Toner GC, Stockler MR, Boyer MJ et al. Comparison of two standard
chemotherapy regimens for good-prognosis germ-cell tumours: a randomised
trial. Australian and New Zealand Germ Cell Trial Group. Lancet 2001;
10:739-745.
31. Mann JR, Raafat F, Robinson K et al. UKCCSG’s germ cell tumour (GCT)
studies: improving outcome for children with malignant extracranial nongonadal tumours—carboplatin, etoposide, bleomycin are effective and less
toxic than previous regimens. United Kingdom Children’s Cancer Study
Group. Mann JR e Coll Med Ped Oncol 1998; 30:217-227.
32. Stern JW, Bunin N. Prospective study of carboplatin-based chemotherapy for
pediatric germ cell tumors. Med Ped Oncol 2002; 39:163-167.
33. Giller R, Cushing B, Lauer S, et al. Comparison of high-dose or standard –
dose cisplatin with etoposide and bleomycin (HDPEB vs PEB) in children
with stage III and IV malignant germ cell tumors (MGCT) at gonadal primary
sites : a Pediatric Intergroup trial (POG/CCG). Proc Am Soc Clin Oncol 1998;
17:525a.
34. Cushing B, Giller R, Lauer S, et al. Comparison of High-dose or standarddose cisplatin with etoposide and bleomycin (HDPEB vs PEB) in children with
stage I-IV extragonadal malignant germ cell tumors (MGCT): a Pediatric
Intergroup trial (POG/CCG). Proc Am Soc Clin Oncol 1998; 17:525a
35. Terenziani M, Massimino M, Casanova M, et al. Childhood malignant ovarian
tumors: a monoinstitutional experience. Gynecol Oncol 2001; 81:436-440.
36. Terenziani M, Piva L, Spreafico F, et al. Clinical stage I nonseminomatous
germ cell tumors of the testis in childhood and adolescence: an analysis of 31
cases. J Pediatr Hematol Oncol 2002; 24:454-458.
37. McCaffrey JA, Mazumdar M, Bajorin DF et al. Ifosfamide- and cisplatincontaining chemotherapy as first-line salvage therapy in germ cell tumors:
response and survival. J Clin Oncol. 1997; 15:2559-2563.
66
Protocollo TCGM AIEOP 2004
38. Rick O, Siegert W, Beyer J. Chemotherapy in patients with metastatic or
relapsed germ-cell tumours. Cancer Treat Rev 2001; 27:283-288.
39. Droz JP, Culine S, Biron P et al. High-dose chemotherapy in germ-cell
tumors. Ann Oncol 1996; 7:997-1003.
40. Motzer RJ, Mazumdar M, Bajorin DF et al. High-dose carboplatin, etoposide,
and cyclophosphamide with autologous bone marrow transplantation in firstline therapy for patients with poor-risk germ cell tumors. J Clin Oncol 1997;
15:2546-2552.
41. Rosti G, Albertazzi L, Salvioni R et al. High dose chemotherapy with
carboplatin, VP16 +/- ifosfamide in germ cell tumors: the Italian experience.
Bone Marrow Trasplant 1991; 7 suppl 2: 94.
42. De Giorgi U, Rosti G, Papiani G et al. The status of high-dose chemotherapy
with hematopoietic stem cell trasplantation in germ cell tumor patients.
Haematologica 2002; 87:95-104.
43. Logothetis C, Samuels M, Trinidade A, et al. The growing teratoma
syndrome. Cancer 1988; 50:1629.
44. Germ Cell Tumors of the Ovary from Blaunstein's Pathology of the Female
Genital Tract Fourth Edition R.J. Kurman, Springer-Verlag 1994.
45. Scully RE, Young RH, Clement PB. Germ cell tumors from Tumors of the
Ovary, Maldeveloped Gonads, Fallopian Tube and Broad Legament Atlas of
Tumor Pathology AFIP 1998.
46. Thurlbeck WM, Scully RE. Solid teratoma of the ovary: a clinicopathological
analysis of nine cases. Cancer 1960; 13: 804-811.
47. Norris HJ, Zirkin HJ, Benson WL. Immature teratoma of the ovary. Cancer
1976; 37:2359-2372.
48. Gonzalez-Crussi F, Winkler RF, Mirkin DL. Sacrococcygeal teratomas in
infants and children: relationship of histology and prognosis in 40 cases. Arch
Pathol Lab Med 1978; 102:420-425.
67