2
2.1.
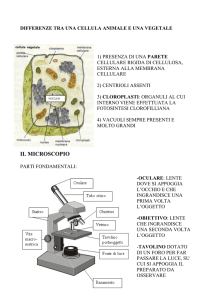
LL’OSSERVAZIONE MICROSCOPICA
BASI DELLA MICROSCOPIA
Tranne alcune situazioni particolari, i singoli microrganismi
non possono essere osservati direttamente ad occhio nudo
(fig. 2.1); ciò è dovuto al fatto che la maggior parte di essi
possiede dimensioni al di sotto delle capacità possedute
dall’occhio umano. Il parametro che esprime questo valore
è indicato come limite di risoluzione dell’occhio ed equivale
approssimativamente a circa 0,1 mm a 25 cm di distanza.
Dal punto di vista pratico questo parametro indica che, alla
distanza di 25 cm, non possono essere distinti tra essi due
punti posti a meno di 0,1 mm. Ne consegue che la scoperta
e lo studio dei microrganismi sono stati possibili solo con
l’impiego di strumenti in grado di ingrandirne adeguatamente l’immagine.
1 mm
Limite di risoluzione
dell’occhio umano
100 μ
Gli strumenti che svolgono questa funzione, utilizzando
la luce come sorgente illuminante, sono definiti microscopi
a luce o microscopi ottici. Pertanto, per microscopia s’intende
la tecnica d’osservazione che utilizza tale strumentazione. I
microscopi a luce, possono essere classificati in semplici e
composti. Si definiscono semplici se sono costituiti da una
sola lente; composti, se possiedono più sistemi di lenti.
L’invenzione delle lenti è piuttosto antica, in quanto risale al basso Medioevo; tuttavia la messa a punto e l’impiego
dei primi strumenti ottici sono avvenuti solo nel periodo
rinascimentale. Nella seconda metà del diciassettesimo
secolo furono perfezionati, in particolare, strumenti come il
telescopio ed il microscopio; entrambi si rivelarono di grande importanza nell’ampliamento delle conoscenze scientifiche dell’epoca. Lo strumento impiegato inizialmente
nell’osservazione microbica era costituito, in realtà, da una
struttura piuttosto semplice; essendo dotato di una sola
lente, deve essere ritenuto come un classico esempio di
microscopio semplice.
Il primo ad utilizzare questo strumento fu un mercante
di stoffe olandese: Antoni van Leeuwenhoek. Il suo micro-
Cellule
eucariotiche
10 μ
1μ
Cellule
procariotiche
Limite di risoluzione del
microscopio ottico
100 nm
Virus
10 nm
Proteine
1 nm
Aminoacidi
Limite di risoluzione del
microscopio elettronico
Atomi
1Å
FIGURA 2.1 ◗ Scala delle dimensioni microscopiche.
FIGURA 2.2 ◗ Il microscopio costruito da Antoni van Leeuwenhoek
era costituito da una semplice lente biconvessa.
1
2
Le basi microbiologiche della Biochimica
FIGURA 2.3 ◗ Esemplare di microscopio ottico composto costruito
FIGURA 2.4 ◗
intorno al 1750.
te nella routine.
scopio era dotato di una lente biconvessa, fissata da due
lamine metalliche e di un sistema di viti; per essere osservato, il campione era posto all’estremità di una punta mobile
in corrispondenza del foro d’alloggiamento della lente (fig.
2.2). Seppure con notevoli difficoltà, permetteva l’osservazione di forme microbiche eucariotiche e procariotiche
unicellulari. Van Leeuwenhoek intorno al 1670 costruì diversi microscopi semplici, che fornivano immagini ingrandite
di circa 200-300×; per quasi 200 anni questi strumenti restarono l’unica possibilità per osservare i microrganismi,
anche perché nessuno fu in grado di produrne altrettanto
validi. Per la verità, intorno al 1590, era stato messo a punto
anche il microscopio ottico composto (fig. 2.3) che, seppure teoricamente più potente rispetto al microscopio semplice, presentava tante e tali aberrazioni ottiche da essere
di scarsa utilità pratica.
Solo nel diciannovesimo secolo, con l’avvento di tecniche innovative nella costruzione delle lenti e delle altre
componenti strutturali, il microscopio composto fu perfezionato nelle sue caratteristiche ottiche e impiegato nella
pratica in modo sempre più diffuso. Divenne, da allora, uno
strumento fondamentale per gli studi microbiologici. In
seguito, nonostante la struttura di base sia stata mantenuta
inalterata, il microscopio ottico composto è stato continuamente perfezionato tanto che, nel corso del ventesimo secolo, la tradizionale osservazione in campo chiaro è stata
arricchita da nuove possibilità come ad esempio il contrasto di fase, la fluorescenza ed il campo oscuro.
Il microscopio ottico (M.O., fig. 2.4) è uno strumento importante in numerose attività e fondamentale nelle indagini microbiologiche; tuttavia presenta notevoli limiti per la
natura ondulatoria della luce. La radiazione luminosa, la cui
lunghezza d’onda è compresa tra i 380 ed i 730 nm, non
permette di distinguere 2 punti posti ad una distanza inferiore a circa la metà della lunghezza d’onda impiegata.
Questo valore, definito limite di risoluzione del microscopio
ottico, corrisponde a circa 200 nm (0,2 μm). Ne consegue
che il reale ingrandimento raggiungibile con la microsco-
Un microscopio ottico composto utilizzato attualmen-
FIGURA 2.5 ◗ Un moderno microscopio elettronico a scansione
(SEM).
Capitolo 2. L’osservazione microscopica
3
Muscolo retto laterale
Camera posteriore
Retina
Corpo vitreo
Congiuntiva
Fovea
Camera anteriore
Coroide
Cristallino
Sclera
Iride
Nervo ottico
Cornea
Vena e arteria della retina
Muscolo ciliare
Muscolo retto mediale
FIGURA 2.6 ◗
Le principali componenti strutturali del globo oculare.
pia ottica è limitato a 1200-1500×. Questi valori sono sufficienti a permettere un’agevole osservazione dei microrganismi eucariotici e procariotici, ma non consentono l’osservazione delle singole forme acellulari. I microscopi ottici (o
a luce), pertanto, sono inutilizzabili negli studi virologici in
quanto le particelle virali possiedono dimensioni comprese
tra i 20 e i 300 nm. Dati i limiti oggettivi del microscopio
ottico, nel corso del novecento la ricerca si è rivolta allo
sviluppo di tecniche innovative (microscopia elettronica,
fig. 2.5) che utilizzavano gli elettroni al posto della radiazione luminosa. Gli elettroni sono prodotti artificialmente con
il tubo catodico. A differenza della radiazione luminosa,
possiedono un’onda associata di lunghezza nettamente
inferiore; impiegati nella microscopia hanno permesso di
raggiungere definizioni delle immagini di gran lunga superiori. La microscopia elettronica è stata messa a punto alla
fine degli anni trenta e nel 1942 ha fornito le immagini del
primo virus (mosaico del tabacco).
L’ingrandimento reale prodotto può raggiungere i 106×;
consente l’osservazione dei dettagli morfologici di tutti i
microrganismi, comprese le particelle virali con le dimensioni più ridotte. Gli elettroni perdono rapidamente il loro
contenuto energetico nell’aria, di conseguenza le osservazioni devono essere eseguite sottovuoto; inoltre, sono
scarsamente assorbiti dal materiale biologico, per cui è
necessario ricorrere al fissaggio e alla colorazione dei preparati. Questo consente di aumentare i contrasti tra le diverse strutture biologiche, ma non permette un’osservazione di materiale vivo. Ne risulta una limitazione delle possibilità applicative, ma l’adozione di complesse e raffinate
tecniche nell’allestimento dei preparati rende questa metodologia insostituibile nell’indagine microbiologica.
2.1.1.
tinuazione del microscopico all’interno del nostro corpo
(viceversa il microscopio può essere ritenuto un’estensione
delle componenti che permettono la visione).
La conoscenza delle strutture anatomiche e dei meccanismi della visione, può essere utile per ottimizzare l’osservazione microscopica e per contribuire ad evitare un uso
scorretto dello strumento. L’occhio (fig. 2.6) è un organo
piuttosto complesso deputato a raccogliere (fig. 2.7) e ad
elaborare le radiazioni elettromagnetiche (tab. 2.1) con
lunghezza d’onda compresa tra 380 e 730 nm; le diverse
lunghezze d’onda sono percepite come colori compresi tra
il violetto ed il rosso (tab. 2.2).
Le radiazioni luminose, raggiungendo gli strati anteriori
dell’occhio, incontrano strutture in grado di regolare:
• la quantità di luce in entrata (in relazione all’intensità della
luce ambientale) attraverso il sistema iride-pupilla;
• la messa a fuoco dell’immagine sulla retina per mezzo del
cristallino.
L’occhio e le sue componenti
Prima di approfondire le conoscenze concernenti gli strumenti impiegati nell’osservazione microscopica, è necessario acquisire alcune nozioni fondamentali sulle strutture e
sui meccanismi alla base della visione. L’occhio è una con-
FIGURA 2.7 ◗ Percorso dei raggi luminosi attraverso le strutture ocu-
lari.
4
Le basi microbiologiche della Biochimica
TABELLA 2.1. Lunghezza d’onda delle radiazioni
elettromagnetiche
TABELLA 2.2. Lunghezza d’onda delle radiazioni
visibili
Radiazione
elettromagnetica
Lunghezza d’onda
in nm
Radiazione visibile
Lunghezza d’onda
in nm
Raggi cosmici
10–6-10–5
Rosso
700
Raggi gamma
10–5-10–2
Arancione
650
Raggi x
–2
10 -20
Giallo
600
Raggi ultravioletti
20-380
Verde
550
Visibile
380-730
Azzurro
500
Raggi infrarossi
730-4·105
Indaco
450
Onde hertziane
4·105-3·1015
Violetto
400
Il fascio di luce che oltrepassa le suddette strutture viene rifratto seguendo le regole dell’ottica geometrica; quindi raggiunge la retina posta nella parte opposta del globo
oculare, dove si ricostituisce l’immagine di quanto osservato. Sulla retina si ritrova una complessa struttura, costituita
da cellule fotorecettrici, rappresentate da coni e bastoncelli,
responsabili rispettivamente della visione a colori e crepuscolare. Questi elementi cellulari sono deputati alla conversione degli stimoli luminosi in segnali elettrici che, convogliati attraverso una fitta rete di cellule situate in prossimità
delle fibre del nervo ottico, giungono alle aree encefaliche
corticali poste in corrispondenza delle regioni occipitali. In
questa sede vengono definitivamente rielaborate e trasformate in immagini.
Anatomicamente l’occhio è una camera oscura in cui si
forma un’immagine rimpicciolita e capovolta su un’espansione del sistema nervoso: la retina. Il globo oculare è rivestito da tre membrane concentriche che, dall’esterno verso
l’interno, sono: la sclera, l’uvea e la retina.
La sclera è costituita da tessuto connettivo compatto; nel
polo anteriore del globo, si presenta con una zona trasparente definita cornea. Sclera e cornea nella parte anteriore
I coni ed i bastoncelli sono elementi cellulari dotati
della capacità di convertire stimoli luminosi in segnali elettrici che, convogliati attraverso il nervo ottico,
giungono fino alle aree corticali della regione occipitale, ove hanno sede le aree visive.
Il cristallino è la principale lente dell’occhio; è deputato alla messa a fuoco delle immagini sulla retina.
Alcune alterazioni anatomiche o funzionali dell’occhio impediscono che l’immagine si formi sulla retina; l’immagine in alcuni casi si forma anteriormente
(miopia); in altri posteriormente (ipermetropia).
La perdita dell’elasticità del cristallino impedisce,
nell’età avanzata, la messa a fuoco delle immagini
ravvicinate (presbiopia).
Luci intense ed osservazioni microscopiche eccessivamente prolungate possono produrre danni all’occhio ed in particolare alla retina.
sono rivestite dalla congiuntiva. A livello del polo posteriore
nel tessuto sclerale passano le fibre del nervo ottico.
L’uvea riveste la superficie interna della sclera fino a livello del solco che la separa dalla cornea; qui si piega verso
l’interno per formare le strutture dell’iride. Tra la cornea e
l’iride è delimitato uno spazio definito camera anteriore riempito da un liquido (umore acqueo). Nell’uvea si distinguono una parte posteriore detta coroide, ricca di vasi e di
cellule pigmentate, un corpo ciliare, che forma la corona dei
processi ciliari e l’iride, che è aperta al centro per formare la
pupilla. L’iride contiene le fibrocellule del muscolo costrittore e del muscolo dilatatore della pupilla.
La retina è la membrana più interna. È costituita da una
lamina cellulare pigmentata, che poggia sull’uvea, e da una
complessa serie di cellule nervose distribuite su più strati.
Tra questi ultimi possono essere individuati in particolare:
• uno strato periferico di coni e bastoncelli;
• uno strato di cellule bipolari d’associazione;
• uno strato più interno di neuroni di trasmissione.
Dai neuroni di trasmissione partono le fibre del nervo
ottico, che convergono tutte nella papilla ottica, posta nei
pressi del polo posteriore del bulbo oculare. Su questo
polo si nota una zona giallastra infossata al centro, che corrisponde all’area della visione distinta. Internamente alla
retina è presente una cavità contenente il corpo vitreo: una
massa semifluida la cui parte liquida è definita umor vitreo.
Dietro la pupilla si trova il cristallino: una lente elastica costituita da cellule epiteliali allungate e mantenuta nella sua
posizione da una corona di fibrille provenienti dai processi
ciliari (muscolo ciliare); tale muscolo, contraendosi, regola la
curvatura del cristallino. Tra il cristallino e l’iride è compresa
la camera posteriore dell’occhio.
2.1.2.
Le lenti
Le lenti sono componenti fondamentali di tutti gli apparecchi ottici come il cannocchiale, il binocolo, gli strumenti
fotografici e cinematografici e il microscopio; dal punto di
vista fisico sono menischi in vetro o in materiale sintetico.
Costruite con spessore variabile dalla periferia al centro,
sono capaci di deviare i raggi luminosi che le attraversano
in rapporto al tipo di curvatura posseduta. In generale si
può affermare che i raggi luminosi, uscenti da una lente
convessa, sono convergenti e danno luogo alla formazione
d’immagini.
Capitolo 2. L’osservazione microscopica
a
Asse ottico
b
Asse ottico
c
Asse ottico
FIGURA 2.8 ◗ Deviazione dei raggi luminosi nel passaggio attraverso
una lente convergente (a) e un corpo trasparente con le due superfici
parallele (b). Nelle lenti i raggi luminosi che passano attraverso il centro
(dove le superfici sono parallele) emergono parallelamente rispetto a
quelli incidenti (c).
5
Il principio su cui si basa una lente è la rifrazione. Con
questo termine s’indica la deviazione di un raggio luminoso che colpisce con una certa angolazione un mezzo trasparente, dotato di una densità diversa da quella ambientale (fig. 2.8). La rifrazione è la conseguenza del ritardo
della velocità della luce che passa dall’aria attraverso le
lenti.
Un raggio luminoso passante attraverso una lente viene
rifratto due volte: una all’entrata e una all’uscita; in una lente
convergente, una prima volta si avvicina all’asse ottico,
mentre all’uscita se ne allontana. Se le superfici esterne sono parallele, un raggio è deviato per due volte con angolazioni opposte. Ne consegue che il raggio incidente e quello
emergente sono paralleli; quindi non vi è deviazione.
La linea perpendicolare al piano della lente e passante
per il suo centro è detta asse ottico. I raggi paralleli all’asse
ottico sono deviati in un punto posto sull’asse ottico stesso,
detto fuoco. La distanza compresa tra fuoco e centro della
lente è definita distanza focale; rappresenta la caratteristica
principale della lente, in quanto da essa dipende l’ingrandimento ottenibile. Il termine fuoco deriva dal fatto che i
raggi provenienti dal sole (in pratica paralleli tra loro ed
all’asse ottico) convergono in modo tanto concentrato in
un punto, situato oltre la lente, da potere bruciare un foglio
di carta posto su di esso (fig. 2.9). Sull’asse ottico, alla stessa
distanza dal centro, esiste un altro fuoco (F1), collocato dalla parte opposta della lente.
I raggi paralleli incidenti sulla lente, con un certo angolo
rispetto all’asse ottico, non convergono sul fuoco, ma su un
piano ad esso perpendicolare contenente il fuoco e definito piano focale. Se un oggetto è posto ad una distanza superiore a quella focale, di esso una lente convergente produce un’immagine reale, ingrandita e capovolta che può
essere raccolta su uno schermo. Se l’oggetto si trova ad una
distanza inferiore a quella focale non si forma un’immagine
F
F
Raggi paralleli
Raggi paralleli
A
Piano
focale
B
F1
F1
F
C
F
D
FIGURA 2.9 ◗ a) In una lente convergente i raggi luminosi paralleli all’asse ottico convergono in un punto definito fuoco. b) I raggi paralleli che
incontrano la lente con un certo angolo rispetto all’asse ottico non convergono sul fuoco, ma in un punto posto su un piano perpendicolare all’asse
ottico, contenente il fuoco e definito piano focale. c) Se l’oggetto è posto ad una distanza maggiore di quella focale, si forma un’immagine reale capovolta e ingrandita dalla parte opposta della lente. d) Se l’oggetto è posto ad una distanza inferiore al fuoco, si forma un’immagine virtuale diritta e
ingrandita dallo stesso lato dell’oggetto.
Le basi microbiologiche della Biochimica
Violetto
Indaco
Blu
Verde
Giallo
Arancione
Rosso
6
FIGURA 2.10 ◗ Alla base dell’aberrazione cromatica è la diversa rifrazione delle componenti della luce bianca.
Luce bianca
reale, bensì, dalla stessa parte dell’oggetto, un’immagine
virtuale diritta ed ingrandita, che non emette luce e non
può essere raccolta su uno schermo. Può essere vista
dall’occhio.
Il diametro delle lenti (apertura) è un parametro molto
importante in quanto influenza la luminosità ed il potere di
risoluzione dell’immagine ottenuta.
2.1.2.1.
Difetti e limiti delle lenti
Le lenti presentano imperfezioni e limiti; quelle che interessano la microscopia sono, in particolare, le aberrazioni
geometriche e cromatiche.
Le aberrazioni geometriche derivano dalle imperfezioni
della curvatura della loro superficie; sono tanto più accentuate quanto più grande è l’angolo che i raggi luminosi
formano con l’asse ottico. Le aberrazioni cromatiche sono
conseguenti alla composizione della luce solare o artificiale. La luce è costituita da un insieme di radiazioni distinguibili per lunghezza d’onda, frequenza e contenuto energetico. Le differenze di tali parametri si evidenziano con una
diversa colorazione e un diverso angolo di rifrazione; ciò
provoca la comparsa di una frangia costituita da diversi
colori, in corrispondenza del punto di formazione dell’immagine (fig. 2.10).
Tubo porta oculare
Anello di regolazione diottrica
Testata binoculare
Revolver portaobiettivi
Colonna
Apparato traslatore del vetrino
Obiettivo
Tavolino traslatore
Vite macrometrica
Vite di traslazione del condensatore
Viti coassiali per la traslazione del vetrino
Vite micrometrica
Condensatore con diaframma e portafiltri
Base
Interruttore di accensione
FIGURA 2.11 ◗
Sistema di illuminazione
Le principali componenti di un microscopio ottico da routine.
Capitolo 2. L’osservazione microscopica
Le aberrazioni geometriche possono essere limitate mediante l’uso di lenti addizionali, mentre quelle cromatiche
possono essere corrette con l’adozione di vetri speciali (costosissimi alla fluorite) o di lenti addizionali. Se la correzione
è parziale, si parla di lenti semiapocromatiche; se la correzione è completa si parla invece di lenti apocromatiche.
2.2.
IL MICROSCOPIO OTTICO COMPOSTO
Il microscopio ottico composto (fig. 2.11) è lo strumento
con cui è stato possibile superare in modo sostanziale i limiti di risoluzione dell’occhio umano. È costituito da più lenti
disposte in modo da consentire ingrandimenti fino a 1.2001.500×. La sua invenzione è attribuita a H. Jansen intorno al
1590. Come già evidenziato, è stato scarsamente utilizzato
fino al secolo diciannovesimo, a causa delle notevoli aberrazioni ottiche che rendevano le immagini prodotte scarsamente leggibili.
Immagine finale ingrandita
Oculare
7
Il microscopio ottico composto è stato perfezionato nel
corso del diciannovesimo secolo ed è anche oggi uno dei
più importanti strumenti del microbiologo. Il suo funzionamento è basato sull’impiego di due sistemi di lenti (oculari
ed obiettivi), con cui sono opportunamente deviati (rifrazione) i fotoni emessi da una sorgente luminosa, che in genere
è costituita da una lampada ad incandescenza (fig. 2.12).
La lampada è alloggiata all’interno della parte inferiore
del microscopio (base). La luce prodotta è indirizzata verticalmente verso l’alto direttamente o tramite uno specchio;
uscita dalla base, in corrispondenza di un’apertura, incontra un primo sistema di lenti che la converge verso il condensatore. Quest’ultimo è costituito da: una sede per il posizionamento dei filtri, un diaframma ad iride (in grado di regolare la quantità di luce) ed un sistema di lenti (condensatore vero e proprio) che concentra la luce sul preparato. In
questo modo il fascio luminoso incontra il preparato illuminandolo intensamente. Le parti del preparato sono oltrepassate dal fascio luminoso in rapporto alla diversa opacità
posseduta. La luce che ne emerge, continuando il suo percorso verticale, entra nell’apertura delle lenti dell’obiettivo
selezionato; ne viene rifratta e, in corrispondenza del fuoco
dell’oculare, forma un’immagine reale ingrandita e capovolta, che viene ulteriormente ingrandita dalle lenti
dell’oculare (fig. 2.13). L’interazione dell’obiettivo con l’oculare permette la formazione di un’immagine finale, posizionata sulla retina dell’osservatore. L’ingrandimento complessivo prodotto da un microscopio ottico composto, dipende dall’ingrandimento dell’obiettivo e da quello
dell’oculare; in pratica si ottiene moltiplicando l’ingrandimento dell’obiettivo per quello dell’oculare.
La natura ondulatoria della luce pone insormontabili
problemi per la realizzazione di strumenti che mirano al
raggiungimento di ingrandimenti reali superiori a 12001500×. Ciò è dovuto al fatto che un oggetto puntiforme
non appare come tale, ma come un alone circolare. In pratica utilizzando il microscopio ottico non è possibile distinguere due punti posti ad una distanza inferiore a 0,2 μm.
Oculare
Testata binoculare
Obiettivo
Materiale
Obiettivo
Campione
Condensatore
Condensatore
Fonte luminosa
Lampada
FIGURA 2.12 ◗
Schema ottico del microscopio a luce composto.
FIGURA 2.13 ◗
culare.
Schema ottico interno di un microscopio a luce bino-
8
Le basi microbiologiche della Biochimica
TABELLA 2.3. Limiti di risoluzione di un
microscopio in base all’ingrandimento
dell’obiettivo ed alla sua apertura numerica,
considerando l’impiego di luce con una
lunghezza d’onda di 0,55 μm.
Obiettivo
A.N.
Limite di risoluzione
in μm
4
0,07
3,93
10
0,25
1,1
40
0,65
0,43
100
1,25
0,25
Questa distanza, che costituisce il cosiddetto limite di risoluzione (LR) del microscopio ottico, dipende essenzialmente dalla lunghezza d’onda (λ) impiegata nell’osservazione
microscopica, dalle caratteristiche della lente e, in particolare, dall’apertura numerica dell’obiettivo (AN) (tab. 2.3) Il limite di risoluzione corrisponde ad un valore che è circa la
metà della lunghezza d’onda della luce impiegata. La formula che consente di ricavare il limite di risoluzione è la
seguente:
LR = 0,61 λ/AN
dove LR rappresenta il limite di risoluzione, mentre lambda
(λ) è la lunghezza della luce impiegata e AN è l’apertura numerica. L’AN dipende essenzialmente dall’angolo d’apertura della lente e dall’indice di rifrazione del mezzo compreso
tra la lente dell’obiettivo ed il vetrino contenente il materiale (fig. 2.14). Più precisamente:
AN = N·senα
In questa relazione N è l’indice di rifrazione del mezzo,
mentre senα è il seno del semiangolo d’apertura della lente. I valori di senα sono inferiori ad 1, mentre l’indice di rifrazione della maggior parte del materiale ottico non supera 1,6; in pratica il massimo valore dell’apertura numerica
(AN) di una lente, se è usato olio per immersione (1,53), è di
circa 1,4. Con questi parametri il limite di risoluzione del
microscopio ottico equivale a circa 170 nm (0,17 μm) qualora sia usata luce monocromatica di 400 nm (violetto). Con
luce bianca il limite di risoluzione è di 250 nm (0,25 μm).
Dato che il valore di AN è limitato, l’unica possibilità di ridurre il limite di risoluzione è quella di usare lunghezze
d’onda corte.
Teoricamente il miglior limite di risoluzione del microscopio ottico si ottiene utilizzando lenti dotate di un’elevata apertura numerica ed una radiazione con la lunghezza
d’onda più corta possibile, come quella ultravioletta. In
queste condizioni il limite di risoluzione è prossimo a valori
di 100-150 nm (0,1-0,15 μm). Tuttavia, nel caso siano impiegate queste radiazioni, le comuni lenti si dimostrano opache e devono essere sostituite da lenti al quarzo.
I parametri numerici che caratterizzano il microscopio
ottico composto sono l’ingrandimento ed il potere risolutivo (inverso del limite di risoluzione). Tra i due quello più importante è il potere risolutivo; infatti un’immagine ingrandita oltre il limite di risoluzione appare sfuocata e quindi
scarsamente leggibile; inoltre la qualità dell’immagine pro-
Obiettivo
Lente
Angolo di apertura
Asse ottico
Condensatore
Raggi luminosi
FIGURA 2.14 ◗ Angolo d’apertura dell’obiettivo dal quale si ricava
l’apertura numerica. AN = N·senα.
dotta dipende da altri due caratteri del sistema ottico, vale
a dire: il potere di penetrazione ed il potere di definizione.
Il potere di penetrazione, definito anche profondità di
campo, è la capacità di un sistema ottico di mettere a fuoco
contemporaneamente due punti del preparato, che siano
posti su piani diversi.
Il potere di definizione dipende dalla qualità delle lenti e
dall’architettura del sistema ottico. Un alto potere di definizione è sinonimo di immagine fedele, esente da aberrazioni cromatiche e geometriche.
2.2.1. Le componenti del microscopio ottico
composto
Le parti costitutive del microscopio possono essere individuate nello stativo, nel sistema d’illuminazione, nel
condensatore, nel tavolino traslatore e nel sistema ottico.
I microscopi attuali impiegano: come fonte luminosa una
lampada ad incandescenza o a LED, come apparato ottico una serie di obiettivi variabile da quattro a cinque, una
coppia di oculari, infine una testata binoculare che, interposta tra obiettivi ed oculari, permette l’osservazione con
entrambi gli occhi (visione binoculare).
Lo stativo comprende una base, in cui sono alloggiate le
componenti del sistema di illuminazione, ed una colonna
variamente conformata. La colonna funge da sostegno per
il sistema ottico e per il tavolino traslatore, che costituisce,
a sua volta, il piano d’appoggio dei preparati. Gli stativi
moderni sono dotati di grande versatilità, in quanto permettono l’aggiunta di numerosi accessori. In questo modo
sono possibili numerosi allestimenti, con cui eseguire diversi tipi d’osservazione: in campo chiaro, in campo oscuro,
Capitolo 2. L’osservazione microscopica
9
Piano
dell’obiettivo
Luce emergente
dal preparato
Tavolino
FIGURA 2.16 ◗ Condensatore, con la leva del diaframma e, in alto a
destra, la sede portafiltri.
Condensatore
Luce emergente
dalla base
ghezza focale; è in grado di concentrare il fascio di luce sul
preparato. Tutto il complesso che costituisce il condensatore è dotato di un sistema a cremagliera, che ne permette il
sollevamento o la discesa in rapporto al tipo d’osservazione;
di norma, è corredato anche da un sistema di viti, che consente il suo spostamento sul piano orizzontale, per centrare
il suo asse ottico con quello dell’obiettivo.
Il tavolino traslatore (fig. 2.17) è localizzato sopra il
condensatore; presenta una forma quadrata o rettangolare
FIGURA 2.15 ◗ Percorso della luce emergente dalla base del microscopio fino al piano dell’obiettivo.
in contrasto di fase, con luce polarizzata. Utilizzando testate trinoculari è possibile aggiungere sistemi di ripresa digitale, con cui documentare tutto quanto si osserva.
Il sistema d’illuminazione è formato da una lampada
ad incandescenza, da un interruttore e da un reostato. La
lampada ad incandescenza rappresenta la fonte d’illuminazione del preparato; è contenuta all’interno della base in
una sede di facile accesso. L’interruttore permette l’accensione della lampada, mentre il reostato regola l’intensità
della luce; interruttore e reostato, in genere, sono posti
nella parte superiore della base. Il fascio di luce emergente
da questa, giunge al preparato dopo aver attraversato un
sistema di lenti, il condensatore ed un’apertura posta al centro del tavolino traslatore (fig. 2.15).
Il condensatore (fig. 2.16) è formato da diverse componenti: un sistema portafiltri, un diaframma ad iride ed il condensatore vero e proprio. Il sistema portafiltri è situato nella
parte inferiore del condensatore; permette l’alloggiamento
di filtri con la colorazione più idonea al tipo d’osservazione
effettuata. Il diaframma ad iride è in grado di regolare la
quantità della luce inviata al preparato. Se la sua apertura è
ridotta, il contrasto delle strutture osservate aumenta in
modo significativo. Ciò è particolarmente importante nelle
osservazioni a fresco. Il condensatore vero e proprio è formato da un sistema di lenti piano-convesse ed a corta lun-
FIGURA 2.17 ◗ Particolare del microscopio nel quale sono evidenti i
rapporti tra il tavolino traslatore ed il revolver portaobiettivi.
10
Le basi microbiologiche della Biochimica
FIGURA 2.18 ◗ Sul barilotto sono indicate tutte le caratteristiche ottiche dell’obiettivo.
e al centro un foro di 2-4 cm di diametro. La messa a fuoco
del preparato si ottiene mediante lo spostamento verticale
del tavolino. Ciò è ottenuto attraverso due viti coassiali, di
cui una permette grandi spostamenti (macrometrica) e l’altra la messa a fuoco accurata (micrometrica). Il tavolino è
dotato di un apparato di traslazione del vetrino, che ne
permette l’esame completo mediante lo spostamento orizzontale, sia in senso laterale, sia in senso antero-posteriore.
Nell’apparato di traslazione del vetrino è compreso anche
un sistema di scale graduate, che facilita l’individuazione
delle aree osservate.
Il sistema ottico. È la componente più importante del
microscopio; è costituita dagli obiettivi (fig. 2.18), dalla testata mono-, bino- o trinoculare e dagli oculari stessi.
Gli obiettivi sono sistemati sopra il tavolino traslatore in
una struttura che, per la capacità di ruotare attorno al proprio asse, è definita revolver. Su di esso, a seconda dei modelli, ne sono alloggiati da quattro a cinque. Il revolver
permette di passare agevolmente da un obiettivo all’altro.
Gli obiettivi sono formati da una struttura cilindrica (barilotto) al cui interno è presente un sistema di lenti di piccole
dimensioni, a fuoco molto corto e con un’apertura angolare relativamente stretta. Sono costruiti impiegando vetri
speciali (flint o crown) o moderni materiali di sintesi. Rispetto ai normali obiettivi, quelli planacromatici e planapocromatici, sono dotati di maggiore apertura numerica, potere
risolutivo più elevato ed un maggiore potere di penetrazione. Alcuni obiettivi richiedono l’interposizione di un idoneo
liquido (olio per immersione), con indice di rifrazione all’incirca del vetro (1,53), che permette di migliorarne il potere
risolutivo; sono i più potenti e sono dotati di una messa a
fuoco in posizione vicinissima al preparato.
Le caratteristiche degli obiettivi sono incise sul barilotto
(fig. 2.19); in particolare sono indicati: l’ingrandimento, la
lunghezza del tubo portalenti (di norma 160 mm), l’apertura numerica, l’impiego in immersione e lo spessore del vetrino coprioggetti.
La testata binoculare (fig. 2.20) è una complessa struttura
dotata di un sistema di prismi; permette la deviazione
dell’unico fascio di luce emergente dall’obiettivo di un angolo di circa 60° e la sua suddivisione in due parti. Ognuna
di esse, opportunamente deviata, giunge ad uno specifico
Numero di serie
Spessore del coprioggetti
Lunghezza tubo portalenti
Obiettivo planacromatico
Ingrandimento
Apertura numerica
FIGURA 2.19 ◗
Caratteristiche fondamentali di un obiettivo impiegato nella moderna microscopia.
Capitolo 2. L’osservazione microscopica
Regolazione
diottrica
Regolazione
interpupillare
TABELLA 2.4. Ingrandimenti complessivi di
un microscopio ottico composto
FIGURA 2.20 ◗
Testata binoculare con le relative componenti.
oculare. La testata binoculare consente di mantenere il tavolino traslatore sul piano orizzontale e, al contempo, la
visione con entrambi gli occhi mantenendo una posizione
corretta.
Gli oculari sono formati, di norma, da due lenti pianoconvesse (oculare di Huygens) o da un sistema costituito da
due o tre lenti poste in cima ed in fondo al tubo portaoculare (oculare di Ramsden). Quelli di superiore qualità, insieme ad obiettivi semi o apocromatici, sono in grado di eliminare gran parte delle aberrazioni cromatiche. In alcuni casi
portano incise scale graduate che permettono determinazioni sulle aree del preparato. Nel tubo portaoculare sono
presenti: un meccanismo a vite con cui è possibile correggere le eventuali differenze di rifrazione tra le strutture ottiche dell’operatore ed un meccanismo in grado di modificare la distanza degli oculari in rapporto alla distanza interpupillare.
Com’è già stato evidenziato, l’ingrandimento complessivo del microscopio composto è calcolato moltiplicando
l’ingrandimento dell’obiettivo per quello dell’oculare (tab.
2.4). Ne consegue che un microscopio dotato di oculare
10× e della seguente serie di obiettivi: 5×, 10×, 40×, 100×,
raggiunge gli ingrandimenti: 50×, 100×, 400× e 1000×. Il
microscopio ottico composto è impiegato nell’osservazione di materiali istologici, citologici, microbiologici. Permette l’esame di strutture uni e pluricellulari; con l’impiego di
idonee tecniche è possibile ottenere una grande quantità
d’informazioni.
2.3.
Ob.
5×
10×
40×
100×
10×
50×
100×
400×
1000×
12×
60×
120×
480×
1200×
15×
75×
150×
600×
1500×
Oc.
Oculari
11
L’impiego di lenti dotate di un elevato potere di penetrazione e di grande apertura numerica, oltre che di sistemi
di messa a fuoco estremamente precisi, ha reso possibile
l’ottimizzazione dello strumento, permettendo di sfruttarne pienamente le potenzialità.
Inoltre, del microscopio ottico tradizionale sono state
prodotte diverse varianti, che hanno permesso l’acquisizione dai preparati di informazioni un tempo impensabili.
L’impiego della luce polarizzata, ultravioletta, di particolari
sistemi di illuminazione ed accorgimenti ottici innovativi,
ha consentito la messa a punto di tecniche microscopiche,
che hanno amplificato enormemente le possibilità offerte
dal tradizionale microscopio ottico. In questo modo ora,
oltre alla microscopia in campo chiaro, sono possibili altre
modalità d’osservazione come: in campo oscuro, in contrasto di fase, in contrasto di interferenza differenziale, con luce
polarizzata ed ultravioletta.
2.3.1.
Microscopia in campo chiaro
È la tradizionale modalità d’osservazione microscopica. Con
questa modalità il preparato posto sul vetrino è illuminato
dal fascio di luce emergente dal condensatore senza l’interposizione di diaframmi o di altre componenti che modifichino il percorso della luce. Possono essere invece impiegati filtri colorati o grigi in relazione alle specifiche necessità.
Ad esempio l’impiego di filtri azzurri consente di aumentare
il potere di risoluzione del microscopio. Nella osservazione
in campo chiaro il fondo appare intensamente illuminato, mentre le componenti cellulari presentano un aspetto
che dipende dal tipo di allestimento adottato o dalla pigmentazione posseduta. La microscopia in campo chiaro è
impiegata su preparati a fresco o fissati e colorati; nel caso
di preparati a fresco non risulta molto efficace, tanto che
LA MICROSCOPIA OTTICA
Il microscopio ottico per lungo tempo è rimasto inalterato
nella sua architettura di base, costituita da una fonte di illuminazione, un condensatore, un tavolino portaoggetti, un
revolver portaobiettivi, una testata binoculare ed un sistema di oculari. Nel corso del secolo passato, tuttavia, sono
stati apportati continui perfezionamenti alle sue componenti ottiche, meccaniche ed al sistema di illuminazione.
FIGURA 2.21 ◗ Epitelio pseudostratificato osservato in campo chiaro.
12
Le basi microbiologiche della Biochimica
ad essa è preferibile l’osservazione in contrasto di fase o in
contrasto di interferenza differenziale. È valida nell’esame
di materiale citologico o istologico colorato (fig. 2.21).
2.3.2.
Microscopia in contrasto di fase
L’occhio ha la capacità di percepire le variazioni della lunghezza d’onda e dell’intensità della luce visibile; tuttavia
la maggior parte delle componenti cellulari, ad eccezione
di alcuni pigmenti colorati come la clorofilla, sono quasi
completamente trasparenti alla radiazione della regione
visibile dello spettro. Il basso assorbimento della luce da
parte della cellula vivente è dovuto, per la maggior parte,
all’elevato contenuto d’acqua; l’essiccamento dei preparati non migliora in modo significativo l’osservazione degli
stessi. Un mezzo per superare questo problema è l’uso di
coloranti; questi si fissano alle strutture cellulari e producono contrasti tra le varie componenti percepite con diverse
intensità delle colorazioni. In genere, le colorazioni devono
essere precedute da tecniche che prevedono trattamenti
come la disidratazione, il fissaggio e talvolta l’inclusione; in
questo modo si ha la perdita delle attività biologiche e la
comparsa di alterazioni (artefatti) che frequentemente mutano l’aspetto morfologico originario.
Lo studio delle cellule viventi si avvale da diversi decenni
dell’adozione di particolari tecniche microscopiche, quali la
microscopia in contrasto di fase e in contrasto di interferenza differenziale. Entrambe si basano sul fatto che le strutture biologiche, seppure piuttosto trasparenti alla radiazione
visibile, quando sono oltrepassate da essa producono una
lieve modificazione di fase. Ciò è in relazione alle piccole
differenze nell’indice di rifrazione delle strutture cellulari ed
al loro diverso spessore.
Consideriamo la luce che colpisce un corpo e lo oltrepassa (fig. 2.22); se tale corpo presenta un indice di rifrazione diverso da quello ambientale (vetro rispetto all’aria),
l’ampiezza dell’onda non è modificata, ma cambia la velocità di propagazione; si verifica in pratica un ritardo di fase.
Se l’onda emerge dall’oggetto, la sua velocità si ristabilisce,
ma permane il ritardo di fase. L’entità del ritardo è proporzionale allo spessore del corpo attraversato ed alla differenza esistente tra l’indice di rifrazione dell’oggetto e quello
dell’ambiente circostante. Se la luce attraversa un corpo
trasparente, ma anche assorbente, nell’onda si ha, oltre ad
un ritardo di fase, una diminuzione dell’ampiezza d’onda,
proporzionale alla capacità assorbente da parte del corpo.
Il meccanismo con cui opera la microscopia in contrasto di
Retina
Oculare
Piano focale
dell’oculare
a
b
Piano focale
posteriore
dell’obiettivo
Obiettivo
c
Preparato
FIGURA 2.22 ◗ Effetto di materiali diversi sul cammino dei raggi luminosi. a) L’effetto di un materiale trasparente e non assorbente con indice di rifrazione più elevato di quello ambientale; si produce un ritardo
di fase; b) l’effetto di un materiale simile al precedente, ma più spesso; in
questo caso il ritardo di fase è più pronunciato; c) l’effetto di un materiale trasparente ed assorbente. Vi è ritardo di fase, oltre alla diminuzione
della ampiezza, quindi dell’intensità luminosa.
Condensatore
Diaframma anulare
FIGURA 2.23 ◗
trasto di fase.
Cammino dei raggi luminosi nel microscopio a con-
Capitolo 2. L’osservazione microscopica
FIGURA 2.24 ◗ Una clorofita (Scenedesmus sp.) osservata in contrasto di fase a 400×.
fase può essere compreso esaminando il passaggio dell’onda associata ad una radiazione luminosa, attraverso un
sottile strato biologico, come una cellula con indice di rifrazione vicino a quello ambientale.
Una parte della radiazione che attraversa la cellula, non
incontra componenti con indice di rifrazione significativamente più elevato rispetto all’ambiente; ne emerge senza
deviare e mantenendo la stessa ampiezza e lunghezza (S).
Un’altra parte della radiazione (D) è rifratta e deviata rispetto alla direzione della radiazione originaria, subendo un ritardo di fase approssimativamente di circa ¼ della lunghezza d’onda. I due raggi S (non modificato) e D (in ritardo
di fase) penetrando nelle lenti dell’obiettivo subiscono un
fenomeno d’interferenza; il raggio risultante ha la stessa
ampiezza di quello che non ha subito modificazioni, ma
13
soltanto con un piccolo ritardo di fase, che non è apprezzabile al microscopio ottico normale.
Nella microscopia in contrasto di fase (fig. 2.23) le piccole differenze di fase sono amplificate in modo tale da potere essere percepite dall’occhio o da una lastra fotografica
(fig. 2.24). Ciò è dovuto al fatto che, a livello dell’obiettivo,
la luce passante ai margini della lente è sfasata in anticipo
o in ritardo di ¼ della lunghezza d’onda, rispetto a quella
che passa nella parte centrale dell’obiettivo. La modificazione della fase è prodotta da un dispositivo ad anello situato sul piano focale posteriore dell’obiettivo, costituito
da un disco trasparente contenente una doccia o un rilievo
anulare corrispondente, per forma e dimensione, all’immagine del condensatore a sua volta dotato di un filtro
anulare.
Il contrasto di fase deriva dall’interferenza tra l’immagine ottenuta dalla parte centrale dell’obiettivo e l’immagine
laterale, che è stata anticipata o ritardata di ¼ della lunghezza d’onda (fig. 2.25a). Nel contrasto scuro o positivo i
due fasci di raggi si sottraggono dando un’immagine
dell’oggetto più scura del fondo (fig. 2.25b). Nel contrasto
chiaro o negativo i due fasci di raggi si sommano e l’oggetto appare più chiaro del fondo (fig. 2.25c). Le piccole variazioni di fase, a causa dell’interferenza, sono amplificate e
trasformate in variazione d’ampiezza. L’oggetto trasparente
appare perciò in vari toni di grigio, che dipendono dal suo
spessore e dal suo diverso indice di rifrazione rispetto
all’ambiente.
Il microscopio a contrasto di fase è impiegato per l’osservazione di cellule e tessuti viventi in cui possono essere
osservati particolari citologici, istologici e microbiologici.
Evidenzia in modo molto dettagliato, numerosi processi
cellulari come la divisione nucleare, la citodieresi, la proliferazione batterica, il movimento e la fagocitosi. È molto utile
nello studio delle cellule coltivate in vitro. L’impiego di sistemi microfotografici e microcinematografici, abbinati alla
microscopia in contrasto di fase, si dimostra molto utile
anche nella produzione di materiale divulgativo, per la notevole efficacia delle immagini prodotte.
Onda centrale S
S
Onda rifratta D
S-D
D
¼L
a
b
S+D
S
D
c
FIGURA 2.25 ◗ Interferenza tra due onde. a) Il normale ritardo di ¼ di
λ della luce rifratta da un oggetto e la sua differenza di fase nei confronti della luce che passa nell’ambiente circostante. b) Per la differenza di
fase le due onde S e D si sovrappongono per sottrarsi in un contrasto di
fase scuro (S-D). c) Le due onde S e D si sovrappongono per rinforzarsi
in un contrasto di fase luminoso (S+D).
14
Le basi microbiologiche della Biochimica
gli oggetti trasparenti intervenendo sul percorso ottico. È
basata sull’impiego di dispositivi capaci di suddividere l’onda in due parti; una di esse attraversando il materiale viene
perturbata, mentre l’altra parte conserva una forma geometrica regolare. Le due parti ricombinandosi interferiscono
e formano un’immagine legata alla struttura dell’oggetto.
L’immagine, rispetto al campo circostante, appare con una
luminosità o un colore diverso a seconda della fase delle
due onde che interferiscono e del tipo di radiazione emessa
dalla sorgente luminosa. L’oggetto perturba localmente la
fase di una delle onde, per cui cambia la relazione di fase fra
le onde interferenti, e quindi la luminosità del campo (o il
suo colore) in corrispondenza della propria immagine.
Un particolare tipo di microscopia interferenziale è la
tecnica DIC (Differential Interference Contrast, figg. 2.27 e.
2.28) che impiega:
• due filtri polarizzatori di cui uno posto sotto il preparato
(nel condensatore o nel diaframma di campo) e l’altro
sopra l’obiettivo.
• due prismi di Wollaston, di cui uno posto a livello del
condensatore e l’altro tra l’obiettivo e il secondo polarizzatore. Il primo prisma suddivide la radiazione in due
parti mentre il secondo la riunisce. Tra le due parti che si
riuniscono avviene l’interferenza.
FIGURA 2.26 ◗ Un’ameba osservata in campo oscuro.
2.3.5.
Microscopia in fluorescenza
La fluorescenza è la proprietà posseduta da alcune sostanze
di assorbire radiazioni a corta lunghezza d’onda ed emettere radiazioni di maggiore lunghezza, situate nel campo del
visibile. Il microscopio a fluorescenza, che di norma impiega radiazione ultravioletta (UV), permette di osservare le
strutture fluorescenti o rese fluorescenti. Possiede diverse
componenti:
• una lampada a vapori di mercurio che produce UV;
• un filtro d’eccitazione per selezionare la radiazione UV;
• un filtro d’arresto, posto tra il preparato e l’osservatore (trattiene la radiazione ultravioletta che, se non è assorbita,
produrrebbe gravi lesioni oculari).
Il microscopio a fluorescenza è largamente utilizzato
nelle indagini batteriologiche ed immunologiche.
2.3.3. Microscopia in campo oscuro
La microscopia in campo oscuro (fig. 2.26), è un’ulteriore metodologia usata nello studio delle cellule viventi. È basata sul
fenomeno della diffusione luminosa, che si verifica al limite
tra due fasi dotate di un indice di rifrazione differente. L’apparecchio è un microscopio in cui il normale condensatore è sostituito da una struttura particolare, che illumina il materiale
obliquamente. Con questa metodologia nessuno dei raggi
luminosi entra direttamente nell’obiettivo, ma penetrano
solamente quelli diffusi dall’oggetto, che appare pertanto luminoso su fondo scuro. Con la microscopia in campo oscuro
possono essere distinti microrganismi di piccole dimensioni,
senza tuttavia poterne analizzare i dettagli strutturali.
2.3.4. Microscopia in contrasto di interferenza
differenziale (DIC)
2.3.6. Microscopia con luce polarizzata
La luce vibra in tutti i piani passanti lungo la linea di propagazione. Facendo passare un pennello di luce monocromatica, attraverso particolari minerali allo stato cristallino, è
È un tipo di microscopia che si propone lo stesso fine della microscopia in contrasto di fase, cioè rendere più visibili
Preparato
Asse ottico
Polarizzatore 1
Prisma di
Wollaston 1
Condensatore
Obiettivo
Prisma di
Wollaston 2
Polarizzatore 2
FIGURA 2.27 ◗ Le componenti microscopiche impiegate nel contrasto di interferenza differenziale (DIC).
Capitolo 2. L’osservazione microscopica
15
FIGURA 2.28 ◗ Alga unicellulare (Closterium sp.) circondata da batteri osservata in contrasto di interferenza differenziale (DIC).
FIGURA 2.29 ◗ L’osservazione a fresco mette in luce le caratteristiche
delle cellule in condizioni di normale vitalità. Nell’immagine un eliozoo.
possibile ottenere una luce polarizzata che vibra in un solo
piano. Questo fenomeno è ottenuto con i prismi di Nicol, costituiti da cristalli di calcite tagliati in due secondo l’asse di
simmetria ternaria e rincollati con balsamo del Canada.
Nella microscopia a luce polarizzata due prismi di Nicol,
il primo polarizzatore ed il secondo analizzatore, sono
montati in modo che il secondo possa essere ruotato, rispetto al primo, intorno alla direzione dei raggi incidenti.
L’intensità della luce che ne esce è massima se i due prismi
sono paralleli, mentre è minima quando il secondo prisma
è ruotato di 90°, rispetto al primo (Nicol incrociati).
Questa metodologia è basata sul comportamento di alcune componenti della cellula e dei tessuti, allorché sono
osservati con la luce polarizzata. Se il materiale è isotropo
la luce polarizzata si propaga in esso con la medesima velocità, in tutte le direzioni. Nelle sostanze anisotrope, invece, la velocità di propagazione della luce polarizzata varia
nelle diverse direzioni. Questo materiale è detto anche birifrangente, in quanto presenta due indici di rifrazione corrispondenti a diverse velocità di trasmissione della luce polarizzata.
Il microscopio a luce polarizzata è impiegato in biologia
per la ricerca di sostanze o composti tissutali birifrangenti a
Nicol incrociati (silice, capelli, collagene), che appaiono luminosi su fondo oscuro. Nel microscopio a luce polarizzata
il disco polarizzatore è situato nel portafiltro del condensatore, mentre il disco analizzatore è posto sopra l’obiettivo.
Quando l’analizzatore è ruotato di 360° nel campo visivo, si
ha alternanza di luce e oscurità ogni 180°. Le due posizioni
di massima luminosità si ottengono allorché l’analizzatore
è parallelo al polarizzatore. Quando analizzatore e polarizzatore sono incrociati a 90° non c’è passaggio di luce polarizzata; se in queste condizioni si pone sul tavolino del microscopio una sostanza birifrangente, il piano di polarizzazione della luce è deviato di un angolo corrispondente al
ritardo introdotto dal campione in esame. La prova usuale,
che è compiuta con il microscopio a luce polarizzata, consiste nel ruotare il preparato su uno speciale tavolino ruotante, per trovare i punti di massima e di minima luminosità.
2.4.1.
2.4. ALLESTIMENTO DEI PREPARATI PER LA
MICROSCOPIA OTTICA
L’osservazione mediante la microscopia ottica può essere
effettuata con due tipi di tecniche: a fresco e dopo colorazione.
Allestimento a fresco
L’esame a fresco consente l’osservazione dei microrganismi
in condizioni di normale vitalità. A seconda delle specifiche
esigenze può essere effettuato in campo chiaro (fig. 2.29),
in campo oscuro, in contrasto di fase (fig. 2.30 a, b) o in contrasto di interferenza differenziale. Può essere impiegato su
vetrino o a goccia pendente.
a
b
FIGURA 2.30 ◗ L’osservazione a fresco, oltre che in campo chiaro, può
essere eseguita anche in contrasto di fase. Con questa tecnica si accentuano i contrasti tra le varie componenti cellulari. a) un eliozoo; b) un
ciliato.
16
Le basi microbiologiche della Biochimica
1) Esame su vetrino. Se il campione è costituito da una
sospensione microbica, se ne preleva una goccia che
viene deposta sul vetrino con una pipetta Pasteur o
con l’ansa di platino. La goccia è ricoperta con un vetrino coprioggetti, evitando la formazione di bolle d’aria.
Si pressa il vetrino coprioggetti con una pinzetta, asciugando dai bordi del vetrino l’eccesso di sospensione
con carta da filtro e si passa all’osservazione microscopica. Questa operazione deve essere eseguita in modo
attento ad evitare pericolose contaminazioni. Se il
campione è costituito da materiale compatto, come ad
esempio una colonia batterica, si prepara una sospensione ponendo al centro del vetrino portaoggetti una
goccia di soluzione fisiologica, in cui è stemperata una
piccola quantità del materiale con l’ansa di platino. In
seguito si distende la sospensione su una piccola porzione del vetrino con movimenti delicati, si ricopre con
un vetrino coprioggetti, si pressa e si passa all’osservazione microscopica.
2) Osservazione con goccia pendente. I vetrini allestiti con la goccia pendente sono spessi e presentano
depressioni in cui è sistemata una goccia del preparato,
che pende dal vetrino coprioggetti. Ne esistono diversi
tipi; sono usati in particolare nell’esame della mobilità
batterica. Il più comune è quello di Koch, che è dotato
di un’escavazione centrale; è adatto per studi sui microrganismi aerobici. Un altro vetrino è quello Sclavo.
Possiede due escavazioni comunicanti; in una di esse
può essere posto un reattivo per creare un ambiente
anaerobico, aggiungendo composti in grado di catturare l’ossigeno molecolare.
L’osservazione a fresco può essere effettuata secondo le
necessità con obiettivi a secco o ad immersione. I preparati
a goccia pendente non possono essere impiegati per il
contrasto di fase, perché l’immagine viene distorta dal menisco che si forma con il preparato.
2.4.2.
Allestimento di vetrini colorati
Le colorazioni aumentano il contrasto tra le diverse componenti biologiche. Producono evidenti differenze cromatiche delle strutture cellulari, di cui permettono la differenziazione altrimenti non apprezzabile con l’esame a fresco.
Si distinguono colorazioni vitali, colorazioni negative e colorazioni vere e proprie; queste ultime devono essere precedute dal fissaggio del preparato. Con particolari colorazioni
è possibile identificare specifici costituenti chimici cellulari; a
tale scopo vengono utilizzati coloranti selettivi, in grado di
legarsi in modo specifico con i costituenti ricercati.
Le colorazioni vitali utilizzano coloranti che mantengono la vitalità cellulare, pertanto permettono l’osservazione
dei microrganismi in vivo. Le colorazioni negative impiegano sostanze che colorano intensamente lo sfondo, senza
penetrare negli elementi cellulari; in questo caso le cellule
appaiono chiare e nettamente distinguibili dal fondo colorato.
Una metodica di questo tipo è la colorazione di Burri, che
impiega l’inchiostro di China; è utilizzata, in particolare, per
evidenziare la capsula batterica. Questa metodica consiste
nel porre al centro di un vetrino portaoggetti una piccola
quantità d’inchiostro di China, in cui è stemperato il materiale microbico. Ottenuta la sospensione si ricopre con un
vetrino coprioggetti, si pressa e si passa all’osservazione
microscopica.
2.4.2.1.
Le fasi dell’allestimento
Le colorazioni vere e proprie richiedono, di norma, il fissaggio alla fiamma. Le fasi dell’allestimento dei preparati colorati sono relativamente complesse e prevedono le seguenti
fasi:
• prelievo del campione (fig. 2.31);
• distensione del materiale sul vetrino (fig. 2.32);
• asciugatura all’aria;
• fissaggio alla fiamma (fig. 2.33);
• colorazione (fig. 2.34);
• lavaggio in acqua corrente;
• asciugatura all’aria.
FIGURA 2.31 ◗ Prelievo di colonia in piastra.
FIGURA 2.32 ◗
Distensione su vetrino.
Capitolo 2. L’osservazione microscopica
17
Se il materiale è costituito da sospensione microbica,
viene prelevato con ansa di platino e posto al centro di un
vetrino portaoggetti. Se è costituito da materiale “compatto” come le colonie provenienti da terreni agarizzati, deve
essere stemperato in una goccia di soluzione fisiologica,
posta in precedenza al centro del vetrino portaoggetti. La
sospensione è distesa delicatamente con movimenti circolari, per allontanare i microrganismi tra di essi senza alterarne gli aggregati.
Il preparato ottenuto è asciugato in ambiente areato,
dopodiché si passa al fissaggio alla fiamma. Questa fase è
piuttosto importante in quanto: blocca le attività cellulari
(quindi impedisce i fenomeni alterativi), disidrata a fondo il
materiale, uccide le forme potenzialmente patogene e fa
aderire il materiale al vetrino. Di norma il fissaggio si esegue passando lentamente il vetrino sulla fiamma di un becco
Bunsen per tre volte consecutive. A questo punto il vetrino è
sottoposto alla colorazione scelta, secondo le sequenze e i
tempi previsti.
Si passa quindi ad un lavaggio prolungato per eliminare
il colorante non assorbito; questa fase si esegue in acqua
corrente fino a che il preparato non cede più colore. Si passa quindi all’asciugatura in ambiente areato. Dopo questa
fase il preparato è pronto per l’esame microscopico.
L’osservazione è eseguita, di norma, con il massimo ingrandimento in immersione con olio di cedro o sintetico. I
campioni costituiti da tessuti o cellule animali devono essere trattati impiegando metodi d’allestimento istologici e
citologici.
FIGURA 2.33 ◗ Fissaggio.
2.5.
I COLORANTI
Un colorante è una sostanza, naturale o di sintesi, dotata
di una duplice caratteristica: da una parte deve essere in
grado di assorbire la luce e di colorarsi, dall’altra deve essere in grado di legarsi ai substrati conferendo ad essi una
colorazione che corrisponde, di norma, alla propria. Il meccanismo della colorazione è caratterizzato da una fase in
cui il colorante è adsorbito sulla superficie della struttura
che deve essere colorata (substrato) e dalla reazione chimica che si stabilisce tra le molecole del colorante e quelle del
substrato.
2.5.1.
Caratteri chimici dei coloranti
I coloranti sono sostanze dotate di caratteristiche quanto
mai diverse. In ogni caso nelle molecole dei coloranti possono essere evidenziate tre distinte componenti:
• una struttura molecolare dotata di funzione di supporto,
come ad esempio il benzene. Su di essa sono legate le componenti che caratterizzano il colorante;
• uno o più gruppi colorati definiti cromòfori;
• uno o più gruppi in grado di legarsi con specifici substrati
definiti gruppi auxòcromi.
Alcuni gruppi cromòfori
−NO2; −N=; −N=N−
Alcuni gruppi auxòcromi
Acidi: −OH; −COOH.
Basici: −NH2; −NHR; −NR2
FIGURA 2.34 ◗
Colorazione.
18
Le basi microbiologiche della Biochimica
OH
O 2N
NO2
O 2N
NO2
Benzene
NO2
NO2
Trinitrobenzene
Acido picrico
NH 2
O 2N
NO2
O 2N
NO2
Benzene
NO2
Trinitrobenzene
FIGURA 2.35 ◗
NO2
Trinitroanilina
Struttura molecolare di un colorante.
La molecola del benzene (C6H6) può essere presa come
modello di riferimento. Tale composto è privo di colore, ma
se tre dei suoi atomi d’idrogeno sono sostituiti da gruppi
–NO2, si ottiene una sostanza dotata di una colorazione gialla definita trinitrobenzene. I gruppi –NO2 sono i cromòfori, in
quanto responsabili della colorazione gialla (fig. 2.35).
Se, nel trinitrobenzene, uno degli atomi dell’idrogeno è
sostituito con un ossidrile (–OH) si ottiene l’acido picrico,
che è in grado di dare reazioni di salificazione con molecole basiche; il gruppo –OH è pertanto auxòcromo. Se invece
del gruppo –OH è inserito un gruppo –NH2, la molecola
ottenuta è basica ed in grado di legarsi con substrati acidi.
2.5.2.
FIGURA2.37 ◗ Le granulazioni metacromatiche sono componenti
cellulari che si colorano in modo diverso dal colorante utilizzato.
Classificazione dei coloranti
I coloranti impiegati nella microscopia sono classificati, in
base alla provenienza, in naturali ed artificiali. Quelli naturali sono relativamente pochi e derivano dal regno animale
o vegetale; tra essi possono essere ricordati: l’indaco, lo zafferano, l’ematossilina, l’orceina. I coloranti artificiali, invece,
sono composti aromatici derivati dal benzene ed ottenuti
esclusivamente per sintesi chimica. Particolarmente impor-
tanti sono i composti contenenti: gruppi azoici (−N=N−), nitrosi (−NO), tiocarbonilici (−C=S). Possono essere classificati
anche in:
• basici. Sono costituiti da un sale ottenuto da una base
colorata e un acido incolore. Colorano selettivamente gli
acidi nucleici. I coloranti utilizzati in batteriologia sono,
in gran parte, coloranti basici. Comprendono il blu di metilene (fig. 2.36), il violetto di genziana, il verde metile, la
safranina, la fucsina basica ed altri;
• acidi. Sono formati da un sale di acido colorato e una
base incolore. Comprendono l’eosina, il verde luce, l’arancio G;
• neutri. Sono costituiti da un sale di una base e di un acido
colorati (eosinato di blu di metilene).
Come già indicato, il colore assunto dai substrati, di norma è lo stesso del colorante; tuttavia alcuni composti come
il blu di toluidina, conferiscono ad alcune componenti cellulari una colorazione diversa rispetto alla propria (metacromasia). Nella colorazione di Albert, ad esempio, i granuli di
volutina dei bacilli difterici si colorano in rosso, mentre il
resto del corpo batterico è colorato in verde (fig. 2.37). La
metacromasia è un elemento diagnostico della difterite.
Alcuni coloranti sono assunti dalle cellule viventi senza
alterarne in modo significativo i processi biologici. Sono
impiegati per lo studio di alcune funzioni. Comprendono il
rosso Congo, il verde janus, il blu di cresile brillante, il rosso
neutro.
CH 3
H 3C
Cl–
H 3C
N
2.5.3.
+
S
N
N
CH 3
FIGURA 2.36 ◗ Struttura del blu di metilene.
Preparazione dei coloranti
Le preparazioni adatte all’uso dei coloranti, sono costituite
da soluzioni idroalcoliche. Tali soluzioni sono poco stabili
e devono essere preparate frequentemente dalle soluzioni
sovrassature in alcool assoluto (soluzione alcolica madre). La
soluzione alcolica madre è più stabile, ma è inidonea all’impiego come colorante, poiché non possiede la tipica dissociazione che permette il suo legame con il substrato.
Per ottenere la soluzione alcolica madre, si prepara una
soluzione sovrassatura del colorante in alcol etilico assoluto e la si lascia a riposo per qualche giorno, agitandola frequentemente per evitare la formazione di grossolani depositi. Le soluzioni idroalcoliche impiegabili come coloranti,
sono preparate con una semplice diluizione in acqua: ad
una parte della soluzione alcolica madre vengono aggiunte dieci parti d’acqua distillata.
Capitolo 2. L’osservazione microscopica
19
OH
La soluzioni alcolica madre si prepara aggiungendo:
Colorante in polvere
g
10
Alcol etilico assoluto
ml 100
Le soluzioni idroalcoliche del colorante si preparano aggiungendo:
Soluzione alcolica madre
ml 10
Acqua distillata
ml 100
Per permettere un più agevole passaggio del colorante
attraverso i tegumenti cellulari, alle soluzioni idroalcoliche
possono essere aggiunte sostanze intensificanti; tra queste
può essere ricordato, in particolare, l’acido fenico, che è
aggiunto alla soluzione satura del colorante dopo averlo
sciolto in acqua.
2.5.4. Reagenti usati nelle colorazioni
Durante le colorazioni, oltre ai coloranti, possono essere
impiegate altre sostanze come gli intensificanti, i mordenti
ed i decoloranti (o differenzianti).
Gli intensificanti sono agenti chimici (tab. 2.5) e fisici in
grado di aumentare l’assunzione del colore da parte del
substrato senza inserirsi nel complesso colorante-substrato. Tra gli intensificanti fisici può essere ricordato il calore;
come già indicato, tra quelli chimici l’acido fenico (fig. 2.38).
Il calore aumenta l’assunzione dell’acqua e dei coloranti
presenti in soluzione, diminuendo l’idrofobia delle strutture cellulari di superficie.
I mordenti o mordenzanti intervengono nella reazione
colorante-substrato, in quanto entrano nella composizione
del prodotto. I mordenti possono essere aggiunti alla soluzione del colorante o in una fase successiva alla colorazione. Nel primo caso si parla di coloranti mordenzati. La
maggior parte dei mordenti o mordenzanti sono agenti
ossidanti come l’acido cromico, lo iodio, l’acido picrico e
l’acido nitrico.
I decoloranti sono sostanze in grado di allontanare l’eccesso di colorante assunto da un preparato. Tra i decoloranti possono essere ricordati: l’alcol etilico, l’acido acetico,
Fenolo
FIGURA 2.38 ◗ Il fenolo (acido fenico) è un composto in grado di facilitare la penetrazione del colorante all’interno della cellula.
l’acido cloridrico, l’alcol-acetone, l’acido solforico. Se l’azione
decolorante è esercitata in modo selettivo, il decolorante è
definito diffenziatore (alcol etilico nella colorazione di
Gram).
2.6. LE COLORAZIONI MICROBIOLOGICHE
Tra le colorazioni microbiologiche assumono particolare rilievo quelle batteriche; in esse, per l’alta concentrazione di
molecole acide intracellulari, vengono impiegati i coloranti
basici. Tra i coloranti batteriologici possono essere ricordati: il blu di metilene, il cristalvioletto, la fucsina ed il verde
malachite.
Si parla di colorazioni positive, se è colorata solo la cellula
batterica, di colorazioni negative se, invece, è colorato lo
sfondo. In quest’ultimo caso i batteri si presentano incolori
e contrastano sul fondo scuro (fig. 2.39).
Se le colorazioni impiegano un solo colorante e richiedono un solo passaggio, si definiscono semplici; se richiedono più passaggi ed anche sostanze diverse dai coloranti,
sono definite complesse o composte.
2.6.1.
Principali colorazioni batteriologiche
I batteri possiedono dimensioni modeste ed uno scarso
contrasto con l’ambiente circostante. Per questo motivo,
frequentemente vengono impiegate colorazioni semplici
monocromatiche o complesse che, se da una parte privano
della vitalità gli elementi cellulari, dall’altra ne migliorano
l’osservazione.
TABELLA 2.5. Coloranti contenenti sostanze
intensificanti
Soluzione
alcolica
madre
Acido
fenico
Acqua
Fucsina fenicata
di Ziehl
10 ml
5g
100 ml
Violetto di
genziana fenicato
di Nicolle
10 ml
1g
100 ml
Blu di metilene
fenicato di Khune
15 ml
2g
100 ml
Cristalvioletto
fenicato di Roux
10 ml
2g
100 ml
Colorante
FIGURA 2.39 ◗ Osservazione a 400× della capsula batterica con inchiostro di China (metodo di Burri).
20
Le basi microbiologiche della Biochimica
2.6.1.1.
Colorazione semplice monocromatica
Impiega un solo colorante ed un’unica fase di colorazione:
• il materiale è prelevato, deposto e disteso sul vetrino,
quindi essiccato all’aria e fissato alla fiamma;
• sul vetrino, posto su un piano orizzontale, si versa tanto
liquido colorante da ricoprire completamente il preparato. Si lascia agire per qualche minuto a freddo;
• si getta il colorante e si lava abbondantemente con acqua corrente. Questa operazione consente di eliminare
ogni traccia del colorante non assorbito;
• si asciuga in ambiente areato.
2.6.1.2.
Colorazione di Gram
È stata proposta dall’anatomopatologo danese Cristian
Gram nel 1884. Rivelò la sua utilità ben oltre lo scopo che
l’aveva ispirata, cioè quello di mettere in luce le cellule batteriche nei preparati istologici. Il suo largo impiego è motivato dal fatto che è di semplice esecuzione e permette di
distinguere agevolmente i batteri Gram positivi (figg. 2.40
e 2.41) dai batteri Gram negativi (figg. 2.42 e 2.43). Si basa
sulla capacità posseduta da alcuni coloranti, come il violetto
di genziana o il cristalvioletto, di legarsi con lo iodio dando
composti non dissociabili con l’alcool. Alcuni batteri hanno
una speciale affinità per questa combinazione. Una volta
colorati, cedono il colorante con difficoltà; in particolare, se
trattati con alcool etilico assoluto, restano colorati in viola
(Gram positivi). Altri batteri nelle stesse condizioni si decolorano del tutto, ma sono ricolorabili con un colorante di
contrasto come la safranina, il verde malachite o la fucsina
basica diluita 1/10 o 1/20; quest’ultima li tinge di rosa-rosso
(Gram negativi).
Il diverso comportamento che le cellule batteriche dimostrano nella colorazione di Gram, si riflette anche in un
diverso comportamento nei confronti di altri agenti. Dal
punto di vista terapeutico è degno di considerazione il
fatto che alcuni antibiotici si presentano più efficaci nei
confronti dei batteri Gram positivi, mentre altri dimostrano
una maggiore attività nei confronti dei Gram negativi.
Da un punto di vista diagnostico, con un semplice esame batterioscopico, come la colorazione di Gram, è possibile giungere ad un preciso orientamento per l’identificazione dei germi in esame. Sono Gram positive: gran parte
delle forme sferiche e una parte delle forme bastoncellari
diritte. Sono Gram negative: tra le forme sferiche solo le
Neisseriaceae (a forma di chicco di caffè), tra le forme bastoncellari diritte diverse famiglie, come le Enterobacteriaceae e le Pseudomonadaceae, tutte le forme bastoncellari
ricurve, come le spirochete del genere Borrelia, Treponema
e Leptospira.
FIGURA 2.40 ◗ Forme bacillari Gram positive. Osservazione a 1000×.
FIGURA 2.42 ◗ Piccoli batteri Gram negativi con forma bastoncellare
diritta. Osservazione a 1000×.
FIGURA 2.41 ◗ Forme cocciche Gram positive. Osservazione a 1000×.
FIGURA 2.43 ◗ Batteri di forma coccica Gram positivi e batteri con
forma bastoncellare Gram negativi. Osservazione a 1000×.
Capitolo 2. L’osservazione microscopica
21
TABELLA 2.6. Schema della colorazione di Gram e degli effetti prodotti in ogni fase sui
Gram positivi e Gram negativi
Fase
Tempi
Gram+
Colorazione primaria con violetto di genziana
1-3 minuti
Mordenzatura con soluzione di Lugol
1 minuto
Decolorazione con alcol etilico assoluto
20"-30"
Colorazione di contrasto con fucsina basica diluita 1/10-1/20
20"-30"
Esecuzione (tab. 2.6)
1) Si preleva il materiale, lo si depone sul vetrino, si distende, si asciuga e si fissa il preparato ottenuto alla fiamma;
2) colorazione primaria: si colora con violetto di genziana,
cristalvioletto o violetto di Nicolle. Tempo 1-3 minuti;
3) mordenzatura: si getta l’eccesso di colorante e, senza
lavare, si versa sul preparato la soluzione di Lugol (soluzione iodo-iodurata in acqua). Tempo 1 minuto;
4) decolorazione: si getta il liquido di Lugol e, senza lavare, si versa goccia a goccia alcol etilico assoluto sul
preparato. Si continua fino a che il preparato non cede
più colore. Il tempo della decolorazione è molto importante ed è influenzato dalla qualità del materiale e dallo
spessore dello striscio. Se da una parte una decolorazione insufficiente rischia di lasciare colorati anche batteri Gram negativi, dall’altra una decolorazione eccessivamente prolungata può privare i Gram positivi della
classica colorazione viola. In genere il tempo previsto
in questa fase è di circa 20″-30″;
5) breve lavaggio con acqua corrente;
6) colorazione di contrasto: questa fase ha essenzialmente lo scopo di evidenziare le cellule batteriche che hanno
perso il colore durante il lavaggio in alcol assoluto (Gram
negativi). Richiede l’impiego di un colorante che contrasti con il violetto dei batteri Gram positivi. In genere s’impiega la fucsina 1/10 o 1/20 o la safranina. I Gram negativi
si colorano in rosso. L’uso di altri coloranti come il verde
malachite evidenzia, in modo ugualmente netto, i Gram
negativi dai Gram positivi. Tempo 20″-30″;
7) lavaggio prolungato in acqua corrente fino a che il
preparato non cede più colore;
8) asciugatura in ambiente areato.
Gram–
2.6.1.3. Colorazione di Ziehl-Neelsen (per alcol
acidi resistenti)
L’alcol-acido resistenza del bacillo tubercolare, scoperta da
Ehrlich, costituisce la base per la diagnosi microscopica della tubercolosi. Questa proprietà è presa anche come criterio per la classificazione di un particolare gruppo batterico:
quello dei micobatteri. Appartengono a questo gruppo: il
bacillo tubercolare, il bacillo della lebbra ed alcune forme
saprofitiche. I batteri alcol-acido resistenti sono dotati di
un’elevata idrofobia; possono essere colorati solo con coloranti mordenzati, come la fucsina fenicata di Ziehl, mediante trattamenti a caldo. Una volta assunto il colorante, hanno
la capacità di trattenerlo anche se sottoposti ad un’energica
differenziazione con alcol ed acidi minerali. L’alcol-acido resistenza è dovuta alla presenza di sostanze di natura lipidica che rivestono la parete.
Esecuzione (tab. 2.7)
1) Si preleva il materiale, lo si depone sul vetrino, si distende,
si asciuga e si fissa il preparato ottenuto alla fiamma;
2) colorazione primaria: si colora con fucsina fenicata di
Ziehl (soluzione alcolica madre di fucsina basica ml 10,
acido fenico 5% ml 100) scaldando alla fiamma in modo che per tutta la durata si sviluppino vapori. Tempo 5
minuti;
3) breve lavaggio in acqua corrente;
4) decolorazione: s’impiega acido solforico al 20% fino a
che il preparato diviene giallo e dopo lavaggio conservi una tinta rosa. Occorrono in genere 30″-60″;
5) breve lavaggio in acqua corrente;
6) decolorazione: si decolora con alcol etilico assoluto,
TABELLA 2.7. Schema della colorazione di Ziehl-Neelsen
Fase
Tempi
Colorazione primaria con fucsina fenicata di Ziehl
5 minuti
Decolorazione con acido solforico al 20%
30"-60"
Decolorazione con alcol etilico assoluto
60"-120"
Colorazione di contrasto con blu di metilene
2-5 minuti
Batteri
alcol-acido
resistenti
Batteri non
alcol-acido
resistenti
22
Le basi microbiologiche della Biochimica
l’elevata luminosità. Possedendo un’elevata idrofobia, assumono i coloranti con grande difficoltà. Ne deriva che, nei
preparati sottoposti alla colorazione semplice od a quella
di Gram (fig. 2.46), le spore appaiono come un centro incolore e trasparente, distinto dalla parte restante del batterio
FIGURA 2.44 ◗ Nella colorazione di Ziehl-Neelsen i batteri alcol-acido resistenti, come il Mycobacterium tubercolosis, appaiono colorati
in rosso. Da. R. Cevenini. Microbiologia Clinica. Piccin Nuova Libraria.
Padova 2002.
fino a che il preparato non cede più colore. Occorrono
in genere 60″-120″;
7) breve lavaggio in acqua corrente;
8) colorazione di contrasto: s’impiega una soluzione
idroalcolica di blu di metilene. Tempo 2-5 minuti;
9) lavaggio prolungato in acqua corrente fino a che il
preparato non cede più colore;
10) asciugatura in ambiente areato.
I batteri alcol-acido resistenti sono colorati dalla fucsina
che trattengono in tutte le fasi successive. I batteri non alcolacido resistenti, sono anch’essi colorati dalla fucsina, ma dopo
essere stati decolorati durante la differenziazione, sono in
grado di assumere il colorante di contrasto. Quest’ultimo, di
norma è costituito da blu di metilene. In conclusione i batteri alcol-acido resistenti assumono una colorazione rossa,
mentre tutti gli altri appaiono azzurri (fig. 2.44).
2.6.1.4. Colorazione delle spore secondo
Alessandrini
Dal punto di vista tecnico e concettuale, la colorazione
delle spore può essere trattata accanto alla colorazione di
Ziehl-Neelsen, in quanto l’elevata idrofobia dei rivestimenti
sporali richiede trattamenti drastici, paragonabili a quelli
impiegati nella colorazione dei batteri alcol-acido resistenti
(fig. 2.45).
Le spore, nell’esame a fresco in campo chiaro o in campo
oscuro, sono distinguibili dalle altre componenti dello sporangio e dalle cellule vegetative per l’alta rifrangenza e
FIGURA 2.46 ◗
Sporangi con morfologia a bactridio. Colorazione di
Gram (1000×).
Colorazione delle spore con il verde malachite
1) Colorazione primaria con verde malachite a caldo
per un tempo di 5-10 minuti. Colora le spore, gli
sporangi e le cellule vegetative.
2) Colorazione di contrasto con safranina per 30 secondi. Questo colorante si sostituisce al verde malachite negli sporangi e nelle cellule vegetative,
ma non penetra nelle spore.
3) Le spore sono colorate in verde, mentre gli sporangi e le cellule vegetative in rosso (fig. 2.47).
FIGURA 2.47 ◗
Sporangi colorati con il verde malachite. Osservazio-
ne a 1000×.
FIGURA 2.45 ◗ Sporangi e spore libere. Colorazione di Alessandrini
(1000×).
e dalle altre cellule vegetative. Nelle spore libere (fig. 2.48)
il colorante si deposita sulla superficie e si evidenzia con un
sottile involucro colorato (esosporio). La colorazione delle
Capitolo 2. L’osservazione microscopica
FIGURA 2.48 ◗ Numerose spore libere frammiste a sporangi con spore subterminali prominenti. Osservazione all’M.O. dopo colorazione di
Gram a 1000×.
400×.
spore richiede l’impiego di una colorazione a caldo, come
la fucsina fenicata di Ziehl ed una successiva differenziazione, che però deve essere meno energica rispetto a quella
impiegata per gli alcol-acido resistenti. La metodologia
proposta è quella di Alessandrini.
tica, secondo Fontana; comporta l’uso del tannino come
mordente. Di particolare significato sono anche le metodologie che utilizzano anticorpi specifici contro gli antigeni
capsulari; evidenziano la capsula direttamente o dopo essere stati marcati con fluorocromi.
Esecuzione (tab. 2.8)
1) Si preleva il materiale, lo si depone sul vetrino, si distende, si asciuga e si fissa il preparato ottenuto alla
fiamma;
2) colorazione primaria: si colora con fucsina fenicata di
Ziehl (soluzione alcolica madre di fucsina basica ml 10,
acido fenico 5% ml 100) scaldando alla fiamma in modo che si sviluppino vapori. Tempo 5-10 minuti;
3) breve lavaggio in acqua corrente;
4) decolorazione: si decolora con solfito di sodio al 10%
per 20"-30";
5) si lava con acqua corrente;
6) colorazione di contrasto: si colora con blu di metilene. Tempo 5 minuti;
7) lavaggio prolungato in acqua corrente fino a che il
preparato non cede più il colore;
8) asciugatura in ambiente areato.
2.6.1.6. Colorazione delle ciglia
2.6.1.5.
Colorazione della capsula
Oltre alla colorazione negativa, la capsula può essere evidenziata mediante alcune colorazioni positive; tra queste
appaiono degne di nota quelle che richiedono un pretrattamento con mordenti a base di tannino o formolo. Uno dei
metodi più importanti è quello dell’impregnazione argen-
FIGURA 2.49 ◗
23
Sporangi batterici osservati in contrasto di fase a
Dato che lo spessore delle ciglia batteriche è inferiore al
limite di risoluzione del microscopio ottico, tutti i metodi
messi a punto per dimostrarle tendono a realizzarne l’ispessimento. L’estrema fragilità di queste appendici impone un
delicato allestimento del preparato e l’impiego di fissativi che non producono un’eccessiva alterazione della loro
struttura originaria. Può essere ricordato il metodo di Pulcher che comporta il fissaggio del preparato (con cloruro
di cobalto e acido cromico), seguito da colorazione a caldo
con cristalvioletto-tannino e successivo trattamento con nitrato d’argento ammoniacale.
2.6.1.7. Colorazione delle granulazioni
metacromatiche
È una metodica utilizzata nella diagnostica microscopica
per la ricerca del bacillo difterico. Tra le diverse tecniche
può essere ricordata quella di Ernst-Neisser modificata (Neisser II). Il preparato è prima colorato con blu-cristalvioletto
acetico (soluzione di blu di metilene, cristalvioletto e acido
acetico), in seguito trattato con soluzione di Lugol acido
(Lugol + acido lattico) e infine sottoposto a colorazione di
contrasto con soluzione di crisoidina. Nei corpi batterici, di
color avana chiaro, spiccano i granuli metacromatici di vo-
TABELLA 2.8. Schema della sequenza delle fasi della colorazione di Alessandrini e degli effetti
prodotti da ogni passaggio su sporangi e batteri
Fase
Colorazione primaria con fucsina fenicata di Ziehl
Tempi
5-10 minuti
a caldo
Decolorazione con acido solforico al 10-15%
20"-30"
Colorazione di contrasto con blu di metilene
5 minuti
Sporangi
Cellule vegetative
24
Le basi microbiologiche della Biochimica
FIGURA 2.50 ◗ Granulazioni metacromatiche di Corynebacterium
diphtheriae. Da M. Marchegiani, M. Mirra. Vita e Microrganismi. Piccin Nuova Libraria. Padova 1988.
FIGURA 2.51 ◗ Schema di un preparato contenente due specie bacillari, trattate con anticorpi marcati con isotiocianato di fluoresceina
(verde) e rodamina (rosso).
lutina, colorati in violetto scuro o neri. Nel metodo di Albert,
il preparato è colorato con blu di toluidina, verde malachite
e acido acetico (Albert I) e, in seguito, trattato con soluzione
iodo-iodurata (Albert 2). I bacilli difterici appaiono verdi con
i granuli metacromatici rossi, mentre gli altri microrganismi
assumono una tenue colorazione verde (fig. 2.50).
luce visibile. La fluorescenza prodotta da sostanze proprie
dei microrganismi si definisce primaria, mentre quella dovuta alle sostanze che vengono legate ai microrganismi
(fluorocromi), si definisce secondaria. In microbiologia è più
importante quest’ultima; è ottenuta legando sostanze fluorescenti alla cellula microbica dopo un idoneo trattamento.
L’uso dei fluorocromi, quali l’isotiocianato di fluoresceina o
l’isotiocianato di rodamina legati agli anticorpi, è alla base
dell’immunofluorescenza. Questa tecnica prevede: una prima fase in cui gli anticorpi marcati si legano agli antigeni
microbici specifici con i quali sono posti a contatto; una seconda fase in cui si ricercano le cellule legate ai fluorocromi
con la microscopia a fluorescenza. È largamente utilizzata
nella diagnostica microbiologica (fig. 2.51).
Esecuzione tecnica del metodo di Albert
• Si preleva il materiale, lo si depone sul vetrino, si distende, si asciuga e si fissa il preparato ottenuto alla fiamma;
• si colora con il colorante di Albert I per 5 minuti;
• si getta il colorante senza lavare;
• si colora con l’Albert II per 1 minuto;
• si lava abbondantemente con acqua corrente, si asciuga
e si osserva in immersione.
2.6.1.8. Colorazione con fluorocromi
Le sostanze fluorescenti hanno la capacità di assorbire radiazioni elettromagnetiche di una determinata lunghezza
d’onda e di rilasciare radiazioni di una lunghezza d’onda
superiore. In pratica, ricevendo gli ultravioletti, emettono
2.7. IL MICROSCOPIO ELETTRONICO
2.7.1. Aspetti generali
Il microscopio elettronico (fig. 2.52) è uno strumento dotato di un potere risolutivo nettamente superiore a quello
FIGURA 2.52 ◗ Il microscopio elettronico è una complessa apparecchiatura costituita da componenti ad alta tecnologia. Nell’immagine un microscopio elettronico a scansione (SEM).
Capitolo 2. L’osservazione microscopica
25
Lastra fotografica
+
e–
FIGURA 2.53 ◗ L’elettrone può essere considerato come una particella di massa infinitesima, a cui è associata un’onda di lunghezza pari a
circa 0,005 nm.
del microscopio ottico (1000 volte più elevato); permette la
visione di strutture di dimensioni dell’ordine dei 2,5-3 Å ed
è dotato di ampie possibilità applicative. In campo biologico consente lo studio dettagliato delle strutture cellulari e
virali.
Il cuore del microscopio elettronico è costituito da un
catodo al cui interno è contenuto un filamento di tungsteno o di esaboruro di lantanio (LaB6) che, una volta riscaldato, emette elettroni accelerati attraverso l’applicazione di
un elevato potenziale elettrico (tra i 50 e i 200 kV). In queste
condizioni gli elettroni tendono a percorrere una traiettoria
rettilinea e mettono in evidenza una natura corpuscolare
ed ondulatoria come la radiazione luminosa. Si differenziano tuttavia da quest’ultima per una lunghezza d’onda molto più breve: quella della luce è compresa tra i 380 (violetto)
ed i 730 nm (rosso), mentre l’onda associata agli elettroni è
prossima a 0,005 nm (fig. 2.53).
Nell’M.E. gli elettroni emessi dal catodo sono deviati da
una prima bobina magnetica, funzionante da condensatore,
e messi a fuoco in corrispondenza del preparato; dopo averlo oltrepassato, sono deviati da un secondo avvolgimento
magnetico, avente la funzione di obiettivo. Quest’ultimo è in
grado di produrre un’immagine ingrandita che è ricevuta da
una terza lente magnetica, la quale funge da oculare e produce un ulteriore ingrandimento. L’immagine finale può essere osservata direttamente su uno schermo fluorescente o
essere proiettata su una lastra fotografica (fig. 2.54).
In contrasto con le apparenti somiglianze, le differenze
tra il microscopio a luce ordinaria e quello elettronico sono
sostanziali (tab. 2.9). In particolare è diverso il meccanismo
con cui si forma l’immagine. Nel microscopio ottico la formazione dell’immagine dipende dal grado d’assorbimento
della luce nelle diverse zone del preparato, mentre nel microscopio elettronico la formazione dell’immagine è legata,
soprattutto, alla dispersione degli elettroni. Questi, entrando in collisione con i nuclei degli atomi del preparato, sono
deviati in modo da cadere fuori dell’apertura della lente
magnetica che costituisce l’obiettivo. L’immagine, che ne
deriva sullo schermo fluorescente, è quindi il risultato della
mancanza d’elettroni. La deviazione degli elettroni può essere conseguente a molteplici collisioni, che comportano
una diminuzione dell’energia contenuta; in questo caso
possono essere prodotti anche effetti cromatici.
L’entità della dispersione elettronica deriva dallo spessore e dalla struttura molecolare del materiale in esame; dipende, in particolare, dal numero atomico degli elementi
Bobina magnetica
di proiezione
Bobina magnetica
con funzione di
obiettivo
Bobina magnetica
con funzione di
condensatore
Sorgente di elettroni
FIGURA 2.54 ◗ Schema delle componenti di un microscopio elettronico a trasmissione (TEM).
contenuti. Tanto più elevato è il numero atomico, tanto
maggiore è la perdita elettronica. La maggior parte delle
molecole che costituiscono la materia biologica ha un basso numero atomico; ciò contribuisce scarsamente alla formazione dell’immagine. Pertanto nel caso di materiale
biologico è necessario aggiungere atomi pesanti alla sua
struttura molecolare.
26
Le basi microbiologiche della Biochimica
TABELLA 2.9. Alcuni elementi distintivi tra
il microscopio ottico e quello elettronico
Caratteri distintivi
M.O.
M.E.
Ingrandimento complessivo
1200-1500×
10×
Ingrandimento dell’obiettivo
100×
200×
Lenti intermedie
—
Presenti
Ingrandimento fotografico
—
Possibile
Il vantaggio del microscopio elettronico è dovuto all’elevatissimo potere di risoluzione, che dipende dalle stesse
variabili del microscopio a luce ordinaria. La lunghezza
d’onda del fascio elettronico non ha un valore costante, ma
dipende essenzialmente dalla tensione d’accelerazione alla
quale gli elettroni sono sottoposti; può essere calcolata con
la formula di De Broglie in cui la lunghezza d’onda impiegata (λ), espressa in angstrom (Å), è uguale a:
L
12,2
Å
V
In un modello corrente di microscopio elettronico, dotato di un potenziale corrispondente a 50 kV (5·104V), l’onda
associata all’elettrone risulterebbe di 0,0535 Å; in questo
caso il limite di risoluzione teorico, essendo equivalente a
circa la metà della lunghezza d’onda, dovrebbe essere intorno a 0,03 Å. Ciò consentirebbe di osservare le piccole
molecole, ma a causa di limitazioni quali ad esempio le
aberrazioni delle lenti magnetiche, la disomogeneità dei
campi elettrici e lo spessore delle sezioni, il limite di risoluzione reale dell’M.E. corrisponde a circa 3-5 Å. Per i preparati d’origine biologica, il limite di risoluzione reale sale a
circa 10 Å (1 nm).
L’immagine prodotta dall’obiettivo, che è di circa 100×,
può essere enormemente ingrandita dall’avvolgimento
oculare, raggiungendo un ingrandimento complessivo di
circa 20.000×. Negli apparecchi recenti, che sono dotati di
lenti intermedie, è possibile ottenere ingrandimenti fino a
160.000× che, con un’ulteriore elaborazione fotografica,
possono raggiungere i 106. Lo scarso potere di penetrazione degli elettroni richiede, oltre ad un ambiente sottovuoto, l’impiego di uno spessore estremamente sottile delle
sezioni. Per raggiungere tale obiettivo si impiegano particolari resine, in cui vengono inclusi i campioni, e speciali
microtomi (ultramicrotomi) che consentono di ottenere
sezioni sottilissime.
FIGURA 2.55 ◗ Microscopio elettronico a trasmissione (TEM). Uno
strumento di questo tipo consente l’osservazione di particolari biologici
con dimensioni di 10 Å.
•
renza di potenziale di oltre 50 kV, si produce un’elevatissima accelerazione degli elettroni;
una colonna (fig. 2.56). È mantenuta sotto vuoto spinto
per evitare la dispersione degli elettroni contenuti nel
fascio, se si è in presenza di molecole d’aria;
2.7.2. Microscopio elettronico a trasmissione
(TEM)
Il microscopio elettronico a trasmissione, definito anche
TEM (Transmission Electron Microscope, fig. 2.55), è costituito essenzialmente da una struttura cilindrica e da una consolle attraverso la quale possono essere programmate tutte
le attività. Le principali componenti sono:
• una sorgente luminosa. È costituita da un filamento di
tungsteno o di esaboruro di lantanio; tale filamento
produce un fascio di elettroni che vengono convogliati
all’interno di un cilindro (calotta di Whenalt). In prossimità di questo si trova l’anodo, attraverso cui passa il fascio
elettronico. Se tra il catodo e l’anodo si applica una diffe-
FIGURA 2.56 ◗
a trasmissione.
Particolare della colonna del microscopio elettronico
Capitolo 2. L’osservazione microscopica
• un sistema di lenti. È costituito da una serie di campi ma-
•
•
gnetici la cui intensità cambia in rapporto all’intensità
della corrente che li genera. Modificando l’intensità del
campo magnetico, varia l’ingrandimento prodotto;
un supporto per l’alloggiamento del preparato. È formato
da una sottile griglia metallica di 3 mm di diametro. Il
supporto è situato nella parte media della colonna del
microscopio e in modo tale che risulti perpendicolare al
fascio elettronico prodotto;
uno schermo fluorescente o pellicola fotografica. Permette
di ricavare le immagini di quanto esaminato. Poiché l’occhio umano non è direttamente sensibile agli elettroni,
è necessario impiegar lastre fotografiche o schermi fluorescenti. Questi ultimi, alla pari di quelli televisivi, assorbono gli elettroni e li convertono in radiazioni luminose,
quindi, in immagini osservabili.
2.7.3. Microscopio elettronico a scansione
(SEM)
Da quando è stato messo a punto nel 1965, il microscopio elettronico a scansione (SEM) ha reso possibile lo sviluppo di un’ulteriore metodologia d’indagine. Con questa
tecnica microscopica è possibile esplorare la superficie dei
campioni esaminati. Da cellule, tessuti e batteri è possibile
ottenere immagini tridimensionali perfette nei più piccoli
particolari e con una risoluzione nettamente superiore a
quella del microscopio ottico. Combina il meccanismo di
funzionamento della microscopia elettronica con quello televisivo, in quanto l’immagine finale è raccolta appunto da
uno schermo televisivo.
A differenza del TEM, gli elettroni non sono trasmessi
attraverso preparati ultrasottili, ma rimbalzano sulla superficie del campione esaminato che può possedere qualsiasi
forma e spessore. L’allestimento dei preparati richiede un
procedimento di lavoro piuttosto complesso. In particolare
le superfici del campione devono essere rese conduttrici
ed in grado di riflettere gli elettroni mediante rivestimento
con carbone e vapori metallici, solitamente oro e argento.
Gli elettroni del microscopio elettronico a scansione sono prodotti da un tubo catodico ad alta energia. Impiegando campi magnetici e lenti, paragonabili al condensatore
del microscopio ottico, dal fascio elettronico è ottenuto un
sottilissimo pennello, di 5-10 nm di diametro, che è fatto
scorrere sul preparato rivestito di metallo. In questo modo
dalla superficie del campione si ottiene la riflessione di
elettroni secondari.
La scansione del campione è effettuata punto per punto;
il piccolo pennello elettronico è inviato su tutta la superficie
ed è in grado di penetrare attraverso tutte le più minuscole
aperture presenti. Ne deriva un potere di risoluzione di 10-20
nm e, perciò, assolutamente impensabile con la microscopia
ottica. La microscopia elettronica a scansione consente una
elevatissima profondità di campo ed è in grado di produrre
sorprendenti effetti tridimensionali.
La produzione dell’immagine finale è ottenuta dagli
elettroni secondari, estratti punto per punto dalla superficie del campione su cui il pennello elettronico incontra le
aree rivestite di metallo. Gli elettroni secondari, selezionati
e deflessi magneticamente da un collettore (detector), producono una serie di segnali corrispondenti all’area esplorata dalla sonda elettronica. Il segnale prodotto dal collettore
è amplificato e trasmesso ad un tubo catodico televisivo
che, in sincronia con il movimento della sonda, forma l’immagine finale. Gli ingrandimenti possibili con il SEM variano da 20 a 106.
27
2.7.4. Microscopio elettronico ad alta
tensione
I microscopi elettronici ad alta tensione sono apparecchiature molto complesse, costose e di difficile manutenzione. Nel
microscopio elettronico convenzionale le tensioni sono comprese tra i 50 e i 200 kV, mentre nei microscopi ad alta tensione si raggiungono tensioni d’accelerazione comprese tra
i 500-3000 kV. Per questo motivo, possiedono un maggiore
potere di penetrazione degli elettroni e la possibilità di esaminare sezioni spesse fino a 5 μm con un’elevata risoluzione
e la possibilità di esaminare campioni allo stato vivente.
2.8. ALLESTIMENTO DEI PREPARATI PER IL TEM
Il materiale biologico assorbe gli elettroni in modo modesto.
Per aumentarne il basso contrasto che ne deriva, si deve ricorrere a trattamenti con metalli, nell’ambito di metodologie
come: l’ombreggiatura, la colorazione negativa, le sezioni ultrasottili e la colorazione positiva. Il trattamento scelto è sempre preceduto da una fase d’allestimento del preparato, che
varia secondo i risultati che si vogliono raggiungere.
Nell’ombreggiatura la griglia, contenente il preparato, è
introdotta in una camera a vuoto. All’interno di questa è
fatto evaporare un metallo pesante come il cromo, il platino
o il palladio, in modo tale che si depositi sul preparato.
Quest’ultimo, rispetto al filamento, si trova disposto con
una certa angolazione; ne deriva che il metallo si deposita
solo sulla superficie del materiale rivolta verso il filamento
di tungsteno. In questo modo le parti in ombra, contrariamente a quelle esposte, non sono ricoperte dal metallo.
Nelle immagini ottenute sullo schermo fluorescente, le parti ricoperte dal metallo appaiono scure, mentre sulla lastra
fotografica, che è stampata in negativo, appaiono luminose. Nella riproduzione fotografica le particelle in esame appaiono ben contrastate rispetto allo sfondo e con un effetto
tridimensionale, dovuto alle ombre non colorate. Forma,
grandezza e collocazione delle ombre forniscono dati circa
morfologia e dimensioni delle particelle esaminate.
La colorazione negativa (fig. 2.57) è un’altra tecnica microscopica. Consiste nel deporre sulla reticella contenente
FIGURA 2.57 ◗ Virus respiratorio sinciziale osservato al TEM dopo colorazione negativa. Da R. Cevenini, Microbiologia clinica, II ed. Piccin
Nuova Libraria. Padova 2010.
28
Le basi microbiologiche della Biochimica
il preparato da esaminare una goccia d’acetato di uranile o
di fosfotungstato di potassio. In questo modo il colorante
tende a depositarsi sulle parti vuote della griglia ed alla
periferia delle strutture esaminate. Queste ultime sullo
schermo fluorescente appaiono, pertanto, più luminose rispetto allo sfondo.
Sezioni ultrasottili. Questa metodologia è impiegata nelle indagini sulle componenti cellulari o virali, contenute
all’interno di cellule o tessuti. L’allestimento delle sezioni
ultrasottili è preceduto da una complessa serie di operazioni sul campione in esame. Tra le fasi possono essere individuate: una prefissazione, un fissazione ed un’inclusione in
resina epossidica.
Colorazione positiva. Le strutture biologiche possono
essere colorate con sali, come l’acetato d’uranile che è adsorbito in modo differente dalle diverse componenti. Nella
colorazione positiva possono essere impiegati anche anticorpi specifici che, legati con una molecola opaca agli
elettroni (ferritina), permettono la colorazione selettiva di
alcune componenti microbiche (fig. 2.58).
I metodi utilizzati mettono in risalto i particolari strutturali in modo differenziato. Le dimensioni di una particella
virale, ad esempio, nell’ombreggiatura appaiono maggiori
rispetto alla situazione reale per l’accumulo di metallo sulla
superficie dei virioni; nelle colorazioni negative appaiono
minori per la penetrazione del colorante nelle strutture
superficiali. Nelle sezioni ultrasottili sono ancora più ridotte, in quanto le strutture virali collassano durante l’allestimento dei preparati.
FIGURA NON ORIGINALE: TRATTA DA
VOLUME DA NOI TRADOTTO. SI PREGA
SOSTITUIRE O ELIMINARE.
FIGURA 2.58 ◗ Aggregati cristallini di adenovirus intranucleari. Da R.
Cevenini, Microbiologia clinica, II ed. Piccin Nuova Libraria. Padova
2010.
QUESITI DEL CAPITOLO 2
1) Quale
Q l ruolo
l ebbe
bb Antoni
A
i van LLeeuwenhoek
h k nell’ambill’ bi
to delle scienze microbiologiche?
2) Si descriva la struttura dell’occhio.
3) Si illustri il meccanismo di formazione dell’immagine
sulla retina.
4) Che cosa s’intende per aberrazione cromatica e per
aberrazione di sfericità?
5) Che cosa s’intende per limite di risoluzione del microscopio ottico?
6) Si descrivano le componenti del microscopio ottico
composto.
7) Si calcoli il limite di risoluzione di un M.O. se AN = 1,25
ed è impiegata una radiazione con lunghezza d’onda di
600 nm.
8) Come si determina l’ingrandimento complessivo di un
microscopio ottico composto?
9) Su quale principio si basa il microscopio a contrasto di
fase?
10) In quali ambiti è impiegato il microscopio a contrasto
di fase?
11) Si evidenzino le componenti impiegate nella microscopia in contrasto di interferenza differenziale (DIC)
12) Quali altri tipi di microscopio sono utilizzati, oltre a
quello in campo chiaro ed a contrasto di fase?
13) Si descriva l’itinerario di lavoro necessario per allestire
un preparato microscopico a fresco.
14) Si descriva l’itinerario di lavoro necessario per allestire
un preparato microscopico colorato.
15) Quali sono le componenti molecolari di un colorante?
16) Quali caratteristiche possiedono i coloranti impiegati
in batteriologia?
17) Quando si parla di colorazioni semplici e di colorazioni
complesse?
18) Quale ruolo svolgono i mordenzanti?
19) Si descriva la colorazione di Gram.
20) Si descriva la colorazione di Ziehl-Neelsen e la colorazione di Alessandrini.
21) Che cosa s’intende per “granulazioni metacromatiche”?
22) Su quale principio si basano le metodologie microscopiche impiegate per osservare le ciglia?
23) Si descriva la colorazione negativa secondo Burri.
24) Che cosa s’intende per fluorescenza?
25) In quali situazioni è impiegata la microscopia a fluorescenza?
26) Quali sono i limiti propri del microscopio ottico?
27) Quali vantaggi presenta il microscopio elettronico rispetto al microscopio ottico?
28) Si evidenzino le caratteristiche fondamentali del TEM e
del microscopio ad alta tensione.
29) Si evidenzino le caratteristiche ed il meccanismo di
formazione dell’immagine nel SEM.
30) Si descriva la tecnica dell’ombreggiatura.
31) Si descriva la tecnica della colorazione negativa impiegata per l’osservazione al TEM.