Slidetube.it
GENETICA MEDICA
Malattie dovute ad anomalie di un singolo gene
L’insieme dei fattori che determinano la trasmissione dei tratti, delle caratteristiche e delle malattie dai
genitori ai figli è definito ereditarietà. Facciamo innanzitutto alcune precisazioni sui cromosomi: i 46
cromosomi umani sono trasmessi per metà dal padre e per metà dalla madre; di queste 23 coppie, 22 sono
definite autonomi e non hanno alcuna relazione col sesso dell’individuo, mentre una ( composta dai
cromosomi X e Y) è strettamente legata alla determinazione del sesso. Nell’uomo sono presenti il
cromosoma X e Y, e quest’ultimo controlla lo sviluppo degli organi sessuali primari maschili (testicoli) e di
tutti i caratteri maschili derivanti dalla secrezione di ormoni da parte di queste ghiandole. Durante il processo
di replicazione del DNA e della scissione cromosomica possono verificarsi errori che provocano una
mutazione in uno o più geni : se la mutazione si verifica durante la formazione dei gameti, allora l’individuo
che si svilupperà dopo la fecondazione avrà il gene mutante in ognuna delle sue cellule e presenterà una
patologia più o meno grave, mentre se la mutazione non coinvolge i gameti la persona portatrice non la
trasmetterà ai propri figli. Le malattie genetiche sono malattie causate proprio da un’alterazione del
patrimonio genetico (DNA) che nella maggior parte dei casi sono ereditarie.
Le malattie genetiche si distinguono in monogeniche o mendeliane (alterazione di un singolo gene),
cromosomiche (alterazione del numero o della struttura di uno o più cromosomi) e multifattoriali
(componente genetica ed ambientale nell’instaurazione della malattia).
Molte malattie ereditarie dell’uomo sono determinate da mutazioni in singoli geni e sono quindi trasmesse
come caratteri monogenetici. Le malattie monogenetiche si possono trasmettere con modalità diverse:
1. autosomica dominante;
2. autosomica recessiva;
3. legata al cromosoma X;
4. legata al cromosoma Y.
Le modalità di ereditarietà dei geni dell’uomo vengono generalmente determinate esaminando come il
carattere compare negli alberi familiari di individui che chiaramente lo manifestano (fenotipo). Lo studi
odell’albero familiare si chiama analisi del pedigree; l’individuo affetto a partire dal quale si costruisce
l’albero è detto probando.
Malattie autosomiche dominanti
Malattie dovute a mutazioni di geni dominanti che esprimono il loro fenotipo sia in eterozigoti che in
omozigosi e che sono localizzati sugli autonomi. Le principali caratteristiche sono:
la malattia è presente in ogni generazione;
un individuo affetto trasmette la malattia alla sua progenie con una probabilità del 50% dei casi;
una persona sana genera una progenie sana;
la trasmissione della malattia è indipendente dal sesso;
il rischio di ricorrenza di una malattia autosomica dominante è del 50%; tale rischio resta costante,
indipendentemente dal numero di soggetti affetti o non che sono già nati.
Slidetube.it
Malattie autosomiche recessive
Si manifestano solo nello stato di omozigosi, quando entrambi gli alleli sono interessati alla mutazione; ecco
le principali caratteristiche:
gli individui affetti sono di solito figli di individui non affetti (portatori asintomatici);
c’è un’aumentata incidenza di consanguineità tra i genitori;
sono colpiti entrambi i sessi;
dopo la nascita di un figlio affetto, ciascun figlio successivo ha il 25% di probabilità di essere affetto;
se entrambi i genitori sono eterozigoti; i figli avranno il 50% di probabilità di essere eterozigoti, il 25%
di essere sani ed il 25% di essere affetti;
se due soggetti malati si sposano, tutti i figli ne saranno affetti;
se un soggetto affetto sposa un soggetto eterozigote, i figli avranno il 50% di probabilità di essere
affetti.
L’interpretazione di un albero genealogico nel caso di una malattia autosomica dominante può essere
complicata da alcuni fenomeni, quali la ridotta penetranza, l’espressività variabile, l’insorgenza di una
mutazione de novo, l’esordio tardivo della malattia.
Un carattere a penetranza ridotta è un carattere che non si manifesta nella totalità degli individui portatori;
la penetranza è una misura quantitativa data dalla percentuale di portatori che esprimono il fenotipo sul
totale degli individui portatori di quel gene mutato; altresì si può dire che la penetranza è la frequenza
(probabilità) che un genotipo esprima il fenotipo. Molte malattie autosomiche dominanti sono a penetranza
incompleta (vengono all’osservazione come fenotipi che saltano una generazione)
Si parla di espressività variabile quando una malattia (fenotipo) si manifesta con caratteristiche cliniche
diverse.
Malattia autosomica recessiva: Ittero ereditario a bilirubina indiretta
Enzima responsabile: UTG, uridilglicuroniltransferasi (enzima dimerico che coniuga una molecola di bilirubina
con due molecole di acido glicuronico formando un composto idrosolubile che viene eliminato con le urine).
L’enzima svolge anche altre diverse reazioni di detossificazione nel nostro organismo e si trova in vari organi,
oltre che nel fegato. È presente nel genoma in due copie, sul braccio lungo del cromosoma 2 e del
cromosoma 4 (2q37 e 4q13), probabilmente per diplicazione e diversificazione nell’ambito dell’evoluzione.
La malattia si manifesta in tre forme
- CN1 (Crigler-Najar) : è la forma più grave, dovuta soprattutto a delezione di singoli nucleotidi che
porta a totale assenza di attività enzimatica. La presenza di bilirubina idrofobica è abbondante e
causa gravi danni alle cellule nervose. Spesso i bambini sono tetraplegici. La fototerapia può curare
parzialmente.
- CN2: L’attività dell’enzima è ridotta al 30 %, è relativamente meno grave. Si verifica di solito per
mutazioni missenzo o nonsenso in eterozigoti. I pazienti possono vivere restando per tutta la vita in
fototerapia e con l’utilizzo di un farmaco, phenobarbital, che agisce al livello di una sequenza
enhancer, barbie, a monte del promotore, che incrementa notevolmente l’attività enzimatica.
- Gilbert: è la forma meno grave. Si ha un lieve subittero alle sclere, e la cura con phenobarbital è
sufficiente.
Spesso queste mutazioni possono essere in eterozigosi con polimorfismi del promotore del gene. Esso infatti
presenta il dinucleotide TA ripetuto un certo numero di volte. La forma più diffusa è TA(6). Molto diffusa è
anche TA(7) nei portatori sani, in quanto un lieve aumento dei livelli di bilirubina porta a vantaggio selettivo
(i portatori sani sono protetti da ictus e infarti.
Slidetube.it
Ereditarietà legata al sesso
Le malattie X-linked sono malattie causate da mutazioni in geni localizzati sul cromosoma X, quindi i
meccanismi di trasmissione sono condizionati dal sesso. I soggetti di sesso femminile hanno due cromosomi
X nel loro assetto diploide, di conseguenza due alleli X-linked: in tal modo è possibile avere tre combinazioni
del carattere (per esempio G) associato all’allele in questione: GG, Gg, gg. Un soggetto di sesso maschile
invece, avendo un solo cromosoma X, presenta sempre una condizione di emizigosità per un locus X-linked. Il
genotipo di un soggetto maschile è chiaramente determinato dal genotipo della madre, di conseguenza una
malattia X-linked non potrà mai essere trasmessa da un padre al proprio figlio maschio ma soltanto dalla
madre al proprio figlio maschio. L’ereditarietà di un gene malattia X-linked può essere sia dominante che
recessivo. Nel caso di ereditarietà dominante, tutti i figli maschi e tutte le figlie femmine di una madre
omozigote e di un padre sano saranno affetti dalla malattia. Il 50% della progenie derivante dall’unione di
una donna eterozigote affetta ed un uomo sano sarà affetto dalla malattia, indipendentemente dal sesso. In
ultima analisi tutta la progenie femminile di un uomo affetto ed una madre sana sarà malata, mentre tutti i
maschi saranno sani. Nel caso di ereditarietà dominante spesso le femmine sono affette in misura più lieve
rispetto ai maschi. Questa è una diretta conseguenza del fenomeno della lyonizzazione, fenomeno in cui si
ha l’inattivazione casuale di uno dei due cromosomi X nelle cellule di un soggetto femminile (in tal modo il
cromosoma X inattivo non sarà trascritto ed apparirà in forma eterocromatica fortemente condensata, nota
come corpo di Barr). In una malattia con eredità X-linked recessiva i maschi affetti trasmettono la malattia a
tutta la progenie di sesso femminile ed a nessuno di sesso maschile. Le donne portatrici non sono affette ma
generano figli di sesso maschile al 50% sani ed al 50% malati, le figlie femmine invece sono tutte sane. In
questo caso quindi la malattia sarà molto più frequente nei maschi poiché una femmina malata può essere
generata solo dall’unione di una donna malata e/o portatrice ed un uomo malato.
Malattia X-linked recessiva (si manifesta solo nei maschi e viene trasmessa da donne sane portatrici)
Distrofia muscolare: Malattia caratterizzata da una progressiva perdita del tessuto muscolare, sostituito dal
connettivo, a causa dell’assenza della distrofina (proteina presente su Xp21). La malattia può presentarsi in
due forme:
- Distrofia muscolare di Duchenne (distrofia muscolare pseudoipertrofica): frequenza 1:3500, è la
forma più grave, caratterizzata dall’assenza della proteina. È dovuta a mutazioni nel gene della
distrofina, enorme di circa 2.5 Mb. I primi sintomi si hanno intorno al II anno di vita; i bambini
camminano in punta di piedi e in posizione arcuata del busto per mantenere l’equilibrio, inoltre
hanno difficoltà a rialzarsi da terra. Presentano pseudoipertrofia muscolare (tessuto connettivo che
sostituisce il muscolo). Dopo il 12-13esmo anno sono costretti a vivere su una sedia a rotelle, e
muoiono intorno al 20-30esimo anno per insufficienza respiratoria. La maggioranza delle mutazioni
che determina la DM è costituita da delezioni intrageniche. Questo può produrre lo spostamento del
quadro di lettura determinando la produzione di una proteina tronca, caratteristica del fenotipo
grave di Duchenne. La malattia è quasi esclusivamente maschile, ma può colpire anche le donne: se
avviene una traslocazione del braccio corto del cromosoma X, che frammenta il gene della distrofina,
tale cromosoma non può essere inattivato (perché non è intero), di conseguenza in tutte le cellule
sarà inattivato l’altro, e si avrà distrofia muscolare.
- Distrofia muscolare di Becker: è la forma più lieve, che si verifica per mutazione puntiforme a livello di
un singolo aminoacido nella proteina che però non perde la sua cornice di lettura, di conseguenza è
presente ma non attiva al 100%. In questi casi la malattia insorge intorno al 20esimo anno di vita, e la
morte può arrivare anche al 60esimo anno.
Slidetube.it
Diagnosi: Uno dei criteri con cui il medico può sospettare la DMD oDMB è il segno di Gowers, cioè il modo
particolare con cui il paziente distrofico si alza da terra o in posizione eretta: il tronco è flesso verso le coscie
ed il paziente usa le braccia poste sulle ginocchia. Alcuni esami di laboratorio possono mettere in evidenza il
danno muscolare, come per esempio il valore dell’enzima creatin-chinasi nel sangue, un enzima che viene
liberato nel sangue quando esiste un danno muscolare. Due accertamenti più precisi sono: la biopsia
muscolare, che permette di valutare la presenza di distrofina, e la diagnosi molecolare, che permette di
vedere se ci sono alterazioni nel gene della distrofina partendo da prelievo di sangue (o villi coriali, liquido
amniotico per diagnosi prenatale).
Malattie Y-linked: Il gene mutato è trasmesso a tutti i figli maschi, mente le femmine sono normali. Poiché la quasi
totalità dei geni associati al cromosoma Y producono il fenotipo maschile, i maschi portatori di mutazioni a questo
cromosoma sono in genere sterili, e quindi la mutazione si estingue col portatore.
Eccezioni all’ereditarietà mendeliana
Lo sviluppo di un organismo a partire da uno zigote è un processo di crescita e di differenziamento, risultato
delle interazioni del menoma con l’ambiente cellulare interno e quello esterno. Quindi il fenotipo è il
risultato di interazioni tra molti fattori durante lo sviluppo.
Eccezioni all’ereditarietà mendeliana sono costituite dalla penetranza incompleta.
La penetranza è la frequenza (probabilità) con la quale un particolare genotipo esprima il fenotipo
atteso. Se ciò avviene per meno del 100% dei casi, allora si parla di penetranza incompleta.
Un altro esempio è l’espressività variabile. Si parla di espressività variabile quando una malattia
(fenotipo) si manifesta con caratteristiche cliniche diverse, come nel caso della sindrome di Marfan,
patologia che attacca il tessuto connettivo, ma in particolar modo lo scheletro, l’occhio ed il cuore
(dita delle mani lunghe e sottili, dislocazione del cristallino, incontinenza valvolare). Un soggetto
affetto da sindrome di Marfan può presentare una o più segni della malattia.
Insorgenza di una mutazione de novo, molto spesso presente in individui i cui genitori sono sani.
Esordio tardivo della malattia, come la Corea di Hungtinton, che presenta una penetranza che
aumenta con l’avanzare dell’età del soggetto portatore.
Conversione genica: è il fenomeno per cui un’allele è capace di modificare la funzione dell’altro allele
(un eterozigote Aa può diventare AA)
Codominanza: è il caso in cui due geni dominanti si esprimono entrambi nel fenotipo (gruppo
sanguigno AB)
Dominanza negativa: il prodotto di un allele mutato interagisce col prodotto dell’allele normale
neutralizzandone la funzione (ex una proteina tronca si lega alla proteina prodotta dall’allele normale
bloccandola)
Dominanza ectopica: un gene si esprime in un tessuto dove normalmente non dovrebbe esprimersi
Dominanza invertita: un gene si comporta in forma dominante in un sesso e recessiva nell’altro (ex
calvizie)
In attivazione del cromosoma X: entro i primi 12-16 giorni di gestazione, uno dei due cromosomi X
viene inattivato con meccanismo genico ad opera di un gene localizzato sul cromosoma X (Xq13).
L’inattivazione del cromosoma avviene contemporaneamente in tutte le cellule. In seguito ad in
attivazione, nella donna funzionerà un solo gene X, e l’inattivazione sarà casuale, cioè in alcune
cellule sarà inattivato il cromosoma X di origine materna, mentre in altre quello di origine paterna. L’X
inattivo può essere osservato nei nuclei interfasici come un piccolo corpicciolo di forma triangolare
addossato alla membrana nucleare, che prende il nome di corpo di Barr.
Slidetube.it
Imprinting genomico
Il concetto di imprinting genomico è importante in quanto può fornire una spiegazione per un numero
consistente di situazioni in cui la trasmissione e l’espressione genetica non si possono spiegare con le leggi di
Mendel. Il termine imprinting è stato utilizzato in generale per indicare qualsiasi tipo di modificazione del
comportamento in conseguenza ad esperienze particolari. Di recente si usa il termine imprinting genomico
per riferirsi all’espressione differenziata di materiale genetico a seconda che esso derivi dal genitore di sesso
maschile o femminile. Il periodo critico durante il quale le informazioni genetiche vengono marcate, vale a
dire che esse vengono temporaneamente modificate per permettere un’espressione differenziata, dovrebbe
essere quello in cui si formano le cellule germinali. L’imprinting genomico è un processo che, in maniera
temporanea e reversibile, lascia un’impronta diversa nei geni trasmessi dal padre rispetto a quelli trasmessi
dalla madre.
Esistono 4 tipi di osservazioni a dimostrazione della presenza del fenomeno dell’imprinting:
1. esperimenti di tipo trasferimento pronucleare nei topi;
2. fenomeni dei triploidi umani;
3. disomie uniparentali in animali e uomo;
4. espressione di materiale genetico transgenico in topi transgenici.
Disomie uniparentali in modelli animali e nell’uomo
Se una cellula uovo possiede due copie dello stesso cromosoma e viene fecondata da uno spermatozoo che
non possiede quel cromosoma, l’embrione che ne risulterà conterrà un numero normale di cromosomi, ma
entrambe le copie di un cromosoma saranno di origine materna (o, in situazioni opposte, di origine paterna).
Secondo il principio dell’equivalenza negli ibridi reciproci, ci aspetteremmo che animali derivati da tali incroci
siano identici: in realtà ciò non vale per diversi cromosomi. Una situazione del genere è stata descritta
nell’uomo in due casi di fibrosi cistica. In entrambi i casi i soggetti affetti presentano due cromosomi 7 di
origine materna ed alla presenza della disopia uniparentale sono ascrivibili segni clinici aggiuntivi quali
ritardo della crescita intra-uterina e post-natale. Non è comunque chiaro se i maggiori effetti fenotipici delle
disopie uniparentali siano causati dalla presenza di due cromosomi dello stesso genitore o dalla mancanza di
quello dell’altro. Altri esempi sono:
sindrome di Prader-Willi: ipotonia, obesità, ipogonadismo, bassa statura, mani e piedi piccoli, capelli
chiari e ipopigmentazione e ritardo mentale medio.. È dovuta alla presenza di una delezione del
braccio lungo del cromosoma 15 (q11-13). Nella quasi totalità dei casi è il cromosoma paterno ad
essere deleto
sindrome di Angelman: accessi di riso inappropriati, andatura atassica, epilessia, bocca larga e lingua
protrudente, assenza della parola, ipopigmentazione e ritardo mentale grave.
È sorprendente quindi osservare come due malattie con quadri clinici così diversi sono dovute ad imprinting
differenziale di una stessa regione cromosomica.
Slidetube.it
Malattie da amplificazione delle triplette
In tutte le patologie ereditarie la mutazione responsabile è stabile, cioè individui affetta di una famiglia
presentano la stessa mutazione. È stata riconosciuta una nuova classe di malattie genetiche: le malattie da
amplificazione delle triplette, caratterizzate dall’espansione, all’interno del gene responsabile, di
determinate triplette (ex CAG, CGG).
Nella trasmissione del gene da generazione in generazione, il numero di triplette che aumenta causa
anomalie a livello dell’espressione e della funzione del gene. Esse sono principalmente malattie di tipo
neurologico.
Corea di Huntington: Disordine neurologico progressivo (demenza, disordini affettivi). È una malattia
età-dipendente (insorge tra i 30 e i 50 anni). Il gene Huntington si trova sul braccio corto del
cromosoma 4, e l’insorgenza sempre più precoce della malattia con l’avanzare delle generazioni è
dovuta a una tripletta, CAG, che si duplica in diverse copie; CAG codifica per un Gln, e la duplicazione
del codone porta a un accumulo di Gln nella proteina codificata, il che accelera l’insorgenza della
malattia.
Sindrome dell’X fragile: è la più comune forma di ritardo mentale dopo la sindrome di Down. In
nome si riferisce ad un sito fragile del cromosoma X in cui la cromatina non riesce a condensare
durante la mitosi. L’espansione della tripletta CGG interessa una parte del gene FMR1 e abolisce
l’espressione e la funzione del gene stesso.
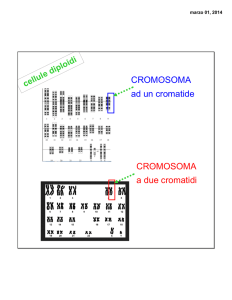
LE BASI CROMOSOMICHE DELL’EREDITARIETA’
Si definisce cromosoma il modo in cui il DNA è organizzato nella cellula. Il DNA cellulare è complessato con
proteine a formare la cromatina. Vi sono differenti livelli di condensazione della cromatina: l’eucromatina,
poco condensata, e l’eterocromatina, molto condensata; i corpuscoli di cromatina visibili al microscopio
durante la metafase sono definiti cromosomi. I cromosomi appaiono come bastoncelli che presentano un
restringimento detto centromero e due segmenti chiamati braccia (uno corto p ed uno lungo q). L’estremità
di ogni braccio è detto telomero. Quest’ultimo ha funzione stabilizzante, in quanto una sua perdita porta il
cromosoma a fondersi con un altro o a venire degradato; il centromero invece è importante per la mitosi. A
seconda della posizione del centromero riconosciamo: cromosomi metacentrici, con il centromero al centro
del cromosoma, cromosomi submetacentrici, con il centromero più vicino ad una delle due estremità,
cromosomi telocentrici, con il centromero sull’estremità telomerica. L’assetto cromosomico di un individuo è
definito cariotipo. Per esaminare il cariotipo si utilizzano globuli bianchi ottenuti da un prelievo di sangue. In
seguito ad alcune procedure di colorazione, è stato possibile rendere visibili sui cromosomi la presenza di
bande chiare e scure che si alternano (regioni di eucromatina che si alternano a eterocromatina): bande G,
scure, che contengono pochi geni trascritti e ricche di AT; bande R, chiare, contengono più geni trascritti e
ricche di GC. Per quanto riguarda l’organizzazione strutturale, ogni cromosoma corrisponde ad una molecola
di DNA avvolta attorno a proteine istoniche; questo complesso DNA-proteine rappresenta un primo livello di
spiralizzazione detto nucleosoma. Ulteriori ripiegamenti contribuiscono a compattare ulteriormente il DNA.
Le anomalie cromosomiche, cioè le alterazioni che riguardano il numero e la struttura dei cromosomi, sono
responsabili del 50% degli aborti spontanei e sono causa di malformazioni. La causa delle anomalie è da
ricercarsi in un errore durante la formazione dei gameti. Vi sono poi anomalie cromosomiche che insorgono
durante la vita adulta e che sono alla base di numerose forme di cancro.
Slidetube.it
Anomalie numeriche: si hanno in seguito ad una non disgiunzione che causa una anormale distribuzione dei
cromosomi durante la meiosi e la mitosi. Si hanno aneuploidie, cioè acquisto (trisomia;quelle del 13,18 e 21,
e dell’X nelle femmine sono le uniche compatibili con la vita) o perdita (monosomia, spesso incompatibile
con la vita) di un cromosoma. Le monosomie e le trisomie possono anche essere parziali e riguardare cioè le
braccia lunghe o corte di un cromosoma (a volte compatibile con la vita). Tuttavia queste appartengono ad
anomalie struttrali.
Anomalie strutturali: derivano da crossino-over ineguali a livello di sequenze uguali, possono essere
quantitative, con aumento o riduzione del materiale cromosomico, o qualitative, con diversa disposizione del
materiale cromosomico. Si dividono in:
Delezioni: dovute a calore, virus, radiazioni, sostanze chimiche. Consistono nella perdita di un
frammento di cromosoma di dimensioni variabili (in genere dell’ordine di una o qualche decina di
geni); si evidenziano nel cariotipo attraverso l’assenza di una o più bande, o addirittura di un intero
braccio. L’effetto di una delezione dipende dalla grandezza della porzione mancante e
dall’informazione in essa contenuta. Possono essere interstiziali o terminali.
Traslocazioni: trasferimento di materiale genetico tra due o più cromosomi diversi. Possono essere
bilanciate, cioè scambio alla pari di frammenti di cromosomi diversi, che non portano a perdita di
materiale genetico e perciò non si ha nessun segno clinico; non bilanciate, e in questo caso uno o più
cromosomi in seguito a traslocazione hanno perdita di materiale, mentre altri ne hanno in sovrappiù.
Inversioni: duplice rottura seguita da rotazione di 180° del frammento. Può investire il centromero
(pericentrica) o non farlo (paracentrica).
Duplicazioni: presenza di due copie di uno stesso frammento di cromosoma, spesso risultato di
crossino-over ineguali; possono avvenire per errori di replicazione in fase S. Causano ridondanza di
geni, producono variazioni fenotipiche che possono aver fornito una importante sorgente di
variabilità nel corso dell’evoluzione
Anomalie numeriche di importanza clinica
Trisomia 21: sindrome di Down (colpisce circa 1/700 nati vivi). Essa è la causa più frequente di ritardo mentale.
Nella maggior parte dei casi (95% circa) questi soggetti hanno 47 cromosomi e la trisomia deriva da una non
disgiunzione durante l’oogenesi. La frequenza degli eventi di non disgiunzione aumenta moltissimo con l’età materna.
Nel 4% dei soggetti invece la malattia deriva da una traslocazione che può essere ereditata da ambedue i genitori.
Nel rimanente 1% dei casi si è visto che i soggetti presentano un mosaicismo: una mutazione dovuta ad una non
disgiunzione mitotica a carico di una cellula nei primi stadi di vita embrionale determina la presenza di alcune cellule
normali e di altre con 47 cromosomi.
Le manifestazioni cliniche sono evidenti fin dalla nascita perché vi sono dei segni particolari. Tra i vari problemi che
queste persone hanno, esse soffrono di cardiopatie congenite che ne determinano una drastica riduzione delle
aspettative di vita, anche se la maggior parte supera almeno i 30 anni.
Tuttavia le persone che arrivano a 40 anni manifestano spesso malattie neurodegenerative simili al morbo di
Alzheimer.
Le altre trisomie autosomiche o non sono compatibili con la vita oppure determinano la morte del bambino nelle
prime fasi della vita.
Per quanto riguarda le anomalie numeriche dei cromosomi sessuali si tratta sempre di non disgiunzione meiotica.
Sindrome di Klinefelter, XXY: anche in questo caso la non disgiunzione si verifica durante l’oogenesi. E’ considerata la
causa più frequente di ipogonadismo maschile, cioè di sviluppo insufficiente delle gonadi maschili.
Come le altre sindromi legate ad aneuploidia dei cromosomi sessuali, la sindrome di Klinefelter diventa evidente solo
durante la pubertà con lo sviluppo sessuale (ginecomastia, testicoli e pene più piccoli della norma, voce sottile ed
acuta…).
I soggetti possono presentare ritardo mentale ma ciò avviene comunque raramente.
Sindrome di Turner XO: il soggetto è fenotipicamente femmina ma è sterile, con genitali infantili, amenorrea primaria e
caratteri corporei particolari: capezzoli molto distanti, statura bassa, orecchie prominenti…
Si associano spesso anormalità congenite a carico dei reni e dell’aorta (in particolare restringimento dell’arco aortico).
Slidetube.it
Malattie da espansione di triplette nucleotidiche
Queste malattie riguardano l’amplificazione di DNA genico a causa della ripetizione di 3 basi. Recentemente è stata
scoperta una malattia che mostra una ripetizione di 12 basi, ma si tratta dell’unico caso conosciuto.
In totale le malattie causate da questo genotipo sono una ventina e sono tutte caratterizzate da un fenotipo
neurodegenerativo. Gli esempi più comuni sono:
Distrofia miotonica;
Sindrome dell’X fragile;
Atrofia muscolare spinobulbare;
Malattia di Huntington.
Ognuno di noi possiede, a livello delle porzioni geniche implicate nelle malattie sopraelencate, un numero di triplette
ripetute fisiologicamente. Esiste un range di normalità: nel caso del gene dell’X fragile questo range è di 6-55. Se il
numero di triplette è più alto (55-200 sempre nel gene dell’X fragile) vi è una situazione di “pre-mutazione” in cui il
soggetto è definito “portatore sano” mentre infine, con più di 200 ripetizioni, si manifesta la malattia.
Sindrome dell’X fragile
E’ stata la prima sindrome, nel 1991, ad essere riconosciuta come malattia da espansione di triplette. Ha una frequenza
piuttosto alta: 1/1250 è colpito e, dopo la sindrome di Down, è la seconda causa di ritardo mentale di origine genetica.
La sindrome dell’X fragile è sempre associata a ritardo mentale e, assieme ad esso, vi sono altre caratteristiche
fenotipiche che vengono identificate fin dalla nascita (orecchie grandi, mandibola pronunciata, lassità articolare e
macroorchidismo).
Le malattie da espansione di triplette sono caratterizzate da una modalità di trasmissione piuttosto peculiare: si
verifica per esempio il fenomeno dell’anticipazione, che comporta che con il passare delle generazioni la gravità della
malattia aumenta e l’insorgenza è sempre più precoce.
Ciò è dovuto al fatto che queste triplette si amplificano durante la gametogenesi: nella sindrome dell’X fragile durante
l’oogenesi, ma nella malattia di Huntington durante la spermatogenesi.
Quindi una mamma premutata (portatrice sana) nel gene dell’X fragile genererà molto probabilmente figli maschi
malati e femmine che possono essere malate o meno a seconda dello lyonizzazione ma, comunque, in forma lieve.
A livello molecolare, a causa dell’espansione di triplette poste al 5’ del gene, si verifica una metilazione inappropriata
che si estende fino alla zona promotoriale. La conseguenza è il silenziamento della trasmissione del gene, che in questo
caso si chiama FMR-1.
La proteina FMR-1 è ubiquitaria ma è particolarmente espressa nel SNC e nei testicoli. La funzione della proteina non è
del tutto chiara. Ultimamente si è scoperto che essa presenta omologia di sequenza con proteine leganti l’RNA. In
effetti essa lega specificatamente il 4% degli mRNA delle cellule neuronali. Probabilmente essa ha funzione di
regolazione della traduzione di alcuni geni.
Distrofia miotonica
E’ la più comune distrofia ad insorgenza in età adulta. I meccanismi patogenetici sono molto diversi rispetto alla
distrofia di Duchenne, che invece è la più comune distrofia infantile. La distrofia miotonica è difatti dovuta ad
amplificazione di triplette del gene per la miotonina chinasi, situato nel cromosoma XIX. Questa malattia è a
trasmissione dominante.
Il quadro clinico è caratterizzato da debolezza muscolare e da miotonia, cioè dalla difficoltà di rilasciare determinati
muscoli dopo averli contratti. Ma oltre ai segni a carico dell’apparato muscolare, la malattia colpisce anche l’apparato
scheletrico, l’apparato cardiovascolare e gli occhi (caratteristica è la cataratta). Si associano molto spesso deficit
dell’apprendimento.
Anche nel caso di questa malattia è presente il fenomeno dell’anticipazione e, analogamente a quanto accade per la
sindrome dell’X fragile, l’insorgenza della malattia è dovuta ad amplificazione durante l’oogenesi.
Il gene coinvolto è il DM-1, che codifica per la miotonina chinasi, espressa in particolar modo nel cervello, nel cuore ed
a livello muscolare.
Le triplette che vengono amplificate si trovano questa volta al 3’ e la loro espansione causa un’alterata emivita
dell’mRNA: nel muscolo la proteina è poco espressa mentre nel cervello è sovraespressa.
Slidetube.it
Atrofia muscolare spino-bulbare
Degenerazione dei motoneuroni con associato ritardo mentale e insensibilità agli androgeni. La mutazione è localizzata
all’interno del gene che codifica per il recettore degli androgeni nel cromosoma X. L’amplificazione porta alla
trascrizione di un prodotto genico alterato perché contiene uno stretch di poli-glutammato.
Malattia di Huntington
E’ una malattia autosomica. Il gene interessato è localizzato nel cromosoma 4. La trasmissione è di tipo dominante e
l’età di insorgenza è normalmente superiore ai trent’anni, tuttavia a causa del fenomeno dell’anticipazione essa può
comparire anche più precocemente. L’amplificazione avviene nel corso della spermatogenesi.
I soggetti affetti manifestano ad un certo punto della loro vita movimenti involontari degli arti superiori ed inferiori che
provocano un tipo di deambulazione che ricorda una danza: da ciò deriva il nome Korea. Essi manifestano inoltre
deficit di memoria ed alri disturbi comuni alle malattie neurodegenerative.
La mutazione implicata nella patogenesi della malattia di Huntington è a carico del gene IT15 ed essa porta alla
neurodegenerazione dello striato, in particolare del nucleo caudato e del putamen. La proteina anomala sembra difatti
avere proprietà tossiche (vi è un acquisto di funzione che giustifica la trasmissione di tipo dominante).
Sembra che fisiologicamente IT15 sia un neuroprotettore, proteggendo il neurone dalla morte per apoptosi. Il
contrario fa la proteina mutata che trasloca nel nucleo, vi si deposita e determina l’apoptosi dei neuroni.
Disordini genetici dell’emoglobina
Sono malattie molto rilevanti e frequenti nell’uomo. Molto di ciò che conosciamo sulla correlazione tra genotipo e
fenotipo nelle malattie genetiche è dovuto proprio allo studio dei disordini genetici dell’emoglobina, essendo essi
svariati e peculiari.
I geni per le catene α si trovano nel cromosoma 16 mentre i geni per le catene ε, γ, δ e β si trovano nel cromosoma 11.
Esistono diversi tipi di emoglobina espressi nelle diversi fasi dello sviluppo: emoglobine embrionali, ζ2ε2 e α2ε2;
emolgobina fetale α2γ2; emoglobina adulta maggiore α2β2 e minore α2δ2 (circa 3% del totale). In un soggetto adulto
residua circa un 1% di emoglobina fetale.
Esistono diverse centinaia di difetti genetici a carico dell’emoglobina. Questi disordini portano ad una produzione di
emoglobina anomala con alterazione di funzione e conseguente anemia.
Riconosciamo:
Anomalie strutturali dell’emoglobina (emoglobinopatie), spesso dovute a mutazioni di senso;
Difetti di sintesi di una o più catene dell’emoglobina (talassemie): sono spesso dovute a mutazioni non senso,
splicing o frameshift.
Le emoglobine mutate più frequenti sono:
- HbS (falco) : responsabile dell’anemia falciforme;
- HbC: responsabile di una lieve anemia emolitica frequente in Africa occidentale;
- HbE: sintesi inefficiente di globina β, è frequente in Asia;
- HbM: non lega l’ossigeno perché l’eme è fissato nella forma ferrica, ridotta, e non si trasforma nella forma
ossidata.
- Hb chesapeake: è un emoglobina con elevata affinità per l’ossigeno.
Alcune rare mutazioni possono alterare la stabilità dell’emoglobina modificandone la struttura terziaria, quaternaria
oppure alterando il sito di legame.
Slidetube.it
Anemia falciforme
È una malattia autosomica recessiva: l’8% dei neri americani è eterozigote (portatori del tratto falcemico) e 1/700 neri
americani sono affetti.
Nei paesi dove la malaria è endemica fino al 30 % dei neri è eterozigote perché questa condizione conferisce resistenza
al plasmodio (polimorfismo bilanciato).
Il difetto a livello genico è dovuto ad una sostituzione, per mutazione puntiforme, di un residuo di acido glutammico
con una valina. Ciò provoca alterazione delle proprietà chimico-fisiche dell’emoglobina. Difatti l’aminoacido idrofobico
valina si mette al posto dell’aminoacido idrofilo acido glutammico. La valina, quando l’emoglobina è deossigenata, è
esposta in superficie e crea una zona adesiva idrofobica che interagisce con una tasca idrofobica presente
normalmente nelle catene di emoglobina deossigenata. Il legame comporta una polimerizzazione delle catene di
emoglobina le quali a loro volta si uniscono a formare delle fibre, genericamente composte ciascuna di 14 catene.
La deposizione di queste fibre cambia la struttura degli eritrociti che da disco biconcavo diventano a forma di falce. In
condizione di pO2 = 0 il globulo rosso è a forma di falce ma quando la saturazione cresce il globulo rosso riassume
gradualmente la sua forma normale.
Dopo un certo numero di cicli, però, si verificano alterazioni a livello della membrana dell’eritrocita il quale non torna
più alla sua struttura originaria e si presenta sempre a forma di falce. Ciò comporta:
- Emolisi a livello splenico, a causa della fagocitosi;
- Occlusione di piccoli vasi con eventi ischemici e macro e micro infarti. A livello renale l’occlusione può
avvenire anche quando il globulo rosso non ha la forma a falce perché le emazie con HbS hanno maggiori
capacità adesive.
La sintomatologia clinica riflette il meccanismo di polimerizzazione e la velocità di polimerizzazione.
I parametri che la influenzano sono:
Bassa tensione di O2;
Quantità di HbS:
o Negli eterozigoti la quantità di HbS è circa il 40%. Sono individui normalmente asintomatici a meno che
non vengano esposti ad ipossia spinta;
o La presenza di HbF previene la polimerizzazione di HbS: difatti nel neonato la malattia non si manifesta fino
al 5°-6° mese di vita. Per la terapia si utilizza un chemioterapico che induce la trascrizione per il gene HbF.
Doppi eterozigoti HbS/HbC presentano una malattia più grave rispetto agli eterozigoti Hbs/HbA;
Concentrazione cellulare di emoglobina:
o Omozigoti in cui coesiste α-talassemia hanno una forma più lieve;
o L’ambiente ipertonico della midollare del rene favorisce la disidratazione e facilita la falcizzazione.
L’ostruzione dei capillari diminuisce la PO2 e quindi aumenta ulteriormente la falcizzazione e peggiora il
quadro.
La diminuzione del pH riduce l’affinità per l’ossigeno e quindi aumenta il grado di falcizzazione.
Definizione di anemia emolitica: E’ una condizione caratterizzata da un’emivita media del globulo rosso inferiore al
normale. In questo caso si verifica emolisi a livello dei capillari splenici ed un’aumentata eritrofagocitosi a carico dei
fagociti dei cordoni splenici.
Quadro clinico dell’anemia falciforme:
o Anemia emolitica cronica;
o Complicazioni vasoocclusive a carico del microcircolo della milza, dei reni, del fegato…
o Iperbilirubinemia dovuta al catabolismo dell’eme;
o Maggior suscettibilità alle infezioni, in particolari a quelle causate da pneumococchi e da emophilus (meningite);
o Epatosplenomegalia: causata da una parte dal fatto che questi sono organi afferenti al sistema reticoloendoteliale
e, dall’altra, al fatto che in queste condizioni ci può essere eritropoiesi extramidollare. Dalla splenomegalia si passa
ad una splenoatrofia per danneggiamento dell’organo a seguito delle occlusioni vasali.
Diagnosi:
Striscio di sangue ed elettroforesi: il numero di globuli rossi a falce può essere enfatizzato trattando il campione di
sangue con sostanze che favoriscono la polimerizzazione abbasando il pH (es metilsolfito).
Prognosi:
Il 90% degli affetti raggiunge i 20 anni, il 50% di essi supera i 50 anni.
Slidetube.it
Talassemie
Talassemia α: α+: ridotta sintesi delle catena α dell’emoglobina;
α0: assente sintesi della catena α dell’emoglobina;
Talassemia β: β +: ridotta sintesi delle catena β dell’emoglobina;
β 0: assente sintesi della catena β dell’emoglobina;
Su scala mondiale le talassemie sono le più frequenti malattie geneticamente determinate, frequente nei paesi
mediterranei nonché in altri paesi tra cui quelli in cui la malaria è endemica.
La malattia porta sia ad un basso livello di emogobina ma anche ad un relativo eccesso di una delle due catene.
Talassemie α
Dal punto di vista dei difetti molecolari nella maggior parte dei casi il problema è la delezione di uno o più de i 4 geni (2
per ogni cromosoma 16, ognuno che contribuisce per il 25%) che codificano per la globina α.
Esistono anche mutazioni più rare, che non sono delezioni:
o Mutazioni del codone d’inizio o della sequenza immediatamente a monte;
o Mutazioni non senso che inseriscono un codone di STOP;
o Mutazioni nel sito di poliadenilazione.
Per quanto riguarda le delezioni, esse avvengono solitamente per crossing over ineguale poiché i due geni ripetuti
possono, nel corso della meiosi, appaiarsi in maniera diseguale. Si ottiene così un cromosoma con tre geni ed uno con
un solo gene.
Più geni sono presenti, meno grave è la malattia. Difatti:
o Tre geni (eterozigote αα/α-): l’individuo è portatore silente, asintomatico e privo di anomalie strutturali nel
sangue;
o Due geni (--/αα oppure –α/-α): asintomatico ma con lieve anemia emolitica e con alcune cellule microcitiche. Si
parla di “tratto α-talassemico”.
o Un gene (--/-α): moderata anemia emolitica con ipocromia e microcitosi. Il problema maggiore è in questo caso
l’eccesso di catene β: si forma difatti la cosiddetta emoglobina H, formata da quattro catene β, che per le sue
caratteristiche precipita nei globuli rossi diminuendone l’emivita e accelerandone l’emolisi. HbH ha inoltre alta
affinità per l’ossigeno;
o Assenza di geni: la condizione è detta idrope fetale e non è compatibile con lo sviluppo intrauterino del feto in
quanto si formano tetrameri di catene γ (Hb di Bart) la quale ha altissima affinità per l’ossigeno.
Talassemie β
A livello molecolare questa malattia è raramente causata da delezioni mentre molto più frequenti sono le mutazioni
puntiformi. In particolare quest’ultimo tipo di mutazione possono modificare:
o La trascrizione (mutazione del TATA box oppure in una sequenza importante per la trascrizione situata 90 basi a
monte del sito d’inizio); β+
o Il significato dell’RNA: mutazioni non senso o frameshift; β0
o Lo splicing:
o Mutazione di una base nel sito di splicing nella giunzione tra esone ed introne. La mutazione annulla
completamente la sintesi della globina; β0
o Creazione di un sito di splicing alternativo; β+
o Mutazione nei siti di poli adenilazione. β+
Anche se rare vanno comunque citate le delezioni. La più frequente di esse è dovuta ad un appaiamento anomalo nella
meiosi tra i geni per le globine δ e β e formazione di un gene di fusione δ/β (Hb lepore). Il promotore del gene della
globina δ è molto debole e l’espressione è bassa.
Le conseguenze dell’alterata sintesi delle catene β sono:
o Insufficiente produzione di HbA con globuli rossi microcitici ed ipocromici;
o Squilibrio tra la sintesi delle globine α e β: le catene α in eccesso si aggregano e precipitano nei globuli rossi
determinandone la morte per apoptosi già allo stadio di eritroblasti (eritropoiesi inefficiacie). Gli eritrociti che
sopravvivono vengono comunque eliminati nella milza;
Anche nel caso delle talassemie β, il quadro clinico dipende da quanti e come i geni sono colpiti. Si distinguono:
o Talassemia maior (omozigosi β0/ β0 o β+/ β+): provoca anemia microcitica ipocromica, emolisi gravi,
epatosplenomegalia, iperplasia midollare (a causa dell’aumentata eritropoiesi) che provoca deformità dello
scheletro. A causa delle ripetute trasfusioni si determina sovraccarico di ferro, che è la causa maggiore di danno
soprattutto a carico di reni e milza. La mancanza di catene β non è comunque incompatibile con la vita.
Slidetube.it
Che cosa è la sindrome di Marfan?
DIFETTO EREDITARIO IN UNA GLICOPROTEINA EXTRACELLULARE (fibrillina-1) che è la maggiore componente delle
micro fibrille che si trovano nella matrice extracellulare,formano un impalcatura su cui si colloca la tropo elastina
per formare elastina.
La sindrome di Marfan è una condizione medica, classificata come un disturbo ereditario del tessuto connettivo che in
primo luogo colpisce le ossa ed i legamenti (sistema scheletrico), gli occhi (sistema oculare), il cuore ed i vasi sanguigni
(sistema cardiovascolare), i polmoni.
SINDROME DI MARFAN: si tratta di una alterazione diffusa della tenuta strutturale del
collagene; tale patologia ha un quadro clinico decisamente più ampio e complesso e
colpisce in particolare occhi, cuore, vasi sanguigni, ossa, polmoni, meningi e molto
altro. A livello clinico genera molto spesso:
■ lassità articolare molto spinta.
■ problemi strutturali a livello dei vasi sanguiferi, soprattutto NELLA AORTA dove sono molto frequenti rotture ed
aneurismi.
■ aracnodattilia.
QUALI SONO LE CARATTERISTICHE SCHELETRICHE?
Le ossa e i legamenti vengono colpiti in molte e diverse maniere. Un individuo affetto sarà alto, magro e dalle
articolazioni sciolte e flessibili. Braccia, gambe e dita possono essere sproporzionatamente lunghe in confronto al
tronco. La flessibilità si estende ai piedi che spesso sono piatti. La curvatura spinale è diffusa e può divenire abbastanza
seria se non trattata. Le ossa del torace possono o avere una protuberanza (detta comunemente torace carenato –
il termine medico è pectus carinatum) o incavato (pectus incavatum) dovuto ad un sovrasviluppo delle costole.
Il palato è generalmente molto arcuato ed i denti sono storti.
Il volto può apparire lungo e stretto in confronto con la forma generale del corpo. 1 bambini hanno spesso uno
sguardo profondo e sembrano più grandi rispetto al loro fratelli e sorelle della stessa età non affetti.
Difetti oculari :sublussazione del cristallino,nota come ectopia lentis. Rara in sogg non affetti da sindrome di Marfan.
Difetti cardiovascolari :
prolasso della valvola mitralica, insufficienza aorta (per la perdita del sostegno dovuto alla tonaca media determina
una progressiva dilatazione della valvola aortica e del bulbo aortico, dando luogo ad una grave insuff.aortica).
Sono le caratteristiche a cui è associato un maggior rischio di complicanze mortali.