UNIVERSITA’ DEGLI STUDI DI MILANO
Facoltà di Scienze Matematiche, Fisiche e Naturali
Corso di Laurea Triennale in Chimica
CORSO DI:
LABORATORIO DI CHIMICA GENERALE
E INORGANICA
Docente:
Dr. Alessandro Caselli
Anno Accademico 2009-2010
Capitolo 1 . Introduzione
CAPITOLO 3
Nomenclatura
1
Capitolo 1 . Introduzione
Numero di ossidazione e nomenclatura
Le reazioni chimiche si possono suddividere in due tipi:
1) Reazioni acido-base (il numero di ossidazione degli atomi resta invariato).
2) Reazioni di ossido-riduzione (il numero di ossidazione di uno o più
elementi varia durante la reazione).
Per riconoscere il tipo di una reazione è necessario quindi determinare
innanzitutto il numero di ossidazione attribuito ad ogni atomo sia nei reagenti, sia
nei prodotti.
Numero di Ossidazione (n.o.)
Viene definito numero di ossidazione (n.o.) di un atomo in un composto
covalente il valore in numero e in segno della carica elettrica che l'atomo
assumerebbe se gli elettroni di legame venissero attribuiti completamente
all'atomo più elettronegativo. La somma algebrica dei numeri di ossidazione deve
essere uguale al numero di cariche elettriche portate dal composto.
Il numero di ossidazione di ciascun atomo in un composto può essere determinato
facilmente qualora sia nota la sua formula di struttura.
Esempi:
Molecola dell’ammoniaca NH3. La formula di struttura è:
N
H
H
H
L’elemento più elettronegativo è l’azoto. Quindi i due elettroni di ogni legame
vengono attribuiti all’atomo N. Rispetto ad un atomo non legato è come se l’atomo
di azoto nell’ammoniaca possedesse una carica -3. Si dice che nell’ammoniaca N
possiede n.o. -3. All’idrogeno, di conseguenza, viene attribuito n.o. +1.
2
Capitolo 1 . Introduzione
Nella maggior parte dei casi è possibile determinare il numero di ossidazione di
ogni atomo di una specie chimica mediante semplici regole:
1) Il n.o. degli atomi negli elementi è 0 (Es. H2, Cl2, O2, P4, S8, Na, Fe);
2) La somma algebrica dei numeri di ossidazione di tutti gli atomi di una
sostanza neutra è zero;
3) La somma algebrica dei numeri di ossidazione di tutti gli atomi di una ione è
uguale alla carica dello ione (nel caso di uno ione monoatomico carica e
numero di ossidazione coincidono, es. Fe3+, Cl-, S2-).
4) Il n.o. degli atomi di alcuni elementi è costante in tutti i loro composti, e
precisamente:
a) Idrogeno: n.o. +1, eccetto che negli idruri, es. NaH, CaH2 nei quali gli
viene attribuito n.o.: -1;
b) Ossigeno: n.o. -2, eccetto nei perossidi come H2O2 e Na2O2, n.o. -1; nei
superossidi come NaO2, n.o. -1/2 e nei composti in cui è legato al flouro
come OF2: n.o. +2;
c) I metalli alcalini (Gruppo 1): n.o. +1;
d) I metalli alcalino-terrosi (Gruppo 2): n.o. +2;
e) Gruppo 3B (o 13) (soprattutto B e Al): n.o. +3;
f) Zn e Cd: n.o. +2;
g) Fluoro: n.o. -1 (sempre);
h) Cloro, bromo e iodio: n.o. -1, tranne che negli ossidi e nei composti con
il fluoro in cui è positivo e variabile tra +1 e +7;
i) Zolfo: n.o. -2, tranne che negli ossidi;
3
Capitolo 1 . Introduzione
Quando si determina, sulla base della formula molecolare, il numero di
ossidazione di un elemento che è presente nella molecola in posizioni non
equivalenti, si ricava il valore medio del numero di ossidazione, che è comunque il
parametro utile per il bilanciamento delle equazioni redox.
Esercizio
Determinare il numero di ossidazione di S in K2SO4
Il numero di ossidazione di K in tutti i suoi composti è sempre +1 (Regola 4c);
Quello di O nei composti usuali è -2 (regola 4b).
Quindi:
2(+1) + n.o.(S) + 4(-2) = 0
n.o.(S) = +6
Il numero di ossidazione di S in K2SO4 è + 6, così come anche nell’acido solforico
H2SO4 e in tutti i suoi derivati.
Esercizio
Determinare il numero di ossidazione di Cl in Ba(ClO3)2
Il numero di ossidazione di Ba in tutti i suoi composti è sempre +2 (Regola 4d);
Quello di O nei composti usuali è -2 (regola 4b).
Quindi:
2(+1) + 2 x n.o.(Cl) + 6(-2) = 0
n.o.(Cl) = +5
4
Capitolo 1 . Introduzione
Esercizio
Determinare il numero di ossidazione di Mn nello ione MnO42Il numero di ossidazione di O nei composti usuali è -2 (regola 4b).
Quindi:
n.o.(Mn) + 4(-2) = -2
n.o.(Mn) = +6
Esercizio
Determinare il numero di ossidazione di O in Na2O2
In questo composto abbiamo 2 atomi di ossigeno che fanno parte di un gruppo
perossidico, -O-O-, con numero di ossidazione -1 (regola 4bpossiamo anche
ricavare il n.o. considerando il numero di ossidazione di Na in tutti i suoi composti
è sempre +1 (Regola 4c).
Quindi:
2(+1) + 2 x n.o.(O) = 0
n.o.(O) = -1
Esercizio
Determinare il numero di ossidazione di S nell’acido perossi disolforico H2S2O8
II nome ci suggerisce che in questo composto abbiamo 2 atomi di ossigeno che
fanno parte di un gruppo perossidico, -O-O-, con numero di ossidazione -1 (regola
4b), mentre gli altri ossigeni hanno n.o. -2 (regola 4b).
5
Capitolo 1 . Introduzione
Quindi:
2(+1) + 2 x n.o.(S) + 2(-1) + 6(-2) = 0
n.o.(S) = +6
Esercizio
Determinare il numero di ossidazione di Cr in K2Cr2O7
Il numero di ossidazione di K in tutti i suoi composti è sempre +1 (Regola 4c);
Quello di O nei composti usuali è -2 (regola 4b).
Quindi:
2(+1) + 2 x n.o.(Cr) + 7(-2) = 0
n.o.(Cr) = +6
Esercizio
Determinare il numero di ossidazione di S nel tiosolfato di sodio, Na 2S2O3
In questo composto un atomo di S ha sostituito un atomo di O .Il numero di
ossidazione di Na in tutti i suoi composti è sempre +1 (Regola 4c); Quello di O nei
composti usuali è -2 (regola 4b).
Quindi:
2(+1) + 2 x n.o.(S) + 3(-2) = 0
n.o.(S) = +2
In realtà i due atomi di S hanno numeri di ossidazione diversi (-2 e +6) la cui
media è +2.
6
Capitolo 1 . Introduzione
Esercizio
Determinare il numero di ossidazione di C in C3H8
Il numero di ossidazione di H in questo composto è +1 (regola 4a).
Quindi:
8(+1) + 3 x n.o.(C) = 0
n.o.(C) = -8/3
I tre atomi di C nella molecola non sono equivalenti e possiedono numeri di
ossidazione non uguali. 2 atomi hanno n.o. formale -3 e 1 atomo -2. Il n.o. -8/3 è
quindi un valore medio.
Esercizio
Determinare il numero di ossidazione di C nell’etanolo, C2H5OH
Il numero di ossidazione di H in questo composto è +1 (regola 4a) e quello di O è 2 (regola 4b).
Quindi:
6(+1) + (-2) + 2 x n.o.(C) = 0
n.o.(C) = -2
I due atomi di C nella molecola non sono equivalenti. Il n.o. -2 è quindi un valore
medio.
7
Capitolo 1 . Introduzione
Esercizio
Determinare il numero di ossidazione di Fe in [Fe(CN)6]4Nello ione complesso [Fe(CN)6]4- i leganti CN- derivano da cianuri, sali di HCN. La
carica -1 di CN- indica che la somma algebrica di n.o.(C) e n.o.(N) in CN- è uguale
a -1.
Quindi:
6(-1) + n.o.(Fe) = -4
n.o.(Fe) = +2
8
Capitolo 1 . Introduzione
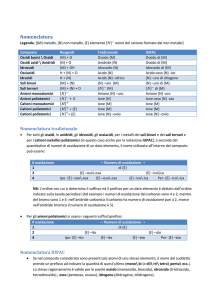
Nomenclatura
Le regole di nomenclatura dei composti inorganici sono state stabilite dalla
Commissione della Nomenclatura Inorganica della International Union of Pure and
Applied Chemistry (IUPAC). Tuttavia per molti composti è ancora radicata la
nomenclatura tradizionale ed è quindi molto importante avere una buona
familiarità con il sistema di nomenclatura più vecchio. Per i composti che
contengono metalli inoltre è ancora in uso la notazione di Stock, che prevede di
far seguire al nome del metallo un numero romano (scritto tra parentesi) che
indica la carica.
Gli elementi vengono suddivisi in base al loro comportamento chimico in metalli e
non-metalli (alcuni elementi si comportano come anfoteri o semi-metalli, es Sn,
Pb…..).
Prima di assegnare un nome ad un composto chimico occorre classificarlo come
ionico o come covalente. A questo scopo occorre prima di tutto rispondere alla
domanda: il composto contiene un metallo o uno ione poliatomico? Se la risposta
è affermativa, ai fini della nomenclatura, classifichiamo il composto come ionico;
se è negativa, lo classifichiamo come covalente.
Nomenclatura dei composti binari
I composti binari sono costituiti da due elementi; essi possono essere sia ionici
che molecolari. La regola è quella di chiamare l’elemento più elettronegativo per
primo e l’elemento meno elettronegativo per secondo. Il nome dell’elemento più
elettronegativo si ottiene aggiungendo il suffisso –uro (oppure -iuro) alla radice
dell’elemento (es. H radice idr: idruro). Fa eccezione l’ossigeno i cui composti con
i metalli non si chiamano ossiuri bensì ossidi. Negli ossidi dei metalli è presente lo
ione O2-. Nei perossidi è invece presente lo ione O22-. Un’altra eccezione è data
dai composti contenenti lo ione N3- che sono detti nitruri, laddove invece i composti
contenenti lo ione N3- , derivati dall’acido azotidrico HN3, sono detti azoturi. Al
nome dell’unità negativa si fa seguire quello dell’unità positiva preceduto da di.
9
Capitolo 1 . Introduzione
Radici comuni:
3A
B
bor
4A
5A
6A
7A
C
carb
N
nitr
O
oss
F
fluor
Si
silic
P
fosf
S
solf
Cl
clor
As
arsen
Se
selen
Br
brom
Sb
antimon
Te
tellur
I
iod
Ossidi
Gli ossidi sono composti che tutti gli elementi, ad eccezione del fluoro, formano
con l’ossigeno. Si dividono in ossidi basici e ossidi acidi (o anidridi). Gli ossidi
basici si ottengono combinando l’ossigeno con un metallo, quelli acidi per reazione
tra un non metallo e l’ossigeno (o con metalli in alto stato di ossidazione).
Ossidi basici
ossidi acidi
Ossigeno + metallo
Ossigeno + non metallo
(o metalli in alto stato di ox)
+ H2O
Idrossidi
+ H2O
+
acidi
sali
10
Capitolo 1 . Introduzione
Ossidi basici
Premesso che l’ossigeno ha numero di ossidazione -2, per scrivere la formula di
questi composti si pone prima il simbolo del metallo e di seguito quello
dell’ossigeno. Il nome a questi composti viene attribuito ponendo prima la
parola ossido seguita dalla preposizione di e dal nome del metallo!
Nel sistema tradizionale di nomenclatura, la distinzione tra ossidi di metalli che
possono esistere in più di uno stato di ossidazione veniva fatta attribuendo la
desinenza –ico al nome del metallo nel più alto stato di ossidazione e –oso al
metallo nello stato di ossidazione più basso (es. Fe2+ : ferroso; Fe3+ ferrico).
Utilizzando la nomenclatura IUPAC si indica tramite un prefisso il numero di atomi
di ossigeno e dell’elemento che costituiscono l’ossido. Il prefisso mono- si omette.
Utilizzando il metodo di Stock si aggiunge al nome del metallo un numero romano
tra parentesi tonde che indica il suo numero di ossidazione.
n.o.
Formula
Nome comune
Nome IUPAC
Nome Stock
+2
FeO
Ossido ferroso
Ossido di ferro
Ossido di ferro(II)
+3
Fe2O3
Ossido ferrico
Triossido di diferro
Ossido di ferro(III)
+2
SnO
Ossido stannoso
Ossido di stagno
Ossido di stagno(II)
+4
SnO2
Ossido stannico
Diossido di stagno
Ossido di stagno(IV)
+1
Na2O
Ossido di sodio
Ossido di disodio
Ossido di sodio
+2
ZnO
Ossido di zinco
Ossido di zinco
Ossido di zinco
+1
Cu2O
Ossido rameoso
Ossido di dirame
Ossido di rame(I)
11
Capitolo 1 . Introduzione
Nella nomenclatura comune per denominare i composti binari con l’ossigeno si
usano anche i prefissi mono-, bi- (o di-), tri-, etc. per indicare il contenuto di
ossigeno nel composto.
Esempi:
MnO2
biossido di manganese
CrO
monossido di cromo
OsO4
tetraossido di osmio
Inoltre quando metallo e ossigeno sono presenti in rapporto 2/3 si adopera il
prefisso sesqui-:
Cr2O3
sesquiossido di cromo
Ossidi acidi o anidridi
Per scrivere la formula di questi composti e per denominarli si usano le stesse
regole viste per gli ossidi basici. Nella nomenclatura comune, però, si sostituisce
la parola ossido con la parola anidride.
Esempi:
CO2
biossido di carbonio o anidride carbonica
CO
ossido di carbonio o monossido di carbonio
Poiché Cl, Br, I possono formare ossidi in quattro diversi stati di ossidazione (+1,
+3, +5, +7), per denominare i composti a valenza più bassa (n.o. +1) e più alta
(n.o. +7) si fa precedere il nome del non metallo rispettivamente dai prefissi ipo- e
per-.
12
Capitolo 1 . Introduzione
n.o.
Formula Nome comune
Nome IUPAC
Nome Stock
+1
Cl2O
Anidride ipoclorosa
Ossido di dicloro
Ossido di cloro(I)
+3
Cl2O3
Anidride clorosa
Triossido di dicloro
Ossido di cloro(III)
+5
Cl2O5
Anidride clorica
Pentossido di dicloro
Ossido di cloro(V)
+7
Cl2O7
Anidride perclorica
Eptossido di dicloro
Ossido di cloro(VII)
+4
SO2
Anidride solforosa
Diossido di zolfo
Ossido di zolfo(IV)
+6
SO3
Anidride solforica
Triossido di zolfo
Ossido di zolfo(VI)
+1
N2O
Protossido di azoto
Ossido di diazoto
Ossido di azoto(I)
+2
NO
Ossido di azoto
Ossido di azoto
Ossido di azoto(II)
+3
N2O3
Anidride nitrosa
Triossido di diazoto
Ossido di azoto(III)
+4
NO2
Diossido d’azoto
Diossido d’azoto
Ossido di azoto(IIII)
+5
N2O5
Anidride nitrica
Pentossido
diazoto
13
di Ossido di azoto(VI)
Capitolo 1 . Introduzione
Ossidi basici più acqua: idrati o idrossidi
Sono composti ternari costituiti da un metallo, ossigeno e idrogeno. Vengono
denominati facendo precedere la parola idrossido al nome del metallo, con il
suffisso –oso e –ico per indicare il numero di ossidazione minore o maggiore.
Per scrivere la formula di questi composti si scrive prima il simbolo dell’elemento
metallico seguito da tanti gruppi OH quant’è il numero di ossidazione del metallo.
n.o.
Formula
Nome comune
Nome IUPAC
Nome Stock
+1
KOH
Idrossido di potassio
Idrossido di potassio
Idrossido di potassio
+2
Mg(OH)2
Idrossido di magnesio
diidrossido di magnesio
Idrossido di magnesio
+3
Al(OH)3
Idrossido di alluminio
triidrossido di alluminio
Idrossido di alluminio
+2
Fe(OH)2
Idrossido ferroso
Diidrossido di ferro
Idrossido di ferro(II)
+3
Fe(OH)3
Idrossido ferrico
triidrossido di ferro
Idrossido di ferro(III)
+4
Sn(OH)4
Idrossido stannico
tetraidrossido di stagno
Idrossido di stagno(IV)
Idracidi
Sono composti dell’idrogeno con gli elementi del gruppo 7A o con lo zolfo. Nella
nomenclatura comune vengono denominati con il suffisso –idrico (tra parentesi la
nomenclatura IUPAC)
HF
acido fluoridrico (fluoruro di idrogeno)
HCl
acido cloridrico (cloruro di idrogeno)
HBr
acido bromidrico (bromuro di idrogeno)
HI
adido iodidrico (ioduro di idrogeno)
H2S
acido solfidrico (solfuro di idrogeno)
14
Capitolo 1 . Introduzione
Ossidi acidi più acqua: acidi ossigenati o acidi
Formalmente si ottengono per addizione di acqua alle rispettive anidridi. La loro
formula si scrive ponendo prima l0idrogeno poi l’elemento e quindi l’ossigeno. Per
denominarli si usano gli stessi prefissi e suffissi adoperati per le anidridi, facendo
però precedere la parola acido.
n.o.
anidride
acido
Nome comune
Nome IUPAC
+1
Cl2O
HClO
Acido ipocloroso
Acido monossoclorico
+3
Cl2O3
HClO2
Acido cloroso
Acido diossoclorico
+5
Cl2O5
HClO3
Acido clorica
Acido triossoclorico
+7
Cl2O7
HClO4
Acido perclorica
Acido tetraossoclorico
+4
SO2
H2SO3
Acido solforoso
Acido triossosolforico
+6
SO3
H2SO4
Acido solforico
Acido tetraossosolforico
+4
CO2
H2CO3
Acido carbonico
Acido triossocarbonico
+3
N2O3
HNO2
Acido nitroso
Acido diossonitrico
+5
N2O5
HNO3
Acido nitrico
Acido triossonitrico
Per gli elementi fosforo, arsenico e antimonio e per gli elementi del gruppo 4A
(carbonio escluso) e per il boro esistono anche due acidi che vengono denominati
con gli stessi suffissi degli altri, ma per i quali occorre premettere i prefissi meta- e
orto-.
L’acido di tipo meta si ottiene formalmente sommando all’anidride una molecola di
acqua, mentre quello orto si ottiene aggiungendo altra acqua all’acido meta.
15
Capitolo 1 . Introduzione
Gli elementi fosforo, arsenico e antimonio danno un altro tipo di acido denominato
mediante il prefisso piro-. Tale acido si ottiene sommando due molecole di acqua
alle anidridi o sottraendo una molecola di acqua da due molecole di orto acido.
n.o.
Anidride
Acido meta
Acido orto
Acido piro
+5
P2O5
HPO3
H3PO4
H4P2O7
+5
As2O5
HAsO3
H3AsO4
H4As2O7
+4
SiO2
H2SiO3
H4SiO4
+3
B2O3
HBO2
H3BO3
Ioni positivi
n.o.
Formula
nome
+1
K+
Ione potassio
+2
Fe2+
Ione ferroso
+3
Fe3+
Ione ferrico
+2
Sn2+
Ione stannoso
+4
Sn4+
Ione stannico
16
Capitolo 1 . Introduzione
Gli ioni positivi contenenti ossigeno si denominano mediante il suffisso –ile
Formula
nome
NO3+
Ione nitrosile
BiO+
Ione bismutile
SO2+
Ione solforile
Lo ione idrogeno H+ si addiziona a molecole neutre tipo NH3, H2O e PH3 per
formare ioni positivi che vengono denominati con il suffisso –onio.
Formula
nome
NH4+
Ione ammonio
H3O+
Ione ossonio
PH4+
Ione fosfonio
Ioni positivi ottenuti per addizione di molecole neutre come NH3 o H2O vengono
denominati facendo seguire alla parola ione un prefisso che indica il numero di
molecole coordinate al metallo.
Formula
nome
Cu(NH3)42+
Ione tetra ammino rame (II)
Al(H2O)63+
Ione esa aquo alluminio (III)
Co(NH3)62+
Ione esa ammino cobalto (II)
17
Capitolo 1 . Introduzione
Ioni negativi (radicali degli acidi)
I radicali degli acidi si ottengono togliendo ad un acido gli atomi di idrogeno e
ponendo tante cariche negative quanti sono gli idrogeni tolti.
Per denominarli si fa seguire la parola ione dal nome del non metallo in cui i
suffissi-idrico, -oso, -ico sono stati sostituiti rispettivamente da –uro, -ito, -ato.
Formula
nome
Cl-
Ione cloruro
S2-
Ione solfuro
NO2-
Ione nitrito
NO3-
Ione nitrato
SO32-
Ione solfito
SO42-
Ione solfato
PO43-
Ione ortofosfato
PO3-
Ione metafosfato
HPO43-
Ione monoidrogeno ortofosfato
H2PO43-
Ione diidrogeno ortofosfato
18
Capitolo 1 . Introduzione
Casi comuni particolari
Formula
nome
CO32-
Ione carbonato
HCO3-
Ione idrogeno carbonato
bicarbonato
HSO4-
Ione idrogenosolfato
bisolfato
HSO3-
Ione idrogenosolfito
bisolfito
Lo ione OH- è detto ossidrile
Formula
nome
Al(OH)4-
Ione idrossoalluminato
Ione tetraidrossoalluminato
Zn(OH)42-
Ione idrossozincato
Ione tetraidrossozincato
Sb(OH)6-
Ione idrossoantimoniato
Ione esaidrossoantimoniato
Sn(OH)62- Ione idrossostannato
Ione esaidrossostannato
19
Capitolo 1 . Introduzione
Gli ioni che si ottengono per unione di alogeni con n.o. -1 con ioni positivi di metalli
sono denominati con i prefissi fluoro-, cloro-, bromo- e iodo-. CN- è denominato
cianoFormula
nome
SnCl62-
Ione esaclorostannato(IV)
Fe(CN)63-
Ione esacianoferrato(III)
Fe(CN)64-
Ione esacianoferrato(II)
HgI42-
Ione tetraiodomercurato(II)
FeF63-
Ione esafluoroferrato(III)
20
Capitolo 1 . Introduzione
Sali
I sali possono essere ottenuti, formalmente, per reazione di un idrossido più un
acido a dare il sale più acqua o per reazione di un ossido più un anidride a dare il
sale.
Il nome di un sale si costruisce nominando prima la parte non metallica, con i
suffissi visti per i radicali acidi, e poi la parte metallica con i suffissi utilizzati per gli
ioni positivi.
Per scrivere la formula si scrive prima il metallo e quindi il radicale dell’acido.
sale
Nome comune
Nome IUPAC
CaCl2
Cloruro di calcio
Dicloruro di calcio
Al(NO3)3
Nitrato di alluminio
Tribiossonitrato di alluminio
Sn(SO4)2
Solfato stannico
Ditetraossido di stagno(IV)
Fe2(CO3)3
Carbonato ferrico
Tritriossocarbonato di ferro(III)
Sn3(PO4)2
Ortofosfato stannoso
Ditetraossofosfato di stagno(II)
21
Capitolo 1 . Introduzione
Sali acidi
I sali acidi si ottengono per parziale sostituzione degli atomi di idrogeno di un
acido con metalli.. per scrivere la formula si scrive prima il simbolo del metallo
seguito dal radicale acido. Questi composti si denominano come gli altri sali, ma si
interpone tra il nome del radicale e quello del metallo la parola mono-, bi- o triacido a seconda cheil radicale abbia conservato uno, due o tre atomi di idrogeno.
sale
Nome comune
oppure
K2HPO4
Ortofosfato monoacido di potassio
Monoidrogeno ortofosfato di potassio
KH2PO4
Ortofosfato biacido di potassio
Diidrogeno ortofosfato di potassio
NaHCO3
Bicarbonato di sodio
Idrogeno carbonato di sodio
KHSO4
Bisolfato di potassio
Tritriossocarbonato di ferro(III)
Ca(HSO3)2
Bisolfito di calcio
Idrogeno solfito di calcio
22
Capitolo 1 . Introduzione
Sali basici
Quando nella formula di un sale sono presenti gruppi ossidrilici (OH) il sale si dice
basico. Nel nome, la dizione babico viene preceduta da un prefisso che indica il
numero di ossidrili presenti.
sale
Nome comune
Al(OH)Cl2
Cloruro monobasico di alluminio
Bi(OH)2NO3
Nitrato bibasico di bismuto
Gli osso sali derivano invece da ioni positivi contenenti ossigeno e vengono
denominati col suffisso –ile.
sale
Nome comune
NOCl
Cloruro di nitrosile
BiOBr
Bromuro di bismutile
SbONO3
Nitrato di antimonile
23
Capitolo 1 . Introduzione
Sali idrati
I sali idrati sono sali accompagnati da un certo numero di molecole di acqua.
sale
Nome comune
CaCl2·6H2O
Cloruro di calcio esaidrato
CuSO4·5H2O
Solfato di rame pentaidrato
MgCl2·2H2O
Cloruro di magnesio biidrato
Sali doppi
I sali doppi si ottengono sostituendo gli atomi di idrogeno di un acido con gli atomi
di due metalli diversi. Si denominano come gli altri sali ponendo prima del nome
dei metalli la parola doppio.
sale
Nome comune
NaKSO3
Solfito doppio di sodio e potassio
LiNaCO3
Carbonato doppio di litio e sodio
MgKSO4
Solfato doppio di magnesio e potassio
Na2K2(SO4)2
Solfato di sodio più solfato di potassio
24
Capitolo 1 . Introduzione
Idruri
idruro
Nome comune
CaH2
Idruro di calcio
NaH
Idruro di sodio
Perossidi
formula
Nome comune
H2O2
Perossido di idrogeno
Na2O2
Perossido di sodio
H2SO5
Acido perossisolforico
K2S2O8
Perossidi solfato di potassio
Tiocomposti
Sono sostanze nelle quali uno o più atomi di ossigeno sono sostituiti da uno o più
atomi di zolfo.
Na2S2O3
tiosolfato di sodio;
Na2S3O2
Na3AsSO3
tioortoarseniato di sodio; Na3AsS4
K2CSO2
tiocarbonato di potassio
25
ditiosolfato di sodio
tetratioortoarseniato di sodio