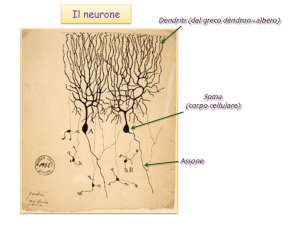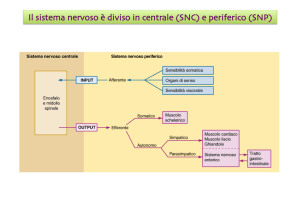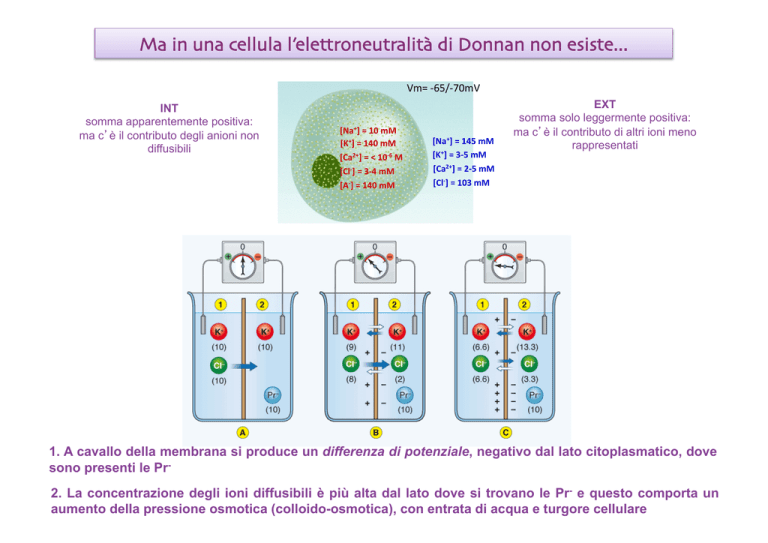
Ma in una cellula l’elettroneutralità di Donnan non esiste...
Vm= -­‐65/-­‐70mV INT
somma apparentemente positiva:
ma c è il contributo degli anioni non
diffusibili
[Na+] = 10 mM [K+] = 140 mM [Ca2+] = < 10-­‐6 M [Cl-­‐] = 3-­‐4 mM [A-­‐] = 140 mM [Na+] = 145 mM [K+] = 3-­‐5 mM [Ca2+] = 2-­‐5 mM [Cl-­‐] = 103 mM EXT
somma solo leggermente positiva:
ma c è il contributo di altri ioni meno
rappresentati
1. A cavallo della membrana si produce un differenza di potenziale, negativo dal lato citoplasmatico, dove
sono presenti le Pr2. La concentrazione degli ioni diffusibili è più alta dal lato dove si trovano le Pr- e questo comporta un
aumento della pressione osmotica (colloido-osmotica), con entrata di acqua e turgore cellulare
Stato stazionario ionico
[Na+] = 10 mM
[Na+] = 120 mM
[K+] = 140 mM
[K+] = 3-5 mM
[Ca2+]
=<
10-6
[Cl-] = 3-4 mM
[A-] = 140 mM
M
[Ca2+] = 2-5 mM
[Cl-] = 120 mM
Le cellule sono in
grado di regolare le
concentrazioni
dei
soluti inorganici al
loro interno a valori
che differiscono da
quelli extracellulari
1. La permeabilità al K+ è circa 30 volte superiore a quella del Na+, la
permeabilità al Cl- è più variabile (simile al K+ o inferiore)
2. La carica netta negativa è dovuta a gruppi carbossilici e siti anionici
presenti sulle molecole non permeanti di proteine e peptidi
3. Se K+ e Cl- fossero gli unici due ioni diffusibili si imporrebbe una
situazione di equilibrio di Donnan
4. Cellule pompano attivamente fuori Na+ e Ca2+, con dispendio energetico.
Effettiva impermeabilità a questi due ioni.
Stato stazionario ionico: una condizione che richiede un continuo
dispendio energetico, piuttosto che un vero equilibrio
La differenza di potenziale transmembrana è un
Potenziale Elettrochimico
Equilibrio elettrochimico
gradiente di concentrazione e quello elettrico sono uguali e opposti.
Il potenziale elettrochimico si genera perché:
a)
le membrane sono selettivamente permeabili ad alcuni ioni
b)
ci sono differenze di concentrazione di ioni specifici ai due lati della membrana mantenuto
con dispendio energetico
L equilibrio elettrochimico di uno singolo ione (x) corrisponde al suo
potenziale di equilibrio (Ex)
Stabilisce una relazione quantitativa tra la differenza di potenziale elettrico
e il rapporto di concentrazione di un singolo ione tra i due lati della
membrana plasmatica Ex = RT ln [X]e zF [X]i
Ex: potenziale di equilibrio per lo ione X R: costante dei gas (0.082 L x atm/K)
T: temperatura assoluta (Kelvin)
F costante di Faraday (96.500 coulomb/grammo eq di carica)
Z: valenza dello ione
[X]e e [X]i: concentrazioni dello ione ai due lati della membrana
Ex = RT/zF ln [X]e / [X]i
Ek = 61 x log 4.5 mM/140mM= - 90 mV
ENa = 61 x log 120 mM/10 mM= + 65 mV
ECl = - 61 x log 120 mM/4 mM= - 90 mV
In base all’equazione di Nernst: quando il gradiente di concentrazione di uno ione attraverso una membrana
aumenta, aumenterà anche il suo potenziale all’equilibrio
- 270
log (0,01) = -3
log (0,01) = -2
- 180
log (0,1) = -1
- 90
log (1) = 0
Il potenziale di equilibrio è proporzionale al log del rapporto delle
concentrazioni nei due compartimenti
Ma nelle misurazioni reali, la curva si discosta da quella predetta con
l’equazione di Nernst per bassi valori di concentrazione di K+ esterno
La membrana cellulare si comporta
qualitativamente
come
previsto
dall’equazione di Nernst, ma se ne
discosta
quantitativamente
per
+
concentrazioni di K esterno inferiori
a 10 mM
Equazione di Goldman, Hodgkin e Katz
Modello quantitativo del potenziale di membrana
determinato da più specie ioniche
Eioni = RT
F
ln Pk [K+]e + P*Na [Na+]e + P*Cl [Cl-]e Pk [K+]i + P*Na [Na+]i + P*Cl [Cl-]i ENa,K = 61 ln 1 [K+]e + 0,01 [Na+]e
1 [K+]i+ 0,01 [Na+]i
ENa,K = 61 log 2,5 + (0,01 x 120)
140 + (0,01 x 10)
=-96mV
A basse concentrazioni esterne di K+, il prodotto PNa[Na+]e si avvicina al valore del
prodotto PK[K+]e, permettendo al Na+ di apportare un maggior contributo al
potenziale
L’equazione di Goldman permette di combinare i concetti base sulla generazione e
mantenimento del potenziale di membrana in una rappresentazione elettrica
circuitale:
Il Circuito Equivalente della membrana cellulare
Resistenza : vie conduttive singole
Condensatore: capacità del
doppio strato fosfolipidico
++++
-------
++++
++++
++++
----
----
Batteria:generatore di potenziale
(rappresenta il potenziale di equilibrio del singolo ione)
Ix = (Em-Ex)/Rx (sostituendo la resistenza R con la conduttanza g, che ne è l’inverso)
Ix = gx (Em-Ex)
Teoria del campo costante Nella condizione di stato stazionario, il potenziale di membrana e le
concentrazioni degli ioni coinvolti rimangono costanti nel tempo, anche a
costo di dispendio energetico
140 mM
10 mM
3 mM
120 mM
La pompa produce un trasporto netto
di carica: trasporto elettrogenico
Reale contributo della pompa al
potenziale di membrana dipende dalla
velocità alla quale K+ e Cl- possono
rifluire a ritroso attraverso la
membrana
Seppure con una minore permeabilità,
il flusso Na+ è 1,5 volte quello del K+ a
causa
della
elevata
fem,
controbilanciando l’azione della pompa
ENa= + 63mV
fem (Vm-ENa) è pari a -150mV
La pompa Na+/K+ ATPasi contribuisce
indirettamente al potenziale di
riposo
Il valore negativo del potenziale di riposo attraverso la
membrana cellulare dipende dai seguenti fattori
1) La concentrazione intracellulare del K+ è elevata rispetto a quella
extracellulare, in concomitanza con una elevata Pk
2) Gli ioni K+ tendono a fluire passivamente fuori dalla cellula
attraverso canali selettivi aperti in condizioni di riposo, lasciando sul
lato interno una carica netta negativa
3) I canali per il Na+ aperti in condizioni di riposo sono pochi: il Na+
contribuisce in modo irrilevante al Vrip 4) Il contributo del Cl- è variabile
5) La pompa Na+/K+, mantenendo basse la [Na+]i fa sì che il K+ sia il
catione predominante all’interno della cellula. Una piccola
componente del Vrip deriva direttamente dal pompaggio di una
carica netta positiva fuori dalla cellula