HIGH LINE “SURGERY”
ARGOMENTI DI CHIRURGIA PEDIATRICA E INFANTILE
Direttore
Claudio S
Università degli Studi di Pisa
Comitato scientifico
Antonio M
Azienda Ospedaliera Universitaria Meyer, Firenze
Giovanni C
Università degli Studi di Padova
Paolo D C
Great Ormond Street Hospital, Londra
HIGH LINE “SURGERY”
ARGOMENTI DI CHIRURGIA PEDIATRICA E INFANTILE
Lo scopo di questa Collana è di accogliere i vari temi di ricerca nell’ambito della Chirurgia pediatrica e infantile. Essa, garantendo la massima
trasparenza, è “aperta” a tutti i contributi scientifici di Esperti, scelti
sia nel nostro Paese sia in campo internazionale, non necessariamente
legati a questo settore disciplinare. Il progetto unitario che accomuna
deve essere quello di aggiornare e informare i lettori sugli aspetti più
avanzati nel campo delle affezioni chirurgiche in età evolutiva. La
Collana, denominata High Line “Surgery”, in linea con i moderni trattamenti chirurgici, è rivolta non solo agli studenti del corso di laurea in
Medicina e Chirurgia, che per la prima volta affrontano questa disciplina, ma in particolare agli specializzandi e a tutti i cultori della materia.
Un particolare ringraziamento va ai Colleghi del Comitato Scientifico
e alla Aracne editrice che mi ha proposto di dirigere questo prodotto
editoriale universitario, che pur venendo alla luce proprio in piena era
digitale, è perfettamente inquadrato nel contesto dei requisiti previsti
dalle recenti disposizioni ministeriali per i docenti universitari.
Claudio Spinelli, Valentina Pucci
Le masse ovariche in età adolescenziale
Aspetti clinici e terapeutici
Prefazione di
Claudio Spinelli
Copyright © MMXII
ARACNE editrice S.r.l.
www.aracneeditrice.it
[email protected]
via Raffaele Garofalo, /A–B
Roma
()
----
I diritti di traduzione, di memorizzazione elettronica,
di riproduzione e di adattamento anche parziale,
con qualsiasi mezzo, sono riservati per tutti i Paesi.
Non sono assolutamente consentite le fotocopie
senza il permesso scritto dell’Editore.
I edizione: ottobre
Ai miei “buoni” Maestri
Indice
Prefazione
Capitolo I
Anatomia ed embriologia dell’ovaio
.. Anatomia dell’ovaio, – .. Embriologia dell’ovaio, .
Capitolo II
Incidenza ed epidemiologia
.. Incidenza, – .. Epidemiologia, .
Capitolo III
Classificazione e stadiazione di malattia
.. Lesioni ovariche funzionali, – .. Neoplasie ovariche, – .. Torsione ovarica, – .. Analisi istopatologica intraoperatoria, .
Capitolo IV
Valutazione clinica in età infantile ed in età adolescenziale
.. Valutazione clinica in eta’ infantile, – .. Valutazione clinica
nell’adolescente, .
Capitolo V
Sintomatologia
.. Dolore addominale acuto, – .. Dolore addominale ricorrente, – .. Dolore addominale cronico, – .. Sintomi secondari, –
.. Alterazioni ormonali, .
Capitolo VI
Diagnostica per immagini
.. Ecografia, – .. Ecocolor doppler, – .. Ueland index e ovarian
Le masse ovariche in età adolescenziale
crescent sign (OCS), – .. Tomografia computerizzata (TC), –
.. Risonanza magnetica nucleare (RMN), .
Capitolo VII
I marcatori tumorali
.. Marcatori tumorali, – .. Marcatori tumorali e masse ovariche, .
Capitolo VIII
Trattamento chirurgico
.. Trattamento chirurgico in elezione, – .. Trattamento chirurgico
in urgenza, .
Ringraziamenti
Prefazione
Nell’occasione della mia relazione al “th World Congress of Pediatric and Adolescent Gynecology” a Montpellier, in Francia, dal titolo “
Surgical management of ovarian lesions in children and adolescents”,
mi resi conto del grande interesse che suscitava tale argomento nella
comunità scientifica chirurgica e mi proposi di condensare in un unico
volume, in modo chiaro, i vari aspetti clinici, diagnostici e terapeutici
delle masse ovariche in età adolescenziale.
Non dobbiamo negare che questo è un argomento d’interesse multidisciplinare, infatti, sia ginecologi sia chirurghi generali sia chirurghi
pediatri eseguono questo tipo di chirurgia. Comunque è necessario
enfatizzare che i giovani pazienti sono completamente differenti dagli
adulti, sotto tutti gli aspetti, come mi piace sottolineare anche ai miei
studenti che «I bambini non sono piccoli adulti». Ne consegue che
questo tipo di chirurgia inevitabilmente sta diventando sempre più
circoscritta al settore chirurgico pediatrico–adolescenziale. Pertanto
si sente la necessità di una formazione specifica in questo campo
ultraspecialistico.
Nella stesura di questa monografia è risultata di fondamentale importanza l’esperienza assistenziale, didattica e scientifica. Un prezioso
contributo è stato fornito anche dalle mie pubblicazioni, inerenti tale
argomento, su riviste internazionali come “Ginecol Endocrinol.”, “J
Pediatr. Adolescent Gynecol.”, “Ann. Surg. Oncology”. Nell’impostazione e nella preparazione del libro ho cercato di affrontare gli aspetti
più rilevanti che riguardano questo tema: dalle nozioni essenziali
di anatomia ed embriologia dell’ovaio, alla classificazione anatomo–
patologica delle varie lesioni ovariche; dall’esame clinico alla diagnosi
ed alla terapia chirurgica, sia in urgenza che in elezione. Nel volume
sono discusse, inoltre, le diverse indicazioni terapeutiche in rapporto
all’istotipo, valutandone sia i limiti sia i vantaggi. L’obiettivo principale è quello di adottare una strategia che preservi il più possibile la
funzione della gonade e dunque la futura fertilità di queste giovani
Le masse ovariche in età adolescenziale
pazienti. Alla stesura dei vari capitoli hanno collaborato qualificati
specialisti nel campo della patologia ovarica della nostra università.
Ringrazio sinceramente tutti per l’entusiasmo e l’impegno con cui
hanno contribuito alla realizzazione di questa monografia
Mi auguro che il volume possa rappresentare un efficace strumento
didattico per gli studenti del corso di laurea specialistica in Medicina
e Chirurgia e per gli specializzandi in Chirurgia pediatrica, Chirurgia generale, Ginecologia e Clinica pediatrica; ma anche un valido
strumento di lavoro e di approfondimento per tutti quei Colleghi che
affrontano quotidianamente queste problematiche.
Prof. Claudio Spinelli
Cattedra di Chirurgia pediatrica e infantile
Dipartimento di Patologia Chirurgica, Medica, Molecolare e
dell’Area Critica
Università di Pisa
Capitolo I
Anatomia ed embriologia dell’ovaio
.. Anatomia dell’ovaio
Le ovaie hanno il compito di produrre gameti (oociti) e secernere
ormoni sessuali (estrogeni, progesterone e, in minima quantità, anche
ormoni androgeni).
L’ovaio è un organo pari sito anteriormente alla parete laterale della
piccola pelvi, in corrispondenza di una piccola depressione che prende
il nome di fossetta ovarica (o fossetta di Krause), la quale è delimitata in
alto dai vasi iliaci esterni, in avanti dal ligamento largo, inferiormente
dall’arteria ombelicale e dall’arteria uterina e posteriormente dall’uretere. Le ovaie sono poste posteriormente e inferiormente rispetto alle
tube uterine e sono rese mobili dalla presenza del mesovario (Fig. .).
Figura .. Immagine laparoscopica di utero e annessi in condizioni fisiologiche
in pz. di anni
Le masse ovariche in età adolescenziale
L’ovaio di destra, nella maggior parte delle donne, risulta piu’ voluminoso rispetto a quello di sinistra. Nella neonata la loro lunghezza
varia tra i e i mm, mentre la larghezza tra i e i mm e lo spessore tra . e mm, con un peso di circa . gr ciascuna. Dimensioni e
peso aumentano progressivamente fino a raggiungere il loro completo sviluppo nel periodo prepuberale con una lunghezza di – mm,
una larghezza di mm, uno spessore di – mm e un peso di – gr.
L’ovaio è un organo extraperitoneale, per tale motivo la sua superficie
risulta opaca rispetto al peritoneo contiguo, ed è rivestito da epitelio
germinativo. Macroscopicamente, nei primi mesi di vita, sono visibili
lobulazioni irregolari alternate a depressioni, le quali scompaiono nella bambina, dove l’ovaio appare liscio e regolare, per poi tornare ad
essere irregolare nella pubertà, per la maturazione dei follicoli oofori.
Periodicamente, in una delle due ovaie avviene la deiscenza follicolare e la liberazione dell’ovocita maturo (follicolo ooforo vescicoloso di
Graaf ). Dal follicolo deiscente si forma il corpo luteo, il quale degenera
in corpus albicans. La conseguenza di tali processi è la comparsa di numerose cicatrici in corrispondenza delle zone di deiscenza follicolare
via via più evidenti col progredire dell’età. Dopo la menopausa l’ovaio
tende a diventare atrofico, acquisendo consistenza quasi lignea; dopo i
anni la sua superficie ritorna ad essere liscia per l’atrofia delle stesse
cicatrici.
La forma e la grandezza richiamano quelle di una mandorla, ovvero un ellissoide lievemente appiattito, ad asse verticale maggiore
disposto su un piano sagittale.Se ne distinguono quindi due facce,
laterale e mediale, due poli e due margini, il margine anteriore e il
margine posteriore. Il polo superiore, detto anche polo tubarico, è
unito all’infundibolo della tuba uterina dalla fimbria ovarica; il polo
inferiore, più assottigliato rispetto al primo, è chiamato anche polo
uterino poichè è unito all’utero dal ligamento utero–ovarico (detto
anche ligamento proprio dell’ovaio).
Il margine anteriore, che corrisponde all’ilo dell’ovaio, è denominato mesovarico in quanto è connesso alla pagina posteriore del
ligamento largo ad opera del mesovario; il margine posteriore è denominato anche margine libero. L’ovaio è irrorato dall’arteria genitale
e dal ramo ovarico dell’arteria uterina. L’arteria genitale è un ramo
diretto dell’aorta addominale e nasce in corrispondenza dalla seconda
vertebra lombare, inferiormente rispetto all’origine delle arterie rena-
. Anatomia ed embriologia dell’ovaio
li; a destra decorre anteriormente rispetto alla vena cava inferiore, da
entrambi i lati, incrocia l’uretere e il tratto iniziale dei vasi iliaci esterni
ed è contenuto all’interno del legamento sospensore dell’ovaio. A
livello dello stretto superiore della pelvi tale vaso viene denominato
arteria ovarica.
Nel suo decorso raggiunge l’estremità superiore dell’ovaio penetrando all’interno del mesovario a livello del quale si incontra con
il ramo ovarico dell’arteria uterina con il quale anastomizza a pieno
canale formando un’arcata da cui nascono rami che penetrano nell’ilo
e si distribuiscono al parenchima ovarico. Il ramo ovarico origina
dall’arteria uterina in corrispondenza dell’angolo laterale dell’utero
e, seguendo il legamento utero–ovarico, raggiunge il mesovario per
anastomizzarsi con l’arteria ovarica. Il drenaggio venoso è operato
dalla vena ovarica la quale si forma a partire da un plesso venoso sito
in corrispondenza della zona midollare, dalle vene superiori del plesso
uterovaginale, le vene tubariche, le vene del ligamento rotondo e del
ligamento largo.
I vasi sopra descritti si anastomizzano tra loro e vanno a costituire
il plesso pampiniforme, il quale circonda l’arteria ovarica e, insieme ad
essa, risale il ligamento sospensore, per poi raccogliersi in un unico
vaso il quale a destra confluirà nella vena cava inferiore e a sinistra
nella vena renale. Il drenaggio linfatico è caratterizzato dalla presenza
di una fitta rete vascolare disposta sulla superficie dell’organo e da
un plesso localizzato a livello dell’ilo da cui si distaccano linfatici che
decorrono a livello del ligamento sospensore insieme ai vasi artero–
venosi ovarici interni. Tale drenaggio termina a livello dei linfonodi
paraortici e preaortici.
L’innervazione ovarica è fornita per lo più dal sistema nervoso
simpatico attraverso il plesso uterovarico che origina dal plesso celiaco
e che accompagna l’arteria ovarica; esso riceve fibre anche dal plesso
uterovaginale, il quale accompagna il ramo ovarico dell’arteria uterina.
I nervi si distribuiscono inizialmente alla midollare e da qui si staccano
fibre amieliniche adrenergiche colinergiche che si portano alla corticale, le quali sono destinate per lo più all’innervazione vasomotoria.
Nell’ovaio si possono distinguere, operando una sezione istologica,
una zona corticale (periferica) ed una zona midollare (centrale e vascolarizzata). La zona corticale è rivestita da epitelio cubico semplice,
ha uno spessore variabile tra e mm ed è formato dallo stroma
Le masse ovariche in età adolescenziale
corticale e, nella sua compagine, sono contenuti gli organuli ovarici,
ovvero i follicoli oofori e i corpi lutei nei loro vari stadi di evoluzione
o regressione.
La zona midollare è la regione piu profonda e centrale ed è costituita da connettivo lasso che accompagna le ramificazioni delle
arterie, le quali sono disposte a spirale (arterie “a cavaturacciolo”).
Tale caratteristica consente alla midollare di deformarsi in rapporto
allo stadio di sviluppo dei follicoli (un aumento di flusso di sangue
nei vasi midollari porterà ad un aumento del volume della midollare, la quale eserciterà una pressione diretta verso la corticale e ciò
potrà determinare lo scoppio di un follicolo maturo) [–]. I follicoli
primordiali sono localizzati subito al di sotto dell’epitelio germinativo
dell’ovaio, nella tunica albuginea. Essi sono costituiti da cellule piatte
che circondano l’ovocita (sferico). I nuclei degli ovociti presentano
cromatina finemente dispersa e prominenti nucleoli.
La maggior parte dei follicoli primordiali contengono un solo ovocita. Quando tali follicoli degenerano a causa dell’ovulazione o per
atresia, il principale componente della tunica albuginea diventa il tessuto denso fibrovascolare. Nel ciclo ovarico, più follicoli maturano
contemporaneamente, ma solo un ovocita è rilasciato con l’ovulazione. Sia il follicolo che l’ovocita, durante la maturazione, diventano più
voluminosi: l’ovocita viene circondato da più strati di piccole cellule
basofile (cellule della granulosa); il follicolo sviluppa un antro ripieno
di liquido (liquor folliculi) e una guaina di cellule stromali che si differenzierà in teca interna (vascolarizzata) e teca esterna (fibrosa). La teca
esterna è attraversata da vasi sanguigni e linfatici, che raggiungono in
questo modo la teca interna.
Tuttavia lo strato di cellule della granulosa che riveste l’ovocita
rimane avascolare. Grazie ad una progressiva attività di sintesi dell’ovocita e delle cellule follicolari, si osserva la formazione della cosidetta
zona pellucida (spesso strato mucopolisaccaridico e glicoproteico), che
va a separare l’ovocita dalle cellule della granulosa. Il follicolo a questo
punto matura fino a diventare un follicolo terziario o di Graaf ed è
così voluminoso che sporge nello spazio periovarico, in preparazione
dell’ovulazione. Al momento dell’ovulazione, l’epitelio di superficie
dell’ovaio si rompe e nello spazio periovarico vengono rilasciati l’ovocita, la zona pellucida e le cellule follicolari che circondavano l’ovocita
definite cumulo ooforo. Successivamente all’ovulazione, le cellule del-
. Anatomia ed embriologia dell’ovaio
la granulosa, rimaste a livello ovarico, vanno incontro ad ipertrofia,
vengono vascolarizzate dalla teca interna, formando il corpo luteo.
Quest’ultimo è costituito da cellule con citoplasma eosinofilo, nucleo voluminoso e cromatina finemente dispersa. Successivamente il
corpo luteo degenera in corpus albicans, il quale da origine alle tipiche
cicatrici visibili sulla superficie ovarica con l’avanzare dell’età [].
.. Embriologia dell’ovaio
Nello sviluppo delle gonadi le principali componenti ad esserne implicate sono due: le cellule germinali e il blastema somatico comune.
Quest’ultimo deriva da una condensazione del mesenchima paramesonefrico, alla cui formazione partecipano anche le cellule dell’epitelio
celomatico.
Il primo abbozzo di gonade, chiamato gonade indifferente, si apprezza a partire dalla quarta settimana di vita intrauterina ed è la cresta
genitale. Tale formazione si trova tra la radice del mesentere dorsale
e il mesonefro omolaterale. La cresta genitale è costituita da un’inspessimento dell’epitelio celomatico e dall’addensamento mesenchimale
sottostante. Dalla sesta settimana, le cellule germinali primordiali, derivate dall’endoderma del sacco vitellino, migrano attraverso il mesentere dorsale sino all’abbozzo gonadico. Tali cellule sono voluminose per
la presenza al loro interno di abbondante glicogeno e fosfatasi alcalina.
Nello stesso periodo, all’interno dell’abbozzo gonadico, si verifica una
proliferazione dei cordoni cellulari, derivati dall’epitelio celomatico, i
quali si spingono nel mesenchima sottostante e all’interno dei quali
penetrano le cellule germinali.
Tali cordoni sono detti primitivi o midollari e dalla loro regressione originerà la midollare dell’ovaio. Nell’ottava settimana avviene
la differenziazione della gonade indifferente in gonade femminile e
si manifesta con la frammentazione e la degenerazione dei cordoni
primitivi. Al momento della differenziazione gonadica, il blastema
comune prolifera inglobando le cellule germinali che si trovano al
di sotto dell’epitelio celomatico. La proliferazione degli elementi del
blastema comune avviene nella direzione della futura corticale dell’organo, dando origine ai cordoni cellulari, i cordoni ovigeri, le cui
Le masse ovariche in età adolescenziale
cellule si dispongono in parte attorno alle cellule germinali, in parte si
trasformano in cellule dello stroma corticale dell’ovaio.
Nel corso dello sviluppo, la gonade femminile modifica la propria
sede discendendo rispetto alla sua prima sede di sviluppo. L’ovaio si
sviluppa a livello delle prime vertebre lombari; a partire dal o mese di
vita intrauterina, per l’accrescimento della porzione inferiore dell’addome, la gonade discende inizialmente nella grande pelvi, essendo
connessa a tale porzione, mediante il ligamento genitoinguinale. Successivamente, verso il o mese di vita intrauterina, raggiunge lo stretto
superiore della pelvi, per poi raggiungere la sua sede definitiva nella
piccola pelvi entro il primo anno di vita [–].
. Anatomia ed embriologia dell’ovaio
Referenze
[] D R, M P, F S, S C, editors. Patologia ovarica.
In Endocrinopatie pediatriche di interesse chirurgico. Padova: Piccin; .
p. –.
[] H JW, D J, C VJ. Anatomy and Physiology. In:
H JW, D J, C VJ, editors. The gynecology of childhood and adolescence. .nd ed. PHiladelphia: Saunders; . p. –.
[] C PB. A . I: B A, K RJ, editors. Blaustein’s Pathology of the Female Genital Tract: Springer;
. p. –.
[] R MH, M A, G RL, B KL. Female reproductive
system. In: T PM, D SM, editors. Comparative Anatomy and
Histology: A Mouse and Human Atlas: Elsevier Science; . p. –.
[] R SJ, B RC, R P. Embriology of the female genital tract
and disorders of abnormal sexual development. In: B A, K
RJ, editors. Blaustein’s Pathology of the Female Genital Tract. th ed. New
York: Springer; . p. –.
[] R SJ, M GL, P J. Robboy’s Pathology of the Female Reproductive Tract. nd ed: Churchill Livingstone/Elsevier; .
Capitolo II
Incidenza ed epidemiologia
.. Incidenza
Le masse ovariche in età pediatrica comprendono un gruppo estremamente eterogeneo di patologie. Esse vanno da lesioni di natura
funzionale fino a neoplasie benigne, maligne o borderline. L’incidenza dei tumori ovarici nell’infanzia e nell’ adolescenza risulta essere
approssimativamente pari a . per , pazienti all’anno []. Tali
tumori rappresentano tuttavia le più comuni neoplasie ginecologiche
in questo gruppo di età. Durante l’adolescenza, i tumori ovarici rappresentano la quarta più comune patologia di natura maligna, dopo i
linfomi, la leucemia e il carcinoma tiroideo [–]. Il rischio di malignità
durante l’infanzia e l’adolescenza differisce da quello dell’età adulta: le
adolescenti rappresentano il % delle donne con neoplasia ovarica [].
In accordo con la letteratura, il % delle lesioni ovariche in età
pediatrica ha un’origine funzionale (di queste quella più frequente è
la cisti follicolare), il % rientra nell’ambito delle neoplasie benigne,
mentre solo il % è costituito da neoplasie maligne [–].
Le lesioni neoplastiche sono suddivise in tre tipi istologici principali:
tumori a cellule germinali (.–.%), tumori epiteliali (.–.%) e
tumori dello stroma e dei cordoni sessuali (.–.%). Tali neoplasie
non seguono la stessa distribuzione istologica presente negli adulti: i
tumori ovarici dell’età adulta sono prevalentemente epiteliali, mentre
in età pediatrica prevalgono i germinali. In particolare, i teratomi sono
il tipo istologico riscontrato più frequentemente.
Per quanto riguarda la distribuzione per età, le cisti funzionali, data
la loro natura ormonale, si presentono maggiormente in età neonatale (.%) e postmenarcale (.%) []. Al contrario, la patologia
neoplastica si verifica principalmente nel periodo premenarcale, con
un tasso atteso di malignità che va dal al %. Alcune tipologie di
Le masse ovariche in età adolescenziale
pazienti sono associate a una ridotta frequenza di malignità (torsioni
ovariche, bambini < anno di età), mentre altre presentano un’aumentata frequenza (bambini – anni di età, con pubertà precoce o massa
addominale). Ricorrendo all’archivio SEER (Surveillance, Epidemiology and End Results) [–], in cui sono stati identificati , pazienti
pediatrici con tumori ovarici maligni, l’incidenza di tali neoplasie maligne in bambini < anni è risultata essere . contro un’incidenza
pari a . per , in quelli con età tra i e i anni; risultano
rare in pazienti < anni.
.. Epidemiologia
Un ridotto numero di sindromi si associa alla patologia ovarica in età
pediatrica. Tumori dei cordoni sessuali con tubuli anulari e cistadenomi ovarici sono stati riscontrati nella sindrome di Peutz–Jeghers
[–], tumori a cellule della granulosa e fibrosarcomi sono stati individuati nella sindrome di Maffucci (osteocondrodisplasia associata
a encondromi e emangiomi multipli); tumori stromali sclerosanti
possono essere associati alla sindrome di Chédiak–Higashi (albinismo oculocutaneo, infezioni batteriche e anomalie dei granulociti,
con deficit della fagocitosi) []. La presenza di cisti ovariche è stata
riscontrata anche in sindromi dismorfiche, caratterizzate da anomalie
cranio–facciali, laringee e digitali [].
I principali fattori di rischio per carcinoma ovarico sono rappresentati dalla nulliparità e dal maggiore sviluppo socio–economico [].
Diete ad alto contenuto di carne, grassi animali e prodotti caseari
costituiscono ulteriori fattori di rischio, ma la loro rilevanza è controversa. Recenti ricerche hanno suggerito che un elevato indice di
massa corporea (BMI) può aumentare la probabilità di sviluppare una
lesione di natura maligna []. Un menarca tardivo, una menopausa
precoce, una dieta ricca di pesce e una corretta e quotidiana attività
fisica sono condizioni generalmente associate a un ridotto rischio di
carcinoma ovarico.
Una percentuale pari al –% delle donne affette da carcinoma
ovarico presenta un’alterazione genetica. Le principali mutazioni che
determinano tale tipo di neoplasia si verificano a livello dei geni oncosoppressori BRCA e BRCA. Approssimativamente, il % dei
. Incidenza ed epidemiologia
carcinomi ovarici è causato da mutazioni ai geni BRCA, il % da mutazioni ai geni BRCA. La trasmissione di tali mutazioni è autosomica
dominante. Se una paziente presenta una delle seguenti mutazioni, ha
un rischio di sviluppare un carcinoma ovarico del %. L’utilizzo dei
test genetici nelle adolescenti è tuttora controverso. È stato visto che
l’uso di contraccettivi orali riduce il rischio di neoplasia ovarica nella
popolazione generale; rimane ancora da definire se i contraccettivi
orali possono ridurre il rischio di carcinoma ovarico nelle giovani
pazienti [].
Le masse ovariche in età adolescenziale
Referenze
[] C DL, H E, B ML, C M, B RS, M
AL, et al. Surgery for ovarian masses in infants, children, and adolescents:
consecutive patients treated in a –year period. J Pediatr Surg. ; ():
–.
[] H ES, D K. O . E J G O. ; (): –.
[] K YA, L JA, K S, A L. Characteristics and management
of adnexal masses in a canadian pediatric and adolescent population. J Obstet
Gynaecol Can. ; (): –.
[] R EM, S AK, S W, S E, H
ME. Pediatric ovarian tumors–dilemmas in diagnosis and management. Eur
J Pediatr Surg. ; (): –.
[] E RN, B RE, S NC, S CC. A Retrospective Review of the Effect of Surgeon Specialty on the Management of Benign and
Malignant Pediatric and Adolescent Adnexal Masses. “Journal of Pediatric
and Adolescent Gynecology”. ; (): –.
[] S C. Patologia ginecologica in chirurgia pediatrica. In: S C,
editor. Principi di chirurgia pediatrica e infantile. Roma: Aracne; . p.
–.
[] S C, D G M, C M, M N. Functional ovarian lesions in
children and adolescents: when to remove them. Gynecol Endocrinol. ;
(): –.
[] M M, H D, A D. Epithelial ovarian tumors in children: a retrospective analysis. J Pediatr Surg. ; (): –; discussion
–.
[] D E, E M, S V, B D, H
D, K A, et al. Ovarian masses during adolescence: clinical, ultrasonographic and pathologic findings, serum tumor markers and endocrinological profile. Gynecol Endocrinol. ; (): –.
[] S MA, S MG, H SA, G JL. Ovarian neoplasms in children. Arch Surg. ; (): –; discussion –.
[] S KA, S SF, M Y, N JP, S ME. Pediatric
ovarian tumors: a review of cases. Pediatr Blood Cancer. ; ():
–.
[] A J FE, A G AA, G T, A D SA, R J, R-
. Incidenza ed epidemiologia
MS. Ovarian tumors in children and adolescents–a clinical study of
patients in a university hospital. J Pediatr Adolesc Gynecol. ; ():
–.
[] H–J A. Surgical management of the incidentally identified ovarian mass. Semin Pediatr Surg. ; (): –.
[] A D. Malignant lesions of the ovary in childhood. Semin Pediatr
Surg. ; (): –.
[] C SM, M YC, C HC, L JY, C JC, Y CP, et al. Ovarian tumors in the pediatric age group: cases treated over an –year period.
Chang Gung Med J. ; (): –.
[] R U, L D–Y, B D–S, Y B–K, C D. Clinical Characteristics
of Adnexal Masses in Korean Children and Adolescents: Retrospective Analysis
of Cases. “Journal of Minimally Invasive Gynecology”. ; ():
–.
[] O SC, F A, B R, H R, H B, G N. Pediatric ovarian malignancy presenting as ovarian torsion: incidence and relevance. J Pediatr Surg. ; (): –.
[] B KF, C MC, K LG, S JE, F AC. A
population–based analysis of malignant ovarian tumors in the pediatric
population. J Surg Res. ; (): –.
[] O SC, G N, B R, H R, H B, F A. Can
we preoperatively risk stratify ovarian masses for malignancy? J Pediatr Surg.
; (): –.
[] P E, K PF, P RC, S K, S JI. Peutz–
Jeghers syndrome with ovarian sex cord tumor with annular tubules and cervical adenoma malignum. Gynecol Oncol. ; (): –.
[] C JE, B SC. Ovarian fibrosarcoma associated with Maffucci’s syndrome. Gynecol Oncol. ; (): –.
[] T Y, S Y, N H, I T, N T. Ovarian juvenile granulosa cell tumor associated with Maffucci’s syndrome. Am J Clin
Pathol. ; (): –.
[] I R, K N, M F, H Y, O T. Chediak–Higashi
syndrome: report of a case with an ovarian tumor. Clin Genet. ;
(): –.
[] M W, K N, P JB, rd. Fused eyelids, airway anomalies, ovarian cysts, and digital abnormalities in siblings: a new autosomal
Le masse ovariche in età adolescenziale
recessive syndrome or a variant of Fraser syndrome? Am J Med Genet.
; (): –.
[] C F, P F, B C, F S, T R,
C V, et al. Risk factors for ovarian cancer histotypes. Eur J
Cancer. ; (): –.
[] Cancer CGoESoO. Ovarian cancer and body size: individual participant
meta–analysis including , women with ovarian cancer from epidemiological studies. PLoS Med. ; (): e.
[] K H, C DY, C DH, C SY, S I, P W, et al. Characteristics and spectrum of BRCA and BRCA mutations in , Korean
patients with breast and ovarian cancer. Breast Cancer Res Treat. .
[] U M, B E, E S, C K, O’C D, B V,
et al. Injectable and oral contraceptive use and cancers of the breast, cervix,
ovary, and endometrium in black South African women: case–control study.
PLoS Med. ; (): e.
Capitolo III
Classificazione e stadiazione di malattia
Le masse ovariche nell’infanzia e nell’adolescenza rappresentano un
gruppo di lesioni eterogenee con diversa etiologia. Gran parte delle lesioni, fino ad un %, risulta neoplastica, ed è ormai assodato
che maggiormente rappresentata sia l’origine dalle cellule germinali.
Meno di un % dei tumori ovarici invece origina dell’epitelio di
superficie e si presentano raramente prima dell’età menarcale. Queste
neoplasie, nell’infanzia e nell’adolescenza, si presentano esclusivamente con sottotipo istologico sieroso o mucinoso e possono essere ulteriormente caratterizzate come benigne, maligne o a basso potenziale
di maignità o borderline.[] Le lesioni ovariche seguono la più recente
classificazione istologica proposta dalla World Health Organization
(WHO) (Tab ., .).
Table .. Classificazione istologica delle lesioni ovariche non neoplastiche secondo la World Health Organization (WHO). Revisione ,
000
D27
E28
E28.2
N70–77
N80
N83
N83.0
N83.1
N83.2
N83.8
World health organization histologic classification of nonneoplastic ovarian lesions
Ectopic pregnancy
Benign neoplasm of the ovary
Ovarian dysfunction
Polycistic ovarian syndrome
Pelvic inflammatory disease
Endometriosis
Noninflammatory disorders of ovary, fallopian tube, and broad ligament
Follicular cyst of ovary
Corpus luteum cyst
Other and unspecified ovarian cysts (simple cyst)
Other noninflammatory disorders of ovary, fallopian tube and broad ligament
Un appropriato trattamento delle neoplasie ovariche richiede un’accurata stadiazione della patologia: tale approccio ha determinato una
maggiore percentuale di sopravvivenza e una migliore preservazione
della fertilità []. Una meticolosa stadiazione è basata sulla valutazione
Le masse ovariche in età adolescenziale
clinica, l’esplorazione chirurgica, lo studio istologico dei tessuti e la
citologia dei fluidi. Negli Stati Uniti, le neoplasie ovariche epiteliali
sono stadiate al momento dell’intervento chirurgico ricorrendo al
sistema di stadiazione dell’International Federation of Gynecology
and Obstetrics (FIGO) del , revisionato ma non variato nel
(Tab. .) [].
Tuttavia il protocollo FIGO non fornisce indicazioni accurate sull’estensione della linfoadenectomia richiesta nel trattamento chirurgico
delle neoplasie ovariche, nonostante il numero di linfonodi rimossi
con la chirurgia abbia un significato clinico e prognostico. I tumori
germinali e stromali sono stadiati ricorrendo a reperti sia chirurgici
che istologici. Lo studio principale a cui si fa riferimento è quello del
Children’s Oncology Group (COG) (Tab. .) []. I lavaggi peritoneali
sono fondamentali per la stadiazione delle neoplasie ovariche.
Table .. Classificazione istologica dei tumori ovarici secondo la World Health
Organization (WHO). Data di creazione: ; ultima revisione:
1
1.1
1.2
1.3
1.4
1.5
1.6
1.7
1.8
2
2.1
2.1.1
2.1.1.1
2.1.1.2
2.1.2
2.2.
2.3.
2.3.1
2.3.2
2.4
3
3.1.
3.1.1
3.1.2.
3.1.3.
3.1.4
3.1.5
World health organization classification of tumors of the ovary
Surface epithelial–stromal tumors
Serous tumors
Mucinous tumors
Endometrioid tumors
Clear cell tumors
Transitional cell tumors
Squamous cell tumors
Mixed epithelial tumors
Undifferentiated and unclassified tumors
Sex cord–stromal tumors
Granulosa–stromal cell tumors
Granulosa cell tumor group
Adult
Juvenile
Tumors in thecoma–fibroma group
Sertoli–stromal cell tumors
Sex cord–stromal tumors of mixed or unclassified cell types
Sex cord tumor with annular tubules
Gynandroblastoma
Steroid cell tumors
Germ cell tumors
Primitive germ cell tumors
Dysgerminoma
Yolk sac tumor (endodermal sinus tumor)
Embryonal carcinoma
Polyembryoma
Nongestational choriocarcinoma
. Classificazione e stadiazione di malattia
3.1.6
3.2.
3.2.1
3.2.2.
3.3
4
4.1
4.2
5
6
6.1
6.2
6.3
7
8
9
Mixed germ cell tumors (specify components)
Biphasic or triphasic teratomas
Immature
Mature
Monodermal teratomas
Germ cell sex cord–stromal tumors
Gonadoblastoma
Mixed germ cell–sex cord–stromal tumor of nongonadoblastoma type
Tumors of rete ovarii
Miscellaneous tumors
Small cell carcinomas, hypercalcemic type
Gestational choriocarcinomas
Soft tissue tumors non specific to ovary
Tumorlike conditions
Lymphoid and hematopoietic tumors
Secondary tumors
Essi dovrebbero essere eseguiti immediatamente dopo l’accesso in
addome (sia in laparoscopia che in laparotomia) per evitare la contaminazione, nell’evenienza in cui si verifichi la rottura intraoperatoria
della massa tumorale. Dato che la natura benigna o maligna della
lesione verrà identificata con certezza solo dopo l’analisi istopatologica, è consigliabile eseguire lavaggi peritoneali in tutti i casi in cui la
massa presenti struttura ecografica complessa. Se all’interno dell’addome non si rileva fluido in modo evidente, può essere utilizzata una
soluzione di Ringer lattato per irrigare la pelvi e i recessi colici, poi
accuratamente aspirata e inviata come lavaggio peritoneale [].
Table .. Stadiazione del carcinoma ovarico secondo l’International Federation of
Gynecology and Obstetrics (FIGO)
Staging of carcinoma of the ovary: international federation of gynecology and obstetrics (FIGO)
Stage
0
I
IA
IB
IC
Extent of disease
Primary tumor cannot be assessed
No evidence of primary tumor
Tumor confined to ovaries
Tumor limited to one ovary, capsule intact
No tumor on ovarian surface
No malignant cells in ascites or peritoneal washings
Tumor limited to both ovaries, capsule intact
No tumor on ovarian surface
No malignant cells in ascites or peritoneal washings
Tumor limited to one or both ovaries, with any of the
following: capsule ruptured, tumor on ovarian surface,
malignant cells in ascites or peritoneal washings
Le masse ovariche in età adolescenziale
II
Tumor involves one or both ovaries with pelvic
extension
Extension to or implants on uterus or tubes or both
No malignant cells in ascites or peritoneal washings
Extension to other pelvic organs
No malignant cells in ascites or peritoneal washings
IIA or IIB with positive malignant cells in ascites or
peritoneal washings
Tumor involves one or both ovaries with
microscopically confirmed peritoneal metastasis
outside the pelvis or regional lymph nodes metastasis
Microscopic peritoneal metastasis beyond the pelvis
Macroscopic peritoneal metastasis beyond the pelvis 2
cm or less in greatest dimension
Peritoneal metastasis beyond the pelvis more than 2
cm in greatest dimension or regional lymph nodes
metastasis
Distant metastasis beyond the peritoneal cavity
IIA
IIB
IIC
III
IIIA
IIIB
IIIC
IV
Table .. Stadiazione dei tumori a cellule germinali secondo il Children’s Oncology Group (COG)
Stage
Clinicopathologic staging of ovarian germ cell tumors: children’s oncology group (cog)
Extent of disease
I
II
III
IV
Limited to oavry (peritoneal evaluation should be
negative); no vlinical, radiographic or hidtologic
evidence of disease beyond the ovaries (Note: the
presence of gliomatosis peritonei does not change
stage I disease to a higher stage)
Microscopic residual; peritoneal evaluation negative
(Note: the presence of gliomatosis peritonei does not
change stage II disease to a higher stage)
Lymph node involvement (metastatic nodules); gross
residual or biopsy only; contiguous visceral
involvement (omentum, intestine, bladder); peritoneal
evaluation positive for malignancy
Distant metastasis, including liver
.. Lesioni ovariche funzionali
Le lesioni funzionali, essendo la loro etiologia correlata ad uno stimolo di natura ormonale, sono diversamente distribuite in base all’età,
con incidenza maggiore nel periodo neonatale (.%), come diretta
conseguenza dello stimolo esercitato sulle ovaie dagli ormoni di origine materna, e nel periodo postmenarcale (.%), secondariamente
all’attivazione dell’asse ipotalamo–ipofisario e quindi della funzione
. Classificazione e stadiazione di malattia
gonadale []. Le cisti funzionali possono essere follicolari, luteiniche e
teco–luteiniche; ciascuna di esse è di natura benigna e tende a risolversi
spontaneamente.
... Cisti follicolari
Le cisti follicolari sono la conseguenza di un’anomalia della follicologenesi per cui un follicolo ooforo, formato da cellule della granulosa
(non luteinizzate) e della teca, va incontro a crescita con aumento
della cavità e del liquido in essa contenuto. L’aumento eccessivo del
liquido follicolare porta sovente alla scomparsa, per degenerazione,
dell’oocita facendo così assumere al follicolo l’aspetto di una cisti.
Da un punto di vista anatomo–patologico esse appaiono come delle
formazioni cistiche contenenti un liquido sieroso chiaro e rivestite da
una parete grigiastra, traslucida; possono essere singole o multiple,
uniloculari (più spesso) o multiloculari ed hanno un diametro di solito
compreso tra e cm. Istologicamente, se la pressione endoluminale non è stata eccessiva, si può identificare lo strato delle cellule
di rivestimento della granulosa; le cellule della teca esterna possono
essere numerose con citoplasma aumentato di volume e di aspetto
pallido (luteinizzate). Quando questa alterazione è significativa (ipertecosi), può causare un aumento della produzione di estrogeni. Sul
piano endocrinologico, le cisti follicolari sono generalmente silenti,
tuttavia possono occasionalmente produrre un’iperincrezione estrogenica, responsabile di pseudo–pubertà precoce o di anomalie del
ciclo mestruale. Esse tendono alla riduzione progressiva e spontanea
fino alla completa regressione, se presentano un diametro < cm; se
invece hanno un diametro > cm, la risoluzione spontanea si verifica
in una percentuale minore di casi [–].
... Cisti luteiniche
Le cisti luteiniche si sviluppano come conseguenza della formazione
di un ematoma o di una raccolta liquida di colore giallo–citrino o
siero–ematico all’interno del corpo luteo in una adolescente che ovviamente è andata incontro a ovulazione. Le cisti luteiniche sono infatti di
riscontro pressocchè esclusivo dell’epoca postmenarcale. Da un punto
di vista anatomo–patologico esse appaiono come delle formazioni
Le masse ovariche in età adolescenziale
cistiche generalmente uniche e uniloculari. Queste cisti sono rivestite
da una corona di tessuto luteale di colore giallo chiaro contenente
cellule della granulosa luteinizzate. Data la loro composizione istologica, esse possono presentare un’increzione ormonale autonoma
che si ripercuote sul piano clinico con iperplasia dell’endometrio e
irregolarità del ciclo mestruale. Le cisti luteiniche possono avere una
duplice evoluzione: nella maggior parte dei casi vanno incontro ad
una risoluzione spontanea in – settimane, mentre in alcuni casi
si ha organizzazione del loro contenuto ematico in coaguli con conseguente formazione di una lesione cistica non più funzionale ma
francamente patologica, che prende il nome di cisti emorragica del
corpo luteo. Questo tipo di lesione può facilmente complicarsi con una
torsione ovarica, una rottura della cisti e un sanguinamento (addome
acuto).
... Cisti teco–luteiniche
Le cisti teco–luteiniche rappresentano le lesioni funzionali meno comuni. Esse si formano quando il follicolo non va incontro a deiscenza
e si verifica una conseguente luteinizzazione sia delle cellule della teca
che di quelle della granulosa. A questo tipo di luteinizzazione, definita
atresica, segue un aumento di liquido follicolare con formazione di
una lesione cistica il cui diametro non supera generalmente i –
cm. Le cisti teco–luteiniche sono solitamente bilaterali e tendono alla
risoluzione spontanea [].
.. Neoplasie ovariche
Le neoplasie ovariche in età pediatrica seguono diversi criteri di classificazione, di cui due sono comunemente considerati essenziali al fine
di un corretto inquadramento diagnostico e terapeutico.
Il primo criterio di classificazione si basa sulla derivazione istologica
della neoplasia []. I tumori ovarici traggono origine da una delle tre
linee cellulari coinvolte nella formazione dell’ovaio:
— le cellule germinali, che migrano verso l’ovaio dal sacco vitellino
e sono totipotenti;
. Classificazione e stadiazione di malattia
— le cellule mesenchimali o stroma dell’ovaio, provenienti dalla
cresta urogenitale; lo stroma ovarico comprende anche i cordoni sessuali, precursori dell’apparato endocrino dell’ovaio
post–natale;
— le cellule dell’epitelio celomatico di superficie, che ricopre la
cresta urogenitale e che dà origine all’epitelio mülleriano durante lo sviluppo embrionale; da esso derivano le tube di Falloppio (cellule ciliate colonnari sierose), il rivestimento endometriale (cellule non ciliate colonnari) o le ghiandole endocervicali
(cellule non ciliate mucinose).
Vi è, come al solito, un gruppo di tumori che sfuggono alla classificazione e, infine, vi sono tumori secondari o metastatici.
Il secondo criterio di classificazione delle neoplasie ovariche in età
pediatrica prende in considerazione il grado di malignità [], suddividendole in:
— neoplasie ovariche benigne, di cui la forma più frequente è
il teratoma maturo cistico, seguito da fibromi e rare forme
epiteliali;
— neoplasie ovariche maligne, quali teratoma immaturo, yolk sac
tumor, disgerminoma e carcinomi;
— neoplasie ovariche borderline, come i tumori di origine epiteliale.
Sebbene alcuni specifici tumori abbiano caratteristiche distintive
e siano attivi dal punto di vista endocrinologico, la maggior parte
sono non funzionanti e tendono a provocare sintomi relativamente
lievi fino a quando essi non raggiungono grandi dimensioni. I tumori
maligni hanno solitamente una diffusione al di fuori delle ovaie al
momento della diagnosi.
... Tumori a cellule germinali
I tumori a cellule germinali o germ cell tumors (GCT) rappresentano il
% di tutti i tumori ovarici in età pediatrica e la maggior parte di essi
sono di natura benigna, come nel caso del teratoma maturo (%) [].
I GCT sono caratterizzati da una notevole omologia con i tumori di
origine germinale del testicolo e originano, in modo anologo, dalla
Le masse ovariche in età adolescenziale
differenziazione della cellula germinale (Fig. .). Intorno alla IV–V
settimana di vita intrauterina, le cellule germinali migrano dalla parete
posteriore dell’intestino primitivo alla base del sacco vitellino verso
la cresta urogenitale, sede della gonade primitiva. Durante tale migrazione, nidi di cellule totipotenti, distaccatisi dal nucleo centrale,
possono rimanere inglobati nei tessuti circostanti e accrescersi dando
origine ad una neoplasia.
Figure .. Istogenesi e interrelazioni dei tumori di origine germinale
. Classificazione e stadiazione di malattia
Table .. Sedi di insorgenza dei GCT in età pediatrica
Sede
Regione sacro–coccigea
Ovaio
Testicolo
Mediastino
SNC
Fegato, testa/collo, pelvi, vagina
Frequenza
40%
30%
10%
10%
6%
<1%
Tumori appartenenti a questo gruppo possono infatti ritrovarsi
con frequenza variabile lungo l’asse mediano, a qualunque livello del
soma, da quello cefalico a quello caudale (Tab. .) []. Il rischio di
malignità nei GCT è circa del % [].
Teratomi
I teratomi sono caratterizzati dalla coesistenza di elementi cellulari
derivanti dai tre foglietti germinativi (ectoderma, endoderma e mesoderma). Essi sono suddivisi in tre categorie: maturi (benigni), immaturi (maligni) e monodermici o altamente specializzati.
I teratomi maturi (benigni) rappresentano circa l’% di tutti i teratomi diagnosticati in età pediatrica. La maggior parte di essi sono cistici (cisti dermoidi) e presumibilmente derivati dalla differenziazione
ectodermica delle cellule totipotenti. Tali teratomi sono bilaterali nel
–% dei casi. Alla sezione, essi rivelano una parete sottile rivestita
da un’epidermide opaca, grigio–bianca, rugosa; possono contenere
ciuffi di capelli, peli e materiale sebaceo; è comune inoltre il riscontro
di strutture dentali e aree calcifiche. Una tale conformazione dei teratomi maturi è dovuta alla prevalenza della linea cellulare ectodermica.
All’esame istologico, la parete cistica è composta di epitelio squamoso
stratificato (epidermide) con eventuali sottostanti ghiandole sebacee
e altre strutture cutanee annessiali. Nella maggior parte dei casi, possono essere identificate altre strutture derivate dai foglietti germinativi,
come cartilagine, tessuto osseo e tessuto tiroideo (Fig. ., .).
Circa l’% dei teratomi maturi va incontro a trasformazione maligna di uno degli elementi che lo compongono (per esempio, carcinomi tiroidei, melanomi, ma in genere carcinoma a cellule squamose).
In rari casi il teratoma è solido: manca in tal caso la differenziazione
Le masse ovariche in età adolescenziale
Figure .. Cisti dermoide
Figure .. Teratoma maturo con strutture cutanee (freccia continua) e cartilaginee
(freccia tratteggiata)
. Classificazione e stadiazione di malattia
preponderante di tipo ectodermico. Tali teratomi possono essere
inizialmente difficili da distinguere rispetto ai teratomi immaturi (maligni), che quasi sempre sono solidi.
I teratomi monodermici o altamente specializzati rappresentano
un importante, raro gruppo di tumori, i più comuni dei quali sono
gli struma ovarii e i carcinoidi. Essi sono sempre bilaterali. Lo struma
ovarii è composto esclusivamente di tessuto tiroideo maturo e può
essere iperfunzionante determinando ipertiroidismo. Il carcinoide
ovarico, che probabilmente deriva dalla presenza di epitelio intestinale
in un teratoma, può essere funzionante, in particolare nei tumori di
dimensioni maggiori (> cm), con produzione di –idrossitriptamina
e sindrome da carcinoide. I carcinoidi ovarici sono raramente maligni
(meno di %).
I teratomi immaturi (maligni) sono rari e differiscono dai teratomi
maturi per il fatto che la componente tissutale ricorda quella osservata
nel feto o nell’embrione piuttosto che nell’adulto (tessuti immaturi e
quindi maligni); essi infatti costituiscono la forma non differenziata
(immatura) dei teratomi. Questi tumori sono voluminosi (fino a
cm) e hanno una superficie esterna liscia. In sezione, essi hanno una
struttura prevalentemente solida. Vi sono aree di necrosi e di emorragia. Capelli, materiale grumoso, cartilagine, osso e calcificazioni
possono essere presenti. All’esame microscopico, si rilevano quantità
variabili di tessuto immaturo, che si differenzia in cartilagine, ghiandole, osso, muscolo, nervi. La successiva diffusione extra–ovarica di
tali tumori dipende dal loro grado istologico (I, II, III), che si basa a
sua volta sulla quantità di tessuto immaturo più rappresentato (neuroepiteliale) riscontrato alle sezioni istologiche: grado , % di elementi neuroepiteliali immaturi; grado I, <%; grado II, –%,
grado III, >%. I teratomi immaturi tendono a crescere rapidamente
e frequentemente infiltrano la capsula con diffusione locale o metastasi. Tuttavia, i tumori in stadio I hanno una prognosi eccellente
[–].
Disgerminomi
Queste neoplasie, che derivano da cellule germinali indifferenziate,
sono definite disgerminomi quando insorgono nell’ovaio e sono
l’equivalente dei seminomi testicolari. Relativamente rari, i disger-
Le masse ovariche in età adolescenziale
minomi rappresentano circa l’% di tutti i tumori primitivi maligni
ovarici, l’–% di tutti i tumori a cellule germinali e tuttavia sono i
tumori a cellule germinali maligni più frequenti (%) [].
Circa il –% dei pazienti con disgerminoma, presentano anche
anomalie nello sviluppo gonadale, con amenorrea o altre alterazioni ormonali []. Essi sono generalmente unilaterali (–%),
solidi e di dimensioni che vanno da piccoli noduli a masse che
potenzialmente possono riempire l’intero addome (fino a cm).
Alla superficie di taglio, essi hanno un aspetto dal giallo–bianco
al grigio–rosa e sono spesso molli e carnosi. All’esame istologico
microscopico i disgerminomi sono costituiti da aggregati, isole o
cordoni di cellule di grandi dimensioni (– micron di diametro),
uniformi e poliedriche separati da setti connettivali contenenti linfociti. Tali cellule neoplastiche possono produrre Fosfatasi Alcalina
Placentare (PLAP) e occasionalmente, se coesistono cellule del
sinciziotrofoblasto, gonadotropina corionica umana (hCG). Tutti
i disgerminomi sono maligni, ma il grado di atipia istologica è
variabile e per questo solo un terzo è aggressivo, con infiltrazione
dell’ovaio e dei tessuti circostanti. La sopravvivenza complessiva
supera l’% [].
Tumori del seno endodermico (tumori del sacco vitellino o yolk sac
tumor)
Questo tumore è raro, ma rappresenta per frequenza la seconda neoplasia maligna a cellule germinali, dopo il disgerminoma. Analogamente
al sacco vitellino, esso è ricco di α–fetoproteina (AFP), che rappresenta
un importante marcatore tumorale per tale neoplasia. Macroscopicamente si presenta come una massa di consistenza dura, grigio–giallastra,
con numerose aree di necrosi ed emorragia che conferiscono a tale tumore una caratteristica friabilità ed una facilità di rottura prima e durante
l’intervento chirurgico. I tumori del sacco vitellino mostrano diversi
pattern di crescita solitamente distintivi, il più frequente è il pattern “reticolare”, microcistico o myxomatoso, anche se il più caratteristico è quello
papillare o festonato che include i patognomonici corpi di Schiller–Duval,
che però si presentano solo in un % dei casi. Generalmente i tumori
del sacco vitellino sono unilaterali, ma crescono rapidamente e in modo
aggressivo.
. Classificazione e stadiazione di malattia
Coriocarcinoma
I coriocarcinomi sono tumori germinali costituiti da citotrofoblasto e
sinciziotrofoblasto e sono estremamente aggressivi: al momento della
diagnosi, spesso hanno già dato metastasi estese per via ematica al polmone, al fegato, all’osso e ad altri visceri. Essi producono alti livelli di
gonadotropine corioniche (β–hCG) a volte utili per porre la diagnosi
o per evidenziare le recidive. La maggior parte dei coriocarcinomi
coesiste con altri tumori a cellule germinali e i coriocarcinomi puri
sono estremamente rari.
Altri tumori a cellule germinali
Essi comprendono: il carcinoma embrionale, altro tumore altamente
maligno formato da elementi cellulari poco differenziati, con estese
aree di necrosi; si presenta frequentemente associato ad altri tumori a
cellule germinali, come yolk sac tumor o coriocarcinoma; è generalmente unilaterale, in circa la metà dei casi si presenta clinicamente
con pseudopubertà precoce e può determinare livelli elevati di PLAP,
hCG e AFP. Il poliembrioma è un tumore maligno contenente i
cosiddetti corpi embrioidi. I tumori a cellule germinali misti possono
contenere varie combinazioni di disgerminomi, teratomi, tumore del
sacco vitellino e coriocarcinoma [].
... Tumori dello stroma e dei cordoni sessuali (Sex Cord Stromal Tumor)
Queste neoplasie derivano dallo stroma ovarico, che a sua volta è
derivato dai cordoni sessuali della gonade embrionale. Poiché il mesenchima gonadico indifferenziato è in grado di produrre specifici
tipi cellulari caratteristici sia delle gonadi maschili (Sertoli e Leydig)
che delle gonadi femminili (granulosa e teca), nell’ovaio possono essere presenti neoplasie costituite da tutti questi tipi di cellule. Inoltre,
poiché alcune di queste cellule secernono normalmente estrogeni
(cellule della teca) o androgeni (cellule di Leydig), i loro corrispondenti tumori possono essere sia femminilizzanti (tumori a cellule
della granulosa o della teca) sia mascolinizzanti (tumori a cellule del
Sertoli–Leydig).
Le masse ovariche in età adolescenziale
Tumori a cellule della granulosa o della teca (di tipo giovanile)
Questi tumori costituiscono l’% delle neoplasie dello stroma e
dei cordoni sessuali []. Essi sono composti quasi interamente da
cellule della granulosa o da un misto di cellule della granulosa e di
cellule tecali. Macroscopicamente, tali neoplasie sono generalmente
unilaterali e variano da foci microscopici a grandi masse solide e
cistiche incapsulate. La componente cellulare granulosa rappresentata
da piccole cellule, cuboidi o poligonali, che possono crescere in pattern
trabecolari o insulari o di tipo follicolare. La componente tecale pu
essere prominente ed rappresentata da grappoli o lamine di cellule
cuboidali o poligonali.
Le cellule tumorali presentano un citoplasma pi abbondante rispetto
a quelle presenti nei tumori a cellule della granulosa degli adulti. Inoltre, paragonate a quest’ultimi, le neoplasie a cellule della granulosa
in età pediatrica, presentano maggiori atipie nucleari ed attivit mitotica, senza per questo implicare una prognosi peggiore []. Questo
gruppo di tumori presenta due caratteristiche distintive: la potenziale
capacità di elaborare grandi quantità di estrogeni e il riconosciuto
rischio di trasformazione maligna. In epoca premenarcale, a causa
dell’iperincrezione di estradiolo da parte del tumore, si possono verificare segni di pubertà precoce: iperplasia dell’endometrio con sanguinamenti vaginali, ipertrofia mammaria, aumento della peluria nella
zona pubica, maturazione genitale, aumento dell’età ossea []. Dopo
il menarca, invece, i segni clinici della femminilizzazione sono meno
specifici e caratterizzati da distensione e dolori addominali, irregolarità
mestruali. In casi sporadici, il quadro clinico può essere caratterizzato da segni di virilizzazione (irsutismo, ipertrofia clitoridea, voce
bitonale), espressione di un’esaltata attività androgenica da parte del
tumore [] La previsione di malignità va dal al %: solitamente
i tumori maligni presentano un andamento lento con recidive che
possono comparire molti anni (– anni) dopo la rimozione del
tumore originario. I tumori composti in prevalenza di cellule della
teca non sono quasi mai maligni.
Recentemente, ai tumori a cellule della granulosa, sono stati associati elevati livelli tissutali e serici di inibina, prodotta dall’ovaio stesso.
Questo marcatore tumorale può essere utile per la diagnosi e per
monitorare i pazienti sotto terapia per queste neoplasie.
. Classificazione e stadiazione di malattia
Fibromi
Sono tumori benigni rari in età pediatrica, privi di attività ormonale.
Sono unilaterali in circa il % dei casi e si presentano come masse
solide, sferiche o lievemente lobulate, incapsulate, di consistenza dura,
grigio–biancastre ricoperte da una capsula ovarica sierosa intatta e
traslucida. All’esame istologico, sono costituiti da tessuto fibroso talvolta accompagnato da aree di calcificazione.
Tumori stromali sclerosanti
Sono rari tumori che si verificano comunemente nelle prime tre
decadi di vita. Possono essere asintomatici o presentarsi clinicamente
con irregolarità mestruali o dolore addominale. Di solito tali tumori
sono unilaterali, solidi, con foci emorragici. All’esame istologico, sono
costituiti da nidi di cellule separati da tessuto fibroso. Le cellule tumorali possono avere forma ovale o fusiforme, margini irregolari,
nuclei vescicolari e rare mitosi. Tutti i casi riportati sono di natura
benigna [].
Tumori a cellule di Sertoli–Leydig
I tumori a cellule di Sertoli–Leydig costituiscono solo il % delle neoplasie dello stroma e dei cordoni sessuali. In epoca premenarcale,
l’iperincrezione di androgeni determina l’insorgenza di segni di virilizzazione (irsutismo, ipertrofia del clitoride, abbassamento del tono
della voce e aumento della velocità di accrescimento); dopo il menarca
si associano ad amenorrea ed acne [] Dal punto di vista morfologico,
la superficie di taglio è solitamente solida e varia nell’aspetto dal giallo
al marrone dorato. All’esame istologico, i tumori ben differenziati
presentano tubuli composti da cellule del Sertoli e cellule del Leydig
dispersi nello stroma. I tumori scarsamente differenziati hanno un
aspetto sarcomatoso con una disposizione disordinata dei cordoni cellulari. Le cellule di Leydig possono essere assenti. Nella maggior parte
dei casi, tali neoplasie sono unilaterali e quelle diagnosticate in stadio
>I, hanno natura maligna, possono dare recidive e metastasi. È stato
descritto un raro sottotipo nei tumori a cellule di Sertoli–Leydig: il
tumore dei cordoni sessuali a tubuli anulari. Quest’ultimo può asso-
Le masse ovariche in età adolescenziale
ciarsi alla sindrome di Peutz–Jeghers, è solitamente benigno, ma nel
% dei casi ha un decorso maligno. Le sue dimensioni sono limitate
ed è costituito da tubuli anulari che circondano globuli eosinofili [].
... Tumori epiteliali
I tumori epiteliali prendono origine dall’epitelio di rivestimento dell’ovaio
il quale, derivando dall’epitelio celomatico che riveste la cresta urogenitale, ha la capacità di differenziarsi in epitelio sieroso (simile a
quello delle salpingi) e mucinoso (simile a quello endocervicale e
endometrioide). I tumori epiteliali in età pediatrica includono forme
neoplastiche benigne (%), borderline (a bassa potenzialità maligna)
(%) e forme con evidenti caratteristiche di malignità (%) []. Le
neoplasie epiteliali possono accrescersi notevolmente, raggiungendo
considerevoli dimensioni (fino a cm) e peso (fino a Kg) [].
Tumori sierosi
Il cistadenoma sieroso non papillifero, pur rappresentando la più
frequente neoplasia epiteliale benigna, è raro in età pediatrica. Esso
appare come una massa ovoidale con superficie liscia e consistenza
soffice per la presenza di formazioni cistiche che contengono un
liquido chiaro o ambrato. Il cistadenoma sieroso papillifero è simile
al precedente, ma da questo si discosta per la presenza di proliferazioni di tipo papillare all’interno e sulla superficie della cisti (Fig.
.).
Esso si manifesta per lo più in età postpuberale ed è bilaterale
nella metà dei casi. Il carcinoma sieroso è una lesione francamente
maligna, di raro riscontro nell’infanzia, frequentemente bilaterale.
Esso si presenta come una formazione a struttura mista (solida e
cistica), con estese ramificazioni e proliferazioni papillari spesso
prive di asse stromale o con strutture simil–ghiandolari nelle aree
più solide (Fig. .). I carcinomi sierosi di basso grado sono rari e
quindi spesso queste lesioni si presentano con diffusa infiltrazione
dello stroma e della capsula dell’ovaio [].
. Classificazione e stadiazione di malattia
Figure .. Cistoadenoma sieroso
Figure .. Carcinoma sieroso con tipiche proliferazioni papillari
Tumori mucinosi
Il cistadenoma mucinoso appare come una formazione plurilobulata
per la presenza di formazioni cistiche a contenuto liquido, talvolta
emorragico, rivestite da un epitelio cilindrico secernente. È bilaterale
Le masse ovariche in età adolescenziale
nel –% dei casi. Il carcinoma mucinoso, rarissimo in età pediatrica,
è frequentemente monolaterale e, alla diagnosi, si presenta spesso
diffuso. Macroscopicamente appare come una struttura cistica plurilobata, a contenuto liquido, con cordoni solidi costituiti da cellule mucipare atipiche. Oltre l’% dei carcinomi invasivi mantengono aree
di differenziazione cistoadenomatosa o borderline, suggerendo una
progressione verso la malignità.
.. Torsione ovarica
La torsione ovarica è il risultato della rotazione dell’organo sul proprio
peduncolo vascolare, con compromissione, parziale o completa, del
flusso linfatico, venoso e arterioso. Tale evento determina congestione del parenchima ovarico, ischemia e infarto emorragico fino alla
necrosi della gonade. Un aspetto macroscopico tipico dell’ovaio in
torsione è l’ovaio black–bluish, che indica una gonade di dimensioni
aumentate con colore che va dal blu al nero e che è dovuto all’ischemia
emorragica, all’edema e all’infiammazione della gonade. La torsione
dell’ovaio destro è più frequente di quella dell’ovaio sinistro in un
rapporto che varia da : a :, perchè il legamento utero–ovarico di
destra è fisiologicamente più lungo del sinistro e perché, a sinistra,
la presenza del colon sigma limita la mobilità ovarica, svolgendo un
ruolo protettivo [–].
La torsione ovarica può verificarsi su un ovaio normale oppure essere associata alla presenza di masse ovariche, come cisti o neoplasie. È
per questo che i due picchi di maggior frequenza con cui un ovaio può
andare incontro a torsione possono riflettere la distribuzione bimodale
delle lesioni funzionali: periodo neonatale, per influenza da parte degli
ormoni materni e periodo postmenarcale, secondariamente al cambiamento dell’assetto ormonale che avviene con la pubertà. Nel periodo
adolescenziale inoltre, si verifica un importante aumento delle dimensioni ovariche che promuove la torsione. Nel caso in cui la gonade
in torsione si associ a tumore, quello più frequentemente riscontrato
è il teratoma maturo []. Quest’ultimo favorisce la torsione perché
determina un aumento sia in dimensioni sia nel peso della gonade [].
Soltanto nel –% dei casi la torsione ovarica si associa a patologia
maligna: le neoplasie di natura maligna creano infatti una reazione in-
. Classificazione e stadiazione di malattia
fiammatoria a livello dei tessuti circostanti che favorisce la formazione
di aderenze, le quali andranno a limitare la mobilità dell’ovaio, impedendone la torsione [–]. Il rischio di recidiva nella torsione ovarica
è stimato intorno al –% [].
.. Analisi istopatologica intraoperatoria
Nella patologia ovarica, la biopsia intraoperatoria può essere fondamentale per ottenere una diagnosi istologica di certezza riguardo la
natura della lesione è determinante nella scelta dell’approccio chirurgico [–]. Una revisione sistematica di , donne con patologia
ovarica, in un range di età da a anni, ha concluso che l’accuratezza
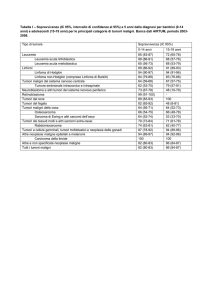
diagnostica dell’analisi istopatologica intraoperatoria è elevata per tumori benigni e maligni (sensibilità rispettivamente del % e del %),
ma ridotta per tumori borderline (sensibilità %) []. Questo perché
le lesioni ovariche epiteliali hanno spesso un aspetto eterogeneo conservando aree che ricordano cistoadenomi o tumori borderline. Non ci
deve sorprendere quindi che circa il –% dei tumori diagnosticati
come borderline all’esame intraoperatorio risultino carcinomi ad un
campionamento più approfondito [–].
Le masse ovariche in età adolescenziale
Referenze
[] M M, H D, A D. Epithelial ovarian tumors in
children: a retrospective analysis. J Pediatr Surg. ; (): –; discussion –.
[] B JL, B H, J H, , N HY, P S. FIGO
staging classifications and clinical practice guidelines in the management
of gynecologic cancers. FIGO Committee on Gynecologic Oncology.
Int J Gynaecol Obstet. ; (): –.
[] K AI. [WHO histological classification of ovarian tumors. Geneva,
(R.E.Scully, L.H.Sobin]. Arkh Patol. ; Suppl: –.
[] A D. Malignant lesions of the ovary in childhood. Semin Pediatr
Surg. ; (): –.
[] C B, G R, A A, C L, C J, H E, et al.
Surgical resection alone is effective treatment for ovarian immature teratoma
in children and adolescents: a report of the pediatric oncology group and the
children’s cancer group. Am J Obstet Gynecol. ; (): –.
[] V A D, F ME. Ovarian tumors. In: C AG, C
A, A NS, K TM, L JM, S R, editors. Pediatric Surgery. Philadelphia: Elsevier Health Sciences; . p. –.
[] K YA, L JA, K S, A L. Characteristics and management
of adnexal masses in a canadian pediatric and adolescent population. J Obstet
Gynaecol Can. ; (): –.
[] S C. Patologia ginecologica in chirurgia pediatrica. In: S C,
editor. Principi di chirurgia pediatrica e infantile. Roma: Aracne; . p.
–.
[] D R, M P, F S, S C. Endocrinopatie pediatriche
di interesse chirurgico Patologia ovarica. In: D R, M P, F
S, S C, editors. Endocrinopatie pediatriche di interesse chirurgico.
Padova: Piccin; . p. –.
[] E SJ. Adnexal masses. In: E SJ, L MR, editors. Emans,
Laufer, Goldstein’s Pediatric and Adolescent Gynecology. th ed. Philadelphia: Lippincott Williams & Wilkins; .
[] C DL, H E, B ML, C M, B RS,
M AL, et al. Surgery for ovarian masses in infants, children, and
adolescents: consecutive patients treated in a –year period. J Pediatr
Surg. ; (): –.
. Classificazione e stadiazione di malattia
[] S C, D G M, M N, M F. Hemorrhagic corpus luteum cysts: an unusual problem for pediatric surgeons. J Pediatr
Adolesc Gynecol. ; (): –.
[] D L. Ovarian tumor pathology in children, adolescents, and
young women. In: A A, D L, editors. Pediatric, Adolescent and Young Adult Gynecology: John Wiley & Sons; . p. –.
[] P C, C J, K E, P A, C P, A J,
et al. Ovarian germ cell tumours: a –year study in a single unit. Eur J
Pediatr Surg. ; (): –.
[] V C, D M, C L, B O, C S, L F, et al. Ovarian germ cell tumors in children. Management, survival
and ovarian prognosis. A report of cases. “Journal of Pediatric Surgery”.
; (): –.
[] D E, E M, S V, B D, H D, K A, et al. Ovarian masses during adolescence:
clinical, ultrasonographic and pathologic findings, serum tumor markers and endocrinological profile. Gynecol Endocrinol. ; (): –
.
[] U TM. Germ cell tumors of the gonads: a selective review emphasizing problems in differential diagnosis, newly appreciated, and controversial issues. Mod Pathol. ; Suppl : S–.
[] R SJ, S–L R, P RY, S MJ, D J, B RC, et al. Malignant struma ovarii: an analysis of cases, including
with extraovarian spread. Int J Gynecol Pathol. ; (): –.
[] D B A, M GC, O JW, H–C
FG, H FW. Ovarian germ cell tumors in children: a clinical
study of patients. Pediatr Blood Cancer. ; (): –.
[] O’N JA. Gonadal tumors. In: O’N JA, O’N D, G
JL, editors. Principles of pediatric surgery. nd ed. St. Louis: Mosby;
. p. –.
[] S DT, J U, C G, G U, H D. Ovarian
sex cord–stromal tumors–a clinicopathological study of cases from the
Kiel Pediatric Tumor Registry. Virchows Arch. ; (): –.
[] K N, P C, O D, L C, P C, P
F, et al. A nationwide study of granulosa cell tumors in pre– and postpubertal girls: missed diagnosis of endocrine manifestations worsens prognosis.
J Pediatr Endocrinol Metab. ; (): –.
Le masse ovariche in età adolescenziale
[] E RN, B RE, S NC, S CC. A Retrospective
Review of the Effect of Surgeon Specialty on the Management of Benign and Malignant Pediatric and Adolescent Adnexal Masses. “Journal
of Pediatric and Adolescent Gynecology”. ; (): –.
[] S P T, M A, D D, P A, P P. Mucinous
cystadenoma of the ovary in perimenarchal girls. Pediatric Surgery International. ; (): –.
[] H C, F A. Adnexal torsion: a literature review. Eur J
Obstet Gynecol Reprod Biol. ; (): –.
[] G A, K M, S A. Conservative laparoscopic approach to
adnexal torsion. Arch Gynecol Obstet. ; (): –.
[] K MJ, K NY, L DY, Y BK, C D. Clinical characteristics of ovarian teratoma: age–focused retrospective analysis of cases. Am J Obstet Gynecol. ; (): e–.
[] O SC, F A, B R, H R, H B, G N. Cannot
exclude torsion a –year review. J Pediatr Surg. ; (): –; discussion
.
[] S D, S ZB, D M, M Z, D S. Torsion of malignant ovarian tumors in childhood and adolescence. J Pediatr Endocrinol Metab.
; (): –.
[] R V, M R, D AA, S F, E S, T E, et
al. Emergency management and conservative surgery of ovarian torsion in children:
a report of cases. J Pediatr Adolesc Gynecol. ; (): –.
[] A–H S, A–H H R, G A, E–S M. Fertility sparing surgery for ovarian tumors in children and young adults. Arch Gynecol Obstet. ; (): –.
[] M LR, R DD, E MI, S AT, B MC, Z A, et al. Accuracy of frozen–section analysis in the diagnosis
of ovarian tumors: a systematic quantitative review. Int J Gynecol Cancer.
; (): –.
[] B A, K RJ. Blaustein’s Pathology of the Female Genital Tract:
Springer; .
[] A A, L KL, L J, K S, G JT, A L. Ovarian
epithelial tumors of low malignant potential: a case series of adolescent patients.
J Pediatr Surg. ; (): –.
[] P D, P E, K D. Germ cell tumors of the ovary.
Cancer Treat Rev. ; (): –.
Capitolo V
Sintomatologia
La presenza di una lesione ovarica funzionale, neoplastica o di altra
natura è una condizione spesso asintomatica. Una lesione ovarica può
essere riscontrata accidentalmente come una massa addominale palpabile o durante un esame ecografico dell’addome. Nei restanti casi,
la sintomatologia delle masse ovariche è variabile e non rappresenta
un utile parametro per differenziare le forme maligne da quelle benigne. Il sintomo più comunemente riscontrato è il dolore addominale,
acuto o cronico. In alcuni casi si possono riscontrare anche sintomi
secondari e anomalie ormonali derivanti dall’attività endocrina della
massa ovarica [–]
.. Dolore addominale acuto
In presenza di dolore addominale acuto, è innanzitutto necessario
distinguere tra una affezione gastro–intestinale o ovarica ed in particolare una torsione. La principale diagnosi differenziale in età pediatrica
deve essere fatta con l’appendicite acuta. In quest’ultimo caso si riscontra all’esordio un dolore addominale che migra dalla regione
epigastrica verso il quadrante inferiore destro, al contrario, in caso di
torsione ovarica l’esordio del dolore è tipicamente a livello pelvico,
improvviso e severo []. Nella diagnosi di appendicite, si provoca dolore con la palpazione profonda nella sede appendicolare in fossa iliaca
destra (punto di Mac Burney) ed è importante rilevare la positività
del segno di Blumberg e di Rovsing. Sintomi associati comuni sono
rappresentati dalla nausea, dal vomito e dalla presenza di leucocitosi.
L’invaginazione intestinale è la seconda causa più comune di dolore
addominale acuto nei bambini. Il dolore da invaginazione intestinale
è tipicamente colico, intermittente e severo; flettere le gambe sull’addome diventa doloroso per tali pazienti ed essi diventano letargici
Le masse ovariche in età adolescenziale
quando tale dolore recede. Altra causa di dolore addominale acuto
è la presenza di malrotazione intestinale con una possibile un’ostruzione acuta, uno dei principali sintomi associati è il vomito biliare. Il
diverticolo di Meckel è la più comune anomalia congenita del tratto
gastrointestinale. Esso può rimanere asintomatico per tutta la vita,
oppure manifestarsi clinicamente con sanguinamento rettale, ostruzione intestinale (dolore addominale acuto) o raramente perforazione.
Altre possibili cause di dolore addominale acuto in pazienti pediatrici
possono essere: le infezioni (endometrite, pelvic inflammatory disease),
l’endometriosi, la gravidanza ectopica o il cosiddetto “mittleschmerz”,
termine che indica il dolore in corso di ovulazione. In alcuni casi tale
dolore è particolarmente severo e può persistere per – giorni; si
ritiene che sia legato all’irritazione peritoneale per la fuoriuscita del
normale liquido follicolare al momento della rottura del follicolo e
dell’espulsione dell’ovocita [–].
.. Dolore addominale ricorrente
In caso di torsioni ovariche intermittenti con risoluzioni spontanee, la
paziente può riferire dolore addominale di tipo ricorrente. Tale quadro
comunque può evolvere verso una torsione ovarica irreversibile.
.. Dolore addominale cronico
In presenza di lesioni ovariche, si parla più propriamente di dolore
pelvico cronico che, secondo l’American College of Obstetricians
and Gynecologists, rappresenta un dolore non ciclico della durata
di almeno mesi oppure un dolore ciclico della durata di almeno
mesi; in entrambi i casi viene ostacolato il normale svolgimento delle
attività quotidiane [].
All’esame clinico devono essere valutate attentamente le caratteristiche del dolore: la severità, la durata, la relazione con il ciclo mestruale
(ciclico o non ciclico), i fattori che ne determinano il peggioramento
o l’attenuazione, la localizzazione. Alla giovane paziente viene inoltre
chiesto di identificare il dolore con una scala da a . In alcune adolescenti con dolore pelvico cronico, per una corretta diagnosi può essere
. Sintomatologia
indicata una laparoscopia esplorativa. Oltre alle affezioni ovariche, altre cause di dolore pelvico cronico possono essere: l’endometriosi, la
pelvic inflammatory disease, l’emoperitoneo, la sierosite, gli ascessi
tubo–ovarici e le cisti paratubariche.
.. Sintomi secondari
I principali sintomi associati alle masse ovariche in età pediatrica sono
rappresentati dalla anoressia, dalla nausea, dal vomito, dalla poliuria,
dall’urgenza minzionale e dall’incremento della circonferenza addominale, in caso di masse ovariche particolarmente voluminose. In rari
casi, si può verificare distress respiratorio, sub occlusione intestinale, schock emorragico per una emorragia intracistica o una rottura
intraperitoneale [–].
.. Alterazioni ormonali
È stata dimostrata la presenza di attività endocrina nel % delle lesioni ovariche sia neoplastiche che non neoplastiche [–]. Cisti di
tipo follicolare possono secernere estrogeni e causare per questo un
precoce sviluppo sessuale nelle bambine pre–pubere, mentre cisti di
tipo luteale, prevalentemente post–menarcali, sono spesso associate a
modificazioni del ciclo mestruale per allungamento della fase luteale,
dovuto alla maggiore produzione di progesterone da parte della cisti.
Tumori maligni a cellule germinali possono essere associati a pubertà precoce come risultato della produzione di βhCG e estrogeno.
Tumori maligni dello stroma e dei cordoni sessuali (neoplasie a cellule della granulosa giovanili, carcinoma embrionale, poliembrioma)
possono produrre estrogeni e neoplasie femminilizzanti — oppure
possono secernere androgeni — neoplasie virilizzanti —, come nei
tumori di Sertoli–Leydig.
Nel caso in cui tali neoplasie siano femminilizzanti, esse possono produrre aumento del volume mammario, aumento della peluria pubica e sanguinamenti vaginali; nel caso in cui siano virilizzanti, si può verificare: irsutismo, oligomenorrea, amenorrea, asimme-
Le masse ovariche in età adolescenziale
tria delle dimensioni mammarie, abbassamento della voce, alopecia
androgenetica (calvizie), acne e aumento del volume clitorideo.
. Sintomatologia
Referenze
[] K YA, L JA, K S, A L. Characteristics and management
of adnexal masses in a canadian pediatric and adolescent population. J Obstet
Gynaecol Can. ; (): –.
[] I S, Y SZ, G JR. Management and outcomes of ovarian
masses in children and adolescents. Am Surg. ; (): –.
[] Y JH, B J, B LS. Ovarian Pathology for the Pediatric Urologist.
Urology. ; (): –.
[] A DG, S N, F BS, T RV. The epidemiology of appendicitis and appendectomy in the United States. Am J Epidemiol. ; ():
–.
[] C A, E O, A H, O C, O G, E A, et al.
Long–term results of conservative management of adnexal torsion in children.
J Pediatr Surg. ; (): –.
[] O SC, F A, B R, H R, H B, G N. Pediatric ovarian malignancy presenting as ovarian torsion: incidence and relevance. J Pediatr Surg. ; (): –.
[] R V, M R, D AA, S F, E S, T E,
et al. Emergency management and conservative surgery of ovarian torsion in
children: a report of cases. J Pediatr Adolesc Gynecol. ; (): –.
[] A JT, D SE. Acute abdominal and pelvic pain. In: A A,
D L, editors. Pediatric, Adolescent and Young Adult Gynecology: John Wiley & Sons; . p. –.
[] E SJ, L MR. Emans, Laufer, Goldstein’s Pediatric and Adolescent
Gynecology. th ed: Lippincott Williams & Wilkins; .
[] S AR. Evaluating chronic pelvic pain. A consensus recommendation.
Pelvic Pain Expert Working Group. J Reprod Med. ; (): –.
[] N FR, S AA, Y G, N C, N C. Pelvic
pain, endometriosis, and the role of the gynecologist. In: A A, D
L, editors. Pediatric, Adolescent and Young Adult Gynecology: John Wiley & Sons; . p. –.
[] V A D, F ME. Ovarian tumors. In: C AG, C A, A NS, K TM, L JM, S R, editors. Pediatric Surgery. Philadelphia: Elsevier Health Sciences; . p.
–.
Le masse ovariche in età adolescenziale
[] A A, D L. Pediatric, Adolescent and Young Adult Gynecology: John Wiley & Sons; .
[] W Y, W W, X C, H X, Z L, K X, et al. Childhood
ovarian juvenile granulosa cell tumor: a retrospective study with cases including clinical features, pathologic results, and therapies. J Pediatr Hematol
Oncol. ; (): –.
[] O SC, G NM, B R, H B, F AC. Pediatric
ovarian malignancies: how efficacious are current staging practices? J Pediatr
Surg. ; (): –.
[] P D, P E, K D. Germ cell tumors of the ovary.
Cancer Treat Rev. ; (): –.
Capitolo VI
Diagnostica per immagini
.. Ecografia
L’indagine ecografica rappresenta il primo livello diagnostico nelle
affezioni ovariche in età pediatrica. Nella bambina le ovaie sono masserelle sferoidali, a margini netti, ecostrutturalmente solide e omogenee,
con diametro intorno ai – mm. Questo aspetto deriva dalla presenza della componente stromale, midollare e corticale, indistinguibili
a causa delle microscopiche dimensioni dei follicoli. In seguito, la
differenziazione tra corticale e midollare si fa sempre più netta con
la comparsa dei primi follicoli ecograficamente rilevabili, di circa –
mm. Con il tempo, le dimensioni ed il numero dei follicoli aumentano
ulteriormente e la componente stromale manifesta una vascolarizzazione sempre più evidente []. Pertanto, le costituenti ecografiche che
vanno sempre ricercate e valutate attentamente sono tre: follicolare,
stromale e vascolare.
L’indagine ecografica, con l’accertamento effettuato per via sovrapubica o in caso di adolescenti sessualmente attive anche con sonda
endovaginale, evidenzia il volume dell’ovaio, la sua morfologia e il
suo contorno.
Dal punto di vista fisiologico, il volume dell’ovaio varia con l’età
da meno di , cm nelle bambine sotto i due anni, a ,–, cm nelle
pazienti postpuberali. Inoltre, con l’età, si ha anche una variazione
della morfologia ovarica: nelle bambine sotto gli otto anni l’ovaio si
presenta generalmente solido, mentre con la pubertà lo spettro ultrasonografico della gonade vira verso l’aspetto cistico, parallelamente
all’attività ovulatoria che si instaura.
Da un punto di vista patologico, vanno analizzate con attenzione le
ovaie il cui volume supera la norma per il grado di sviluppo puberale e
Le masse ovariche in età adolescenziale
per età, ovaie con morfologia non sferoidale e con contorni irregolari
(fig. .).
Figura .. Ecografia ovaio destro normale in bambina di anni
Le cisti semplici, quasi invariabilmente associate a benignità e meritevoli di semplice osservazione, si distinguono in quanto presentano
morfologia approssimativamente sferica, parete sottile e contenuto
liquido perfettamente transonico (non corpuscolato). Un esempio di
cisti ovarica semplice è la cisti follicolare o funzionale: raramente oltre i
mm di diametro ed è sempre dimostrabile il parenchima ovarico da
cui origina. Essa di norma regredisce con la fase mestruale del ciclo
(fig. .).
Figura .. Ecografia: cisti semplice
. Diagnostica per immagini
Le cisti complesse, richiedono sempre un approfondimento
diagnostico. Esse sono caratterizzate da molti echi interni riferibili
a muco, pus o materiale ematico, grossolane travate interne (ipoecogene) riferibili a setti, calcificazioni o papille e contenuto misto
solido–liquido corpuscolato o meno. Appartiene a questa categoria
la cisti emorragica del corpo luteo, che può raggiungere oltre
mm di diametro, presenta contenuto liquido corpuscolato, con evidenti sepimenti ed il parenchima ovarico di origine è quasi sempre
riconoscibile. La cisti può scomparire durante la fase mestruale e
la sua rottura può causare emoperitoneo (liquido nello scavo di
Douglas e se il sanguinamento è cospicuo il liquido è rintracciabile
anche tra le anse intestinali e, progressivamente in sede periepatica
e perisplenica) [].
La cisti emorragica del corpo luteo può condurre a un dilemma
diagnostico, poiché la sua struttura ultrasonografica può presentarsi complessa o solida, nonostante la sua natura benigna. Balan
e coautori [] hanno documentato una paziente nella quale una
lesione ovarica appariva fortemente sospetta per malignità all’ecografia, ma che in realtà risultò essere una cisti emorragica del corpo
luteo (Hemorragic Corpus Luteum Cyst), dopo l’intervento chirurgico.
Nello studio di Spinelli e collaboratori [] il .% delle HCLC
analizzate si presentavano con struttura complessa, nonostante la
loro natura funzionale (fig. . e fig. .).
Figura .. Ecografia: cisti emorragica
Le masse ovariche in età adolescenziale
Figura .. Ecografia: cisti corpuscolata
Fra i tumori a cellule germinali, i teratomi maturi, si presentano
ecograficamente come una lesione cistica, uniloculare, con un nodulo
iperecogeno all’interno definito Nodulo di Rokitansky o dermoid
plug, che può contenere capelli, frammenti di osso o denti. All’interno
della massa altri tipici aspetti ecografici del teratoma maturo sono
rappresentati da lunghe linee e spot iperecogeni, corrispondenti a
peli che galleggiano liberamente nel liquido cistico (dermoid mesh),
da un sottile strato lievemente iperecogeno, dovuto alla presenza di
sebo che galleggia sopra il liquido sieroso cistico; dalla presenza di
coni d’ombra dovuti a componenti calcifiche, i quali spesso rendono
difficile o addirittura impossibile valutare correttamente le dimensioni
dei teratomi maturi [–].
I teratomi immaturi invece, presentano dimensioni maggiori, struttura complessa, foci adiposi sparsi e poche calcificazioni []. Secondo
Alotaibi e Navarro, [] la predominanza di una componente cistica
suggerisce la diagnosi di teratoma maturo, mentre una struttura prevalentemente solida o complessa suggerisce un teratoma immaturo.
Recentemente, Vaysse e collaboratori [] hanno proposto un cut–off
di . cm per differenziare le neoplasie germinali benigne da quelle
maligne. I disgerminomi, forma più comune di neoplasia ovarica
. Diagnostica per immagini
maligna in età pediatrica, si presentano all’indagine ecografica come
masse solide e lobulate per la presenza di sottili setti fibrovascolari
all’interno della massa tumorale. Spesso all’interno di queste lesioni
si rilevano calcificazioni o piccole cisti, che possono essere il risultato
di necrosi ed emorragie [–].
Nell’ambito dei tumori dello stroma e dei cordoni sessuali, i tumori
a cellule della granulosa rappresentano la forma più comune. L’aspetto
ecografico di quest’ultimi è estremamente variabile: possono presentarsi come masse solide, neoplasie con componenti emorragiche e
fibrotiche, o lesioni cistiche multiloculari. Tele eterogeneità è correlata alla presenza di emorragia intratumorale, infarto, degenerazione
fibrosa e irregolare rigenerazione cellulare. Anche i fibromi sono caratterizzati da un variabile aspetto ecografico e ciò dipende dalla quantità
di tessuto fibroso che contengono. I tumori a cellule di Sertoli–Leydig
si presentano come masse solide, prevalentemente ipoecogene [].
Tra i tumori epiteliali, i più comuni sono sierosi e mucinosi. I cistadenomi sierosi si presentano ultrasonograficamente come masse
cistiche uniloculari o multiloculari con setti sottili. I cistadenomi mucinosi sono tipicamente di notevoli dimensioni, cistici, multiloculari con
setti sottili e cavità contenenti liquido all’interno della lesione. I cistadenofibromi sierosi sono rare masse cistiche, benigne, caratterizzate
da stroma fibroso (solido) all’interno della lesione.
In presenza di torsione ovarica, l’ecografia consente di verificare
se la lesione è insorta su un ovaio sano, oppure se è complicanza di
una lesione ovarica preesistente. Il segno ecografico più frequente
in caso di torsione su un ovaio non patologico è l’aumento volumetrico dell’organo a causa dell’edema e della congestione venosa [].
L’ingrandimento può essere così importante da far assumere all’ovaio colpito dimensioni dieci volte maggiori rispetto al controlaterale
[–]. Nel –% dei casi si evidenziano piccole cisti, distribuite
alla periferia dell’ovaio,causate dall’incremento del contenuto fluido
nei follicoli periferici conseguentemente alla stasi linfatica e venosa.
L’immagine ecografica del peduncolo avvolto su se stesso (“a spirale”) può essere ben visibile negli adulti ma raramente rilevabile in
età pediatrica []. Mediante l’indagine ecografica è inoltre possibile
valutare la presenza di eventuali raccolte liquide in addome o nel cavo
del Douglas (segno tardivo, frequentemente associato a emorragia del
tessuto ovarico e a grave compromissione ischemica di quest’ultimo)
Le masse ovariche in età adolescenziale
[]. In caso di torsione su ovaio patologico, la lesione potrà apparire
cistica, complessa o solida all’ecografia. L’osservazione di una massa
complessa o solida è associata a un rischio maggiore di malignità [].
A parte sono considerate le cisti emorragiche del corpo luteo associate
a torsione, che, nonostante la loro immagine ecografica complessa o
solida, sono di natura funzionale.
.. Ecocolor doppler
L’utilizzo dell’ecocolor doppler può essere di aiuto nella diagnosi di
torsione ovarica, ma il suo ruolo di strumento diagnostico rimane
attualmente controverso: se infatti la valutazione di un assente flusso
ematico in direzione dell’ovaio suggerisce la diagnosi di torsione, la
presenza di flusso non la esclude [].
Questa metodica consente di visualizzare sia il flusso venoso sia
quello arterioso. La mancanza di flusso venoso è sicuramente più
frequente rispetto a quella arteriosa, infatti le arterie, oltre ad avere una
pressione maggiore e quindi a essere meno facilmente comprimibili,
hanno una duplice origine: arteria ovarica e ramo ovarico dell’arteria
uterina. In caso di torsione ovarica intermittente, con risoluzione
spontanea, lo studio mediante doppler darà immagini diverse in base
al momento in cui questo viene eseguito []. Tuttavia, in assenza di
flusso sia arterioso che venoso la probabilità di torsione è molto alta
[–]. Alcuni autori riportano una bassa specificità e sensibilità del
color doppler come strumento di diagnosi. Tuttavia, tali studi non
trattano esclusivamente casi pediatrici e ciò può creare imprecisione
nei risultati.
.. Ueland index e ovarian crescent sign (OCS)
Per classificare e distinguere i tumori pediatrici benigni da quelli maligni, sono stati introdotti due sistemi di punteggio basati su reperti
ultrasonografici (ultrasonographic scoring system). Il primo è l’ Ueland Index è calcolato a partire da volume del tumore e dalla sua
struttura ecografica e ha un cut–off < per le lesioni benigne e ≥
per quelle maligne []. Il secondo l’Ovarian Crescent Sign (OCS) o
. Diagnostica per immagini
“segno della mezza luna ovarica” misura, invece, la quantità di tessuto
ovarico sano adiacente alla cisti ed è per questo un buon indicatore di
benignità, soprattutto nelle bambine postmenarcali [].
.. Tomografia computerizzata (TC)
La tomografia computerizzata (TC) può contribuire alla valutazione
diagnostica delle masse ovariche tramite la definizione delle caratteristiche della parete, del contenuto intracavitario e dell’identificazione
precisa della struttura di provenienza. In particolare, tale strumento
diagnostico può risultare utile quando all’ecografia non può essere
stabilita l’origine della massa pelvica o quando è necessario valutare
l’estensione pelvica ed extra–pelvica della lesione. La TC è inoltre
particolarmente utile nella ricerca delle lesioni metastatiche.
Alla TC le neoplasie benigne si presentano come masse ripiene di
liquido con componenti di tessuto adiposo, emorragia e calcificazioni
(fig. . e .), mentre le neoplasie maligne sono caratterizzate da maggiori dimensioni e struttura prevalentemente solida, con occasionali
aree cistiche e grossolane calcificazioni.
Figura .. TC assiale: cisti semplice
Le masse ovariche in età adolescenziale
Figura .. TC assiale:cisti emorragica
Nell’ambito dei tumori a cellule germinali, i teratomi maturi presentano alla TC una caratteristica patognomonica: la presenza di grasso intratumorale consistente in tessuto adiposo — a livello della parete
cistica o del nodulo di Rokitansky — o in sebo contenuto nel lume
cistico. La presenza di componenti calcifiche all’interno del nodulo
di Rokitansky incrementa il sospetto di teratoma maturo alla TC. In
quest ultimo, infatti, le calcificazioni hanno una distribuzione focale e
una forma curvilinea, mentre nel teratoma immaturo, le calcificazioni
sono disperse all’interno della massa.
Dal momento che la diagnosi di teratomi benigni si basa principalmente sull’identificazione delle componenti adiposa e calcifica, la
TC può fornire dati fondamentali per la diagnosi differenziale [] (Fig.
.).
I teratomi immaturi, così come i disgerminomi, si presentano alla
TC prevalentemente come masse solide o miste. Nei disgerminomi si
possono riscontrare calcificazioni “a chiazze”; tipicamente tali tumori
si presentano come masse solide multilobulate con importanti setti
fibrovascolari; le aree a bassa intensità corrispondono a foci necrotici
o emorragici.
I tumori del sacco vitellino (yolk sac tumors) si presentano come
masse complesse, di notevoli dimensioni, che contengono componenti solide e cistiche []. Per quanto riguarda le neoplasie dello stroma
. Diagnostica per immagini
e dei cordoni sessuali, i tumori a cellule della granulosa alla TC, così
come all’ecografia, sono caratterizzati da un’estrema variabilità di
immagini: masse solide, neoplasie con componenti emorragiche e
fibrotiche o lesioni cistiche multiloculari.
Figura .. Immagine TC assiale, coronale e sagittale di teratoma in bambina di
anni. Sono evidenti le calcificazioni intralesionali
I fibromi, poiché costituiti da abbondante collagene e tessuto fibroso, si presentano alla TC come masse solide omogenee. All’interno
della lesione si possono riscontrare dense calcificazioni e aree sparse
di intensità aumentata, indicanti edema o degenerazione cistica. Una
ridotta intensità di segnale a livello della lesione, può indurre il sospetto di torsione ovarica; in tal caso può associarsi la presenza di ascite
nel –% dei casi [].
I tumori stromali sclerosanti appaiono alla TC come una massa
di grosse dimensioni con componenti cistiche iperintense. Infine, i
tumori di Sertoli–Leydig sono diagnosticabili alla TC come una massa
solida ben definita, con cavità cistiche intratumorali [].
Nell’ambito dei tumori epiteliali, i cistadenomi si presentano alla
TC come masse cistiche, uni o multiloculari, con sottili setti; i cistadenofibromi, sempre di natura benigna come i precedenti, appaiono
alla TC come masse puramente cistiche o complesse, quest’ultime
associate a componenti solide (nodulari o trabecolari) che possono
occasionalmente determinare un risultato falsamente positivo per
malignità; [] infine, i cistadenocarcinomi, di natura maligna, sono
diagnosticati alla TC prevalentemente come lesioni solide o miste. La
TC può incidentalmente diagnosticare una torsione ovarica in bam-
Le masse ovariche in età adolescenziale
bine con dolore addominale (o pelvico) o con massa palpabile; in tal
caso i reperti TC sono meno specifici di quelli ultrasonografici, ma
possono mostrare un ovaio ingrandito con follicoli periferici [].
.. Risonanza magnetica nucleare (RMN)
La Risonanza Magnetica (RM) è da preferirsi alla TC nello studio delle
giovani pazienti poiché non espone a radiazioni ionizzanti. La RM
può confermare la natura cistica di lesioni ovariche (Fig. .).
Figura .. Immagine RM cisti semplice assiale, sagittale e coronale
Il principale valore aggiunto della metodica è però quello di evidenziare con certezza la presenza di grasso o di sangue all’interno delle
lesioni ovariche e, dopo somministrazione di mezzo di contrasto, di
definirne meglio la vascolarizzazione.
La RM è determinante nella differenziazione di masse benigne
(residui adiposi e aumentata intensità di segnale nelle immagini T–
pesate) e maligne (masse cistiche con componenti solide) []. Tuttavia
la RM, così come la TC, va integrata con i risultati di ulteriori indagini
diagnostiche, quali la valutazione dei marcatori tumorali.
Nell’ambito dei tumori a cellule germinali, la RM mette in evidenza, nei teratomi maturi, i depositi adiposi intratumorali, dato che il
tessuto adiposo determina un segnale a elevata intensità nelle immagini T–pesate, mentre i teratomi immaturi e i disgerminomi si differenziano per la loro struttura prevalentemente solida e le maggiori
dimensioni (Fig. . e .).
Per quanto riguarda i tumori dello stroma e dei cordoni sessuali,
le neoplasie a cellule della granulosa si distinguono alla RM, così
. Diagnostica per immagini
Figura .. Teratoma in ragazza di anni immagini RM assiale, coronale e
sagittale
Figura .. RM assiale, sagittale e coronale. Nodulo di Rokitanski in una ragazza
di anni
come all’US e alla TC, per la loro notevole eterogeneità. Nei fibromi
l’abbondante quantità di tessuto fibroso determina un segnale a bassa
intensità nelle immagini T e T–pesate. Tali lesioni possono causare
torsione ovarica e la scoperta, nell’ambito del fibroma, di aree con
segnale ad elevata intensità nelle immagini T–pesate può aiutare nella
diagnosi di infarto emorragico e quindi di probabile torsione ovarica.
I tumori stromali sclerosanti si presentano alla RM come masse
solide eterogenee, con aree a intensità variabile nelle immagini T–
pesate. Si può rilevare la presenza di uno spesso margine periferico,
ipointenso nelle immagini T–pesate, determinato dalla compressione della corteccia ovarica, dovuta al lento accrescimento tumorale.
Inoltre, nelle immagini con mezzo di contrasto, i tumori stromali
sclerosanti presentano una precoce captazione di segnale a livello periferico, con progressione centripeta: ciò riflette la presenza di aree
cellulari periferiche vascolarizzate e di un’area più interna ricca di tes-
Le masse ovariche in età adolescenziale
suto collagene e povera di cellule. Queste caratteristiche risultano utili
per la diagnosi differenziale tra tumori stromali sclerosanti e fibromi.
I tumori di Sertoli–Leydig sono caratterizzati alla RM da masse
ipointense con multiple cavità cistiche di varie dimensioni. Il segnale
a bassa intensità nelle immagini T–pesate dipende dalla presenza di
stroma fibroso in tali neoplasie [].
Tra i tumori epiteliali, i cistadenomi sono diagnosticati alla RM
come masse cistiche uni o multiloculari. Nei cistadenofibromi, le
componenti solide presenti all’interno della lesione, si manifestano
tipicamente con un segnale ad intensità molto bassa nelle immagini T–pesate []. I cistadenocarcinomi si presentano come lesioni
solide o miste. In molti casi, i tumori epiteliali non possono essere
differenziati sulla base delle immagini ricavate dalla RM, TC o US.
Un tumore che si presenta alla RM come massa cistica uni o multiloculare, con omogeneo segnale a livello delle cavità cistiche, sottile e
regolare parete e senza vegetazioni endo/esocistiche, è considerato
un cistadenoma sieroso (benigno). Una massa che si presenta invece
come lesione cistica multiloculare, con una sottile e regolare parete,
senza vegetazioni endo/esocistiche, ma con cavità ripiene di fluidi che
determinano un segnale variabile nelle immagini–RM, è considerata
un cistadenoma mucinoso (benigno).
I principali reperti RM che differenziano le forme epiteliali benigne
da quelle maligne sono i seguenti: massa cistica, con parete sottile
(< mm) e senza proiezioni papillari, nel caso di lesione benigna;
massa con abbondante tessuto molle, corrispondente ad aree di necrosi, parete spessa (> mm), proiezioni papillari, calcificazioni interne,
bilateralità e diffusione peritoneale, in caso di lesione maligna [].
. Diagnostica per immagini
Referenze
[] N A, N J. Lo studio ecografico delle pelvi e della mammella in
età pediatrica e adolescenziale. In: B V, D M, editors. Ginecologia dal
periodo neonatale all’età evolutiva. Firenze: SEE Editrice; . p. –.
[] B P. Ultrasonography, computed tomography and magnetic resonance
imaging in the assessment of pelvic pathology. Eur J Radiol. ; (): –
.
[] S C, D G M, M N, M F. Hemorrhagic corpus
luteum cysts: an unusual problem for pediatric surgeons. J Pediatr Adolesc
Gynecol. ; (): –.
[] S C, D G M, C M, M N. Functional ovarian lesions in
children and adolescents: when to remove them. Gynecol Endocrinol. ;
(): –.
[] E M, C KR, C N, S S. Imaging of pediatric
ovarian neoplasms. Pediatric Radiology. ; (): –.
[] A MO, N OM. Imaging of ovarian teratomas in children: a
–year review. Can Assoc Radiol J. ; (): –.
[] V C, D M, C L, B O, C S, L
F, et al. Ovarian germ cell tumors in children. Management, survival and
ovarian prognosis. A report of cases. “Journal of Pediatric Surgery”. ;
(): –.
[] M R, R V, D AA, S F, J F, N–
F C. Serous and seromucinous infantile ovarian cystadenomas–a study
of cases. Eur J Obstet Gynecol Reprod Biol. ; (): –.
[] S S, E M. Imaging. In: A A, D L, editors. Pediatric, Adolescent and Young Adult Gynecology: John Wiley & Sons;
. p. –.
[] L LE, D R, N LN, B LL, O’H S M, H
PJ, et al. US findings of adnexal torsion in children and adolescents: size really
does matter. Pediatr Radiol. ; (): –.
[] S S, Z D, L MR, F N, C JS. Sonographic
findings of ovarian torsion in children. Pediatr Radiol. ; (): –.
[] S LL, A RF, K RL. Preoperative sonographic and
clinical characteristics as predictors of ovarian torsion. J Ultrasound Med.
; (): –.
Le masse ovariche in età adolescenziale
[] G P, C L, D M, B Q, L F, L
M A, et al. Ovarian torsion. Management and ovarian prognosis: a
report of cases. J Pediatr Surg. ; (): –.
[] O SC, G N, B R, H R, H B, F A. Can
we preoperatively risk stratify ovarian masses for malignancy? J Pediatr Surg.
; (): –.
[] G A, K M, S A. Conservative laparoscopic approach to
adnexal torsion. Arch Gynecol Obstet. ; (): –.
[] H PJ, M JS, S A. Ultrasound of a torsed ovary: characteristic gray–scale appearance despite normal arterial and venous flow on Doppler.
Pediatr Radiol. ; (): –.
[] N K, D M, F S, W B, B R, W Z.
Doppler studies of the ovarian venous blood flow in the diagnosis of adnexal
torsion. J Clin Ultrasound. ; (): –.
[] B–A M, P Y, H S. The effectiveness of spectral and color
Doppler in predicting ovarian torsion. A prospective study. Eur J Obstet Gynecol Reprod Biol. ; (): –.
[] A F, H UM. Ovarian and adnexal torsion: spectrum of sonographic findings with pathologic correlation. J Ultrasound Med. ; ():
–.
[] S ZB, D MK, S D, L BJ, D S, S
K, et al. Pre–operative differentiation of pediatric ovarian tumors: morphological scoring system and tumor markers. J Pediatr Endocrinol Metab. ;
(): –.
[] S ZB, B A, D MK, S D. Value of ultrasonographic detection of normal ovarian tissue in the differential diagnosis of adnexal masses in pediatric patients. Ultrasound in Obstetrics and Gynecology. ; (): –.
[] J SE, L JM, R SE, B JY, J JI, H ST. CT and MR imaging of ovarian tumors with emphasis on differential diagnosis. Radiographics.
; (): –.
[] V A D, F ME. Ovarian tumors. In: C AG, C A,
A NS, K TM, L JM, S R, editors. Pediatric
Surgery. Philadelphia: Elsevier Health Sciences; . p. –.
[] J SE, R SE, L JM, P SY, O SN, C KS, et al. CT and MRI
findings of sex cord–stromal tumor of the ovary. AJR Am J Roentgenol. ;
(): –.
. Diagnostica per immagini
[] C SM, B JY, R SE, J SE, P GS, K BK, et al. CT and MRI
findings of cystadenofibromas of the ovary. Eur Radiol. ; (): –.
[] E SJ, L MR. Emans, Laufer, Goldstein’s Pediatric and Adolescent
Gynecology. th ed: Lippincott Williams & Wilkins; .
Capitolo VII
I marcatori tumorali
In età pediatrica, i marcatori tumorali rappresentano uno strumento
diagnostico utile per differenziare le diverse lesioni ovariche e per
scegliere il più appropriato approccio chirurgico, ponendo come finalità quella di preservare la fertilità delle giovani pazienti. Il loro ruolo
nella patologia ovarica rimane però controverso e per questo motivo
è consigliabile associare sempre una valutazione clinica, ultrasonografica ed eventualmente un’analisi istopatologica intraoperatoria per
ottenere una diagnosi più accurata.
Nell’ambito delle lesioni neoplastiche dell’ovaio, ciascun istotipo
è correlato a differenti marcatori tumorali: i tumori a cellule germinali possono presentare elevati valori sierici di AFP, β–hCG, CA ,
LDH, CEA, CA .; i tumori epiteliali possono essere caratterizzati da elevazione di AFP, β–hCG, CA , CEA e CA .; i tumori
dello stroma e dei cordoni sessuali possono essere associati ad elevati livelli di AFP, CA , LDH, CEA e Inibina (Fig. .). I livelli dei
marcatori tumorali sono misurati con dosaggi sierici o con colorazione immunoistochimica di cellule tumorali fissate con paraffina o
congelate.
.. Marcatori tumorali
... Alfafetoproteina (AFP)
Nell’embriogenesi il sacco vitellino è il principale produttore di AFP,
per questo tale marcatore presenta valori elevati soprattutto nei tumori
del seno endodermico (yolk sac tumor) [–].
Dalla nascita fino al primo anno di vita, i valori dell’AFP sono
altamente variabili: le massime concentrazioni di AFP sono riscontrabili tra la dodicesima e la quindicesima settimana di gestazione;
Le masse ovariche in età adolescenziale
Figura .. Marcatori tumorali ovarici. Asse x: marcatori tumorali; asse y: % di
probabilità che un marcatore sia elevato (diagnostico) in ciascun tipo di massa
ovarica
AFP risulta solitamente elevata nei neonati e ritorna ai normali livelli
riscontrati negli adulti ( mg/mL) a partire dagli mesi di età. Per
questa ragione, l’utilità di tale marcatore nella diagnosi dei tumori del
seno endodermico è limitata nel primo anno di vita, in particolare nel
primo mese.
L’emivita dell’AFP è compresa tra e giorni. Monitorare i livelli sierici postoperatori di AFP è importante per determinare la
radicalità della resezione del tumore e per individuare precocemente
eventuali recidive [–]. AFP si presenta elevata anche in patologie
maligne del tratto gastrointestinale e del fegato, inoltre nelle epatiti, nell’ipotiroidismo, nell’atassia–teleangectasia e nella tirosinemia
ereditaria.
... Gonadotropina corionica umana (β–hCG)
La gonadotropina corionica umana è una glicoproteina prodotta principalmente dalla placenta, in particolare dal sincizio trofoblasto placentare.
Tale glicoproteina è costituita da due catene polipeptidiche, subunità alfa e
beta, che ricordano la struttura delle gonadotropine corioniche; la subuni-
. I marcatori tumorali
tà β può essere dosata in maniera attendibile ed è per questo la subunità
di riferimento []. Valori elevati di β–hCG in un paziente pediatrico
con un tumore a cellule germinali suggerisce la presenza di cellule di
sincizio trofoblasto come nel caso di disgerminoma, di coriocarcinoma e,
occasionalmente, di carcinoma embrionale.
In particolare, elevazioni maggiori di ng/ml sono inusuali e, se
presenti, indicano una diagnosi di coriocarcinoma. A differenza dell’AFP,
β–hCG ha un’emivita più breve pari a – ore. La sua rapida riduzione
è segno di una completa rimozione della neoplasia [] Altri tumori
in cui si può riscontrare valori elevati β–hCG sono l’epatocarcinoma,
l’epatoblastoma ed il germinoma della ghiandola pineale.
... Lattico deidrogenasi sierica (LDH)
La lattico deidrogenasi sierica è un marcatore tumorale aspecifico e per
questo di limitata utilità nel valutare il tipo istologico o la risposta al
trattamento di una neoplasia ovarica. Tuttavia valori aumentati di LDH
possono indicare un elevato turnover cellulare e possono essere utilizzati
come indicatori aspecifici di malignità []. In particolare, il disgerminoma
può presentare un aumento dei livelli sierici di LDH.
... CA
CA è il miglior marcatore disponibile per i tumori epiteliali dell’ovaio,
sebbene possieda una ridotta sensibilità e specificità per lesioni allo stadio
I. Livelli di CA maggiori di U/ml possono indicare tumori maligni
o borderline, tuttavia tale marcatore può aumentare anche in patologie di
natura benigna come nell’endometriosi, nei miomi uterini, nella salpingite (acuta o cronica) e nella patologia infiammatoria pelvica []. Una
revisione di pazienti pediatrici con tumori epiteliali ovarici, [] ha rilevato
una bassa specificità e sensibilità del CA nella diagnosi di malignità in
età premenarcale.
.. Marcatori tumorali e masse ovariche
È interessante sottolineare che in letteratura sono stati riscontrati
valori elevati di marcatori tumorali non solo nelle lesioni ovariche
Le masse ovariche in età adolescenziale
maligne, ma anche in circa il .% di quelle benigne. In particolare, si
possono verificare aumenti di AFP, CA e LDH nei teratomi maturi,
CA in caso di cistadenoma e Fosfatasi Alcalina Placentare (PLAP) in
caso di fibroma (Fig. .). È anche per questo che il ruolo dei marcatori
tumorali nella patologia ovarica pediatrica rimane controverso.
Si possono riscontrare valori aumentati di marcatori tumorali anche
in presenza di torsione ovarica associata prevalentemente a lesioni
di natura benigna, come teratomi maturi o cisti funzionali [–].
Nella letteratura medica sono stati documentati finora nove casi di
marcatori aumentati in torsione ovarica associata a lesioni benigne o
ad assenza di patologia: Savic e coautori [–] hanno descritto una
cisti paraovarica, tumori benigni e ovaie normali correlate a CA
elevato; McCarthy e coautori [] hanno riportato un ovaio normale
associato ad elevazione di CA . L’elevazione dei marcatori tumorali
in presenza di torsione è probabilmente da ricercarsi nell’ischemia e
nella possibile necrosi tissutale, che determinano appunto rilascio di
marcatori.
Nei pazienti con marcatori elevati, è importante eseguire un’accurata analisi anatomopatologica per escludere la presenza di microscopici
foci di yolk sac tumor all’interno della massa neoplastica. È stato infatti
documentato dagli studi del Children’s Oncology Group (COG) che
tali foci di yolk sac tumor possono essere associati a teratomi prevalentemente di grado o (%), ma perfino di grado (%), causando
così un aumento di AFP.
Per scegliere il più adeguato trattamento chirurgico di masse ovariche (miste o solide) in età pediatrica, Jordan e coautori [] suggeriscono
di associare alla valutazione dei marcatori tumorali lo studio delle
dimensioni tumorali e dei referti ecografici.
La completa escissione della massa con conservazione della gonade
è giustificata in lesioni ovariche con diametro < cm, senza evidenza di
pubertà precoce e con normali livelli di marcatori tumorali. È invece
consigliata una ovariectomia in caso di masse > cm, con elevati
marcatori, con o senza evidenza di malignità.
Concludendo, secondo la recente letteratura [], la percentuale
di probabilità che essi siano diagnostici nelle masse ovariche di età
pediatrica è del .% (Fig. .).
Per questo motivo, un incremento dei marcatori non dovrebbe
guidare a priori verso un trattamento chirurgico radicale ma un ap-
. I marcatori tumorali
proccio conservativo dovrebbe essere preso in considerazione anche
in presenza di lesioni ovariche con marcatori aumentati.
Figura .. L’andamento della probabilità che i marcatori tumorali siano diagnostici per neoplasie benigne o maligne è gaussiano. Il valore medio di tale probabilità
è .%, come indicate sull’asse x []
Le masse ovariche in età adolescenziale
Referenze
[] A J FE, A G AA, G T, A D SA, R J, R MS. Ovarian tumors in children and adolescents–a clinical study of
patients in a university hospital. J Pediatr Adolesc Gynecol. ; (): –
.
[] O SC, G N, B R, H R, H B, F A. Can
we preoperatively risk stratify ovarian masses for malignancy? J Pediatr Surg.
; (): –.
[] S C, D G M, C M, M N. Functional ovarian lesions in
children and adolescents: when to remove them. Gynecol Endocrinol. ;
(): –.
[] S S, B H. Surgery of ovarian tumors in children. Horm Res
Paediatr. ; (): –.
[] R EM, S AK, S W, S E, H ME. Pediatric ovarian tumors–dilemmas in diagnosis and management. Eur J Pediatr Surg. ; (): –.
[] S ZB, D MK, S D, L BJ, D S, S
K, et al. Pre–operative differentiation of pediatric ovarian tumors: morphological scoring system and tumor markers. J Pediatr Endocrinol Metab. ;
(): –.
[] H–J A. Surgical management of the incidentally identified ovarian
mass. Semin Pediatr Surg. ; (): –.
[] A D. Malignant lesions of the ovary in childhood. Semin Pediatr
Surg. ; (): –.
[] P D, P E, K D. Germ cell tumors of the ovary.
Cancer Treat Rev. ; (): –.
[] K N, S C. Juvenile ovarian granulosa cell tumor: a benign or
malignant condition? Gynecol Endocrinol. ; (): –.
[] S C, P V, B I, L J, M A, B F, et al.
The Role of Tumor Markers in the Surgical Approach of Ovarian Masses in
Pediatric Age: A –Year Study and a Literature Review. Ann Surg Oncol.
; –.
[] V A D, F ME. Ovarian tumors. In: Coran AG, C
A, A NS, K TM, L JM, S R, editors. Pediatric Surgery. Philadelphia: Elsevier Health Sciences; . p. –.
. I marcatori tumorali
[] P E, F M. The female reproductive system. In: S
JT, D LP, editors. Pediatric Pathology. nd ed. Philadelphia:
Lippincott Williams & Wilkins; . p. –.
[] O J, S S. Biologic markers in pediatric solid tumors. In:
P PA, P DG, editors. Principles and Practice of Pediatric Oncology. nd ed. Philadelphia: Lippincott Williams & Wilkins; . p.
–.
[] MC JD, E KM, S YR, Q EH. Premenarchal
ovarian torsion and elevated CA–. J Pediatr Adolesc Gynecol. ;
(): e–.
[] S Z, D S, D M, J D, V M. Epithelial ovarian tumors and CA in premenarchal girls. Eur J Gynaecol
Oncol. ; (): –.
[] M M, H D, A D. Epithelial ovarian tumors
in children: a retrospective analysis. J Pediatr Surg. ; (): –;
discussion –.
[] S KA, S SF, M Y, N JP, S ME. Pediatric ovarian tumors: a review of cases. Pediatr Blood Cancer. ;
(): –.
[] P C, C J, K E, P A, C P, A J,
et al. Ovarian germ cell tumours: a –year study in a single unit. Eur J
Pediatr Surg. ; (): –.
[] D B A, M GC, O JW, H–C
FG, H FW. Ovarian germ cell tumors in children: a clinical
study of patients. Pediatr Blood Cancer. ; (): –.
[] K B, T YJ, Z WW, Q YJ. A pure nongestational ovarian
choriocarcinoma in a –year–old girl: case report and literature review. J
Obstet Gynaecol Res. ; (): –.
[] T Y, K H, M T, J K, O H. A case of pediatric ovarian dysgerminoma associated with high serum levels and positive immunohistochemical staining of neuron–specific enolase. J Pediatr
Surg. ; (): –.
[] A A, L KL, L J, K S, G JT, A L. Ovarian epithelial tumors of low malignant potential: a case series of adolescent patients. J Pediatr Surg. ; (): –.
[] S DT. Ovarian Sex Cord–Stromal Tumors in Children and
Adolescents. “Journal of Clinical Oncology”. ; (): –.
Le masse ovariche in età adolescenziale
[] H C, F A. Adnexal torsion: a literature review. Eur J
Obstet Gynecol Reprod Biol. ; (): –.
[] S D, S ZB, D M, M Z, D S. Torsion of
malignant ovarian tumors in childhood and adolescence. J Pediatr Endocrinol
Metab. ; (): –.
[] C B, G R, A A, C L, C J, H E, et al.
Surgical resection alone is effective treatment for ovarian immature teratoma
in children and adolescents: a report of the pediatric oncology group and the
children’s cancer group. Am J Obstet Gynecol. ; (): –.
[] M NM, C B, G R, C L, L SJ, A A, et
al. Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology
Group/Children’s Cancer Group Intergroup Study. J Clin Oncol. ;
(): –.
Capitolo VIII
Trattamento chirurgico
L’obiettivo principale del trattamento chirurgico delle masse ovariche in età pediatrica è quello di preservare quanto più possibile la
funzione della gonade e quindi la futura fertilità. Per questa ragione, nella letteratura scientifica, la tendenza è verso una chirurgia
più conservativa mediante un approccio laparoscopico [].
Tuttavia, la laparotomia rimane l’approccio chirurgico di scelta
nei casi in cui il rischio di malignità è alto. Infatti, essa facilita la
rimozione della neoplasia nella sua interezza, evitando lo “spillage”
in cavità peritoneale [].
Il chirurgo può confrontarsi con due situazioni cliniche completamente diverse, una in urgenza ed una in elezione. La prima, con
una paziente con un dolore addominale acuto ed una massa pelvica
— per una possibile complicanza in atto come una torsione, una rottura o un’emorragia —; la seconda, con una paziente asintomatica
o con dolore di tipo cronico e massa ovarica.
.. Trattamento chirurgico in elezione
... Lesioni ovariche funzionali
Le cisti funzionali sono generalmente benigne e asintomatiche e si
caratterizzano per la loro tendenza a risolversi spontaneamente. Data
la loro natura, si presentano principalmente nel periodo neoanatale
e puberale, raramente nell’intervallo tra la nascita e la pubertà []. Il
trattamento chirurgico è limitato alle lesioni di notevoli dimensioni o
sintomatici.
Le masse ovariche in età adolescenziale
Cisti follicolari
La dimensione della cisti è il principale fattore che influenza la scelta
del trattamento chirurgico. Le cisti semplici, indipendentemente dalle dimensioni, vanno frequentemente incontro nella maggior parte
dei casi a regressione spontanea. Le cisti con diametro > cm. sono
a rischio di torsione e possono essere associate a segni di pubertà
precoce.
Le cisti ovariche diagnosticate in periodo prenatale si risolvono
generalmente entro il primo anno di vita per la progressiva riduzione della stimolazione ormonale materna. Per quanto riguarda cisti
di piccole dimensioni (< cm) e asintomatiche, è consigliata la sola
osservazione tramite controlli ecografici []. Alcuni autori [] suggeriscono che la semplice osservazione dovrebbe essere adottata anche
nelle pazienti con cisti asintomatiche fino a – cm.
L’indicazione chirurgica è limitata ai casi di cisti con diametro >
cm. che non tendono a regredire spontaneamente nel tempo; alle lesioni che presentano una struttura ecografica complessa o solida, tale
da far sospettare una neoplasia; ai casi di dolore addominale severo e
persistente o in presenza di una complicazione della cisti, come la torsione dell’ovaio. Il trattamento chirurgico consigliato è la cistectomia
laparoscopica: la cisti viene escissa con preservazione dell’adiacente
tessuto ovarico sano e successivo esame istologico. Un’altra scelta
terapeutica, anche se gravata da un’alta percentuale di recidive, è
l’aspirazione laparoscopica della cisti [–].
Cisti del corpo luteo
Le cisti del corpo luteo si sviluppano solo nelle adolescenti con cicli
ovulatori. Sebbene tali cisti siano spesso bilaterali e tendano a raggiungere notevoli dimensioni, di solito regrediscono spontaneamente
con il ciclico declino del progesterone sierico. Le cisti emorragiche
del corpo luteo quando si presentano ecograficamente sotto forma di
masse complesse o solide, possono mimare una lesione neoplastica,
determinando difficoltà sia diagnostiche sia terapeutiche. L’intervento chirurgico, indicato solamente nei casi di lesioni solide o complesse sintomatiche che non tendono a regredire, è la cistectomia
laparoscopica [].
. Trattamento chirurgico
... Neoplasie ovariche
Esiste una netta correlazione tra l’età ed i vari istotipi delle neoplasie
ovariche. Sebbene i tumori a cellule germinali siano predominanti
in ogni gruppo di età, i tumori dello stroma e dei cordoni sessuali
prevalgono invece nei primi quattro anni di vita, mentre i tumori
epiteliali sono più comuni nelle adolescenti [].
Nella scelta del trattamento chirurgico delle neoplasie ovariche, è
importante differenziare, sia mediante indicatori pre–operatori sia medianti indicatori intraoperatori, le lesioni benigne da quelle maligne.
Gli indicatori preoperatori di malignità sono rappresentati dalla struttura ultrasonografica solida o complessa; dal diametro della massa >
cm. ; dall’età – anni e dai segni di pubertà precoce [].
I criteri intraoperatori che possono far sospettare una lesione maligna sono: la diffusione extra–ovarica della neoplasia; il legamento
utero–ovarico allungato; l’aumento del numero dei vasi a livello del
mesovaio, con un tipico pattern “a pettine”; l’infiltrazione agli organi circostanti; le vegetazioni intra e axtra–cistiche e le metastasi
peritoneali [].
Loh e coautori [] hanno recentemente creato un “index score”,
che indica, attraverso un punteggio, il rischio di malignità. I parametri
usati sono: il diametro massimo della lesione; la presenza del flusso in
un setto o in una proiezione papillare della massa ovarica ed infine la
presenza di eventuali sintomi legati all’attività ormonale della lesione.
Tumori a cellule germinali
Il rischio di malignità nei tumori a cellule germinali nei bambini è
circa il % [].
I teratomi
La maggior parte dei teratomi in età pediatrica è di tipo maturo.
Nei neonati, essi si localizzano più frequentemente nell’area sacro–
coccigea o a livello della testa–collo. L’ovaio diventa una sede importante nell’infanzia e soprattutto nell’adolescenza. Tali lesioni sono
prevalentemente benigne e nel % dei casi sono bilaterali []. Il
trattamento chirurgico di scelta è la rimozione laparoscopica del tera-
Le masse ovariche in età adolescenziale
toma, se possibile mediante una tumorectomia o altrimenti mediante
un’ovariectomia. La scelta tra l’approccio laparoscopico e laparotomico è, comunque, tuttora controversa. La causa risiede nel pericolo
di “spillage” del contenuto durante la rimozione della massa; perché,
in alcuni casi, una lesione apparentemente benigna può rivelarsi, alla
diagnosi definitiva, di natura maligna [–].
La gliomatosi intraperitoneale è una condizione che si associa in
alcuni casi al teratoma maturo ed è definita come la presenza depositi
di cellule gliali a livello intraperitoneale []. Dati recenti hanno documentato che questi impianti gliali originano da cellule subperitoneali
e non dal teratoma maturo []. In presenza di gliomatosi peritoneale
è necessaria la biopsia dei depositi intraperitoneali di cellule gliali.
La gliomatosi peritoneale non è espressione di cellule tumorali maligne e la sua presenza non fa variare, in alcun modo, il trattamento
chirurgico del tumore primario.
I teratomi funzionali sono così definiti perché hanno la caratteristica di secernere ormoni; quando è presente tessuto tiroideo a livello di
tali lesioni, si parla di struma ovarii.
I teratomi immaturi presentano un’elevato indice di malignità e
vengono stadiati in accordo con la classificazione del Children’s Oncology Group (COG) per i tumori a cellule germinali (vedi: Cap. –Tab.
.– “Classificazione e Stadiazione di malattia”). Essi sono differenziati
istologicamente in vari gradi. I teratomi di grado – presentano le
cellule più differenziate (minore potenziale di malignità), mentre quelli di grado sono costituiti da cellule meno differenziate ad elevato
potenziale di malignità.
La principale componente cellulare analizzata è quella neuroepiteliale; il grading dei teratomi si basa, infatti, sulla quantità degli elementi
neuroepiteliali immaturi. La sopravvivenza a anni dipende dallo stadio del tumore (% per stadio I, % per stadi II e III) e dal suo grado
istologico (% per grado I, % per grado II, % per grado III). Il
trattamento chirurgico in presenza di teratoma immaturo prevede, oltre alla salpingo–ovariectomia unilaterale, un’accurata stadiazione con
lavaggi peritoneali, omentectomia, biopsie diaframmatiche, pelviche
e linfonodali [].
Da un’analisi della letteratura, la terapia dei teratomi immaturi è
mutata progressivamente; da un trattamento chirurgico radicale seguito da chemioterapia siamo passati ad una chirurgia più conservativa
. Trattamento chirurgico
spesso senza terapia adiuvante. Lo studio congiunto del Children’s
Oncology Group e del Pediatric Oncology Group [] include pazienti con teratomi immaturi dell’ovaio trattati con la sola chirurgia
conservativa; il tasso di sopravvivenza a anni è risultato del .% e
nessun paziente ha presentato recidiva.
Disgerminomi
In generale i germinomi sono definiti “seminomi” se presenti a livello
del testicolo, disgerminomi se si localizzano nell’ovaio. Tali tumori
rappresentano le neoplasie maligne più frequentemente riscontrate
in età pediatrica []. Nei disgerminomi puri, LDH è elevato nel %
dei casi, gli altri marcatori generalmente sono negativi. Nelle forme
miste possiamo assistere ad una elevazione dell’ Enolasi Neurone
Specifica (NSE), del β–hCG e del CA . Il trattamento chirurgico
comprende la salpingo–ovariectomia unilaterale e l’accurata ispezione
dell’ovaio controlaterale con eventuale biopsia delle lesioni sospette. I
disgerminomi, infatti, sono bilaterali nell’–% dei casi [].
Essi sono estremamente radiosensibili anche se tale trattamento
può produrre effetti avversi sulla capacità riproduttiva. Nei pazienti
con patologia in stadio avanzato o bilaterale, è suggerito un trattamento chirurgico radicale con una salpingo–ovariectomia bilaterale
associata ad isterectomia ed staging intraoperatorio [].
Tumori del seno endodermico (tumori del sacco vitellino o yolk sac
tumors)
I tumori del seno endodermico sono neoplasie maligne molto aggressive. Si localizzano principalmente a livello dell’area sacro–coccigea
nei neonati e nei bambini più piccoli; nell’ovaio per quanto riguarda invece gli adolescenti. L’elevazione di AFP è caratteristica di tale
tumore.
Il trattamento chirurgico di scelta è la salpingo–ovariectomia unilaterale, dato che nella maggior parte dei casi queste neoplasie sono
unilaterali e in stadio I; in presenza di patologia avanzata è suggerita
l’isterectomia con chemioterapia [].
A differenza del disgerminoma, lo yolk sac tumor non è radiosensibile e prima dell’introduzione della chemioterapia la mortalità era
Le masse ovariche in età adolescenziale
molto alta. Diversamente dal disgerminoma, tale tumore è difficilmente trattabile anche per la sua tendenza a diffondersi rapidamente
al peritoneo, ai linfonodi, al fegato e al polmone [].
Carcinoma embrionale
Il carcinoma embrionale è un tumore a cellule germinali raro e molto aggressivo; si presenta frequentemente in associazione ad altre
neoplasie germinali ed è per questo più propriamente definito come
“neoplasia germinale mista”. Esso è raramente bilaterale e tende a
diffondersi a livello peritoneale. Il trattamento chirurgico indicato
è la salpingo–ovariectomia laparotomica seguita da una stadiazione
di malattia. La chemioterapia post–operatoria si è rivelata utile nel
ridurre l’incidenza di recidive.
Poliembrioma
Il poliembrioma produce elevati livelli sierici sia di AFP sia di β–hCG
ed è associato negli adolescenti a sintomi come la pubertà precoce o l’
irregolarità mestruale. L’approccio chirurgico di tale tumore prevede
una salpingo–ovariectomia unilaterale per lesioni in stadi precoci e
l’ isterectomia se la patologia è in stadio avanzato []. La prognosi è spesso infausta, dato che la chemioterapia post–operatoria solo
raramente può indurre remissione del tumore [].
Coriocarcinoma
I coriocarcinomi “puri” sono molto rari, infatti si presentano frequentemente come tumori germinali “misti”. Essi sono endocrinologicamente attivi e altamente maligni. Si possono riscontrare, nelle pazienti
affetta da tale patologia, livelli elevati di β–hCG ma non di AFP.
L’escissione chirurgica radicale di tali neoplasie può essere molto
difficoltosa, a causa della loro friabilità e della frequente infiltrazione
alle strutture anatomiche contigue. Se la lesione è localizzata, il trattamento chirurgico è limitato alla salpingo–ovariectomia unilaterale.
Spesso richiedono, proprio per l’estensione di malattia, una procedura chirurgica più radicale che includa la rimozione del tumore,
. Trattamento chirurgico
dell’ovaio controlaterale e dell’utero [] seguita da una chemioterapia
post–operatoria [].
... Tumori dello stroma e dei cordoni sessuali o Sex Cord Stromal
Tumors
I tumori dello stroma e dei cordoni sessuali determinano spesso sintomi endocrini. Prima dei nove anni di età i sintomi sono prevalentemente femminilizzanti, dopo i nove anni sono per lo più mascolinizzanti []. Queste neoplasie rappresentano dal .% al % dei tumori
maligni in età pediatrica [].
Tumori a cellule della granulosa–teca (di tipo giovanile)
I tumori a cellule della granulosa–teca rappresentano la tipologia più
comune tra le neoplasie dello stroma e dei cordoni sessuali. L’inibina
e l’ormone antimülleriano sono prodotti dalle cellule della granulosa
e possono essere utili come marcatori per la diagnosi e il follow–up
di tali neoplasie. Nonostante i tumori a cellule della granulosa degli
adulti siano generalmente indolenti, a lenta crescita e a basso potenziale di malignità, quelli riscontrati in età pediatrica possono avere un
comportamento più aggressivo.
Poichè solo il % di tali tumori è bilaterale e la maggior parte dei
pazienti presenta neoplasie allo stadio IA, il trattamento chirurgico
più appropriato consiste in una salpingo–ovariectomia unilaterale
associata ad una stadiazione di malattia. I livelli di “inibina sierica”
sono utili nel follow–up per determinare precocemente la presenza di
recidive.
Fibromi–tecomi
I fibromi–tecomi sono molto rari in età pediatrica, si presentano frequentemente bilaterali e la loro natura è generalmente benigna. In
pazienti pediatrici sono stati riscontrati fibromi con ascite e versamento
pleurico (Sindrome di Meigs); tra gli adolescenti è stata documentata
la Sindrome di Gorlin, patologia autosomica dominante caratterizzata
da fibroma ovarico, carcinoma nevico delle cellule basali, cisti dentarie
e anomalie scheletriche []. I tecomi possono produrre estrogeni e, in
Le masse ovariche in età adolescenziale
alcuni casi, anche testosterone. L’ovariectomia unilaterale rappresenta
il trattamento chirurgico di scelta [].
Tumori stromali sclerosanti
I tumori stromali sclerosanti rappresentano rare neoplasie benigne
dell’ovaio, che si differenziano dai fibromi–tecomi per una predominante incidenza prima dei trenta anni, per mancanza di attività
ormonale e per una caratteristica etrogenicità istologica. La terapia
chirurgica è la resezione del tumore con conservazione dell’ovaio [].
Tumori a cellule di Sertoli–Leydig
I tumori a cellule di Sertoli–Leydig rappresentano il % delle neoplasie dello stroma e dei cordoni sessuali. I marcatori tumorali più
frequentemente rilevati sono: l’AFP e il CA . LDH può presentarsi
elevato o normale. Nella maggior parte dei casi si tratta di neoplasie
maligne di basso grado, per questo il trattamento chirurgico indicato è la salpingo–ovariectomia unilaterale associata a stadiazione. Se
la neoplasia è bilaterale e scarsamente differenziata, è suggerito un
approccio più aggressivo con chemioterapia.
... Tumori epiteliali
In età pediatrica, i tumori epiteliali sono fondamentalmente di tipo
mucinoso o sieroso. Ciascun tipo di questi tumori è ulteriormente
suddiviso in forme benigne, a basso potenziale di malignità (o bordeline) e maligne. I tumori epiteliali benigni rappresentano il tipo
più comune, seguiti da quelli con malignità borderline e dai maligni.
Quest’ultimi sono molto rari nei pazienti pediatrici []. Il principale
marcatore tumorale è il CA .
Tra le neoplasie epiteliali benigne, il cistoadenoma è il più rappresentativo e si presenta come un tumore contenente fluido pseudomucinoso (cistadenoma pseudomucinoso) o sieroso (cistadenoma
sieroso). Esso è diagnosticato nella maggior parte dei casi dopo il menarca, ma è stato documentato in rari casi anche in età premenarcale
[]. Il trattamento chirurgico dei tumori epiteliali benigni limitati a un
. Trattamento chirurgico
solo ovaio prevede la sola ovariectomia unilaterale. I tumori a malignità bordeline in stadio IA (limitati ad un solo ovaio) possono essere
chirurgicamente trattati con una salpingo–ovariectomia unilaterale,
seguita da una accurata stadiazione. L’ovaio controlaterale deve essere
esaminato e sottoposto a biopsia in caso di lesione sospetta. Questi
pazienti richiedono un follow–up a lungo termine, con dosaggio dei
marcatori tumorali ed esami strumentali, dal momento che le recidive
possono presentarsi anche dopo molti anni di distanza (– anni) dal
trattamento primario [–].
La maggior parte delle bambine con tumori in stadio IB (limitati
ad entrambe le ovaie) possono essere adeguatamente trattate con una
salpingo–ovariectomia bilaterale con preservazione dell’utero. Per
quanto riguarda le neoplasie epiteliali maligne in stadio avanzato, è necessario eseguire, mediante un approccio laparotomico, una salpingo–
ovariectomia bilaterale con un’accurata stadiazione di malattia seguita
da chemioterapia [].
.. Trattamento chirurgico in urgenza
... Torsione ovarica
La torsione richiede un trattamento chirurgico d’urgenza per evitare
la necrosi dell’ovaio stesso. Il trattamento della torsione varia con il
grado di compromissione vascolare, da un intervento conservativo ad
uno radicale. In caso di necrosi è necessario eseguire un intervento
radicale mediante un’ovariectomia o una salpingo–ovariectomia (in
caso di coinvolgimento tubarico); in assenza di necrosi possiamo procedere alla detorsione, lasciando in sede l’ovaio — in caso di torsione
su ovaio normale — o trattare contemporaneamente le eventuali
affezioni in caso di torsione su ovaio patologico — mediante una cistectomia o tumorectomia preservando il parenchima sano residuo
(intervento conservativo) [].
Da un’analisi della letteratura, veniva eseguito in passato nella
maggior parte dei casi un trattamento chirurgico radicale perché si
temeva sia il rischio di trombo–embolia — secondaria alla detorsione
dell’ovaio — sia il rischio di lasciare in sede un ovaio con un’eventuale
lesione maligna. In realtà, è stato riportato in letteratura un solo evento
Le masse ovariche in età adolescenziale
trombo embolico in età pediatrica dopo detorsione [] e il rischio di
una torsione di tumore ovarico maligno è relativamente basso e varia
dal % al %.
Inoltre era diffusa la convinzione che l’ovaio ischemico non avesse
nessuna possibilità di ripresa funzionale; anche l’ovaio così detto black–
bluish era considerato irreversibilmente compromesso tanto da essere
asportato []. Recentemente è stato dimostrato che in realtà è difficile
valutare macroscopicamente il grado di necrosi di una gonade (Fig.
.).
Alla luce delle evidenze sopra descritte, adesso si preferisce trattare
la torsione ovarica in modo più conservativo possibile, cercando di
preservare la futura fertilità. L’approccio chirurgico dovrebbe essere
laparoscopico. Nel caso in cui è lasciato in sede, dopo la detorsione,
un ovaio apparentemente ischemico ma non necrotico, è necessario
eseguire un attento follow–up clinico ed ecografico, per valutare il
recupero funzionale della gonade.
Essa può progressivamente ritornare alle dimensioni fisiologiche
con una ripresa della normale funzione, documentabile con la presenza di follicoli all’esame ecografico, oppure può non ridursi di volume con persistenza della sintomatologia dolorosa addomino–pelvica,
comparsa di febbre e leucocitosi. In quest’ultima evenienza, è necessario programmare un secondo intervento finalizzato a rimuovere
definitivamente l’ovaio [–].
Nel caso in cui ci troviamo difronte ad una torsione ovarica su
lesione cistica o solida e non è possibile eseguire tecnicamente dopo
la detorsione, a causa dell’edema per la pregressa ischemia, una cistectomia o una tumorectomia — in caso di lesione benigna accertata
intraoperatoriamente, possiamo lasciare in sede la massa con un successivo follow–up clinico ed ecografico e, se necessario, eseguire un
secondo intervento (second–look) finalizzato a rivalutare la possibilità
di asportare la lesione cercando di conservare, quanto più possibile, il
parenchima ovarico residuo (Fig. .).
In caso di torsione ovarica è necessario controllare sempre anche l’ovaio controlaterale per escludere una torsione sincrona. Alcuni
Autori suggeriscono l’esecuzione di una ovariopessi per limitare la
mobilità della gonade e quindi il rischio di una seconda torsione, che
può verificarsi anche settimane o anni dopo il primo episodio, sia
sull’ovaio già colpito sia su quello controlaterale []. L’incidenza delle
. Trattamento chirurgico
Figura .. Aspetto black–bluish di ovaio destro “normale” dopo detorsione del
peduncolo in bambina di anni
Figura .. Cisti emorragica complicata da torsione in paziente di anni
torsioni recidivanti aumenta in caso di legamento ovarico abnormemente lungo o nel caso di torsione di un “ovaio normale” o nel caso
di torsione dell’ovaio sinistro — dato che l’incidenza della torsione
ovarica destra è maggiore di quella sinistra, perché il sigma soprastante la gonade sinistra riduce la sua mobilità. L’ovariopessi può essere
eseguita mediante la sutura su se stesso del legamento utero–ovarico
— al fine di ridurne la sua lunghezza — oppure mediante la sutura
dell’ovaio al legamento utero–sacrale []. Attualmente, comunque,
l’utilizzo della ovariopessi rimane controverso per il possibile rischio
Le masse ovariche in età adolescenziale
d’infertilità dovuto alle modificazioni anatomiche che tali procedure
possono indurre [–].
. Trattamento chirurgico
Referenze
[] K YA, L JA, K S, A L. Characteristics and management
of adnexal masses in a canadian pediatric and adolescent population. J Obstet
Gynaecol Can. ; (): –.
[] E SJ, Adnexal masses. In: E SJ, L MR, editors. Emans,
Laufer, Goldstein’s Pediatric and Adolescent Gynecology. th ed. Philadelphia: Lippincott Williams & Wilkins; .
[] B RE, T RS, A DK, T EL, M FJ.
Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta–analysis. J Clin Oncol. ; ():
–.
[] C DL, H E, B ML, C M, B RS, M
AL, et al. Surgery for ovarian masses in infants, children, and adolescents:
consecutive patients treated in a –year period. J Pediatr Surg. ; ():
–.
[] Z N, B F, Z C, C FS. Foetal and neonatal
ovarian cysts: a –year experience. Archives of Gynecology and Obstetrics.
; (): –.
[] B RE, N AC, Z ML, K V, F HE. Impact
of surgeon specialty on ovarian–conserving surgery in young females with an
adnexal mass. J Adolesc Health. ; (): –.
[] P C, B C, G M, M P, E G, G P, et al. Ovarian masses in adolescent girls. Endocr Dev. ; : –.
[] H–J A, Surgical management of the incidentally identified ovarian mass. Semin Pediatr Surg. ; (): –.
[] M JP, B M, K–S A, L M, S
F, H I, et al. Laparoscopic Approach to Ovarian Mass in Children and
Adolescents: Already a Standard in Therapy. “Journal of Laparoendoscopic
& Advanced Surgical Techniques”. ; (s): s–s.
[] S C, D G M, C M, M N. Functional ovarian lesions in children and adolescents: when to remove them. Gynecol Endocrinol.
; (): –.
[] M ER, B LA, H LJ, K SL, T MS,
C KE, et al. Management of adnexal mass. Evid Rep Technol Assess
(Full Rep). ; (): –.
[] E RN, B RE, S NC, S CC, A Retrospective Re-
Le masse ovariche in età adolescenziale
view of the Effect of Surgeon Specialty on the Management of Benign and
Malignant Pediatric and Adolescent Adnexal Masses. “Journal of Pediatric
and Adolescent Gynecology”. ; (): –.
[] S C, D G M, M N, M F, Hemorrhagic corpus
luteum cysts: an unusual problem for pediatric surgeons. J Pediatr Adolesc
Gynecol. ; (): –.
[] V A D, F ME, Ovarian tumors. In: C AG, C A, A NS, K TM, L JM, S R, editors. Pediatric Surgery. Philadelphia: Elsevier Health Sciences; . p.
–.
[] O SC, G N, B R, H R, H B, F A. Can
we preoperatively risk stratify ovarian masses for malignancy? J Pediatr Surg.
; (): –.
[] S C, Patologia ginecologica in chirurgia pediatrica. In: S C,
editor. Principi di chirurgia pediatrica e infantile. Roma: Aracne editrice;
. p. –.
[] L AHP, O CL, L SL, C JHY, C CH, Pediatric risk of malignancy index for preoperative evaluation of childhood ovarian tumors.
Pediatric Surgery International. ; (): –.
[] P C, C J, K E, P A, C P, A J, et
al. Ovarian germ cell tumours: a –year study in a single unit. Eur J
Pediatr Surg. ; (): –.
[] T P, L V, G G, P C, B
S, T AT, et al. A retrospective analysis of twenty–eight borderline
ovarian tumours in adolescent girls. Eur J Gynaecol Oncol. ; (): –
.
[] I S, Y SZ, G JR. Management and outcomes of ovarian
masses in children and adolescents. Am Surg. ; (): –.
[] T CL, H SP, S JP, P SE, F ME.
The management of mature cystic teratomas in children and adolescents: a
retrospective analysis. Hum Reprod. ; (): –.
[] V C, D M, C L, B O, C S, L
F, et al. Ovarian germ cell tumors in children. Management, survival and
ovarian prognosis. A report of cases. “Journal of Pediatric Surgery”. ;
(): –.
[] C B, G R, A A, C L, C J, H E, et al.
Surgical resection alone is effective treatment for ovarian immature teratoma
. Trattamento chirurgico
in children and adolescents: a report of the pediatric oncology group and the
children’s cancer group. Am J Obstet Gynecol. ; (): –.
[] M P, C S, E H J, P P, D P, C
D. Clinical outcomes and fertility after conservative treatment of ovarian borderline tumors. Fertil Steril. ; (): –.
[] M NM, C B, G R, C L, L SJ, A A, et
al. Complete surgical excision is effective treatment for children with immature teratomas with or without malignant elements: A Pediatric Oncology
Group/Children’s Cancer Group Intergroup Study. J Clin Oncol. ;
(): –.
[] P E, F M, The female reproductive system. In: S JT,
D LP, editors. Pediatric Pathology. nd ed. Philadelphia: Lippincott Williams & Wilkins; . p. –.
[] B KF, C MC, K LG, S JE, F AC, A
population–based analysis of malignant ovarian tumors in the pediatric
population. J Surg Res. ; (): –.
[] M M, H D, A D. Epithelial ovarian tumors in children: a retrospective analysis. J Pediatr Surg. ; (): –; discussion
–.
[] S D, S ZB, D M, M Z, D S, Torsion of
malignant ovarian tumors in childhood and adolescence. J Pediatr Endocrinol
Metab. ; (): –.
[] S DS, K MS, Deep venous thrombosis as a cause of pelvic
pain in children. J Ultrasound Med. ; (): –.
[] O SC, F A, B R, H R, H B, G N.
Pediatric ovarian malignancy presenting as ovarian torsion: incidence and relevance. J Pediatr Surg. ; (): –.
[] S AK, L MR, Ovarian bivalving after detorsion. Fertil Steril.
; (): –.
[] C A, E O, A H, O C, O G, E A, et al.
Long–term results of conservative management of adnexal torsion in children.
J Pediatr Surg. ; (): -.
[] H C, F A, Adnexal torsion: a literature review. Eur J
Obstet Gynecol Reprod Biol. ; (): –.
[] G A, K M, S A. Conservative laparoscopic approach to
adnexal torsion. Arch Gynecol Obstet. ; (): –.
Le masse ovariche in età adolescenziale
[] C NS, G B, C AS, C SM. Ovarian torsion:
to pex or not to pex? Case report and review of the literature. J Pediatr Adolesc Gynecol. ; (): –.
[] A D, Malignant lesions of the ovary in childhood. Semin Pediatr
Surg. ; (): –.
[] S C, B I, P V, L J, A E, N L, M
A, L P R, M A. Adnexal torsion in children and adolescents:
new trend to conservative surgical approach. Our experience and review of
literature. Gynecol Endocrinol. Jul .
Ringraziamenti
Hanno collaborato: il professore Davide Caramella, direttore U.O. Radiodiagnostica — Università di Pisa; il professore Gadducci Angelo,
Dipartimento della Medicina della Procreazione e dell’Età evolutiva,
Divisione di Ginecologia e Ostetricia — Università di Pisa; la dottoressa Pacciardi Federica, U.O. Radiodiagnostica — Università di Pisa; la
dottoressa Ugolini Clara, U.O. Anatomia ed Istologia Patologica III —
Università di Pisa.
Un ringraziamento particolare per il contributo e l’impegno alla
dottoressa I. Buti, dottoressa G. Poli, dottoressa C. Menchini, dottoressa V. Matteucci e al dottor L. Fregoli.
HIGH LINE “SURGERY”
ARGOMENTI DI CHIRURGIA PEDIATRICA E INFANTILE
. Claudio Spinelli, Valentina Pucci
Le masse ovariche in età adolescenziale. Aspetti clinici e terapeutici
----, formato x cm, pagine, euro
Compilato il ottobre , ore :
con il sistema tipografico LATEX 2ε
Finito di stampare nel mese di ottobre del
dalla «ERMES. Servizi Editoriali Integrati S.r.l.»
Ariccia (RM) – via Quarto Negroni,
per conto della «Aracne editrice S.r.l.» di Roma