DecapÄ :sistema mininvasivo per la rimozione della
CO2.
Antonio balducci, Ph.D.; Paolo BraganÄ; Gualtiero Guadagni, Ph.D.
La fisiologia della respirazione si basa sugli scambi gassosi
intrapolmonari che governano sia la diffusione dell'ossigeno (O2)
dagli
alveoli
al
sangue
arterioso
(ossigenazione),
sia
l’eliminazione dell’anidride carbonica (CO2). E‘ da notare che gli
scambi gassosi dipendono oltre che dalla diffusione anche dalle
capacit‚
pompanti dell’apparato respiratorio che permettono il
ricambio dell’aria.
Le alterazioni degli scambi gassosi intrapolmonari possono causare
ipossiemia (ossigenazione del sangue insufficiente) o ipercapnia
(inadeguata eliminazione della CO2 dal sangue). Solitamente i
fenomeni ipossici sono piƒ frequenti di quelli ipercapnici, dal
momento che la capacit‚ di diffusione della CO2 attraverso la
membrana alveolare „ molto maggiore di quella dell'O2 ed inoltre le
zone
di
ipoventilazione
regionale
(inadeguata
ventilazione
alveolare), con scarsa rimozione della CO2, possono essere
compensate da un aumento della ventilazione delle unit‚ polmonari
normali.
Molti
processi
patologici
possono
compromettere
contemporaneamente sia lo scambio di O2 che di CO2, ma piƒ
comunemente
si
verificano
compromissioni
selettive
o
sproporzionate dell'uno o dell'altro.
In generale, l’ipossiemia „ correlata al malfunzionamento degli
scambi alveolari (ad esempio un inspessimento della parete degli
alveoli), mentre l’ipercapnia „ correlata ad un deficit della
“pompa respiratoria” che si verifica quando il sistema della
muscolatura polmonare non „ in grado di garantire un adeguato
ricambio dell’aria alveolare.
Un paziente affetto da ALI (Acute Lung Injury), presenta uno stato
infiammatorio delle vie aeree che si pu‡ tramutare in un quadro
clinico ancora piƒ grave che „ quello di ARDS (Acute Respiratory
Distress Sindrome). Nella sua fase acuta la ARDS „ caratterizzata
da un afflusso di fluido edematoso ricco di proteine negli spazi
alveolari
a causa di un’aumentata permeabilit‚ della barriera
alveolo-capillare. Il grado di danno epiteliale alveolare „ un
importante predittore dell’esito e ha numerose conseguenze:
contribuisce all’inondazione alveolare e ostacola la rimozione
dell’edema, riduce la produzione e il turnover del surfactante,
pu‡ predisporre allo shock settico nei pazienti con polmonite
batterica e favorisce l’evoluzione di uno stato fibrotico. Un
ruolo importante „ giocato dai Polimorfonucleati (PMN) neutrofili.
1
L’accumulo di neutrofili „ precoce e marcato, sia negli alveoli
che nel liquido bronco alveolare (BAL). La reazione infiammatoria
nell’ARDS „ iniziata e mantenuta da una rete complessa di
citochine (IL-8, IL-1, IL-10, MIF) e altri mediatori prodotti
localmente da vari tipi cellulari.
In sostanza, sia in ALI che in ARDS si assiste ad uno stato piƒ o
meno marcato di infiammazione localizzata a livello alveolare che
conduce a una riduzione della compliance del polmone (che diventa
piƒ rigido), alla presenza di zone non areate o scarsamente areate
e zone iper-inflate.
ˆ dimostrato che nel paziente in ARDS, mantenere dei bassi volumi
correnti di ventilazione (6 ml/kg), porta ad un aumento della
sopravvivenza, proprio perch‰ previene il polmone gi‚ infiammato
da un carico di lavoro aggiuntivo (NEJ 2000; 342:1301 ). Tuttavia,
un basso volume corrente, mantenuto sia in regime volumetrico, sia
in regime pressorio, induce un naturale innalzamento dei livelli
di CO2, tollerabile fino a quando non comporti uno stato di acidosi
respiratoria (pH<7.2).
Negli anni, vari ricercatori hanno proposto sistemi di scambio
gassoso extracorporeo atti a rimuovere la CO2 senza “stressare” il
polmone dei pazienti. Questi dispositivi vengono comunemente
chiamati ECCO2-R (extracorporeal CO2 removers). Il sistema arterovenoso NovalungŠ „ forse il device piƒ conosciuto di questa
categoria: prevede l’accesso dalla vena e dalla arteria femorale
attraverso cannule da 17 French.
Figura 1 : sistema NovalungÅ
Il sistema, artero-venoso e privo di
pompa ematica, tratta una
portata di sangue di circa 1 - 2 litri/minuto ed „ in grado di
eliminare circa il 50% della CO2 prodotta dal paziente. A fronte di
una notevole semplicit‚ d’uso, questo sistema presenta numerose
complicanze, sia analoghe a quelle dei sistemi ECMO (ad esempio
2
legate all’uso di cannule di grande diametro), sia legate alla
perfusione artero-venosa, che ne hanno impedito la diffusione.
Figura 2:
Complicanze del sistema artero-venoso. Fonte : Crit Care Med
2006;34(5):1372-7
In questo contesto, nel tentativo di proporre un sistema per la
rimozione della CO2 che superasse i limiti dei precedenti sistemi
ECCO2-R, „ stato progettato ed introdotto sul mercato il sistema
DecapŠ
(Hemodec,
SA,
Italia).
Si
tratta
di
un
sistema
extracorporeo MINIINVASIVO per rimuovere la CO2 in eccesso, che
riduce al minimo l’impatto sull’emodinamica grazie all’uso di
accessi vascolari di piccole dimensioni (catetere bilume da 14 Fr)
e ad un volume di priming del circuito ridotto (~300 ml). Il
sistema, unico nel suo genere, comporta anche una in PREDILUIZIONE
con ultra-filtrato proprio del paziente e consente unaridotta
infusione di eparina.
DecapŠ non „ un sistema alternativo alla ventilazione ma un
supporto alla stessa ed „ in grado di rimuovere circa 1/2 della CO2
prodotta dal paziente permettendo al rianimatore di ventilare il
paziente a bassi volumi e basse pressioni inspiratorie, riducendo
i danni associati al ventilatore.
Nel dettaglio il sistema DecapŠ „ composto da:
Decapneizzatore a fibre cave in polipropilene da 1.35 m2
Emofiltro da 0.6 m2 posto a valle del decapneizzatore ed
utilizzato per prelevare acqua plasmatica ( 10 – 15 % del
flusso ematico ) dal sangue. Il prelievo di acqua plasmatica
ha la duplice funzione di:
a)
il
prediluire, mediante reinfusione di ultrafiltrato,
sangue che attraversa il decapneizzatore, per poi
3
riportarlo al valore
ultrafiltrazione;
di
ematocrito
del
paziente
per
b)
mantenere la pressione del sangue in ingresso nel
decapneizzatore sempre superiore alla pressione in ingresso
del gas (si evita la formazione di emboli).
Figura3: schema di funzionamento del sistema.
Per capire la logica di funzionamento del sistema DecapŠ, occorre
rifarsi ai fenomeni di trasporto della CO2 nel sangue. ˆ
fondamentale ricordare che solamente il 7 % dell’anidride
carbonica presente nel sangue viene trasportata ai polmoni sotto
forma di gas disciolto in soluzione; in pratica, ogni 100 ml di
sangue circa 3.5 ml di CO2 viene trasportato sotto forma di gas
disciolto.
La gran parte dell’anidride carbonica, circa il 70 %, viene
trasportata sotto forma di ioni bicarbonato. Infatti, l’anidride
carbonica disciolta nel sangue reagisce con l’acqua presente nei
globuli rossi. Qui „ presente un enzima, l’anidrasi carbonica, che
accelera enormemente la reazione.
Si ottiene quindi che l’anidride carbonica reagisce con l’acqua
contenuta nei globuli rossi formando acido carbonico (H2CO3) ancor
prima che il sangue abbia lasciato i capillari tessutali.
In un’altra frazione di secondo, l’acido carbonico formatosi nei
globuli rossi si dissocia in ioni idrogeno e ioni bicarbonato.
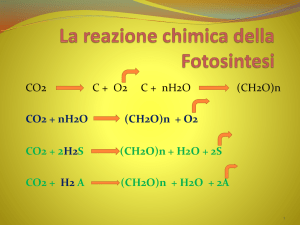
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO34
Il
legame
reversibile
dell’anidride
carbonica
con
l’acqua
contenuta negli eritrociti, catalizzato dall’azione dell’anidrasi
carbonica, „ responsabile di circa il 70 % del trasporto totale di
CO2.
Oltre a combinarsi con l’acqua, la CO2 reagisce anche con i
radicali aminici delle molecole di emoglobina per formare il
composto carbaminoemoglobina (CO2 Hgb). E’ un legame reversibile e
di debole intensit‚ e di piƒ lenta formazione rispetto al legame
con l’acqua. E’ quindi responsabile di circa il 23 % del trasporto
totale di CO2.
Riassumendo, il trasporto di CO2 nel sangue avviene:
Per il 7 % in forma libera
Per il 23 % legata alla carbaminoemoglobina
Per il 70 % sotto forma di ioni bicarbonato
Questo significa che per ottenere delle riduzioni significative
dei livelli di pressione parziale arteriosa di CO2, (30-35%), il
sistema DecapŠ, lavorando a bassa portata (ed un tempo di transito
del sangue nell’ossigenatore superiore ai 20-30 secondi), rimuove
la CO2 disciolta, innescando i meccanismi di trasformazione dei
bicarbonati in CO2 che “ricaricano” il plasma di nuova CO2
disciolta che il sistema continua a rimuovere. Questo „ il motivo
per cui, purch‰ la superficie del dispositivo sia abbastanza
grande e purch‰ la permeabilit‚ della membrana usata sia alta
(fibre in polipropilene), „ possibile decapneizzare il sangue
lavorando a portate estremamente basse.
5
Terragni et al,( Anesthesiology 2009; 111:826–35) hanno gi‚
dimostrato le potenzialit‚ di questa metodica per il trattamento
di pazienti affetti da ARDS; in questo studio il sistema DecapŠ ha
permesso ai ricercatori di ottenere delle ventilazioni desiderate
mantenendo dei livelli contenuti di CO2
Bibliografia
1. Terragni PP., Del Sorbo L., Mascia L. Urbino R., Martin EL,
Birocco A., Faggiano C., Quintel M., Gattinoni L., Ranieri V.M.
UN VOLUME CORRENTE INFERIORE A 6 ml/kg MIGLIORA LA PROTENZIONE
POLMONARE Anesthesiology , V, No. 4, Oct. 2009; 111:699-700
2. Livigni S., Maio M., Ferretti E., Longobardo A., Potenza R.,
Rivalta L., Selvaggi P., Vergano M., Bertolini G. EFFICACY AND
SAFETY OF A LOW-FLOW VENO-VENOUS CARBON DIOXIDE REMOVAL DEVICE:
RESULTS OF AN EXPERIMENTAL STUDY IN ADULT SHEEP Critical Care
2006, 10:R151(doi:10.1186/cc5082)
3. Bigatello L.M., Pesenti A. DANNO POLMONARE INDOTTO DA
VENTILAZIONE Anesthesiology 2009; 111:699-700
6