Escrezione nel latte
• Quasi tutti i farmaci passano nel latte.
• Il passaggio dal plasma al latte avviene principalmente per diffusione passiva, ed
è quindi influenzato da:
legame alle proteine plasmatiche
liposolubilità
pH: il pH del latte (6,5-7,2) è leggermente più acido di quello del plasma (7,4) ⇒
favorita l’escrezione di basi deboli. (es. NH3+H+
NH4+ più solubile)
• Composti fortemente lipofili (es. DDT, PCB, piretroidi, ecc.) passano dal plasma al
latte insieme con i lipidi; per questi composti il latte può essere una via
importante di eliminazione.
• Alcuni composti sono secreti attivamente nel latte, raggiungendo concentrazioni
più elevate di quelle plasmatiche
Figure 1. Mean (± SD) milk and serum
concentrations in four lactating
women after 100-mg dose of
nitrofurantoin macrocrystals.
• La dose ingerita dal lattante può esser calcolata in base al volume di latte
ingerito giornalmente, la concentrazione plasmatica materna ed il rapporto
AUClatte/AUCplasma.
• Per stabilire l’eventuale pericolosità, occorre tenere conto della biodisponibilità
orale dello xenobiotico e della clearance dello xenobiotico nel neonato, che è in
genere minore rispetto all’adulto.
• In genere, i farmaci possono ritenersi sicuri se la dose/kg nel lattante è inferiore
al 10% della dose/kg materna, tranne nel caso di farmaci molto tossici (es.
citotossici, isotretinoina, immunosoppressori ed altri), per i quali è necessaria
l’interruzione dell’allattamento.
62
•
Farmaci nel latte di animali d’allevamento
• Per legge, il latte non deve contenere farmaci
• Tuttavia, tracce di alcuni farmaci, soprattutto antibiotici, sono state trovate nel
latte per uso alimentare.
• Anche in tracce, gli antibiotici possono essere dannosi per:
possibili allergie
sviluppo di resistenza agli antibiotici
Dose e livelli plasmatici
• All’aumentare della dose somministrata, aumenta in modo proporzionale la
quantità di farmaco assorbito ⇒ aumento della concentrazione plasmatica e di
AUC.
• Dato che l’eliminazione segue una cinetica di I ordine, all’aumentare della
concentrazione plasmatica aumenta anche la velocità di eliminazione.
• Quasi sempre, la concentrazione plasmatica ad un certo tempo e l’AUC sono
direttamente proporzionali alla dose somministrata.
63
Cp e AUC sono direttamente proporzionali alla dose somministrata
64
Cinetiche di saturazione
I meccanismi di eliminazione mediati da enzimi o trasportatori (eliminazione presistemica, metabolismo, trasporti tubulari) sono saturabili.
In questi casi, si passa da una cinetica di I ordine ad una cinetica di ordine 0 ⇒ la
velocità di eliminazione non è proporzionale alla concentrazione del farmaco ma
diventa costante ⇒ la concentrazione plasmatica e l’AUC aumentano non più in modo
proporzionale ma in modo circa esponenziale all’aumentare della dose (es. fenitoina).
Questo fenomeno avviene nelle intossicazioni acute in cui si ha saturazione dei
carriers.
65
Una cinetica inizialmente di ordine 0 diventa di primo ordine al diminuire della
concentrazione plasmatica
Questo si verifica nel caso di un’intossicazione acuta in cui c’è saturazione dei carriers
e quindi cinetica di ordine 0. Dopo un pronto intervento in cui si fa diminuire la conc.
plasmatica, la cinetica viene ripristinata all’ordine 1.
66
• Nelle cinetiche di saturazione, t1/2 aumenta all’aumentare della dose ⇒
sperimentalmente, non è possibile definire t1/2 (o kel). Invece nelle cinetiche di 1°
ordine 1, il t1/2, il Vd e CL sono fissi per quella sostanza.
• La saturazione di una via metabolica porta ad una maggiore formazione di
metaboliti che si formano per altre vie (es. paracetamolo, aspirina, ecc) ⇒
sperimentalmente, si osserva una cambiamento della composizione percentuale
della miscela di xenobiotico + metaboliti.
67
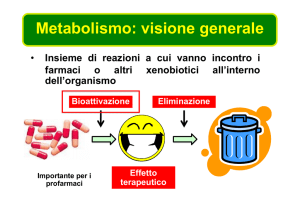
Metabolismo
68
• Il metabolismo di uno xenobiotico è l’insieme delle trasformazioni
chimiche che la molecola subisce all’interno dell’organismo,
principalmente ad opera di enzimi.
• Il metabolismo ha una ‘logica’: trasformare la molecola in modo che
possa essere facilmente escreta per via renale o biliare. Dato che le
molecole idrofile sono eliminate più rapidamente di quelle lipofile, il
metabolismo consiste principalmente nella trasformazione di molecole
lipofile in molecole idrofile.
• Le sostanze lipofile sono escrete più lentamente di quelle idrofile
perché:
sono più facilmente riassorbite nel tubulo renale (o nell’intestino in
caso di eliminazione biliare).
Ad esempio, durante il processo di formazione delle urine, si ha
riassorbimento di acqua ⇒ aumento della concentrazione dei soluti
nell’urina ⇒ gradiente di concentrazione urina-plasma ⇒
riassorbimento. Le sostanze lipofile sono riassorbite più facilmente
perché attraversano meglio lo strato cellulare dell’epitelio tubulare.
si accumulano nel tessuto adiposo
• Il metabolismo degli xenobiotici è estremamente importante in
Tossicologia, poiché può avere sia un effetto protettivo (eliminazione
e/o detossificazione dello xenobiotico) sia un effetto dannoso
(formazione di metaboliti tossici).
69
Caratteristiche generali del metabolismo degli xenobiotici
• Scarsa selettività per i substrati
⇒ possibilità di metabolizzare un enorme numero di sostanze con un
numero relativamente esiguo di enzimi
⇒ uno xenobiotico può essere metabolizzato da enzimi diversi
⇒ lo stesso enzima può catalizzare reazioni diverse sullo stesso
substrato
⇒ in genere uno xenobiotico viene metabolizzato secondo più vie
metaboliche
⇒ uno stesso enzima può metabolizzare più substrati compresenti
nell’organismo ⇒ possibilità di interazioni (inibizione competitiva,
induzione) tra xenobiotici, o tra xenobiotici e composti endogeni
70
Metabolismo del flunitrazepam
71
Esempio di interazione: inibizione del metabolismo della terfenadina
(antistaminico ritirato dal commercio) ⇒ aritmie
72
• Una sostanza può inibire o indurre una via metabolica di un’altra
sostanza, causando una variazione della composizione dei metaboliti
73
Variabilità degli enzimi metabolizzanti
1. Variabilità interspecie
• In natura, gli xenobiotici con cui vengono in contatto gli organismi
animali sono di origine vegetale.
• La capacità di diverse specie animali di metabolizzare gli xenobiotici
dipende dalla selezione operata dall’esposizione agli xenobiotici
vegetali.
• Ad es., insetti che si cibano di molte piante diverse possono
metabolizzare una varietà di xenobiotici maggiore degli insetti che si
alimentano di poche o una sola specie vegetale. I pesci hanno minore
capacità metabolizzante dei mammiferi, probabilmente perché possono
più facilmente eliminare gli xenobiotici tramite le branchie.
74
75
L’evoluzione degli isoenzimi CYP450 riflette l’esposizione ad un numero
sempre maggiore di xenobiotici potenzialmente tossici, sintetizzati dai
vegetali a scopo difensivo.
• Specie diverse di mammiferi possono avere differenze qualiquantitative della capacità metabolizzante:
⇒ importanti per l’estrapolazione all’uomo di dati animali.
• la maggior parte delle differenze di tossicità tra specie diverse di
mammiferi è dovuta a diversità del metabolismo.
2. Variabilità intraspecie
• All’interno di una specie, vi è una variabilità genetica, perché molti
enzimi sono polimorfi (più varianti alleliche, con diversa attività; più
copie dello stesso gene)
⇒ differente suscettibilità agli effetti tossici
3. Variabilità individuale
• A livello individuale, la capacità metabolizzante è determinata, oltre
che da fattori genetici, anche da fattori endogeni ed ambientali
fattori endogeni: età, sesso, stati fisiologici (ritmi circadiani, ciclo
mestruale, gravidanza ecc.), patologie
fattori ambientali: induzione e inibizione enzimatica
⇒ variazioni della suscettibilità individuale
• Gli effetti di un fattore di variabilità dipendono da tutti gli altri
fattori.
Esempi:
Gli effetti di un inibitore di un enzima saranno più marcati in un
individuo con un carenza genetica di quell’enzima.
Le differenze legate al sesso sono molto più forti nel ratto che
nell’uomo.
Distribuzione tissutale degli enzimi metabolizzanti
• L’organo più ricco di enzimi metabolizzanti è il fegato.
• Altri organi o tessuti con significativa capacità metabolica sono i
polmoni, i reni, il sangue.
76
• Alcuni tessuti hanno un’elevata concentrazione di enzimi
metabolizzanti (mucosa nasale, cristallino), che servono a difendere il
tessuto, ma il cui contributo al metabolismo sistemico è pressoché
nullo dato il volume del tessuto.
• La localizzazione degli enzimi è importante nel determinare l’organo
colpito nel caso di formazione di metaboliti tossici. Molti metaboliti
tossici sono infatti altamente reattivi e colpiscono quindi solo le cellule
dell’organo in cui si formano. Ad es., molti composti sono epatotossici
perché i metaboliti reattivi si formano nel fegato.
• Inoltre, la tossicità è spesso limitata, all’interno dell’organo, alle cellule
che esprimono l’enzima che porta alla formazione del metabolita
tossico. Ad es., il paracetamolo e CCl4 causano necrosi centrolobulare
perché le cellule della regione centrolobulare sono ricche di citocromo
P450.
77
Localizzazione intracellulare degli enzimi
• Molti enzimi hanno diverse isoforme, che hanno spesso diversa
localizzazione cellulare.
• Una determinata isoforma ha in genere un’unica localizzazione
intracellulare.
• Nel fegato gli enzimi sono localizzati principalmente nel reticolo
endoplasmatico (enzimi microsomiali) deputati prevalentemente a
catalizzare reazioni di fase I mentre nel citosol abbiamo enzimi
deputati principalmente a catalizzare reazioni di fase II
(coniugazioni). Un numero minore di enzimi è localizzato nei mitocondri,
nei lisosomi, nel nucleo.
78
Classificazione delle reazioni di biotrasformazione. Fase I e fase II
• Composti che già contengono un gruppo nucleofilo e composti
elettrofili possono essere direttamente coniugati (fase II), ma
possono anche subire reazioni di fase I (es. paracetamolo che viene
ossidato formando metabolita tossico).
• Le reazioni di fase II sono in genere più veloci di quelle di fase I ⇒
basse concentrazioni dei metaboliti di fase I
• La capacità delle reazioni di fase I è limitata dalla attività enzimatica
(quantità di enzima)
• La capacità delle reazioni di fase II è limitata principalmente dalla
disponibilità del cofattore
La maggior parte dei metaboliti tossici si forma nelle reazioni di fase I,
in particolare nelle reazioni di ossidazione.
Reazioni di fase I
• Sono le reazioni di ossidazione, idrolisi, riduzione.
• Portano in genere all’introduzione o smascheramento di un gruppo
nucleofilo (-OH, -NH2, -SH, -COOH).
• Ciò causa solo un modesto aumento dell’idrofilia. Tuttavia, il gruppo
funzionale nucleofilo fornisce un punto di attacco per le reazioni di
fase II.
• Le reazioni di fase I determinano in genere perdita dell’attività
farmaco-tossicologica (modificazione della struttura chimica e della
79
capacità di interagire con il recettore). In alcuni casi, tuttavia, i
prodotti delle reazioni di fase I sono biologicamente attivi.
• Nelle reazioni di fase I, soprattutto le reazioni di ossidazione, si
possono formare metaboliti tossici.
Reazioni di ossidazione degli xenobiotici
• L’ossidazione è la trasformazione più frequente negli xenobiotici (>75%
delle reazioni di fase I)
• Le reazioni di ossidazione sono catalizzate principalmente da 7 enzimi,
che differiscono per:
i substrati ossidati (tuttavia un substrato può essere ossidato da
più enzimi: es. etanolo viene ossidato dall’alcol deidrogenasi e dal
CYP2E1)
localizzazione tissutale e intracellulare;
attività
80
Citocromo P450 o CYP 450
• E’ l’enzima più importante di fase I perché metabolizza un gran numero
di xenobiotici ⇒ principale responsabile dell’inattivazione di molti
farmaci e tossici diretti.
• Coinvolto anche nella biosintesi o degradazione di molti composti
endogeni (ormoni steroidei, TXA2, PGI2, vitamine liposolubili, acidi
grassi ecc.)
• Presente in tutti i tessuti. I livelli più alti sono nel fegato, a livello del
reticolo endoplasmatico (frazione microsomiale)
81
82
Reazione generale del CYP450
RH (substrato) + O2 + NADPH + H+ → ROH + H2O + NADP+
•
•
E’ una reazione di monoossigenazione in cui un atomo di ossigeno è incorporato nel
substrato; l’altro atomo di ossigeno è ridotto ad H2O (CYP450 è quindi un’ossidasi a
funzione mista), con l’apporto degli equivalenti riducenti (elettroni) forniti dal NADPH.
Il prodotto ROH può subire riarrangiamenti ⇒ molti prodotti finali, diversi da alcol e
fenoli.
gruppo eme (Fe-protoporfirina)
del CYP
83
84