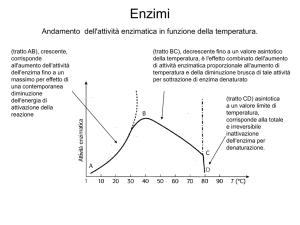
Fondamenti di Chimica Farmaceutica
Inibizione
enzimatica
Cinetica enzimatica
𝒌𝟏
𝑬+𝑺
𝐄𝐒
𝒌𝟐
𝑬+𝑷
𝒌−𝟏
La reazione catalizzata dall’enzima avviene in
due passaggi:
•
•
la formazione del complesso enzima-substrato: una
reazione per la quale si stabilisce un equilibrio;
la formazione del prodotto: una reazione invece
irreversibile, perché il prodotto viene continuamente
rimosso.
Cinetica enzimatica
𝒌𝟏
𝑬+𝑺
𝐄𝐒
𝒌𝟐
𝑬+𝑷
𝒌−𝟏
ES è un intermedio di reazione con bassa
energia di attivazione per l’effetto catalitico
dell’enzima.
ES raggiunge uno stato di equilibrio dinamico e
la sua concentrazione si mantiene costante nel
tempo; si raggiunge così uno stato stazionario
(steady state).
Cinetica enzimatica
L’equazione di Michaelis−Menten
𝒗𝒎𝒂𝒙 [𝑺]
𝒗=
𝒌𝑴 + [𝑺]
La velocità dipende dalla concentrazione del substrato e,
attraverso 𝒗𝒎𝒂𝒙 dalla quantità di enzima.
𝒗𝒎𝒂𝒙
è la velocità massima della reazione che viene
raggiunta
quando
tutto
l’enzima
disponibile
è
complessato dal substrato.
𝒌𝑴
è una caratteristica dell’enzima ed è uguale alla
concentrazione del substrato quando 𝒗 = 𝟏/𝟐𝒗𝒎𝒂𝒙
𝒌𝑴 misura l’efficienza dell’enzima, quanto più è piccolo,
tanto più l’enzima è potente.
Cinetica enzimatica
L’equazione di Michaelis−Menten
Inibizione enzimatica
I farmaci che hanno come bersagli gli enzimi in genere
agiscono come inibitori.
Sono molecole che inibiscono, cioè bloccano, l’enzima.
Il meccanismo più comune è quello di andare ad
occupare il sito catalitico, impedendo così al substrato
di entrare, senza alcuna formazione di prodotti.
Inibizione enzimatica
I farmaci che hanno come bersagli gli enzimi in genere
agiscono come inibitori.
Sono molecole che inibiscono, cioè bloccano, l’enzima.
Il meccanismo più comune è quello di andare ad
occupare il sito catalitico, impedendo così al substrato
di entrare, senza alcuna formazione di prodotti.
Inibizione enzimatica
Un inibitore enzimatico può essere:
reversibile, quando l’inibitore si lega all’enzima
attraverso forze intermolecolari non covalenti ed in
questo modo il legame è reversibile; si stabilisce un
equilibrio tra farmaco legato e non legato
E+I
EI
E+I
EI
irreversibile, quando l’inibitore si lega all’enzima
attraverso un legame covalente e blocca l’enzima
permanentemente
Inibizione enzimatica
Gli inibitori irreversibili si legano in genere a gruppi OH
(es. serine) o SH (cisteine) di residui aminoacidici
dell’enzima attraverso un meccanismo di sostituzione
nucleofila.
In genere si cerca di evitare l’uso di inibitori
irreversibili, spesso fonte di effetti collaterali non
facilmente controllabili.
Inibizione enzimatica
IC50
Concentrazione di inibitore richiesta per
ridurre del 50% l’attività dell’enzima
Ki
Costante dell’equilibrio:
EI E + I
EC50
Concentrazione di inibitore richiesta per
ridurre del 50% l’effetto dell’enzima
Inibitori competitivi
Gli inibitori reversibili possono avere vari profili
farmacologici:
competitivi: interagiscono allo stesso sito del
substrato e competono con esso, finché l’inibitore
rimane ancorato al sito il substrato non può essere
trasformato;
non competitivi: interagiscono ad un sito allosterico,
non competono con il substrato ma attraverso
adattamento indotto modificano il sito catalitico ed
impediscono al substrato di legarsi;
incompetitivi: si legano al complesso substrato enzima
una volta che esso si è formato.
Inibitori competitivi
In presenza di un inibitore competitivo si stabiliscono
due equilibri in competizione:
E+S
ES
E+P
E+I
EI
E+P
Il processo globale:
EI + S
E +S+I
ES +I
E + P+ I
Inibitori competitivi
L’inibitore competitivo può essere spiazzato
aumentando il livello del substrato naturale.
Inibitori competitivi
L’equazione di Michaelis Menten in presenza di un
inibitore competitivo diventa:
𝒗𝒎𝒂𝒙 [𝑺]
𝒗=
𝑰
𝒌𝑴 (𝟏 + ) + [𝑺]
𝒌𝑰
kI è il rapporto tra le costanti cinetiche inversa e
diretta della reazione di formazione del complesso EI
Inibitori competitivi
L’effetto dell’inibitore competitivo è quello di far
aumentare Km come se l’enzima fosse diventato meno
efficace.
Grafico di Lineweaver-Burk
Invertendo i due termini dell’equazione di MichaelisMenten si ottiene una relazione lineare tra 1/V e
1/[S].
Equazione di Michaelis-Menten
V = Vmax [S]/([S] + KM)
Grafico di Lineweaver-Burk
1/V = 1/ Vmax + KM /(Vmax [S])
Riportando in grafico 1/V vs 1/[S] si ottiene una retta
di pendenza Km/Vmax, che incrocia l’asse delle
ordinate al valore 1/Vmax e quello delle ascisse al
valore -1/Km.
Grafico di Lineweaver-Burk
Inibitori non competitivi
Gli inibitori non competitivi sono quelli che pur
legandosi reversibilmente non competono con il
substrato.
L’aumento della concentrazione di substrato quindi non
spiazza questo tipo di inibitori dall’enzima.
Gli inibitori reversibili non competitivi sono in genere
degli inibitori allosterici.
Tuttavia in alcuni casi anche l’inibizione allosterica può
essere competitiva.
Possono essere considerati non competitivi anche tutti
gli inibitori irreversibili.
L’effetto dell’inibitore non competitivo è quello di
impedire ad una parte di enzima di interagire con il
substrato: è come se ci fosse minor quantità di enzima.
Inibitori non competitivi
L’equazione di Michaelis-Menten
inibitore non competitivo diventa:
𝒗𝒎𝒂𝒙
in
presenza
di
[𝑺]
𝑰
(𝟏 + )
𝒌𝑰
𝒗=
𝒌𝑴 + [𝑺]
La presenza dell’inibitore non competitivo in pratica
abbassa il valore di Vmax, lasciando invariato kM.
E’ come se ci fosse meno enzima con la stessa efficacia.
Inibitori non competitivi
Inibitori non competitivi
Inibitori incompetitivi
Grafico di Lineweaver-Burk
Grafico di Lineweaver-Burk
Inibitori irreversibili
Esempi di inibitori irreversibili sono i gas nervini, le
penicilline (solo nei batteri).
L’Orlistat è un inibitore irreversibile della lipasi
pancreatica usato nella cura dell’obesità.