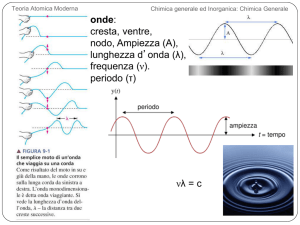
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
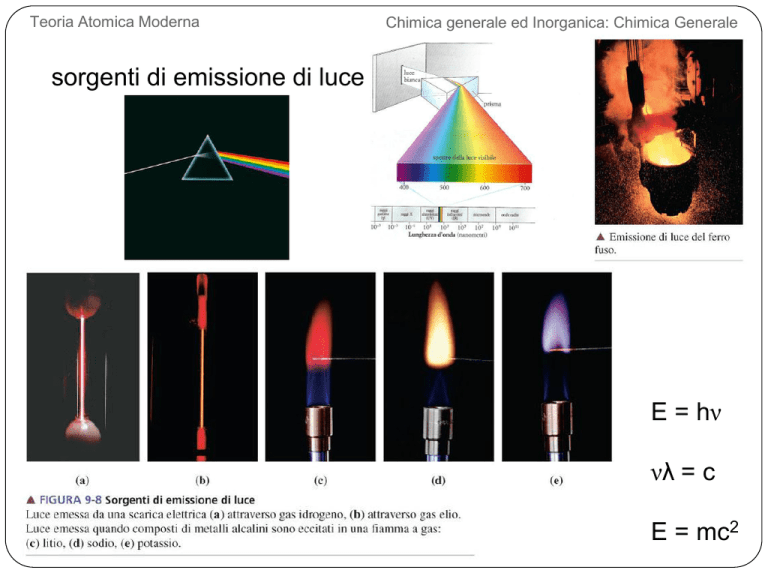
sorgenti di emissione di luce
E = hν
νλ = c
E = mc2
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-9 Spettro atomico, o a righe, dell’elio
Spettri Atomici:
emissione, assorbimento
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno - spettro a righe
serie di Balmer
equazione di Rydberg
æ 1 1ö
- ÷;
è 22 n2 ø
n = 3,2881´1015 ç
n>2
s-1
Dove n è un numero intero superiore a 2
Teoria quantica
L’energia come la materia non è continua (Max Plank)
Un corpo nero è un oggetto
(ideale) che assorbe tutta la
radiazione elettromagnetica
Non riflettendo il corpo nero
assorbe tutta l'energia incidente e,
per la conservazione dell'energia,
reirradia tutta la quantità di
energia assorbita
Radiazione del Corpo Nero
Modello di Plank – spiegazione del corpo nero
Gli atomi oscillano con la stessa frequenza la cui
energia è ricavabile da:
E=hn (equazione di Plank)
h è la costante di Plank pari a 6.62607•10-34 J•s
n la frequenza dell’oscillazione
Effetto fotoelettrico
Quando la luce colpisce la superficie di alcuni metalli, vengono
emessi elettroni
Effetto fotoelettrico
•
L’emissione ha luogo solamente quando la frequenza della
luce incidente supera un particolare valore di soglia n0
•
Il numero di elettroni emessi dipende dall’intensità della
luce incidente
•
L’enegia cinetica degli elettroni dipende dalla frequenza
della luce
La dipendenza dalla frequenza non poteva
essere spiegata con la teoria classica delle
onde
Nel 1905 Einstein propose che la
radiazione elettromagnetica avesse qualità
di tipo particellare – particelle di luce
chiamate FOTONI hanno l’energia
caratteristica data dall’equazione di
Plank
E=hn
hn
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Modello di Bohr
FIGURA 9-13 Modello di Bohr dell’atomo di idrogeno
•
L’elettrone si muove in orbite
circolari descritte dalla fisica classica
•
L’elettrone possiede una serie fissa di
orbite permesse, detti stati stazionari
•
Questa proprietà è detta momento
angolare e i valori possibili sono dati
da nh/2p con n=1, 2 …
•
Un elettrone può passare solo da
un’orbita permessa ad un’altra,
vengono coinvolte quantità fisse di
energia (quanti) assorbita o emessa
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
modello di Bohr
Il modello di Bohr permette di prevedere i
raggi delle orbite permesse in un atomo di
idrogeno
Rn=n2a0
Dove n=1, 2, 3… e a0=0.53 Å
E’ possibile prevedere anche velocità
dell’elettrone e la sua energia nelle varie
orbite
A distanza infinita l’energia dell’elettrone è
pari a 0 per convenzione
Si ha emissione di energia quando l’elettrone
è attratto nel nucleo e confinato nell’orbita n,
l’energia diventa negativa
En= -Rh/n2
Rh è una costante numerica pari a
2.179•10-18 J
Diagramma dei livelli energetici
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-15 Spettroscopia di emissione e di assorbimento
Spettroscopia:
di assorbimento
di emissione
Teoria di Bohr ed energia di ionizzazione
Se si somministra energia all’idrogeno fino a rimuovere l’unico elettrone
dello stato fondamentale avremo:
hnfotone= Ei = -E1
Dove Ei è detta energia di ionizzazione, essendo En= -Rh/n2 per n=1
hnfotone= Ei = -E1 = Rh/12 =Rh = 2.179•10-18 J
Il modello funziona anche per specie idrogenoidi, come He+ e Li+
En= -Z2Rh/n2 (ioni idrogenoidi)
Dove Z è il numero atomico
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Dualismo onda-particella
E mc hn
2
E = mc2
hn mc 2
hn
mc p
c
dove p è il momento del fotone
essendo:
n c
p
h
Applichiamo questa equazione all’elettrone,
considerando il suo momento pari a p=m•u
Dove m è la massa dell’elettrone e u la sual
velocità
L’elettrone è un’onda materiale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Diffrazione di raggi-X e di fasci di elettroni
esperimento di Davisson-Germer su cristallo di Ni e fogli di metallo
verifica sperimentale dell’ipotesi di De Broglie
G.P. Thomson - Nobel 1937 l’elettrone ha natura ondulatoria
esperimenti su fogli di Sn
J.J. Thomson - Nobel 1906 l’elettrone ha natura corpuscolare
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
oggetti macroscopici e microscopici
ℏ = 1,054571628(53)×10-34
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
principio d’indeterminazione
Non è possibile misurare simultaneamente posizione e momento con
grande precisione
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Onde Stazionarie
y=y0[sen(kx+ωt)+sen(kx–ωt)]
y=2y0[sen(kx)cos(ωt)]
lunghezza d’onda quantizzata
1,2,…
n=
onde stazionarie bidimensionali e tridimensionali
Nel 1927 Erwin Schrödinger suggerì che un elettrone
possedesse proprietà ondulatorie descrivibili con una
funzione matematica detta funzione d’onda ed indicata con
la lettera y
La funzione d’onda y deve corrispondere ad un’onda stazionaria entro i confini del
sistema descritto
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Meccanica Ondulatoria – Schrödinger
equazione agli autovalori
autovalori e autofunzioni
Meccanica Matriciale: Born – Heisenberg – Jordan, Dirac
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Equazione di Schrödinger - approccio postulativo
i)
ii)
iii)
iv)
FIGURA 9-18 L’elettrone come onda materiale
esiste una funzione delle coordinate delle particelle in un
sistema - Ψ(x1,y1,z1, …., xn,yn,zn,t)- che descrive lo stato del
sistema nella sua evoluzione temporale. La funzione
contiene tutta l’informazione relativa al sistema;
si può sempre trovare un’equazione che descriva l’evoluzione
temporale del sistema;
gli osservabili sperimentali possono essere calcolati
attraverso l’opportuna definizione di operatori quantomeccanici;
la funzione |Ψ|2 rappresenta una densità di probabilità - per
esempio riferendoci ad un sistema uni-particellare la
probabilità di trovare la particella in una data regione di
spazio in un dato tempo.
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
n 1,2, ... ∞
l 0,1, ... n-1
ml -l, -l+1, ... 0, ...+l
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-22 Livelli e sottolivelli di un atomo di idrogeno
orbitali idrogenoidi
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
FIGURA 9-24 Due rappresentazioni della funzione angolare dell’orbitale p
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
isoipse
ψ=±
.01
ψ=±
.01
Soluzione matematica dell’equazione di Schrödinger
Numeri quantici
n è il numero quantico principale
n=1, 2, 3, 4, …
l è il secondo numero quantico orbitale può assumere valore 0 e
ogni numero intero positivo non superiore a n
l= 0, 1, 2, 3, n-1
Il terzo numero quantico magnetico ml che può assumere ogni
valore intero sia positivo che negativo, tra –l ed l
ml = -l, -l+1, -l+2, … 0, 1, 2,…l -1, l
Teoria Atomica Moderna
FIGURA 9-26 I tre orbitali 2p
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
FIGURA 9-27 Sezioni dei cinque orbitali d
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
probabilità di trovare l’elettrone
e
densità di probabilità
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
FIGURA 9-25 Tre rappresentazioni della probabilità di trovare l’elettrone e della densità di carica per un orbitale
2p
Teoria Atomica Moderna
FIGURA 9-29 Lo spin elettronico visualizzato
esperimento di Stern-Gerlach
spin dell’elettrone
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
atomo idrogenoide e metodo auf-bau
FIGURA 9-33 Diagramma dell’energia degli orbitali dei primi tre gusci elettronici
principio di esclusione di Pauli
regola della massima
molteplicità di Hund
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Metodo auf-bau
• Gli elettroni occupano gli orbitali in modo da minimizzare l’energia
dell’atomo
• In un atomo non possono esistere due elettroni aventi tutti e quattro i numeri
quantici uguali (Principio di esclusione di Pauli)
• Quando sono disponibili orbitali di identica energia, gli elettroni inizialmente
occupano questi orbitali singolarmente (regola di Hund)
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale
Teoria Atomica Moderna
Chimica generale ed Inorganica: Chimica Generale