Liceo Scientifico E. Fermi Nuoro
Programma di Chimica e laboratorio
Classe III sez. E
a.s 20010/2011
Insegnante G. Guiso
La quantità chimica
La massa atomica e la massa molecolare
Contare per moli
La costante di Avogadro
Calcoli con le moli
Formule chimiche e composizione percentuale
La formula minima
Dalla formula minima alla formula molecolare
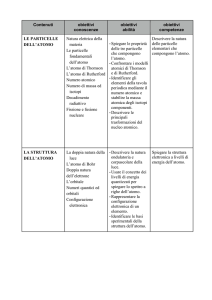
Le particelle dell’atomo
La natura elettrica della materia
La scoperta delle proprietà elettriche
Le particelle fondamentali dell’atomo
La scoperta dell’elettrone
L’esperimento di Rutherford
Il numero atomico
Il numero di massa e gli isotopi
La struttura dell’atomo
La doppia natura della luce:
▪natura ondulatoria e natura corpuscolare
Gli spettri: continuo e a righe
L’atomo di Bohr
La doppia natura dell’elettrone
L’elettrone e la meccanica quantistica
Il principio d’indeterminazione di Heisenberg
Numeri quantici e orbitali
Principio di esclusione di Pauli e principio della massima molteplicità di Hund
Dall’orbitale alla forma dell’atomo
L’atomo di idrogeno secondo la meccanica quantistica
La configurazione degli atomi polielettronici
Il sistema periodico degli elementi
La classificazione degli elementi
Il sistema periodico di Mendeleev
La moderna tavola periodica
La struttura della tavola periodica
I simboli di Lewis
Le proprietà periodiche degli elementi:
▪raggio atomico
▪l’energia di ionizzazione
▪la periodicità dell’energia di ionizzazione
▪l’affinità elettronica
▪l’elettronegatività
Metalli, non metalli e semimetalli
I legami chimici
L’energia di legame
I gas nobili e la regola dell’ottetto
Il legame covalente: puro e polare
I legami covalenti multipli
Il legame covalente dativo
Il legame ionico
Il legame metallico
La tavola periodica e i legami tra gli elementi
La forma delle molecole
La teoria VSEPR:
▪molecole con legami covalenti semplici
▪molecole con legami multipli o coppie di elettroni liberi sull’atomo centrale
I limiti della teoria di Lewis
Gli ibridi di risonanza
Le forze intermolecolari
Molecole polari e apolari
Le forze dipolo-dipolo e le forze di London
Il legame a idrogeno
Classificazione e nomenclatura dei composti
La classificazione dei composti binari con e senza ossigeno e relativa nomenclatura
tradizionale ed IUPAC
La classificazione degli acidi e degli idrossidi e relativa nomenclatura tradizionale ed
IUPAC
La classificazione dei Sali e relativa nomenclatura tradizionale ed IUPAC
Attività pratica
Saggi alla fiamma
Caratteristiche dei metalli e non metalli
Gli alunni
L’insegnante