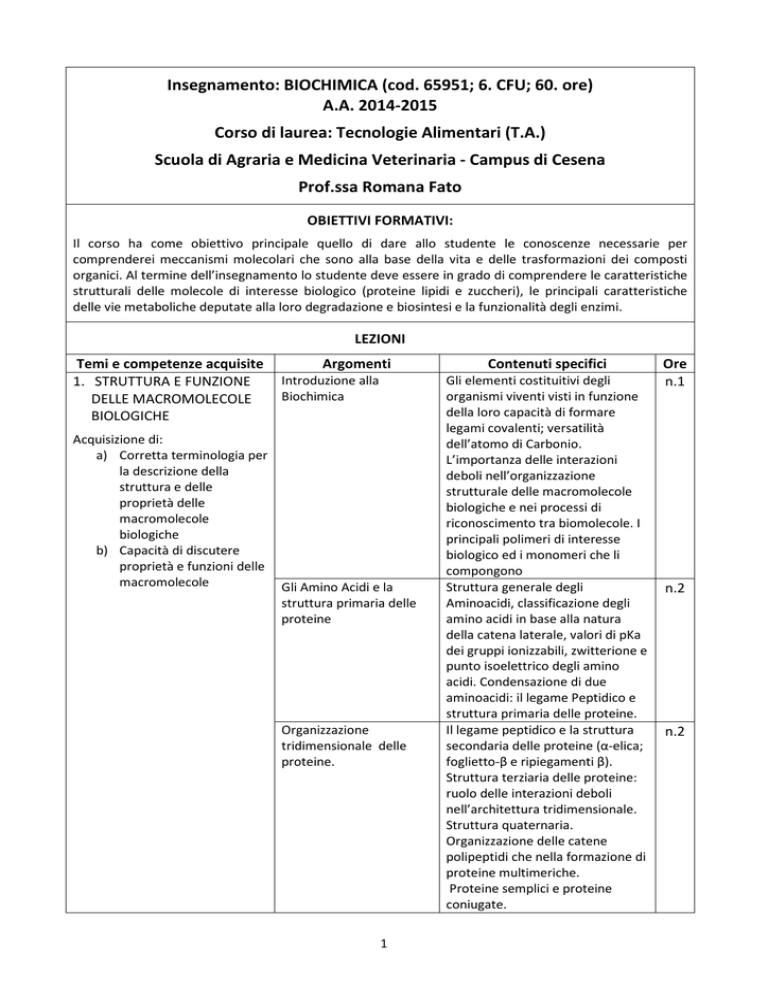
Insegnamento: BIOCHIMICA (cod. 65951; 6. CFU; 60. ore)
A.A. 2014-2015
Corso di laurea: Tecnologie Alimentari (T.A.)
Scuola di Agraria e Medicina Veterinaria - Campus di Cesena
Prof.ssa Romana Fato
OBIETTIVI FORMATIVI:
Il corso ha come obiettivo principale quello di dare allo studente le conoscenze necessarie per
comprenderei meccanismi molecolari che sono alla base della vita e delle trasformazioni dei composti
organici. Al termine dell’insegnamento lo studente deve essere in grado di comprendere le caratteristiche
strutturali delle molecole di interesse biologico (proteine lipidi e zuccheri), le principali caratteristiche
delle vie metaboliche deputate alla loro degradazione e biosintesi e la funzionalità degli enzimi.
LEZIONI
Temi e competenze acquisite
1. STRUTTURA E FUNZIONE
DELLE MACROMOLECOLE
BIOLOGICHE
Argomenti
Introduzione alla
Biochimica
Acquisizione di:
a) Corretta terminologia per
la descrizione della
struttura e delle
proprietà delle
macromolecole
biologiche
b) Capacità di discutere
proprietà e funzioni delle
macromolecole
Gli Amino Acidi e la
struttura primaria delle
proteine
Organizzazione
tridimensionale delle
proteine.
1
Contenuti specifici
Gli elementi costituitivi degli
organismi viventi visti in funzione
della loro capacità di formare
legami covalenti; versatilità
dell’atomo di Carbonio.
L’importanza delle interazioni
deboli nell’organizzazione
strutturale delle macromolecole
biologiche e nei processi di
riconoscimento tra biomolecole. I
principali polimeri di interesse
biologico ed i monomeri che li
compongono
Struttura generale degli
Aminoacidi, classificazione degli
amino acidi in base alla natura
della catena laterale, valori di pKa
dei gruppi ionizzabili, zwitterione e
punto isoelettrico degli amino
acidi. Condensazione di due
aminoacidi: il legame Peptidico e
struttura primaria delle proteine.
Il legame peptidico e la struttura
secondaria delle proteine (α-elica;
foglietto-β e ripiegamenti β).
Struttura terziaria delle proteine:
ruolo delle interazioni deboli
nell’architettura tridimensionale.
Struttura quaternaria.
Organizzazione delle catene
polipeptidi che nella formazione di
proteine multimeriche.
Proteine semplici e proteine
coniugate.
Ore
n.1
n.2
n.2
Meccanismi di
ripiegamento delle
Proteine
Emoglobina e
Mioglobina: Relazione
struttura funzione.
Le membrane biologiche:
Acquisizione della
capacità di descrivere la
struttura dei lipidi e delle
membrane per capirne e
discuterne le proprietà e
le funzioni correlandole
con la loro composizione.
2. BIOENERGETICA ED ENZIMI
La bioenergetica
Acquisizione della capacità di
applicare i principi di base
della termodinamica alle
variazioni energetiche
associate ai processi
metabolici.
Termodinamica e
spontaneità dei processi
metabolici
Gli enzimi:
Acquisizione di conoscenze
relative alla funzione degli
enzimi come catalizzatori
biologici ed al loro ruolo nella
cinetica delle reazioni che
2
Dinamica del ripiegamento delle
proteine, ruolo dei chaperoni
molecolari nei processi di folding.
Funzioni delle proteine in
relazione alla loro forma. Stabilità
della forma nativa delle proteine.
Curve di saturazione: effetto dei
legami cooperativi e non
cooperativi. Definizione di
proteina allosterica e ruolo dei
modulatori allosterici. Cenni
sull’effetto della sostituzione di un
aminoacido sulla
struttura/funzione della proteina:
es.: emoglobina S dell’anemia
Falciforme.
I lipidi: natura chimica, struttura e
proprietà: Classificazione dei lipidi:
acidi grassi, trigliceridi, fosfolipidi,
colesterolo e derivati.
Struttura delle membrane
biologiche: Struttura e
caratteristiche chimico fisiche di
micelle e doppi stati fosfolipidici.
Modello a mosaico fluido e
diffusione laterale dei lipidi e delle
proteine di membrana. Cenni sui
lipid rafts.
Il trasporto di membrana:
trasporto attivo e passivo:
diffusione semplice e facilitata.
Definizione e significato biologico
dell’energia libera; relazione tra
energia libera, entropia ed
entalpia di un sistema. Relazione
tra energia libera e costante di
equilibrio. Rapporto tra energia
libera standard e reale.
Reazioni di trasferimento di
energia e composti ad alta
energia: composti fosforilati ad
alta energia (es.: ATP, 1,3bisfosfoglicerato,
fosfoenolpiruvato) e nucleotidi
ridotti (NADH, NADPH e FADH2).
n.2
n.5
n.2
n.2
n.1
n.2
n.2
avvengono negli organismi
viventi per meglio
comprenderne il corretto
utilizzo nei processi di
trasformazione e di
conservazione degli alimenti
Gli enzimi e la cinetica
enzimatica
Controllo dell’attività
enzimatica.
Proprietà generali degli enzimi,
classificazione e specificità.
L’energia di attivazione e la
velocità delle reazioni. Meccanismi
di catalisi enzimatica. Struttura del
sito catalitico e stabilizzazione
dello stato di transizione e velocità
della reazione.
La cinetica delle reazioni
catalizzate da un enzima:
definizione dello stato stazionario
ed equazione di MichaelisMenten. Significato di Vmax e di
Km. Definizione di costante
catalitica (kcat) ed efficienza
catalitica.Grafico dei doppi
reciproci e sua utilità nella
determinazione delle costanti
cinetiche di una reazione
enzimatica. Effetto della
temperatura e del pH sulla velocità
delle reazioni catalizzate dagli
enzimi. Gli enzimi allosterici:
caratteristiche e ruolo dei
cambiamenti conformazionali
cooperativi nella modulazione
dell’attività catalitica.
Principali meccanismi di
regolazione dell’attività degli
enzimi: ruolo dei modulatori
allosterici e delle modulazioni
covalenti. Regolazione a feedback. Gli zimogeni e meccanismi di
attivazione irreversibile.
Inibitori irreversibili e reversibili.
Classificazione degli inibitori
reversibili in competitivi, incompetitivi e non-competitivi.
Effetto delle varie classi di inibitori
sui parametri cinetici di un enzima
(Km e Vmax). Inibitori suicidi.
3
n.2
n.4
n.4
n.3
Le vie dell’informazione:
Acquisizione delle
conoscenze di base sulla
struttura degli acidi
nucleici e sui principali
meccanismi di
duplicazione, trascrizione
e sintesi delle proteine
3. METABOLISMO
Acquisizione delle conoscenze di
base delle principali vie
metaboliche allo scopo di
comprendere le diverse strategie
messe in atto dagli organismi
viventi per catturare l’energia
libera dall’ambiente che li
circonda.
Introduzione al
metabolismo e
Metabolismo degli
zuccheri.
4
Struttura dei nucleotidi: zucchero
a cinque atomi di carbonio (ribosio
e deossiribosio), gruppo fosforico
in posizione 5’ e basi azotate per la
sintesi del DNA e dell’RNA.
Differenze tra deossiribonucleotidi
e ribonucleotidi. Reazione di
polimerizzazione e formazione
degli acidi nucleici (DNA ed RNA).
Struttura a doppia elica del DNA e
complementarietà tra le basi
azotate.
Diverse funzioni dell’RNA.
n.2
Meccanismi di duplicazione,
trascrizione e sintesi delle
proteine: DNA polimerasi e
duplicazione del DNA.
RNA polimerasi e sintesi
dell’mRNA.
tRNA e sintesi delle proteine.
Organizzazione generale delle vie
metaboliche e loro
compartimentazione cellulare.
Definizione di via catabolica ed
anabolica. I cicli del substrato.
Definizione della tappa di
comando di una via metabolica,
meccanismi di controllo allosterico
e covalente.
Ruolo dell’ATP nella spontaneità
delle vie metaboliche. Carica
energetica cellulare e stato
stazionario.
n.2
n.2
La Glicolisi.
2 fasi: Fase si investimento
energetico: cinque reazioni da
Glucosio a 2 molecole di
gliceraldeide 3-Fosfato.
Fase di recupero energetico:
cinque reazioni da Gliceraldeide 3fosfato a Piruvato.
La resa netta è di 2 molecole di
ATP guadagnate per ogni molecola
di glucosio trasformato.
Destino metabolico del piruvato:
1) aerobico: decarbossilazione
ossidativa e trasformazione in
acetil CoA
2) anaerobico: fermentazione
lattica / alcolica.
Ruolo della fosfofruttochinasi nel
controllo della glicolisi.
La Gluconeogenesi.
Il fegato e il rene possono
sintetizzare glucosio da lattato,
piruvato e amminoacidi.
7 delle 10 reazioni della glicolisi
sono utilizzate anche nella
gluconeogenesi, le tre reazioni
irreversibili della glicolisi sono
sostituite: la piruvato chinasi è
sostituita dalle reazioni della
piruvato carbossilasi e della
fosfoenolpiruvato carbossichinasi.
Fosfofruttochinasi ed esochinasi
sono sostituite da reazioni
catalizzate da fosfatasi.
La glicolisi e la gluconeogenesi
sono reciprocamente regolate
tramite effetti allosterici,
fosforilazioni e cambiamenti della
velocità di sintesi degli enzimi.
5
n.4
6
La via del Pentosio fosfato:
1. Reazioni Ossidative, che portano
alla formazione di NADPH e di
ribulosio-5-fosfato (Ru5P).
2. Reazioni di isomerizzazione e di
epimerizzazione , che trasformano
il Ru5P in ribosio-5-fosfato (R5P)
oppure in xylulosio-5-fosfato
(Xu5P).
3. Una serie di tagli di legami C-C e
di reazioni di condensazione che
servono a riciclare gli intermedi
per riinserirli nella via glicolitica.
n.1
Metabolismo del glicogeno:
Degradazione del glicogeno: ruolo
della glicogeno fosforilasi e
dell’enzima deramificante.
La biosentesi del glicogeno:
Formazione dell’UDP-glucosio.
Ruolo della glicogeno sintasi, della
glicogenina e dell’enzima
ramificante.
Regolazione del metabolismo del
glicogeno: ruolo dell’insulina e del
glucagone nella regolazione del
metabolismo del glicogeno.
n.2
Il ciclo di Krebs: via catabolica
comune al metabolismo di tutti i
nutrienti (glucidi, protidi e grassi).
• Gli otto enzimi del ciclo di Krebs
catalizzano le reazioni di
degradazione dell’acetil CoA.
• Due reazioni producono CO2, una
reazione produce GTP e quattro
reazioni generano i coenzimi
ridotti NADH o FADH2.
n.2
La fosforilazione ossidativa: uso
dell’ossigeno molecolare come
accettore finale degli equivalenti
riducenti liberati dal catabolismo
cellulare. Organizzazione della
catena di trasporto degli elettroni
e formazione del gradiente
protonico transmembrana ed
ipotesi chemiosmotica per la
sintesi di ATP.
n.3
Il metabolismo dei lipidi:
cenni sui meccanismi di
digestione e di
assorbimento intestinale
dei lipidi. Catabolismo
degli acidi grassi.
Il metabolismo degli
Amino Acidi:
Acquisizione dei principali
concetti riguardo la
degradazione degli
aminoacidi e delle vie di
eliminazione dell’azoto.
Catabolismo degli acidi grassi:
ruolo della carnitina nel
trasferimento degli acidi grassi
nei mitocondri. Reazioni della
beta-ossidazione per la
degradazione di acidi grassi
saturi ed insaturi.
n.2
I corpi chetonici: definizione e
struttura di questi composti; ruolo
dei corpi chetonici nel digiuno
prolungato.
n.2
Biosintesi degli acidi grassi:
sistema dell’acido grasso sintasi.
Meccanismi di trasferimento
dell’acetil-CoA dai mitocondri al
citosol.
Ruolo del Malonil-CoA nella
biosintesi degli acidi grassi.
Cenni sulla formazione di acidi
grassi saturi diversi dall’acido
Palmitico e sulla introduzione di
insaturazioni.
La degradazione delle proteine:
ruolo delle proteasi.
Definizione di aminoacidi
chetogenici e glucogenici.
Le reazioni di transaminazione
interconvertono tra loro un
amminoacido e un a-cheto acido.
n.1
La degradazione degli Aminoacidi:
destino del gruppo amminico e
ciclo dell’urea.
Ruolo del glutammato e della
glutammina nel trasporto
dell’ammoniaca dai vari tessuti al
fegato.
La deaminazione ossidativa del
glutammato rilascia ammoniaca da
eliminare.
Eliminazione dell’ammoniaca e
ciclo dell’urea.
n.1
n.2
E’ possibile inserire di seguito alla tabella la descrizione testuale delle “ESERCITAZIONI, SEMINARI
E VISITE GUIDATE”, i cui contenuti possono essere descritti sia con lo stesso livello di dettaglio
utilizzato per le lezioni frontali (ossia indicando le attività svolte per ciascun tema, argomento e/o
contenuto specifico), sia in modo meno analitico, descrivendo le attività previste (ad es. visite
presso impianti di trasformazione, esercitazioni in laboratorio, seminari tenuti da esperti, ecc.).
7












