ISTITUTO D’ISTRUZIONE SUPERIORE STATALE
”G. PEANO – ROSA” NERETO (TE)
PROGRAMMA DI SCIENZE NATURALI
Anno Scolastico 2012/2013
Indirizzo: Liceo Scientifico opzione Scienze Applicate
Classe: II Sezione: G
BIOLOGIA
Campi di studio della biologia,organizzazione gerarchica degli organismi viventi, caratteristiche degli
organismi viventi.
Il metodo scientifico (Fleming e la scoperta della penicillina)
Le molecole della vita: elementi, composti, struttura dell’atomo (particelle subatomiche, numero atomico,
numero di massa, disposizione degli elettroni sui gusci elettronici); legami chimici (legame ionico, covalente
semplice, doppio, triplo).
Le proprietà dell’acqua: caratteristiche chimiche (polarità e legami idrogeno); proprietà di interesse
biologico (coesione, adesione tensione superficiale, resistenza alle variazioni di temperatura, densità del
ghiaccio e potere solvente).
Proprietà del carbonio: caratteristiche dell’atomo di carbonio, gruppi funzionali dei principali composti
organici, reazioni di sintesi e di demolizione delle molecole organiche, concetto di monomero e polimero.
I carboidrati: struttura chimica e funzione, monosaccaridi (pentosi ed esosi); disaccaridi, polisaccaridi di
origine animale e vegetale.
I lipidi: struttura chimica delle molecole (acidi grassi e glicerolo) e funzione; trigliceridi, i fosfolipidi e gli
steroidi.
Le proteine: struttura chimica e funzioni, struttura degli amminoacidi, legame peptidico, il concetto di
denaturazione, struttura primaria, secondaria, terziaria e quaternaria.
Gli acidi nucleici: struttura chimica e funzioni, il DNA e l’RNA.
Introduzione alla cellula: il microscopio ottico ed elettronico (TEM e SEM), le dimensioni delle cellule.
La cellula procariote: strutture fondamentali.
La cellula eucariote:la struttura e gli organuli della cellula eucariote, confronto tra cellula eucariote animale
e vegetale, la membrana plasmatica, il nucleo, i ribosomi, il reticolo endoplasmatico(liscio e
ruvido),apparato di Golgi, i lisosomi, i vacuoli, i mitocondri, i cloroplasti, il citoscheletro, ciglia e flagelli, la
matrice extracellulare, la parete cellulare.
Struttura e funzioni della membrana plasmatica: le proteine della membrana plasmatica, il trasporto
passivo (diffusone semplice e facilitata), l’osmosi, il trasporto attivo (uniporto, simporto e antiporto),
esocitosi e endocitosi
Il concetto di soluzione ipertonica, ipotonica e isotonica, il comportamento delle cellule animali e vegetali
in soluzioni di diversa tonicità.
Le cellule e l’energia: diverse forme di energia, leggi della termodinamica (primo e secondo principio della
termodinamica), le reazioni chimiche esoergoniche ed endoergoniche.
Il metabolismo cellulare: anabolismo e catabolismo.
L’ATP: il lavoro cellulare e il ciclo dell’ATP.
Le tappe principali della fotosintesi: fase luminosa, fase oscura.
Le tappe principali della respirazione cellulare: glicolisi, ciclo di Krebs, fosforilazione ossidativa.
Gli enzimi: l’energia di attivazione, il ruolo degli enzimi, la struttura degli enzimi, le condizioni ottimali per
l’azione degli enzimi.
La divisione cellulare e la riproduzione: la riproduzione asessuata e sessuata, la riproduzione dei procarioti
(la scissione binaria).
Il ciclo cellulare delle cellule eucariote e la mitosi: la struttura dei cromosomi degli eucarioti, la struttura
dei cromosomi duplicati, il ciclo cellulare ( interfase e fase mitotica), fasi della mitosi, la citodieresi.
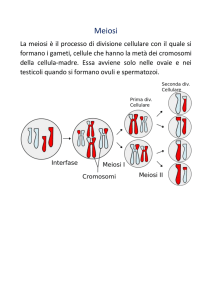
La divisione cellulare per meiosi: il corredo cromosomico delle cellule somatiche (cromosomi omologhi,
autosomi, cromosomi sessuali), il cariotipo, il corredo cromosomico dei gameti, la meiosi: meiosi I e meiosi
II (cenni), analogie e differenze tra mitosi e meiosi.
CHIMICA
La materia e i suoi stati
Proprietà e trasformazioni della materia: trasformazioni fisiche e chimiche della materia, ,proprietà
elettriche della materia.
Sostanze pure e miscugli:sostanze pure, miscugli omogenei ed eterogenei, metodi di separazione
(distillazione e filtrazione).
Le caratteristiche delle soluzioni: vari tipi di soluzioni, il concetto di solvente e soluto, sostanze miscibili e
immiscibili, soluzioni concentrate e diluite, la solubilità e le soluzioni sature.
Elementi e composti: elementi e composti, gli elementi in natura, simboli e formule chimiche, le unità base
di elementi e composti, la legge della composizione costante.
Atomo e particelle subatomiche: la teoria atomica di Dalton, le particelle subatomiche, gli ioni (cationi e
anioni).
L’atomo nucleare e la sua massa: il modello atomico di Thomson, modello atomico di Rutherford,
l’esperimento di Rutherford, il numero atomico e numero di massa, gli isotopi, la massa atomica, il
significato di unità di massa atomica, il concetto di abbondanza relativa, come si calcola la massa atomica di
un elemento.
La tavola periodica degli elementi: la tavola periodica di Mendeleev , la tavola periodica moderna, metalli,
non metalli, semimetalli, gruppi, periodi, famiglie chimiche.
Formule e massa molecolare: la massa molecolare, come si calcola la massa molecolare.
La mole: il significato di mole, il numero di Avogadro, la massa molare, come si convertono le moli in
massa, come si converte la massa in moli, dalle moli al numero di particelle.
Massa ed energia delle trasformazioni chimiche: le equazioni chimiche, la legge di conservazione della
massa, l’energia nelle trasformazioni chimiche, la legge di conservazione dell’energia, il legame tra massa e
energia.
Le reazioni chimiche: come si manifestano le reazioni chimiche, le equazioni chimiche dal punto di vista
qualitativo e quantitativo, il bilanciamento delle equazioni chimiche.
Nereto, 08/06/2013
La docente
Maria Antonietta Belardinelli