C.I. MEDICINA DI LABORATORIO
MICROBIOLOGIA CLINICA
CL MEDICINA E CHIRURGIA – AA 2014-2015
Modulo 4: DIAGNOSI DI LABORATORIO
DELLE INFEZIONI VIRALI
Giovanni Di Bonaventura, PhD
Università “G. d’Annunzio” di Chieti-Pescara
Nuovo Polo Farmacia, corpo D, III livello (tel 0871 3554812)
Centro Scienze dell’Invecchiamento (Ce.S.I.), V livello (tel 0871 541519)
E-mail: [email protected]
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
APPROCCIO GENERALE
Presuppone un’adeguata diagnosi clinica:
Buona conoscenza della patogenesi delle infezioni sospette
corretto inquadramento differenziale sul piano clinico per restringere lo spettro delle
indagini da eseguire
corretto prelievo ed invio di un adeguato campione clinico
Diagnosi di laboratorio indispensabile quando:
sia prospettabile uno specifico intervento profilattico o terapeutico
il quadro clinico può essere sostenuto da più virus non correlati (forme esantematiche,
forme enteriche acute, infezioni respiratorie)
sia necessario seguire “particolari” categorie di pazienti (ad esempio, immunodepressi)
si predisponga il controllo di preparazioni commerciali di emoderivati
si ricerchi l’agente eziologico di nuove o gravi patologie
si eseguano indagini a carattere epidemiologico su una determinata popolazione
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
APPROCCIO GENERALE
La diagnosi di laboratorio di una infezione virale può essere eseguita seguendo
due approcci differenti:
approccio DIRETTO, a cui è riconducibile una ricerca di tipo virologico, si avvale di
tecniche atte ad identificare il virus direttamente nel campione clinico. Ad eccezione
dell’isolamento colturale, sono metodiche rapide, in grado di fornire una risposta al
quesito diagnostico in poche ore o, al massimo, in giornata.
isolamento virale (coltivazione)
ricerca di particelle virali (microscopia)
ricerca di antigeni virus-specifici (immunoenzimatica, IF)
ricerca di acidi nucleici virali (biologia molecolare)
approccio INDIRETTO, a cui è riconducibile una diagnosi di tipo sierologico, si avvale di
tecniche in grado di rilevare nel siero dei pazienti la presenza di anticorpi contro
specifici antigeni virali:
ricerca di anticorpi vs antigeni virus-specifici
RICERCA VIRALE
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
ISOLAMENTO (COLTIVAZIONE) VIRALE
E’ il GOLD STANDARD tra le metodiche utilizzate in diagnosi virologica.
I virus sono patogeni “intracellulari obbligati”,
quindi:
richiedono l’inoculazione in ospiti viventi adeguati (cioè: sensibili e permissivi)
OSPITI PER L’ISOLAMENTO DI:
Fagi (batteriofagi o virus batterici)
Batteri
Virus animali
Animale
Uova embrionate
Coltura cellulare animale
Virus vegetali
Pianta
Coltura cellulare vegetale
ISOLAMENTO (COLTIVAZIONE) VIRALE
OSPITI PER VIRUS ANIMALI
Animale
Topo, coniglio, maiale
Embrione di pollo (uova embrionate)
Ancora usata per la produzione di vaccini (influenzali)
Colture cellulari
Coltura di cellule adese a substrato (monostrato) oppure in sospensione (tessuto emopoietico: linfociti).
Tre tipologie di coltura, a seconda dello spettro di infezione (n specie virali infettanti) e vita media:
Colture “primarie”: cellule ottenute a seguito di separazione chimica/meccanica da campione
bioptico. Ampio spettro di infezione virale ma vita a breve termine (1 generazione). Esempio: cellule
di rene (canine, umane o di coniglio) per l’isolamento di Paramyxovirus, Enterovirus, Adenovirus.
Colture semicontinue (diploidi): derivano dall’embrione umano. Spettro di infezione simile alle
primarie, possono però essere mantenute per più generazioni (fino a 100). Esempio: fibroblasti fetali
umani per isolamento di HSV, VZV, CMV, Adenovirus.
Colture continue o “trasformate”: cellule trasformate (immortalizzate) ed aneuploidi, si replicano
indefinitamente, sebbene presentino uno spettro di infezione più ridotto. Esempio: cellule HeLa,
Caco-2, Hep-2.
ISOLAMENTO (COLTIVAZIONE) VIRALE
TECNICA DI ISOLAMENTO
Procedura:
1.Trattamento del campione per limitare la inattvazione virale (es. neutralizzazione pH
urine; decontaminazione batterica in campioni altamente contaminate)
2.Semina del campione
3.Mantenimento ed ispezione delle colture (33-37°C; 1-2 volte al giorno)
4.Rilevazione di avvenuta replicazione virale.
formazione di placche (aree localizzate di lisi/distruzione cellulare)
comparsa di “effetti citopatici caratteristici” (CPE)
5.Tipizzazione del virus
ISOLAMENTO (COLTIVAZIONE) VIRALE
TECNICA DI ISOLAMENTO
Esposizione del monostrato
cellulare al campione
Rilevazione di antigeni virali
(virus a crescita lenta o CPE-)
Effetto citopatico
(CPE o placca)
ISOLAMENTO (COLTIVAZIONE) VIRALE
MATERIALI BIOLOGICI
ISOLAMENTO (COLTIVAZIONE) VIRALE
CYTOPATHIC EFFECT (CPE)
Sincizio: cellule giganti multinucleate formate dalla fusione, virus-indotta,
di singole cellule.
Paramyxovirus, Herpesvirus, HIV, RSV.
Virus del morbillo. Sezione istologica di
biopsia polmonare in paziente
immunocompromesso con polmonite.
RSV in coltura cellulare.
Virus del morbillo. Cellule A549
(carcinoma gastrico umano).
ISOLAMENTO (COLTIVAZIONE) VIRALE
CPE
Corpi di inclusione: cambiamenti istopatologici cellulari causati, direttamente od
indirettamente, dal virus:
corpi del Negri (Rhabdovirus)
inclusioni di Cowdry di tipo A (Herpesvirus, varicella-zoster)
inclusioni ad “occhio di gufo” (CMV)
CMV: inclusioni ad
“occhio di gufo”
ISOLAMENTO (COLTIVAZIONE) VIRALE
PLACCA LITICA
Formazione di placche litiche,
evidenziate a seguito di
colorazione con cristalvioletto
Vaiolo su cellule di rene di
scimmia (BSC40). Placca
singola, 48 h. MOI: 1
Vaiolo su cellule di rene di
scimmia (BSC40). Numerose
placche, 48 h. MOI: 100
Molteplicità di infezione (Molteplicity Of Infection, MOI): rapporto tra numero di agenti
infettanti (batteri, virus) e numero di cellule infettate, presenti in un sistema sperimentale.
Fields Virology, 4th ed, Knipe & Howley, eds, Lippincott Williams & Wilkins, 2001, Fig. 2-4
ISOLAMENTO (COLTIVAZIONE) VIRALE
PRO & CON
Consente di isolare, tipizzare e conservare il virus.
Possibilità di isolare virus non sospettabili o non conosciuti al momento
dell’isolamento.
Importante per HIV (diagnosi precoce in bambini nati da madri sieropositive) e CMV
(diagnosi in bambini da madri con infezione in atto od immunodeficienti)
Altamente sensibile e specifica, se associata ad ID sierologica
TUTTAVIA:
Richiede lunghi tempi di esecuzione, strumentazione dedicata, elevato “expertise”.
E’ necessario un sospetto eziologico, in quanto i virus presentano un tropismo
cellulare.
Dipendente dalla presenza di virus vitali nel campione (la refrigerazione inattiva i
virus «enveloped»).
Impossibilità di coltivare alcuni virus (HPV, EBV, HBV, HCV, rotavirus).
Poco sensibile (in caso di infezioni paucivirali) e specifico, se non associata ad altri
tests (sierologici).
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
OSSERVAZIONE MICROSCOPICA
Le ridotte dimensioni virali (20-300 nm) richiedono l’utilizzo della microscopia elettronica.
Il campione viene attraversato da un fascio di elettroni in un sistema sotto vuoto; in tal modo, viene
proiettata una immagine, ingrandita centinaia di migliaia di volte, su uno schermo a
fluorescenza.
L’osservazione microscopica ha valore identificativo in quanto fornisce informazioni sulla forma,
dimensioni, struttura ed organizzazione virale.
Causa scarsa sensibilità della tecnica, il campione viene generalmente concentrato
(ultracentrifugazione) prima dell’osservazione, tranne che per campioni fecali o lesioni da HSV
(1011 virioni/ml). E’ possibile aumentare la sensibilità mediante utilizzo di anticorpi specifici
(immunomicroscopia elettronica).
La tecnica della colorazione negativa è quella più frequentemente utilizzata:
adsorbimento virale su retino, quindi colorazione con un sale
metallico pesante elettron-denso (acetato di uranile, acido
fosfotungstico).
colorazione del fondo ma non delle particelle virali (contrasto
negativo); in realtà, anche i virus assorbono una piccola quantità di
colorante che ne mette in evidenza alcuni dettagli strutturali.
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
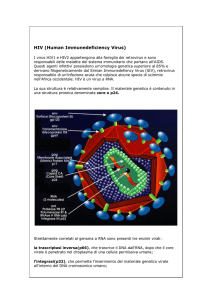
OSSERVAZIONE MICROSCOPICA
HIV
Ebola virus
SARS
HBV
MICROSCOPIA ELETTRONICA
PRO & CON
Consente di identificare nuovi virus (es. coronavirus della SARS)
Rapida (15-30 min)
Specifica
TUTTAVIA:
Scarsa sensibilità: 106-107 virioni/ml
Elevati costi di gestione
Richiesta di elevato expertise
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ANTIGENI VIRALI
E’ necessario disporre di sieri immuni (anticorpi anti-antigene) specifici.
Tecnica impiegata nella diagnosi di numerose infezioni:
A seconda del virus e, quindi, della tipologia del materiale da esaminare (cellule,
feci, sangue-siero) possono essere applicate differenti tecniche:
Immunofluorescenza (IF)
Immunoperossidasi
Immunoenzimatica
In genere, la sensibilità di queste tecniche è maggiore di quella associata
all’isolamento virale.
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ANTIGENI VIRALI
Immunofluorescenza (IF): rivelazione “fluorescente” del complesso Ag-Ab mediante tecnica
«diretta» od «indiretta»
IF impiegata per la ricerca di:
antigeni virali presenti nelle cellule epiteliali di sfaldamento delle vie respiratorie (BAL,
aspirato naso-faringeo) (adenovirus, coronavirus, VRS, virus influenzali e para) o di occhio
e cute (HSV, VZV);
antigene precoce pp65 di CMV nei leucociti infetti.
Coronavirus in cellule
epiteliali di sfaldamento
CMV all’interno di leucociti
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ANTIGENI VIRALI
Immunoperossidasi (IP): rivelazione “colorimetrica” del complesso Ag-Ab
similare alla IF, sebbene l’anticorpo sia marcato con perossidasi di rafano che, in
presenza di idoneo substrato, sviluppa una reazione colorimetrica
molto utile se applicata a tessuti integri, colorati per l’istochimica (definizione
delle relazioni spaziali tra antigene virale e strutture cellulari).
Ricerca di antigeni specifici mediante ELISA
Ricerca immunoistochimica antigenica del West
Nile virus nel cervello di hamsters infetti
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ANTIGENI VIRALI
Immunoenzimatica (ELISA, EIA): rivelazione “colorimetrica” complex Ag-Ab.
“sandwich test”: anticorpo (specifico per un antigene) di cattura adsorbito ad una superficie
plastica (pozzetto o biglia); legame con anticorpo di rilevazione direttamente marcato con
un enzima o viene riconosciuto da un terzo anticorpo marcato in grado di legare Fc delle Ig
utilizzabile anche per antigeni “solubili”
non è influenzata dalla qualità (prelievo, trasporto) del campione
E’ la metodica più frequentemente impiegata nei laboratori di virologia.
Adatta per la ricerca di antigeni virali cellulo-associati, antigeni in fase fluida (sangue, liquor,
siero) od antigeni rilasciati nel surnatante delle co-colture infette.
Impiegata nella diagnosi rapida di virus respiratori (influenza, RSV), enterici (rotavirus), epatici
(HBV) e HIV.
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ACIDI NUCLEICI
Permettono la rilevazione di quantità infinitesimali di acidi nucleici virali
Tecnica rapida ed altamente sensibile (sensibilità teorica: 1 virione)
Trovano particolare applicazione nella ricerca di virus:
difficili o impossibili da coltivare (HPV, HIV, poliomavirus)
a lenta crescita (CMV, VZV)
ad elevata (enterovirus) o scarsa variabilità antigenica
Non influenzata dalla qualità del campione e dalla sua vitalità
Differenti tipologie di saggi molecolari:
Tecniche che amplificano la sequenza bersaglio (PCR, TMA)
Polymerase Chain Reaction (PCR): amplificazione di DNA target e rivelazione
elettroforetica
Transcription Mediated Amplification (TMA): amplificazione isotermica che impiega
una transcrittasi inversa e T7 RNA polimerasi (maggiore efficienza di amplificazione
vs PCR)
Tecniche che amplificano il segnale di rilevazione (bDNA, HC):
bDNA: rilevazione in chemioluminescenza (sonde marcate con fosfatasi alcalina
complementari alla molecola di bDNA)
Hybrid capture (HC): ibridazione in fase liquida del DNA target denaturato con sonda
a RNA specifica per la sequenza in esame
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ACIDI NUCLEICI
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ACIDI NUCLEICI: PCR
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RICERCA DI ACIDI NUCLEICI: HYBRID CAPTURE (HC)
HC assay: utilizzato per la ricerca e
la genotipizzazione di HPV
DIAGNOSI SIEROLOGICA DELLE INFEZIONI VIRALI
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RISPOSTA UMORALE (PRODUZIONE ANTICORPALE)
La prevalente componente proteica della struttura virale rende il virione altamente
immunogeno. Nel corso dell’infezione virale vengono prodotte tutte le tipologie anticorpali:
IgM, si manifestano precocemente (indice di infezione in atto/recente) e solo nella
“prima infezione” di soggetto non immune. Scompaiono dopo alcune settimane.
IgG, si presentano più tardivamente ma persistono per anni. Sono prontamente
mobilizzate a seguito dei possibili successivi contatti con l’antigene. “Controllo” virale a
livello sierico. Più efficaci delle IgM.
IgA secretorie mucosali, che svolgono un importante ruolo di “barriera” alla penetrazione
virale delle mucose.
La diagnosi sierologica si basa essenzialmente sulla ricerca di IgM o alternativamente:
sieroconversione (comparsa di Ab specifici): indice di infezione (primaria) in atto
aumento (≥ 4-fold) del titolo anticorpale (2 campioni: fase acuta vs convalescenza): indice
di infezione (riattivazione o reinfezione) in atto.
Generalmente preferita all’isolamento, la diagnosi sierologica risente della reattività crociata
tra virus appartenenti alla stessa famiglia (sierotipi)
Le tecniche immunologiche per la ricerca di anticorpi virali comprendono:
saggi FUNZIONALI
saggi su MEMBRANA
saggi di LEGAME
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RISPOSTA UMORALE (PRODUZIONE ANTICORPALE)
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RISPOSTA ANTICORPALE
SAGGI FUNZIONALI: evidenziazione di specifiche attività derivanti dalla formazione
dell’immunocomplex:
Saggio di neutralizzazione: Abs specifici neutralizzano un caratteristico effetto
citopatico (CPE). Rappresenta il “gold standard”, sebbene costoso e timeconsuming.
Reazione di inibizione dell’emoagglutinazione: Abs specifici in grado di inibire
l’attività emoagglutinante di alcuni virus (influenza, parainfluenza, morbillo).
Reazione di fissazione del Complemento: in presenza di Abs specifici si forma
un immunocomplesso che lega il Complemento. In queste condizioni, il
Complemento non può lisare gli eritrociti (sistema di rilevazione della
formazione dell’immunocomplesso: Ag + eritrociti).
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RISPOSTA ANTICORPALE
Titolo anticorpale. Il titolo è il reciproco della più alta diluizione del
siero del paziente che mantiene attività rilevabile nei confronti di
un antigene noto:
neutralizzare un CPE
inibire la reazione di emoagglutinazione
Nella diagnosi sierologica, il titolo anticorpale ci da informazioni sulla:
sieroconversione (comparsa di Ab specifici): indice di infezione
(primaria) in atto
aumento (≥ 4-fold) del titolo anticorpale misurato in 2
campioni (fase acuta vs convalescenza): indice di infezione
(riattivazione o reinfezione) in atto.
DIAGNOSI SIEROLOGICA DELLE INFEZIONI VIRALI
SAGGIO DI NEUTRALIZZAZIONE CPE
DIAGNOSI SIEROLOGICA DELLE INFEZIONI VIRALI
SAGGI DI INIBIZIONE EMOAGGLUTINAZIONE
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RISPOSTA ANTICORPALE
SAGGIO SU MEMBRANA (Western blot):
identificazione di Abs diretti verso singole e
specifiche proteine virali.
Procedura
1. separazione degli Ags virali (da cellule
infette) mediante elettroforesi
2. trasferimento Ags su membrana
3. esposizione al siero in esame
4. sistema di rilevazione colorimetrica
dell’immunocomplex: Abs anti-Ig umane
marcati con enzima
5. aggiunta del substrato per l’enzima
6. rilevazione segnale (colorimetrico,
chemiluminescenza)
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
WESTERN BLOT
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
RISPOSTA ANTICORPALE
SAGGI DI LEGAME (immunoenzimatico e radiometrico):
1. adsorbimento Ags su supporto solido (pozzetto o microsferule di
polistirene)
2. aggiunta del siero in esame
3. rilevazione immunocomplex mediante aggiunta Ab 2ario anti-IgG umane
marcato con:
• EIA (saggio immunoenzimatico): enzima in grado di reagire con
idonei substrati; reazione colorimetrica, misurata allo
spettrotometro.
• RIA (saggio immunoradiometrico): isotopo radioattivo (125I); segnale
misurato con un contatore di raggi .
Sensibilità RIA > EIA. Tuttavia, il saggio EIA viene comunemente preferito perchè
automatizzabile, versatile, standardizzabile.
DIAGNOSI DI LABORATORIO DELLE INFEZIONI VIRALI
EIA
RIA
DETERMINAZIONE DEL TITOLO VIRALE
DETERMINAZIONE DEL TITOLO VIRALE
MICROSCOPIA ELETTRONICA
La microscopia elettronica può essere utilizzata anche per valutare il titolo virale
presente in un campione.
1. La sospensione virale viene posta su un retino per ME e colorato.
2. Alla sospensione viene aggiunta una quantità nota di sfere
di latex.
3. Il rapporto relativo sfere-virus fornisce una stima della
carica virale.
Non è una tecnica standardizzata e di uso frequente
Richiede un sufficiente numero di particelle virali. Adatto
per diagnosi di infezioni con massiva eliminazione virale
(Rotavirus)
Aggiunta di anticorpi specifici per aumentare la sensibilità
(immunoelettromicroscopia)
Sovrastima del titolo
Microfotografia di una goccia contenente microsfere in
lattice (sferiche) ed unità di virus vaccinico (Poxvirus)
(più piccole, forma a “mattone”).
(Virology, 4th ed, Knipe & Howley, eds, 2001)
MISURAZIONE DELLA CONCENTRAZIONE
DELLE UNITÀ (VIRALI) INFETTANTI
Titolo virale (ufp/ml)
Concentrazione di unità infettanti in grado di indurre la formazione di placche
(ufp) in cellule animali in coltura od in uova embrionate
Dose letale 50 (LD50)
Numero (titolo) di virus che uccide il 50% di un gruppo di cavie infettate
sperimentalmente
Dose di coltura tessutale (TVD)
Numero di virus che causa effetto citopatico in coltura cellulare
Dose infettante (ID50)
Numero di virus che dà inizio a sintomi rivelabili, o risposta anticorpale, nel
50% di un gruppo di cavie infettate sperimentalmente
CALCOLO DI LD50
DETERMINAZIONE DEL TITOLO VIRALE
SAGGIO DI PLACCA (PLAQUE ASSAY)
Titolo virale = 100 ufp (unità formanti placca) x 105 (fattore diluizione) = 1 x 107 ufp/ml
Fields Virology, 4th ed, Knipe & Howley, eds, Lippincott Williams & Wilkins, 2001, Fig. 2-5
DETERMINAZIONE DEL TITOLO VIRALE
INOCULAZIONE DI UOVA EMBRIONATE
Davis, Duylbecco, Eisen, Ginsberg “Microbiology” 4th ed, J.B. Lippincott 1990, Fig. 48-1
Formazione di “pocks” emorragici indotte da cowpox virus
sulla membrana corion-allantoidea (CAM) di embrioni di
pollo, a seguito di incubazione per 3 gg a 37.5°C.
Fields Virology, 4th ed, Knipe & Howley, eds, Lippincott Williams & Wilkins, 2001, Fig. 2-1
DETERMINAZIONE DEL TITOLO VIRALE
SAGGIO DI EMOAGGLUTINAZIONE
1. Allestire diluizioni seriali “2-fold” del campione (1:2, 1:4, 1:8, 1:16, …)
2. Aggiungere 1% RBC animali (maiale, pollo)
3. Incubare a +4°C per 1-2 h
4. Lettura risultati
Titolo virale = reciproco della max diluizione virale che causa emoagglutinazione = 32 unità HA/ml
DETERMINAZIONE DEL TITOLO VIRALE
SAGGIO DI EMOAGGLUTINAZIONE
Saggio di emoagglutinazione. Sette differenti campioni, numerati da 1 a 7, sono stati diluiti serialmente come
indicato nella prima riga, esposti ad eritrociti di pollo, ed incubati in ghiaccio per 1-2 h. I pozzetti dell’ultima riga
non contengono virus (ctrl negativo). Il Titolo è indicato a destra dell’ultima colonna.
(Fields Virology, 4th ed, Knipe & Howley, eds, Lippincott Williams & Wilkins, 2001, Fig. 2-8)
DETERMINAZIONE DEL TITOLO VIRALE
sensibilità
SENSIBILITA’ TECNICA
Tecnica
Quantità (per ml)
Conta al microscopio elettronico
1010 particelle EM
Saggio in uova embrionate
109 egg ID50
Saggio di formazione di placca
108 ufp
Saggio di emoagglutinazione
103 unità HA
Fields Virology, 4th ed, Knipe & Howley, eds, Lippincott Williams & Wilkins, 2001, Table 2-4