LA GENETICA NELLA PREVENZIONE E NELLA DIAGNOSI DELLE MALATTIE
EREDITARIE E MALFORMATIVE.
INTRODUZIONE
Nel nucleo delle nostre cellule incontriamo 46 strutture filiformi chiamate cromosomi.
Questi comprendono 44 cromosomi “non sessuali” o “autosomi” e 2 cromosomi sessuali,
che sono identici nella femmina (XX) e diversi nel maschio (XY) (figura 1)
Ai
cromosomi
è
di
custodire
e
affidato il compito
trasmettere
l’informazione
genetica.
Sui
sono
cromosomi
allineati
i
geni. I geni sono
tratti di materiale
ereditario
(DNA)
Figura 1. rappresentazione del cariotipo umano; in evidenza i cromosomi
sessuali. Nel maschio sono rappresentati da un cromosoma X e da un
cromosoma Y; nella donna sono presenti due cromosomi X.
che svolgono specifiche funzioni ed a loro è affidata l’informazione ereditaria. Ogni
individuo
alcune
possiede
decine
di
migliaia di geni. (figura
2). Le alterazioni di
questa complessa rete
di strutture determina
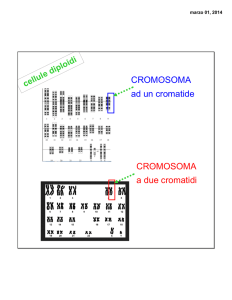
Figura 2. differenza fra cromosoma e gene.
“guasti”
irreparabili.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
spesso
1/44
LE ANOMALIE CROMOSOMICHE
Le modificazioni del numero o della struttura dei cromosomi, possono determinare
malformazioni, ritardo mentale, aborti o alti tipi di patologie. Queste modificazioni
causano dunque le “malattie cromosomiche” dette anche cromosomopatie.
Un gran numero di concepimenti (zigoti) presenta un difetto nel corredo cromosomico.
In questi casi l’aborto spontaneo può rappresentare la “selezione naturale” per
quell’embrione che non avrebbe una buona qualità di vita; spesso, infatti, alcune
malattie sono talmente gravi da essere incompatibili con la vita. L’aborto spontaneo si
può verificare poche ore o pochi giorni dopo il concepimento (ancora prima che
l’embrione si impianti in utero) o durante le altre fasi della gravidanza. Attualmente 1
bambino su 150 nati è affetto da anomalie cromosomiche. Le sindromi dovute ad
anomalie cromosomiche possono colpire sia gli autosomi che i cromosomi sessuali.
La sindrome di Down è la più frequente anomalia cromosomica. Essa è causata dalla
trisomia del cromosoma 21; in questo caso il numero dei cromosomi non è 46, bensì 47
(46 più un cromosoma 21) (figura 3).
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
2/44
Figura 3. Cariotipo femminile con trisomia del cromosoma 21 (sindrome di Down). Laboratorio di
citogenetica e genetica molecolare P.O. “Madonna delle Grazie” di Matera.
Oltre alla sindrome di Down, le anomalie cromosomiche di numero più frequentemente
riscontrate sono la trisomia del cromosoma 18 (sindrome di Edwards) e del 13
(sindrome di Patau). Ognuna di queste malattie presenta quadri clinici a se stanti, ma
tutte sono sempre associate a ritardo mentale. È importante mettere in evidenza che
esiste una correlazione tra l’età della madre, al momento del concepimento, e la
percentuale di nati con trisomia (figura 4).
In altre parole, il rischio di avere un figlio malato diviene maggiore con l’aumentare
dell’età della madre.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
3/44
Anche i cromosomi sessuali
possono andare incontro ad
“errori”.
Le
sessuali
comportano
numero
dei
variazioni
di
cromosomi
una
sintomatologia clinica diversa
da quella che si riscontra nel
caso di anomalie autosomiche:
1. Le anomalie dello sviluppo
cerebrale non sono così
Figura 4. L’incidenza della sindrome di Down nella prole
di genitori sani aumenta con l’età della madre.
pronunciate come nei casi precedenti: infatti molti individui hanno un quoziente
intellettivo normale.
2. Le anomalie fisiche più gravi riguardano lo sviluppo dell’ovaio e del testicolo.
Esempi di patologie dovute ad anomalie dei cromosomi sessuali sono: la sindrome di
Klinefelter e la sindrome di Turner. La prima è dovuta alla presenza di un cromosoma
X in più (XXY al posto di XY), e colpisce i maschi con una frequenza di un caso su 700
nuovi nati; la sindrome di Turner invece è causata dalla mancanza di un cromosoma X
(X anziché XX), ed interessa le femmine con una frequenza di 1 caso su 2500 nuove
nate.
Le monosomie complete sono incompatibili con la vita postnatale, l'eccezione è
rappresentata dalla monosomia del cromosoma X, associata alla sindrome di Turner
(45,X).
Oltre alle anomalie dovute al non coretto numero di cromosomi vi sono anomalie che
colpiscono la struttura del cromosoma.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
4/44
Le anomalie di struttura originano da una rottura dei cromosomi durante la divisione
della cellula: spesso queste rotture vengono “riparate” in modo da recuperare
interamente la struttura originaria. Quando la “riparazione” avviene in maniera non
corretta si crea un nuovo tipo di allineamento dei geni, cioè una anomalia di struttura
del cromosoma (figura 5). Le anomalie di struttura possono essere “bilanciate
sbilanciati”.
Le
alterazioni
cromosomiche
strutturali
bilanciate non danno luogo
né
a
guadagno
perdita
genetico
portatrici
e
di
le
ad
materiale
generalmente
fenotipicamente
Possono
né
persone
sono
normali.
essere
sia
ereditate da un genitore
(portatore sano) o possono
verificarsi
“de
novo”
e
quindi essere riscontrate
nelle
fetali.
solo
nelle
cellule
Figura 5. alterazioni strutturali dei cromosomi.
Le anomalie sbilanciate, invece, provocano perdita/guadano di materiale genetico,
perciò vengono identificate in soggetti con fenotipo clinico.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
5/44
LE MALATTIE MONOGENICHE
Anche le modificazioni dei geni (mutazioni) determinano patologie denominate
“malattie geniche”; dette anche monogeniche o monofattoriali.
Per cercare di capire la trasmissione di questi caratteri è necessario tenere presenti
pochi concetti basilari. Ogni individuo riceve metà dei propri caratteri (geni) del padre
e metà della madre. Ogni carattere è perciò presente in doppio (uno all’interno del
cromosoma di origine paterno ed uno all’interno del cromosoma di origine materno).
Essi sono disposti lungo i cromosomi ciascuno in uno specifico "locus". Le forme
alternative di un gene sono definite alleli: gli alleli occupano lo stesso locus sui
cromosomi omologhi.
I geni ereditati dal padre, insieme a quelli ereditati dalla madre, determinano un dato
carattere (tratto genetico). Un bambino può ereditare dai genitori due alleli uguali
(per esempio AA o aa) o diversi (ad esempio Aa). Nel primo caso il bambino è
omozigote (es. AA o aa) per quel carattere, nel secondo eterozigote (Aa). Inoltre
l’effetto di uno dei due alleli, ai fini dell’espressione di un carattere, può essere
prevalente (dominante) rispetto a quello dell’altro (recessivo). Per convenzione l’allele
dominante è rappresentato con la lettera maiuscola, mentre quello recessivo con la
lettera minuscola. Un allele dominante (es.A) porta all’espressione di un certo
carattere anche quando l’altro allele è diverso (es.a). Invece i caratteri recessivi si
manifestano solo quando entrambi gli alleli sono uguali (omozigote es.aa). Se la causa di
un “errore” (mutazione) riguarda un solo gene, si parla di malattie monogeniche. Il
gene in questione può essere localizzato su un cromosoma non sessuale (autosoma) o
sul cromosoma sessuale X.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
6/44
Nell’uomo sono note più di 1000 malattie monogeniche (caratteri mendeliani) che
vengono ereditati secondo le seguenti modalità:
Autosomiche dominanti e recessive.
Dominante associata al cromosoma X.
Recessiva associata al cromosoma X.
Associata al cromosoma Y.
Eredità autosomica dominante
Nella trasmissione ereditaria di tipo autosomico dominante la malattia è espressione
di un singolo gene mutato, mentre l'allele corrispondente risulta normale. In sintesi, il
gene può manifestarsi a livello fenotipico allo stato eterozigote (Aa) (figura.6).
Alcune di queste condizioni morbose
possono essere tanto gravi da non
consentire
portatore
la
o,
sopravvivenza
comunque,
da
del
non
permettergli di riprodursi e quindi di
trasmettere l'affezione alla prole. In
questi casi la comparsa della malattia,
nella
popolazione
non
può
essere
spiegata in termini di trasmissione
ereditaria, ma è necessariamente la
conseguenza di una mutazione recente
nei gameti di un genitore.
Figura 6. modello di trasmissione delle malattie
autosomiche dominanti.
Se si prescinde dalle situazioni sopra esposte, in caso di eredità autosomica
dominante, ogni individuo malato ha, di regola, un genitore affetto.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
7/44
Regole generali:
La malattia è trasmessa di generazione in generazione (trasmissione verticale) solo
Ciascun figlio di individuo affetto ha il 50% di essere sano e il 50% di essere
tramite gli individui affetti.
malato.
I figli sani di soggetti affetti avranno solo figli sani.
La malattia colpisce indifferentemente maschi e femmine.
Su tali regole andrà basato il consiglio riproduttivo.
Eredità autosomica recessiva
La malattia è l'espressione di un gene mutato presente in ambedue gli elementi di una
coppia di cromosomi (figura
7).
Il gene mutato può quindi
manifestarsi
a
livello
fenotipico solo allo stato
omozigote. I geni recessivi
hanno
una
distribuzione
frequenza
molto
di
alta
Figura 7. modello di trasmissione delle malattie autosomi che
recessive
nella popolazione: si calcola che ogni individuo sia
portatore di 3-8 geni autosomici recessivi allo
stato
eterozigote
(Aa);
l'evenienza
che
si
verifichi una nascita di un omozigote e quindi la
malattia è però molto rara, essendo legata alla
possibilità che si verifichi un incrocio tra due
Figura 8
eterozigoti.
A
differenza
delle
malattie
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
8/44
autosomiche dominanti, nelle malattie autosomiche recessive, la persona affetta (aa)
deve aver ricevuto il gene mutato da entrambi i genitori.
L’albero genealogico mostrato in figura 8 rappresenta l'unione tra due individui
fenotipicamente normali, ma portatori del gene mutato allo stato eterozigote (Aa).
Regole generali:
Gli eterozigoti (Aa) sono normali come aspetto fenotipico, ma portatori sani del
Quando un individuo affetto nasce da genitori normali, si deve ritenere che
carattere patologico.
entrambi i genitori sono eterozigoti e che, come media statistica, 1/4 della prole
(25%) risulterà affetta, 1/2 portatrice (50%) ed 1/4 normale (25%).
Quando
un
individuo
affetto
(aa)
contrae
matrimonio
con
una
persona
genotipicamente normale (AA), la prole sarà genotipicamente eterozigote (Aa) e
fenotipicamente normale.
Quando contraggono matrimonio due individui ammalati (aa), tutta la prole risulterà
affetta (100%).
La malattia colpisce indifferentemente maschi e femmine.
Il rischio di ricorrenza nelle generazioni successive è basso a meno che non si
verifichino particolari circostanze che favoriscano l'unione tra due eterozigoti (es.
consanguineità, alta frequenza del gene).
Su tali regole andrà basato il consiglio riproduttivo.
Eredità legata al sesso
Nelle malattie che seguono questo tipo di eredità il gene mutato è localizzato, anziché
sugli autosomi, sul cromosoma X.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
9/44
Poiché la femmina ha due cromosomi X, mentre il maschi ne ha uno solo, ne deriva che i
criteri di omozigosi ed eterozigosi, dominanza e recessività, nell'eredità legata all'X
hanno valore solo per la femmina, mentre nel maschio la malattia si manifesta sempre
quando è presente il gene mutato.
Eredità dominante legata al cromosoma X
La malattia è l'espressione di un singolo gene mutato contenuto nel cromosoma X,
mentre l'allele corrispondente è normale. Per tale motivo la malattia si manifesta sia
nella femmina eterozigote, sia, naturalmente, nel maschio. L'eredità dominante legata
all'X è responsabile
solo di pochi e rari
quadri morbosi. Tra
le
malattie
che
seguono questo tipo
di eredità si possono
citare
l'osteodistrofia
ereditaria
di
Figura 9. modello di trasmissione delle malattie X-linked dominanti.
Albright (pseudoipoparatiroidismo) e l'ipofosfatia o rachitismo vitamina D resistente.
Caratteristica principale è la cosiddetta eredità crociata: i maschi affetti
trasmettono la malattia a tutte le figlie ma non ai figli maschi. Le femmine malate
trasmettono invece la malattia a metà della prole indipendentemente dal sesso (figura
9).
Eredità recessiva legata al cromosoma X
La malattia è l'espressione di un gene mutato presente in ambedue i cromosomi X della
femmina o sull'unico X del maschio. Nella femmina la malattia può, generalmente
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
10/44
manifestarsi solo allo stato omozigote, mentre nel maschio si manifesta allo stato
emizigote.
Se la persona affetta è il padre, i figli maschi saranno tutti normali e le figlie femmine
saranno tutte portatrici del difetto che predispone alla malattia (figura 10).
Regole generali:
La
malattia
è
sempre
trasmessa
attraverso una femmina eterozigote
che appare fenotipicamente normale
().
La femmina eterozigote () trasmette
il gene mutato a metà della prole:
statisticamente i figli maschi sono per
metà affetti () e per metà normali
Figura 10. modello di trasmissione delle malattie
X-linked recessive.
(), le femmine presentano tutte un aspetto normale ma sono per metà portatrici
().
Le figlie di un maschio affetto sono tutte portatrici (), i figli tutti sani ().
Gli individui affetti sono in prevalenza di sesso maschile ().
Un esempio di malattia X-linked recessiva è rappresentata dalla sindrome dell’X
fragile, la quale ha una modalità di trasmissione alquanto particolare.
Eredità legata al cromosoma Y
Questa eredità, chiamata anche oloandrica, presenta le seguenti caratteristiche:
Colpisce solo i maschi;
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
11/44
I figli maschi hanno sempre un padre affetto, ad eccezione dei casi di mutazioni de
Tutti i figli di un padre affetto sono affetti.
novo:
Sono noti pochissimi geni localizzati sul cromosoma Y, alcuni dei quali sono responsabili
della spermatogenesi.
EREDITÀ MITOCONDRIALE
Le cellule umane contengono centinaia di mitocondri, ognuno dei quali è provvisto di 210 copie di una piccola molecola di DNA circolare lunga circa16596 bp. Sono noti 37
geni mitocondriali, caratterizzati dall’assenza di introni. Mutazioni a carico di alcuni
geni mitocondriali sono responsabili di un discreto numero di malattie con frequenza di
6-7 ogni 100000 nati. L’eredità mitocondriale presenta delle caratteristiche che la
distinguono molto dall’eredità mendeliana:
a. Uno zigote eredita solo i mitocondri presenti nell’ovulo, poiché i mitocondri
paterni, eventualmente presenti, vengono selettivamente distrutti. Ne
consegue che i mitocondri si trasmettono da madre a madre: tale modello di
eredità è definito patrilineare.
b. In generale, un maschio affetto non trasmetterà mai la malattia.
c. Le cellule contengono parecchie molecole di DNA mitocondriale. Se ogni
mitocondrio di un individuo porta la mutazione patogena si parla di
“omoplasmia”, se invece ogni cellula di un individuo contiene sia genomi
mitocondriali sani che mutati, si parla di “eteroplasmia”. La condizione di
eteroplasmia può essere trasmessa da madre a figlia, sebbene non venga
necessariamente conservata la proporzione tra genomi mitocondriali sani e
mutati. Ciò è conseguenza del fatto che, durante la mitosi, i mitocondri si
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
12/44
distribuiscono a caso nelle cellule figlie, alterando la proporzione di genomi
mitocondriali mutati e sani caratteristica della cellula madre.
d. Il genoma mitocondriale è instabile e molte malattie possono risultare dalla
combinazione di diverse mutazioni contemporaneamente presenti.
e. Diverse funzioni mitocondriali sono regolate da geni nucleari rendendo più
difficile la determinazione dei difetti molecolari responsabili di una
determinata patologia.
Una delle patologie mitocondriali più conosciute “l’atrofia ottica ereditaria di
Leber” (OMIM 535000).
EREDITÀ MULTIFATTORIALE E POLIGENICA
Se il carattere è determinato soltanto da un insieme di fattori genetici viene definito
poligenico. Se il carattere è dovuto all’interazione dei geni con l’ambiente viene
definito
multifattoriale.
Costituiscono
esempi
di
caratteri
multifattoriali:
il
comportamento, il diabete mellito, l’ipertensione, l’aterosclerosi, la schizofrenia, il
labbro leporino, il piede torto, la spina bifida, le sindromi maniaco-depressive. Anche
molte patologie congenite isolate sono caratteri multifattoriali.
Questa definizione implica l’esistenza di una diretta interazione tra geni e ambiente.
Un bambino con genitori alti, sarà molto probabilmente più alto di un bambino con
genitori di bassa statura. Tuttavia una cattiva nutrizione (un fattore ambientale) può
compromettere
la
crescita
di
entrambi.
La
suscettibilità
genetica
(o
la
predisposizione) è in genere ereditata da entrambi i genitori. I geni ed i fattori
ambientali associati ad un particolare fenotipo possono variare tra i diversi gruppi
etnici. Il colore scuro della pelle, è condiviso tra africani e aborigeni australiani.
Tuttavia questi gruppi differiscono sensibilmente per il loro background genetico. Il
colore scuro della pelle, riflette soltanto lo stesso adattamento alla luce solare del
clima tropicale. La pelle scura che si è schiarita, mentre l’uomo si spostava al Nord, o
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
13/44
le narici pronunciate negli ambienti umidi e quelle sottili dove l’aria è secca. Sono
esempi di come lavora il Genoma.
L’esatta natura della familiarità in queste malattie è difficile da identificare. Gli studi
familiari mostrano chiaramente che non sono ereditate secondo gli schemi di
trasmissione mendeliana di un singolo gene. L’analisi statistico-matematica dei dati
familiari ha portato piuttosto alla formulazione di modelli interpretativi più che
plausibili circa l’eziologia di queste malattie, la cui espressione sarebbe il risultato
dell’azione congiunta di più geni e di fattori ambientali.
TERATOGENESI E MUTAGENESI
Durante la vita prenatale, un bambino può essere sottoposto ad agenti dannosi
provenienti dal mondo esterno. Pertanto l’ambiente e le abitudini di vita della mamma
influiscono in maniera importante sullo sviluppo del nascituro o su un soggetto nella
vita postnatale.
Quando l’ambiente provoca dei “danni” nel nascituro, non sempre determina
l’instaurarsi di una malattia genetica poiché non altera il patrimonio genetico;
l’ambiente può infatti disturbare solo lo sviluppo di un organo o di una parte del corpo,
determinando un effetto embriopatico non ereditabile dalla generazione successiva.
Di seguito sono riportate le classi più comuni di teratogeni:
Alterazioni metaboliche materne.
Agenti
infettivi
(sifilide,
toxoplasmosi,
rosolia,
citomegalovirus,
streptococco agalactis, infezione da HIV, infezione da parvovirus).
varicella,
radiazioni ionizzanti.
farmaci e droghe
o alcool: rischio di bambini affetti da sindrome feto-alcolica, per le madri
alcolizzate;
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
14/44
o talidomide: nel primo trimestre di gravidanza può causare riduzione degli
arti, malformazioni facciali e altre anomalie congenite;
o anticonvulsivanti: rischio aumentato per difetti del tubo neurale (acido
valproico);
o cocaina: può causare aborto spontaneo e lesioni crebro-vascolari;
o tabagismo: aumento del rischio di aborto spontaneo, prematurità e basso
peso alla nascita.
CONTROLLO DELLE MALATTIE GENICHE
Ogni volta che un bambino viene concepito, entrambi i genitori passano al figlio le
“informazioni”
(geni)
che
ne
determineranno
le
caratteristiche (ad esempio il colore degli occhi e dei
capelli) (figura 11). In definitiva, ogni individuo diventa,
custode di un patrimonio genetico e gli spetta nel
contempo
trasmettere
discendenti
solo
ricevuta
ai
non
l’eredità
dagli
avi, ma anche le
eventuali
mutazioni
“de
nell’ambito dei propri geni.
Si
Figura 12. Agenti che possono
indurre al patrimonio genetico.
crede
diffusamente
Figura 11
novo”
che
le
espresse
malattie
ereditarie si verifichino solo in quelle famiglie
che hanno avuto precedenti esperienze di
patologie di questo tipo. Ciò non è vero!
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
15/44
Questo rischio è sempre presente, ma grazie alla corretta informazione e alla
diagnosi prenatale, oggi è possibile monitorare lo stato di salute e di benessere del
concepito durante il corso della gravidanza.
L’impiego delle tecniche di diagnosi prenatale è volto ad identificare patologie che
interessano il concepito su base genetica, infettiva, farmacologica o ambientale
(figura 12).
Attualmente, con il progredire delle biotecnologie, i laboratori di genetica medica
posseggono mezzi diagnostici sempre più precisi che, in molte situazioni considerate
fino a qualche anno fa idiopatiche (sconosciute), hanno permesso di chiarire molti
meccanismi di trasmissione del messaggio genetico.
Non essendoci però, allo stato attuale, una cura efficace per la maggior parte delle
patologie genetiche, si deve attribuire necessariamente molta importanza al momento
preventivo. Questo può essere attuato sia nei confronti di malattie genetiche per le
quali esiste una terapia che per quelle per le quali una terapia non è disponibile, oppure
non è del tutto soddisfacente. Per alcune patologie genetiche esiste qualche forma di
terapia. Per esempio, la labioschisi (malformazione congenita dovuta alla mancata
saldatura delle due porzioni del labbro superiore del neonato) o certe cardiopatie
congenite possono essere corrette chirurgicamente; per alcune malattie dovute a
carenza di un fattore importante, questo può essere somministrato per via esogena
(insulina nel diabete; fattore VIII e IX della coagulazione rispettivamente
nell’emofilia A e nell’emofilia B; ecc.); in altre malattie, dovute all’accumulo di
metaboliti tossici, si può ridurre tale accumulo con mezzi opportuni (es. dieta
specifica). Vi sono alcuni concetti errati sulle malattie genetiche, tra i quali i più
frequenti sono elencati da Condor e Ferguson-Smith nella tabella 1.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
16/44
Tabella 1. Alcune opinioni errate sulle malattie genetiche
Se una malattia non è presente in più componenti della famiglia non è genetica, e
viceversa.
Una malattia congenita è sempre ereditaria.
Per le malattie genetiche non esistono terapie.
I traumi psichici e fisici della madre durante la gravidanza sono causa di
malformazioni.
Se una malattia ha un rischio di ricorrenza di ¼ , dopo la nascita di un figlio affetto
il successivo sarà sicuramente sano.
Se in una famiglia sono colpiti solo i maschi o solo le femmine, significa che la
malattia è legata al sesso.
Le malattie ereditarie insorgono solo alla nascita o durante i primi anni di vita.
Quindi ai fini di attuare una sana prevenzione delle patologie genetiche sono
applicabili, a seconda della patologia genetica sospettata, le seguenti tipologie di
tests:
i test diagnostici consentono di effettuare una diagnosi o confermare, in una persona
affetta, un sospetto clinico. Possono essere eseguiti in epoca prenatale o nel corso
della vita.
I test di identificazione dei portatori sani permettono di individuare mutazioni
comuni in specifici gruppi etnici, attraverso screening di popolazione (anche in epoca
neonatale), oppure indagini “a cascata” sui familiari rischio di soggetti affetti da
patologie genetiche più o meno rare.
I test preclinici o presintomatici permettono di individuare il gene responsabile di
malattie genetiche, i cui sintomi, non sono presenti alla nascita, ma compaiono
successivamente, anche in età avanzata. Possono fornire informazioni utili a
pianificare scelte individuali e familiari.
I test di suscettibilità consentono di individuare i genotipi che di per sé non causano
una malattia, ma comportano un aumento del rischio di svilupparla, in seguito
all’esposizione a fattori ambientali favorenti, o alla presenza di altri fattori genetici
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
17/44
scatenanti. Rientra in questo ambito la maggior parte delle malattie multifattoriali
dell’adulto.
I test per lo studio della variabilità individuale si basano sull’analisi di una serie di
regioni del DNA polimorfiche (cioè differenti tra gli individui), finalizzata a definire
un rapporto di consanguineità o ad attribuire una traccia biologica ad una specifica
persona. Questi test sono utili per verificare i rapporti di parentela, nello studio dei
trapianti e della zigosità e trovano applicazioni in ambito forense.
I test farmacogenetici, riguardano le analisi finalizzate alla identificazione di
variazioni di sequenza nel DNA in grado di predire la risposta “individuale” ai farmaci,
in termini di efficacia e di rischio relativo di eventi avversi. Le persone che si
sottopongono a questi test devono essere adeguatamente informate.
I test genetici finalizzati alla ricerca, riguardano test utilizzati per comprendere le
basi biologiche di una malattia, e utili a sviluppare nuovi test genetici.
Una volta focalizzato il rischio specifico, le cui modalità sono state già esposte, le
linee di intervento saranno diverse a seconda che trattasi di donne in fase
preconcezionale o in fase di gravidanza in atto.
Nel primo caso c’è la possibilità ed il tempo utile per poter valutare tutte le eventuali
soluzioni in rapporto al tipo di patologia genetica in esame.
In caso di gravidanza in atto con un rischio di patologia genetica fetale aumentato
rispetto alla popolazione generale, l’unico mezzo disponibile per sapere lo stato di
salute del futuro nascituro è rappresentato dalla diagnosi prenatale.
La diagnosi prenatale di malattia genetica può essere definita, in termini generali,
come un procedimento finalizzato all’accertamento dell’eventuale presenza nel feto o
nell’embrione (nel caso della diagnosi preimpianto) di una condizione patologica
geneticamente determinata.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
18/44
DIAGNOSI PRENATALE INVASIVA:TECNICHE DI PRELIEVO DI MATERIALE FETALE
Villocentesi
La villocentesi viene effettuata normalmente nel primo trimestre di gravidanza( tra la
11^ e la 13^ setimana di gestazione), e più esattamente non prima della decima
settimana. Nota anche come biopsia coriale (Chorionic Villous Sampling, CVS), consiste
nel prelievo di villi coriali dal
corion
frondosum.
Il
villo
coriale è il tessuto che avvolge
l’embrione e che in seguito darà
luogo alla placenta.
È un tessuto di origine fetale in
quanto deriva dalla cellula uovo
fecondata.
Il prelievo dei villi normalmente
è
eseguito
mediante
Figura 13. villocentesi.
introduzione transaddominale di un ago e successiva aspirazione (figura 13):
l’introduzione dell’ago viene seguita sotto controllo ecografico. Il rischio cui è
sottoposto il nascituro è “l’aborto” che ricorre circa nel 2% dei casi. D’altra parte è
bene tenere presente che, tra la decima e la dodicesima settimana di gravidanza, si ha
il massimo rischio di aborto spontaneo anche per donne che non si sono sottoposte a
diagnosi prenatale. Pertanto, il 2% degli aborti che si verificano dopo il prelievo di villo
coriale, non sono necessariamente legati al prelievo eseguito.
Sul villo coriale può essere eseguita sia l’analisi cromosomica (esame citogenetico) che
l’analisi genetica (esame molecolare).
Amniocentesi
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
19/44
L’amniocentesi (figura 14) è effettuata nel secondo trimestre di gravidanza, di solito
tra la sedicesima e la diciottesima settimana; con questa tecnica si preleva liquido
amniotico. Il rischio di provocare un aborto a causa del prelievo è di 1/200.
Il
liquido
amniotico
è
essudati
ed
costituito da vari tipi di
secrezioni:
urina fetale. Sospese in
esso vi sono cellule di
origine fetale: amniociti
(dall’amnios)
e
cellule
tessuti
di
epiteliali di sfaldamento
dei
rivestimento
Figura 14. Amniocentesi.
(trachea,
ultime vie urinarie e cute).
Il prelievo di liquido amniotico avviene sempre attraverso la parete dell’addome
materno.
Con
l’ausilio
dell’ecografia
viene
scelto
il
punto
per
l’esecuzione
dell’amniocentesi. Vengono prelevati 15-20 ml di liquido amniotico. A differenza della
villocentesi, l’amniocentesi permette la raccolta di cellule fetali, e non annessiali,
nonché di liquido amniotico, su cui possono essere condotti vari test biochimici (per
esempio la misurazione della alfa-feto-proteina) e microbiologici , in caso di sospetta
infezione
materno-fetale
citomegalovirus).
(per
esempio
toxoplasmosi,
rosolia,
infezione
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
da
20/44
Funicolocentesi o Cordocentesi
Il prelievo di sangue fetale viene eseguito con un prelievo di sangue dall’arteria
ombelicale fetale (figura 15). Questa tecnica comporta per il feto rischi sicuramente
maggiori rispetto alla villocentesi ed
all’amniocentesi;
si
calcola
che
il
rischio di provocare un aborto causa il
prelievo sia di circa il 4%.
L’analisi cromosomica su sangue fetale
viene effettuata di solito per motivi
particolari, quali il controllo di un
mosaicismo
precedentemente
riscontrato su amniociti o su cellule di
Figura 15. funicolocentesi
villo coriale, oppure una malformazione fetale evidenziata con ecografia a gravidanza
inoltrata.
L’analisi su sangue fetale permette di avere una risposta piuttosto rapida, di solito,
entro una settimana dal giorno del prelievo.
Tutti questi prelievi vengono effettuati in un centro ostetrico di diagnosi
prenatale.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
21/44
LA DIAGNOSI GENETICA PREIMPIANTO
Il termine stesso dice che si tratta di una
diagnosi di una malattia genetica eseguita
prima dell’impianto dell’embrione in utero.
È una acquisizione più recente rispetto alla
diagnosi prenatale classica. È stata resa
possibile dallo sviluppo, da un lato delle
tecniche
di
fecondazione
in
vitro
e,
dall’altro, di quelle di biologia molecolare,
Figura 16. Diagnosi preimpianto
che consentono di condurre analisi citogenetiche e molecolari anche su singole cellule
(blastomero) ottenute mediante microbiopsia da embrioni allo stadio di di 4-8 cellule
(figura 16). Dall’esperienza finora raccolta l’embrione non sembra risentire della
biopsia e il suo sviluppo successivo non differisce da quello di embrioni che non hanno
subito questo trattamento.
Le blastule che non presentano il difetto vengono impiantate in utero. Nonostante il
perfezionamento della metodica restano aperti molti problemi tecnici (al di là di quelli
etici), come quelli relativi alla difficoltà di amplificare singole cellule e la possibilità di
errore e di basso successo dell’avvio di una gravidanza mediante fecondazione in vitro.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
22/44
TEST DI SCREENING PRENATALI
L’interesse dei ricercatori nell’identificare marcatori di cromosomopatie nasce dalla
considerazione che nelle gravide over 35, mediante tecniche invasive, sono
diagnosticate solo il 40% circa delle cromosomopatie mentre il 60% di queste si rileva
in nati da gestanti di età inferiore a 35 anni (molto più numerose delle gravide over
35) e senza indicazioni specifiche alla diagnosi invasiva. Poiché l’uso indiscriminato
delle tecniche invasive nelle gestanti under 35 appare improponibile si può facilmente
comprendere come la comunità scientifica ha cercato di identificare in epoca
prenatale dei test di screening capaci di identificare le gravide alle quali consigliare la
diagnosi invasiva.
Dunque, l’obiettivo di un test di screening è quello di identificare i feti affetti dalle
principali aneuploidie, in particolare i feti affetti dalle sindromi di Down, di Edwards e
di Patau.
Translucenza Nucale Test: NT test
La translucenza nucale (NT) è uno spazio
anecogeno (non riflette gli ultrasuoni) che
si evidenzia nella regione posteriore del
collo fetale attorno alla 12a settimana di
gravidanza.
L’aumento della NT (figura 17) può essere
determinato:
da anomalie cardiache e/o dei grossi
vasi;
da
aumento
endotoracica
(per
della
es.
pressione
da
ernia
Figura 17. NT test
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
23/44
diaframmatica) e da displasie scheletriche; da anomalo o ritardato sviluppo dei vasi
linfatici; da alterata composizione del tessuto connettivo.
Valori di NT superiori al 95°- 99° percentile sono indicativi di cardiopatie congenite
con una sensibilità rispettivamente del 56-40% e falsi positivi del 1-5%; quindi la
valutazione della NT è utile anche quale test di screening per l’indicazione ad
un’accurata ecocardiografia fetale (dalla 21-24 settimane). Inoltre, l’aumento dello
spessore della NT è spesso associato ad anomalie cromosomiche.
La misurazione della NT si effettua mediante esame ecografico del feto svolto verso
la fine del terzo mese di gravidanza.
La lunghezza del feto (CRL) deve essere compresa tra i 45 e gli 83 mm, misure che
corrispondono ad un’epoca di amenorrea (calcolata dal primo giorno dell’ultima
mestruazione) che varia da un minimo di 11,4 ad un massimo di 13 settimane 3 giorni.
Per la rilevazione della NT è indispensabile che i parametri e gli accorgimenti imposti
dalla F.M.F. vengano rispettati ed effettuati da personale specializzato in modo che la
valutazione dell’aumento del rischio possa essere standardizzata, precisa e quindi
attendibile.
La NT misurata con la tecnica standardizzata dalla FMF, valutata come calcolo di
rischio statistico in associazione con l’età materna, mantenendo come soglia 1/300 (un
feto malato su 300), ha una sensibilità verso la trisomia 21 dell’80% (su 100 feti
malati se ne individuano 82). I falsi positivi con questa metodica superano l’8% (su
cento esami effettuati su feti sani, 8 risultano falsamente portatori di anomalia
genetica).
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
24/44
Screening combinato “biochimico-ecografico” del primo trimestre di gravidanza (bi
test o duo test allargato).
È un esame di screening statistico che utilizza una tecnica combinata: la rilevazione
della translucenza nucale e del C.R.L. associate al dosaggio di due sostanze (da cui il
nome bitest) presenti nel circolo materno (figura 18): Free-β-hCG (frazione libera
della gonadotropina corionica) e PAPP-A (proteina A plasmatica associata alla
gravidanza).
In
questo
rischio”
modo
calcolato
“l’indice
per
di
la
sindrome di Down (trisomia del
cromosoma 21), la sindrome di
Patau (trisomia del cromosoma
13) e la sindrome di Edwards
(trisomia del cromosoma 18) ha
una sensibilità che si avvicina
al 93% e i falsi positivi si
Figura 18. biomarker di cromosomopatia.
riducono ulteriormente (~3%). L’epoca gestazionale in cui l’esame è consentito è
naturalmente sovrapponibile all’epoca di rilevazione della NT. Se dal test risulta un
rischio aumentato, ciò non significa necessariamente che il feto abbia un problema,
ma è opportuno sottoporre la gravida ad amniocentesi con successivo studio del
cariotipo fetale.
Le
gestanti
portatrici
di
feti
affetti
da
sindrome
di
Down
presentano
generalmente livelli sierici ridotti di PAPP-A (circa 0,5 MoM) e livelli sierici più
elevati di free βhCG (circa 2 MoM) rispetto ai feti normali.
Nel caso di negatività del test, non si può comunque escludere completamente un
eventuale problema del feto, in quanto tale indagine rimane sempre di tipo
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
25/44
probabilistico, e pertanto non esprime una diagnosi. Bisogna ricordare che, in caso di
gravidanza con aumentato rischio fetale di patologia cromosomica (es. età
materna
avanzata,
o
storia
familiare
di
aumentato
rischio
di
patologia
cromosomica), il bitest non è un’alternativa alla diagnosi prenatale invasiva (villo
centesi, amniocentesi).
Il bitest può essere un supporto per le donne che non hanno motivi seri per
sottoporsi alla diagnosi prenatale invasiva. Nel caso si abbia un risultato fuori dalla
norma, è sempre bene indagare ulteriormente con una diagnosi prenatale invasiva, una
ecografia
morfologica
ecocardiografia fetale.
alla
21a
settimana,
e
possibilmente
anche
con
una
Test prenatale del DNA fetale nel circolo materno.
È un test che si esegue sul sangue materno da cui viene estratto il Dna fetale
presente nel circolo venoso materno (cell free DNA – cfDNA). Dal DNA fetale
estratto è possibile effettuare il calcolo del rischio che il feto ha di essere affetto
oltre che da trisomia 21 (sindrome di Down) anche da trisomia 13 (sindrome di Patau)
e 18 (sindrome di Edwards). Il test del DNA fetale è un test di screening che ha una
maggiore accuratezza (sensibilità e specificità) rispetto ai test di screening finora
utilizzati. In presenza di test positivo, cioè presenza di un rischio elevato di patologia
cromosomica fetale è indispensabile effettuare una consulenza post-test e proporre il
test diagnostico (villocentesi, amniocentesi, funicolocentesi). Quindi esso non
sostituisce la diagnosi prenatale invasiva Se il test è negativo, è opportuno verificare
che la donna/coppia abbia ben compreso il significato del test: rischio molto basso,
quasi trascurabile che il feto sia affetto da trisomia 21, 18 o 13. Il test in oggetto è
infatti in grado di identificare il 98% dei feti trisomici.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
26/44
Indicazioni alla diagnosi prenatale invasiva
Protocollo ministeriale esenzione ticket in gravidanza - Donne in Gravidanza e Tutela
della Maternità - Decreto Legge 10.9.98 - G.U. n 245 del 20.10.98 - Protocolli di
accesso ad esami di Laboratorio e di Diagnostica strumentale
Allegato C. Indicazioni alla diagnosi prenatale (desunte dalle linee guida per i test
genetici approvate dal Comitato Nazionale per la Biosicurezza e Biotecnologie della
Presidenza del Consiglio dei Ministri). Le indicazioni per la diagnosi prenatale esenti
dal pagamento rientrano in due categorie:
Presenza di rischio procreativo prevedibile a priori:
età materna avanzatagenitore portatore eterozigote di anomalie cromosomiche
strutturali genitori portatori di mutazioni genetiche.
Presenza di rischio fetale resosi evidente nel corso della gestazione:
malformazioni evidenziate dall'esame ecograficomalattie infettive insorte in
gravidanzapositività dei test biochimici per anomalie cromosomichefamiliarità
per patologie genetiche.
Le indicazioni per indagini citogenetiche per anomalie cromosomiche fetali in corso
di gravidanza sono:
età materna avanzata ( >= 35 anni).
genitori con precedente figlio affetto da patologia cromosomica.
genitore portatore di riarrangiamento strutturale non associato a difetto
fenotipico.
genitore non aneuploide dei cromosomi sessuali compatibili con la fertilità.
anomalie malformative evidenziate ecograficamente.
probabilità di 1/250 o maggiore che il feto sia affetto da Sindrome di Down (o
alcune altre aneuploidie) sulla base dei parametri biochimici valutati su sangue
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
27/44
materno o ecografici, attuati con specifici programmi regionali in centri
individuati dalle singole Regioni e sottoposti a verifica continua della qualità.
CGH Array
L’analisi comparativa del genoma umano (Array-CGH) è un esame genetico utilizzato
per
identificare
piccole
perdite
(microdelezioni)
o
piccole
acquisizioni
(microduplicazioni) di materiale cromosomico. È da considerarsi un approfondimento
dell’analisi del cariotipo standard, rispetto alla quale presenta maggiore risoluzione:
(200 kb contro le di 6-10 Mb del cariotipo standard), permette pertanto di
evidenziare perdite o acquisizioni di materiale genetico anche di piccola entità, non
visibili con la citogenetica classica. Attraverso l’analisi dell’intero genoma, questo test
consente di identificare alterazioni, sbilanciate per eccesso (duplicazioni) o per
difetto (delezioni), che possono essere associate ad una sindrome genetica già nota, o
a varianti di nuovo riscontro il cui significato clinico deve essere via via valutato. Nella
diagnostica postnatale l’analisi microarray può essere utilizzata come test genetico di
prima scelta in sostituzione del cariotipo standard. In linea generale si suggerisce di
procedere con l’analisi tramite microarray in presenza di segni e sintomi in verosimile
associazione sindromica, per i quali o non è possibile formulare un’ipotesi clinica di
mutazione in un singolo gene, o si intende avere conferma dell’ipotesi clinica di uno
specifico riarrangiamento cromosomico e si ritiene di valutarne l’estensione.
Indicazioni
a) caratterizzazione di riarrangiamenti cromosomici identificati con il cariotipo
standard;
b) categorie con deficit intellettivo e/o autismo con/senza associazione con uno o più
dei seguenti segni e sintomi:
- epilessia;
- ipotonia muscolare;
- anomalie fenotipiche minori, soprattutto a carico delle strutture craniofacciali,
delle mani e dei piedi;
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
28/44
- anomalie della crescita, sia in eccesso o in difetto, inclusa macrocefalia o
microcefalia;
- una (o più) malformazione maggiore.
- “autismo non sindromico”, per la ricerca di varianti quantitative note per agire come
fattore predisponente a queste condizioni;
- Sindrome da delezione 1p36, Sindrome di Wolf-Hirschhorn, Sindrome Cri du Chat,
Sindrome da delezione 22q11.
Da quanto esposto si deduce che l’analisi microarray viene indicata in tutte le
condizioni con disabilità intellettiva di qualunque entità, e/o disturbi nello spettro
autistico, previo accertamento clinico di condizioni monogeniche o da sregolazione
dell’imprinting genomico.
Questo test può essere proposto anche in diagnosi prenatale, in caso di:
- anomalie del cariotipo fetale, in particolare riarrangiamenti cromosomici de novo
apparentemente
bilanciati,
riarrangiamenti
cromosomici soprannumerari (ESAC).
cromosomici
sbilanciati,
marcatori
- riscontro di anomalie ecografiche.
- presenza di alterazioni del volume del liquido amniotico, poli idramnios o oligo
idramnios, di ritardo dell’accrescimento fetale.
- presenza di microriarrangiamento strutturale bilanciato nei genitori.
Conclusioni
Il progresso delle conoscenze sulle malattie genetiche e la messa a punto di metodi
rapidi e affidabili di analisi genetica aprono certamente nuove prospettive per
l’applicazione dei principi e delle tecnologie biomolecolari in campo diagnostico e
terapeutico.
Siamo probabilmente agli albori di una forma rinnovata di medicina, che è stata
chiamata “medicina genomica” in quanto prevede l’uso estensivo della genetica non
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
29/44
solo per la diagnosi sempre più perfezionata di malattie cromosomiche e mendeliane
classiche, ma anche per la prevenzione del rischio ereditario di malattie complesse con
componente genetica, a scopo di prevenzione, e della suscettibilità ereditaria a
un’alterata risposta ai farmaci, per approntare terapie personalizzate (tabella 2).
CONTROLLO DELLE MALATTIE GENETICHE
Clinica
Diagnosi
di laboratorio
Cura
del gene patologico
management
della
malattia
chirurgici, riabilitativi, ecc.)
(interventi
screening
Prevenzione consultorio
diagnosi prenatale
Tebella 2
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
30/44
Glossario dei termini utilizzati nella pratica genetica
Albero genealogico: Ideogramma che permette di stabilire l’esatta modalità di
ereditarietà di un carattere, quando siano disponibili sufficienti informazioni sulla
famiglia.
Allele: Una delle forme alternative di un gene che risiede in un data posizione (locus
genetico) su un cromosoma. Gli alleli occupano lo stesso locus sui cromosomi omologhi e
rappresentano il genotipo (il complesso dell’informazione genetica presente in un
organismo) di un determinato individuo a quel locus. In una normale cellula diploide non
può esistere più di una coppia di alleli per ogni gene; un individuo che possiede due
alleli identici ad un determinato locus polimorfico è definito, per tale locus,
omozigote; se, invece, possiede due alleli diversi l’individuo è definito eterozigote per
quel locus.
Anomalia cromosomica: Alterazione del materiale genetico visibile al microscopio
ottico comprendente le anomalie di numero e di struttura dei cromosomi. La
modificazione del normale assetto cromosomico è dovuta al verificarsi di duplicazioni,
inversioni o altri cambiamenti a carico del materiale genetico su un cromosoma
(aberrazioni intracromosomiche). In altri casi può essere determinata dalla rottura di
cromosomi non omologhi seguita dalla riunione dei frammenti dopo che tra essi si sono
verificati scambi di materiale (aberrazioni intercromosomiche). Tali fenomeni possono
avvenire spontaneamente oppure essere causati da fattori esterni quali le radiazioni
ionizzanti.
Anomalia genica: Alterazione del materiale genetico non visibile al microscopio ottico;
consiste in cambiamenti del DNA di singoli geni con la conseguente possibile
alterazione della proteina prodotta dal gene stesso.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
31/44
Aploide: Termine utilizzato per definire una cellula che possiede un gruppo di
cromosomi diversi ciascuno ripetuto una sola volta. L’assetto cromosomico aploide
delle cellule umane consta di 23 cromosomi ed è ripetuto due volte in tutte le cellule
somatiche (tutte le cellule somatiche sono infatti diploidi) mentre è singolo nelle
cellule germinali.
Autosomico: Riferito ad un autosoma cioè a qualsiasi cromosoma che non partecipa alla
determinazione del sesso (nell’uomo vi sono 22 coppie di autosomi).
Carattere dominante: In una normale cellula diploide non può esistere più di una
coppia di alleli per ogni gene; spesso l’effetto di uno dei due alleli (dominante) è
predominante ai fini dell’espressione del carattere rispetto a quello dell’altro
(recessivo). Un gene è dominante rispetto al suo allele (recessivo) quando esprime il
carattere codificato sia in condizioni di eterozigosi che di omozigosi.
Carattere recessivo: vedi carattere dominante.
Cariotipo: Schema ordinato del corredo cromosomico di una cellula, nel quale i singoli
cromosomi sono identificati in base alle loro caratteristiche morfologiche.
Cellula somatica: Ogni elemento cellulare di un organismo non devoluto alla
riproduzione.
Cellula germinale: Ognuna delle cellule deputate, negli animali e nelle piante, alla
riproduzione. Le cellule germinali nell’uomo sono costituite dai gameti.
Cromosoma: Unità discreta del genoma che contiene numerosi geni in sequenza
lineare. Ciascun cromosoma è costituito essenzialmente da DNA e proteine. I
cromosomi sono evidenziabili microscopicamente come entità morfologiche soltanto
durante le fasi della mitosi e della meiosi e sono intensamente colorabili con coloranti
basici. Il loro numero presente nel nucleo cellulare di una data specie animale o
vegetale è costante. Nelle cellule somatiche umane, i cromosomi consistono di 22 paia
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
32/44
di autosomi più due cromosomi sessuali: due cromosomi X nelle femmine, un
cromosoma X e un cromosoma Y nei maschi. In condizioni normali, quindi, ciascuna
cellula somatica umana contiene 46 cromosomi (corredo diploide).
Cromosoma sessuale: Cromosoma i cui geni svolgono il ruolo principale nel determinare
le caratteristiche sessuali di una specie (cromosoma X e cromosoma Y).
Diploide: Termine utilizzato per definire cellule o organismi che possiedono due set
completi di cromosomi omologhi, ognuno dei quali corrispondente al corredo aploide;
ogni cromosoma è pertanto rappresentato due volte ed i cromosomi identici sono
chiamati cromosomi omologhi.
DNA: Acido desossiribonucleico; Polinucleotide che presiede alla conservazione,
trasmissione ed espressione dei caratteri ereditari. Il DNA è costituito da due
filamenti complementari avvolti l’uno sull’altro attorno allo stesso asse per formare
una doppia elica.
Dominanza: La dominanza è la proprietà di un allele (dominante) di prevalere sull’altro
o sugli altri nell’espressione di un carattere fenotipico.
Dominanza
incompleta: Capacità di un allele, che codifica un carattere, di
manifestarsi interamente solo in condizioni di omozigosi, mentre in eterozigosi il
carattere in esame si presenta qualitativamente o quantitativamente intermedio. Si
dice anche che in caso di penetranza incompleta l’espressione di un carattere
(penetranza) è dipendente dall’influenza dell’ambiente (ad esempio lo stile di vita
dell’individuo).
Eterozigosi: Condizione caratterizzata dalla presenza, in tratti corrispondenti di due
cromosomi omologhi, di una coppia di alleli differenti che determinano un determinato
carattere.
Fenotipo: L’insieme delle caratteristiche morfologiche e funzionali di un organismo.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
33/44
Gamete: Cellula germinale matura, con corredo aploide, formata nelle gonadi. I gameti
sono
morfologicamente
differenziati
in
rapporto
ai
sessi:
quello
maschile
(spermatozoo) si unisce con la corrispondente cellula femminile (cellula uovo) nel corso
del processo di fecondazione per dare origine alla cellula uovo fecondata o zigote.
Gene: Unità di informazione genetica, che controlla la sintesi di una proteina.
Rappresenta l’unità ereditaria e si trova in una posizione definita e fissa (locus) di un
particolare cromosoma. I geni possono subire modificazioni chimiche o strutturali
note come mutazioni, spontaneamente oppure per effetto di agenti chimici, fisici o
virali. La presenza di mutazioni in uno o più geni è spesso la causa di molte malattie.
Genotipo: Il complesso dell’informazione genetica presente in un organismo,
corrispondente all’insieme degli alleli presenti nelle sue cellule, che presiede
all’espressione dei caratteri.
Omozigosi: Condizione caratterizzata dalla presenza di alleli identici in loci
corrispondenti di una coppia di cromosomi omologhi.
Meiosi: Processo attraverso il quale una cellula germinale immatura diploide,
dividendosi, origina quattro gameti immaturi aploidi.
Mitosi: Processo consistente nella divisione di una cellula in due cellule figlie,
effettuato con particolari meccanismi che consentono la ripartizione equa del corredo
cromosomico dalla cellula progenitore alle due cellule figlie.
Monosomia: Anomalia cromosomica di numero, consistente nella mancanza, in un
organismo diploide, di un cromosoma e quindi nella presenza del cromosoma omologo
spaiato.
Mosaicismo: Presenza in un medesimo tessuto di cellule con corredo cromosomico
diverso. Il mosaicismo si può istaurare in seguito a mutazioni o a mancata disgiunzione
delle cellule in mitosi.
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
34/44
Mutazione: Termine con cui viene indicata qualsiasi alterazione del DNA. Le mutazioni
che hanno le conseguenze più importanti sono quelle che si verificano nei gameti o nei
loro precursori e che quindi possono produrre un cambiamento ereditario dei caratteri
della progenie quando non sia presente l’allele normale proveniente dall’altro genitore.
Patrimonio genetico: L’insieme degli elementi ereditari di un dato individuo.
Penetranza: La frequenza con cui un carattere monogenico (controllato cioè da un
singolo gene), dominante o recessivo, compare negli individui eterozigoti o omozigoti.
Sindrome: Complesso di sintomi o segni che concorrono alla caratterizzazione di un
quadro clinico.
Trisomia: Anomalia di numero dei cromosomi; consistente nella presenza in una cellula
di un cromosoma soprannumerario, omologo di una delle coppie normalmente presenti,
che quindi compare tre volte nel genoma.
Zigote: Cellula uovo fecondata; possiede un corredo diploide, derivante dalla fusione
dei corredi cromosomici aploidi dei due gameti, quello maschile (spermatozoo) e quello
femminile (la cellula uovo).
___________________________________________________________________________________________________
Laboratorio di Citogenetica e Genetica Molecolare – P.O. Madonna delle Grazie – 75100 Matera
Responsabile Dott. Domenico Dell’Edera
35/44