LA CHIMICA NUCLEARE
Lo studio delle trasformazione che avvengono nel nucleo atomico permette applicazioni che spaziano in
numerosi campi della scienza, dallo studio della formazione degli elementi nell’universo alla sintesi di
molecole radioattive per la medicina
“La storia della scoperta e dell’isolamento di questa
sostanza [il radio] ha fornito la prova della mia ipotesi,
secondo cui la radioattività è una proprietà atomica della
materia e può fornire un metodo di ricerca per nuovi
elementi. L’ipotesi ha condotto alle attuali teorie sulla
radioattività…”. (Marie Curie, Nobel Lecture ,19111).
Le reazioni chimiche sono trasformazioni che comportano lo scambio o la condivisione
degli elettroni tra gli atomi coinvolti nella formazione dei legami, mentre le reazioni
nucleari provocano cambiamenti dell’identità degli elementi stessi in quanto
interessano il cuore dell’atomo fatto di protoni e neutroni. Le reazioni nucleari sono
spesso accompagnate dal rilascio di
quantità di energia enormemente
più grandi di quelle coinvolte nelle
reazioni chimiche, ed inoltre, la
velocità e la resa di queste reazioni
generalmente non dipendono dalle
variazioni di temperatura, pressione
o dalla presenza di catalizzatori.
La chimica nucleare ha avuto origine
dalla scoperta del chimico francese
Henri Becquerel che nel 1896,
durante
i
suoi
studi
sulla
fosforescenza, notò casualmente
che un minerale ricco di uranio, la
pechblenda, posto accanto a lastre
fotografiche
chiuse
nei
loro
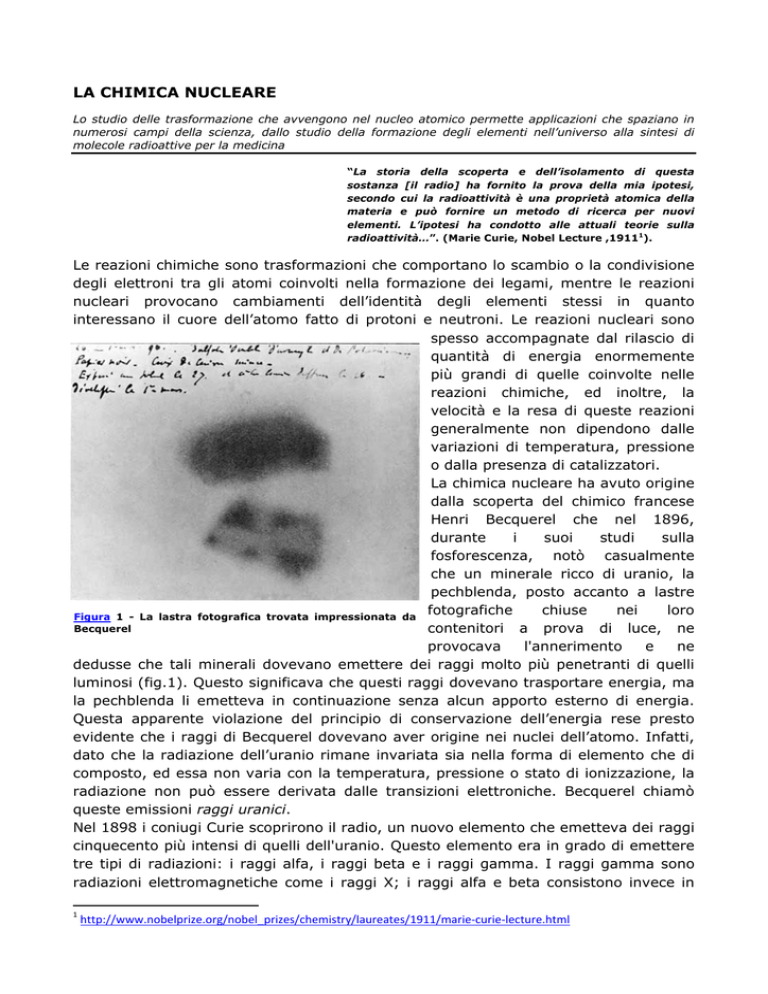
Figura 1 - La lastra fotografica trovata impressionata da
Becquerel
contenitori a prova di luce, ne
provocava
l'annerimento
e
ne
dedusse che tali minerali dovevano emettere dei raggi molto più penetranti di quelli
luminosi (fig.1). Questo significava che questi raggi dovevano trasportare energia, ma
la pechblenda li emetteva in continuazione senza alcun apporto esterno di energia.
Questa apparente violazione del principio di conservazione dell’energia rese presto
evidente che i raggi di Becquerel dovevano aver origine nei nuclei dell’atomo. Infatti,
dato che la radiazione dell’uranio rimane invariata sia nella forma di elemento che di
composto, ed essa non varia con la temperatura, pressione o stato di ionizzazione, la
radiazione non può essere derivata dalle transizioni elettroniche. Becquerel chiamò
queste emissioni raggi uranici.
Nel 1898 i coniugi Curie scoprirono il radio, un nuovo elemento che emetteva dei raggi
cinquecento più intensi di quelli dell'uranio. Questo elemento era in grado di emettere
tre tipi di radiazioni: i raggi alfa, i raggi beta e i raggi gamma. I raggi gamma sono
radiazioni elettromagnetiche come i raggi X; i raggi alfa e beta consistono invece in
1
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1911/marie‐curie‐lecture.html particelle di materia. Il radio, emettendo energia e materia, si trasforma in elio e
piombo, cioè in elementi più leggeri. Dato che la stessa cosa avviene per tutte le altre
sostanze radioattive, si può dedurre che in natura si realizza spontaneamente la
trasmutazione degli elementi. Dato che era chiaro che questi raggi non erano una
caratteristica solo dell’uranio fu cambiato il nome da raggi uranici a radioattività. Ai
Curie e Bacquerel nel 1903 fu assegnato il premio Nobel per la Fisica per il loro lavoro
sulla radioattività. Nel 1911 Marie Curie vinse il premio Nobel per la Chimica per aver
scoperto due nuovi elementi e rimane l’unica persona ad essere stata premiata con il
Premio Nobel sia in fisica che in chimica.
Ci sono essenzialmente tre sorgenti elementi radioattivi: i nuclidi primordiali sono gli
elementi radioattivi presenti dalla formazione della Terra e hanno un’età comparabile
a quella del sistema solare; i nuclidi cosmogenici che sono atomi costantemente
prodotti nell’atmosfera dal bombardamento dei raggi cosmici; gli elementi radioattivi
di origine antropogenica sono il risultato delle attività umane nella produzione
dell’energia nucleare e nella dispersione di fallout radioattivo durante le esplosioni
nucleari.
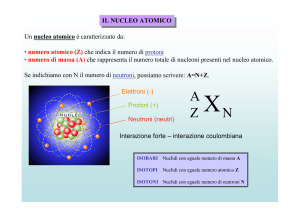
Il nucleo costituisce la parte centrale dell’atomo, presenta dimensioni dell’ordine di
10-14 ÷ 10-15 m ed è formato da protoni e da neutroni, che sono detti nucleoni
(particelle formanti il nucleo). I primi presentano carica elettrica positiva, mentre i
secondi sono privi di carica elettrica. Il numero di protoni è uguale al numero di
elettroni, così che l'atomo è elettricamente neutro. La somma del numero dei protoni
più il numero dei neutroni viene chiamato numero di massa e si indica con la lettera
A, mentre il numero totale di protoni viene chiamato numero atomico e si indica con la
lettera Z. Per un dato elemento, il numero di protoni è fisso ed è quello che lo
caratterizza, mentre il numero di neutroni può essere variabile. Atomi che presentano
lo stesso numero atomico ma diversa massa atomica sono detti isotopi.
Nel 1903, Ernest Rutherford e Frederik Soddy proposero che la radioattività è il
risultato del cambiamento naturale di un isotopo di un elemento in un isotopo di un
altro elmento, e chiamarono questo processo reazione nucleare.
A differenza delle equazioni chimiche in cui gli elementi mantengono la loro identità,
nelle reazioni nucleari questi si trasformano in altri elementi con diverse
caratteristiche.
Comunque anche le reazioni nucleari vanno bilanciate, nel senso che la somma delle
masse iniziali deve essere uguale a quella delle masse finali.
L’isotopo generico X viene rappresentato con la seguente notazione:
Per esempio, i simboli
e
rapprentano rispettivamente l’isotopo del Carbonio
con 6 protoni e 6 neutroni e l’isotopo con 6 protoni e 8 neutroni.
Le principali particelle subatomiche (protoni, neutroni ed elettroni) hanno notazioni
simili:
Protone
Neutrone
Elettrone
Nel caso dell’elettrone l’esponente 0 sta ad indicare un numero di massa praticamente
zero rispetto al nucleo. L’indice inferiore -1 indica la carica negativa della particella.
Esso non è un è un numero atomico ma scrivendo il simbolo in questo modo è utile
per bilanciare le equazioni nucleari.
Consideriamo il decadimento del radio-226 in radon-222. In questa reazione nucleare
detta decadimento alfa, il nucleo instabile emette una particella alfa composta da due
), e si trasforma in un nucleo diverso, con
protoni e due neutroni (un nucleo di elio
numero atomico (Z-2) e numero di massa (A–4).
Come si può vedere dalla tabella precedente, la somma dei numeri dei numeri di
massa e dei numeri atomici rimane uguale nella reazione nucleare.
Le radiazioni alfa sono poco penetranti e nell’aria possono percorrere pochi cm perché
vengono bloccate dagli urti con le molecole che costituiscono l’aria stessa. Il passaggio
di una particella alfa attraverso un mezzo provoca, a causa della carica elettrica +2 e
della massa 7400 volte maggiore di quella dell'elettrone, la ionizzazione di un gran
numero di atomi. Quando la radiazione ionizza molecole all’interno di cellule di
organismi viventi, queste possono modificare le normali reazioni biochimiche
determinando la morte della cellula o la sua riproduzione anormale. La capacità di
ionizzare molecole o atomi da parte della radiazione è detto potere ionizzante. Di tutti
i tipi di radiazione, quella alfa presenta il potere ionizzante maggiore
Nel decadimento beta, un neutrone può essere convertito in un protone , un elettrone
e un’altra particella chiamata antineutrino2. Il nucleo si trasforma in un nucleo con
numero atomico (Z + 1) ma stesso numero di massa A. Un esempio è il decadimento
del Carbonio-14 in Azoto-14:
La somma dei numeri di massa rimane uguale nella reazione ([14 = 14 + 0], così
come la somma della carica elettrica [6 = 7 + -1]). Le radiazioni beta sono più
penetranti di quelle alfa e sono in grado di attraversare sottili fogli metallici, ma sono
molto meno massive delle particelle alfa e quindi hanno un potere ionizzante inferiore.
Il decadimento gamma è di natura elettromagnetica ed accompagna solitamente una
radiazione alfa o una radiazione beta. Infatti, dopo l'emissione alfa o beta, il nucleo è
ancora eccitato perché i suoi protoni e neutroni non hanno ancora raggiunto il nuovo
stato di equilibrio. Pertanto, il nucleo si libera rapidamente dell’eccesso di energia
attraverso l'emissione di una radiazione gamma. Il raggio gamma non ha massa né
carica e pertanto quando viene emesso da un atomo radioattivo questo non cambia la
2
Il neutrino è una particella ad elevato contenuto di energia senza carica elettrica e di massa praticamente nulla, la cui esistenza fu prevista teoricamente da L.Pauli nel 1931 per rendere conto dell'energia e della quantità di moto mancanti nel decadimento beta e da E. Fermi nel 1934. Nel 1956 trovò evidenza sperimentale ad opera di F. Reines e C.L. Cowan Jr. L’antineutrino è l’antiparticella del neutrino. sua massa atomica o il numero atomico. Per esempio, l’emissione alfa dell’ U-238 è
anche accompagnato dall’emissione di un raggio gamma:
Le
radiazioni
gamma
sono
molto
penetranti, e bloccarle richiede materiali
ad elevata densità come il piombo (Fig.
2).
Altro tipo di radiazione è l’emissione di
positroni. Questa avviene quando in un
nucleo instabile un protone è convertito in
un neutrone ed è emesso un positrone ed
un
neutrino.
Il
positrone
è
dell’elettrone: ha la
Figura 2 - Diverso potere di penetrazione delle un’antiparticella
radiazioni nucleari
stessa massa dell’elettrone ma carica
opposta. Se un positrone collide con un
elettrone queste due particelle si annichilano l’una con l’altra rilasciando energia nella
+
forma di raggi gamma. L’emissione di positroni è a volte chiamata emissione β . Il
potere ionizzante e di penetrazione dei positroni è simile a quello dei raggi β.
Quando un atomo emette un positrone, il suo numero atomico decresce di 1, mentre il
numero di massa rimane invariato: ad esempio, l’equazione nucleare per l’emissione
positronica del fosforo-30:
ν
Lo stesso risultato dell’emissione positronica si ha con un altro tipo di decadimento, la
cattura elettronica. In questo tipo di radiazione, un elettrone proveniente dallo strato
più esterno dell’atomo viene assorbito da un nucleo instabile, e unendosi ad un
protone, si trasforma in un neutrone con l’emissione di un neutrino. Un esempio di
cattura elettronica è il decadimento del potassio-40 in argo-40:
ν
Il potassio-40 costituisce lo 0,01% della crosta terrestre ed è il responsabile della
maggior parte della radiazione di origine naturale nelle specie viventi e nel suolo.
Il rapporto tra protoni e neutroni all'interno di un nucleo ed il numero ed il tipo di
interazioni che si stabiliscono tra essi determina se questo nucleo sia o non sia stabile
(fig. 3). Ciascun nucleone è in grado di stabilire interazioni con altri nucleoni; una
coppia protone-neutrone stabilisce una somma di interazioni stabili e bilanciate
reciprocamente, mentre un eccesso o un difetto di neutroni nel nucleo sbilancia il
numero ed il tipo delle interazioni e pertanto il nucleo risulta instabile. Solo quei nuclei
che possiedono approssimativamente lo stesso numero di protoni e di neutroni risulta
stabile nelle condizioni attuali presenti sulla terra.
Nel nucleo la repulsione elettrostatica tra i
protoni è molto intensa, ma esso è mantenuto
unito da una forza specifica, detta interazione
(o forza) nucleare forte (fig.3). Questa forza è
estremamente intensa, ma decresce molto
rapidamente all'aumentare della distanza tra i
nucleoni; perciò il nucleo, quando le sue
dimensioni
aumentano
tanto
da
non
permettere all’interazione forte di superare
quella elettrica repulsiva, tende a decomporsi
Figura 3 - Le due opposte forze presenti in un
nucleo sono la repulsione elettrostatica tra i formando,
così, nuclei più stabili. Un
protoni positivi e la forza nucleare forte che
importante numero per determinare la stabilità
tiene insieme i protoni e neutroni
nucleare è il rapporto di neutroni e protoni
(N/Z). La fig. 4 mostra un grafico in cui sono posti in ascisse il numero di protoni (Z)
ed in ordinata il numero di neutroni (N) per tutti i nuclei conosciuti. Gli elementi che
stanno sulla diagonale hanno
tutti una stabilità nucleare
elevata, (questa regione è
conosciuta
come
banda
di
stabilità) mentre quelli che si
trovano sopra la diagonale
(eccesso di neutroni) e sotto
(eccesso
di
protoni)
sono
instabili
e
soggetti
a
decadimento radioattivo.
I nuclei degli elementi leggeri
hanno un rapporto N/Z tendente
ad uno, mentre i nuclei degli
elementi pesanti mostrano tutti un eccesso di neutroni noto come eccesso di massa.
Figura 4 - La banda di stabilità nucleare mostra diverse Quando Z cresce, la stabilità
combinazioni di protoni/neutroni che danno luogo a isotopi con
del nucleo tende a diminuire a
tempo di dimezzamento misurabile. L’ingrandimento della banda
della
repulsione
nella regione da Z=66 a Z=79 mostra i diversi tipi di decadimento causa
radioattivo
coulombiana, le forze nucleari
attrattive devono quindi aumentare ed è necessario un numero N di neutroni
percentualmente maggiore. Pertanto all'aumentare del numero di protoni, la
repulsione elettrostatica rende necessario un leggero eccesso di neutroni e per questo
il rapporto N/Z si discosta dall'unità per molti nuclei stabili. Per esempio, a Z=40 i
nuclei stabili hanno un rapporto N/Z di circa 1,25 e a Z=80 il rapporto raggiunge 1,5.
Il limite di questa stabilità è dato dall'elemento bismuto con Z=83, dopodiché in
natura non esistono nuclei stabili in condizioni normali. Per raggiungere la stabilità i
nuclei con Z > 83 danno luogo a processi di decadimento che riducono il valore di Z.
Nuclei con Z elevato (>83) come l’americio emettono spontaneamente particelle alfa
diminuendo il suo numero atomico Z due unità e il suo numero di massa A di quattro
unità.
Il tipo di radioattività emessa dipende in parte dal rapporto N/Z. Se questo è molto
alto, i nuclidi che si trovano sopra la valle di stabilità hanno troppi neutroni e tendono
a dar luogo a decadimenti beta, convertendo neutroni in protoni e incrementando così
il numero atomico. Se il rapporto N/Z è troppo basso, i nuclidi sotto la valle di stabilità
tendono convertire protoni in neutroni attraverso una emissione di positroni. Oltre al
rapporto N/Z , anche il numero reale di protoni e neutroni agisce sulla stabilità del
nucleo. La tabella mostra diversi nuclidi che hanno combinazioni di nucleoni pari o
dispari. È da notare che i nuclidi stabili hanno un numero pari sia di protoni che di
neutroni.
A partire dagli anni ’50 è stato sviluppato un modello a gusci del nucleo, costituito da
particelle che si muovono in un campo di forze nucleari. Analogamente ai gusci
elettronici completi, il modello prevede che, in corrispondenza di gusci nucleari pieni,
contenenti un prestabilito numero di nucleoni (N o Z = 2, 8, 20, 28, 50, 82 e N=126),
il sistema sia particolarmente stabile. Questi numeri sono chiamati numeri magici.
Dato che i numeri magici sono pari, questo spiega perché gli elementi con numeri di
protoni e neutroni pari rappresentano il 90% degli elementi presenti nella crosta
terrestre (tab. 1). Esempi sono:
,
,
,
e
Il piombo-208, ha 82 protoni
e 126 neutroni e il nucleo,
“doppiamente
magico”,
appare essere virtualmente
eterno.
Diversi
isotopi
radioattivi
decadono
spontaneamente
per formare un prodotto che
a sua volta è radioattivo. La
maggior parte degli elementi
radioattivi
non
decade
direttamente in un nucleo
stabile, ma passa attraverso
una serie di decadimenti
successivi fino a raggiungere
un isotopo stabile.
Queste
sequenze di reazioni nucleari
sono
dette
catene
di
decadimento radioattivo. In
ogni stadio della sequenza, il
reagente è chiamato isotopo
genitore,
e
il
prodotto
isotopo figlio.
Ad esempio l’uranio, il più pesante elemento presente in natura (Z=92), ha l’isotopo
Figura 5 - Catena di decadimento dell’U-238; i pallini celesti
rappresentano emissione beta e quelli rosa emissione gamma
la cui catena di decadimento segue lo schema seguente riportato in fig.5. Nel
primo stadio l’uranio-238 emette una particella alfa e si trasforma in torio-234.
Il nuclide figlio,
, che si forma in seguito al decadimento dell’uranio, è esso
stesso radioattivo, e decade a Proactinio-234.
Anche il
è radioattivo e pertanto decade a
attraverso l’emissione beta. Il
decadimento radioattivo continua finché è raggiunto lo stato stabile del Pb-207.
Le leggi del decadimento radioattivo sono stabilite in termini matematici. Il momento
in cui un dato nucleo radioattivo decadrà non può essere previsto. La radioattività è
un processo statisticamente casuale, e la probabilità che un nucleo decada in un dato
momento è la stessa per tutti i nuclei di ogni nuclide radioattivo. Tutti i nuclei
radioattivi decadono con una cinetica di primo ordine, e ciò significa che la velocità di
decadimento di un particolare campione è direttamente proporzionale al numero di
nuclei presenti. La velocità di decadimento sarà quindi espressa dalla relazione:
Dove N è il numero di nuclei radioattivi e λ la costante di velocità detta costante di
decadimento, che rappresenta la frazione dei nuclei radioattivi presenti che decadrà in
una data unità di tempo (il segno meno sta ad indicare che N diminuisce). Integrando
questa equazione si ottiene:
(1)
Dove No e Nt sono i numeri di atomi della specie radioattiva esistenti rispettivamente
al tempo zero e al tempo t. Indicando con / , il tempo necessario affinché il 50%
degli
atomi
considerati
decadano, la (1) diventa:
0,5
/
e quindi:
/
/
è
chiamato
,
tempo
di
dimezzamento
ed
è
caratteristico per ogni nuclide.
Il tempo di dimezzamento è
Figura 6 - Decadimento del Radon-220 con tempo di indipendente
dal numero di
dimezzamento di 55,6 s
nuclei
ed
è
inversamente
proporzionale alla costante di decadimento. In fig. 6 è riportato l’andamento del
decadimento del Radon-220. In tabella 2
sono riportati i valori dei tempi di
dimezzamento di alcuni isotopi radioattivi, e
da essi risulta quanto sia ampio l’intervallo di
valori di / , anche per i diversi nuclidi di uno
Tabella 2 – Tipo di decadimento e tempo di
dimezzamento di diversi isotopi radioattivi
stesso elemento. Sulla base della velocità di
decadimento di un isotopo radioattivo è
possibile datare l’età di un materiale.
L’esempio più conosciuto è la procedura
usata per datare i manufatti archeologici
basata sulla misura delle quantità di
carbonio-14 e carbonio-12 in materiali di
origine biologica.
Confrontando il rapporto tra il contenuto di
238
U (t1/2 = 4,5 × 109 anni) e quello del
prodotto finale del suo decadimento, 206Pb nei
meteoriti, è stato possibile misurare l’età del
Sistema Solare, e quindi della Terra: 4,7
miliardi di anni3.
In natura è possibile trovare isotopi
instabili, o perché questi isotopi
presentano tempi di dimezzamento
molto lunghi come (ad esempio
l’uranio-235, l’uranio-238 e il torio232) o perché, nonostante abbiano
brevi tempi di dimezzamento sono
continuamente formati da reazioni
nucleari (ad esempio, il carbonio-14
formato in reazioni nucleari iniziate
dai raggi cosmici o gli isotopi formati
Figura 7 - Diagramma schematico di un ciclotrone. Al
centro vengono introdotte le particelle cariche che
subiscono un accelerazione mediante i due elettrodi cavi.
Magneti
presenti
sopra
e
sotto
questi
elettrodi
determinano una traiettoria a spirale che si espande
all’aumentare della velocità delle particelle. Quando
queste hanno velocità sufficiente escono dall’acceleratore
e si dirigono verso i nuclei target
nelle
catene
radioattivo).
di
decadimento
Tutti gli altri isotopi sono stati
sintetizzati
mediante
reazioni
nucleari artificiali, indicate come
trasmutazioni. La prima trasmutazione è stata realizzata da Ernest Rutherford nel
1919, il quale bombardando con particelle alfa atomi di azoto osservò tra i prodotti la
formazione di protoni. Egli correttamente concluse che era avvenuta la reazione
nucleare seguente:
3
Le trasformazioni nucleari: "La datazione mediante radioisotopi" - Lezioni di Scienze Naturali – Treccani.it
Le particelle alfa usate nei primi studi sulle reazioni nucleari venivano da materiali
radioattivi naturali come l’uranio e presentavano energie relativamente basse rispetto
a quelle necessarie per superare la repulsione elettrostatica dei nuclei. La scoperta del
neutrone e il suo uso come proiettile nel bombardamento dei nuclei e l’utilizzo di
particelle di alta energia ottenute mediante acceleratori, hanno esteso notevolmente
la chimica delle reazioni nucleari aprendo la strada alle trasmutazioni artificiali degli
elementi chimici. Le particelle, accelerate ad altissima velocità, sono in grado di
superare la repulsione elettrostatica e penetrare i nuclei bersaglio, dando luogo a
trasformazioni nucleari. In fig. 7 è riportato il diagramma schematico di un
acceleratore di particelle, il ciclotrone.
Grazie alle reazioni nucleari si sono ottenuti degli elementi artificiali con numero
atomico Z superiore a 92 (uranio), i cosiddetti elementi transuranici.
Lo sviluppo degli acceleratori di particelle ad alta energia ha permesso di far avvenire
collisioni di nuclei più leggeri mediante fasci di ioni pesanti ed ottenere anche nuclidi
con tempi di dimezzamento brevissimo ampliando così il sistema periodico con nuovi
elementi con numero atomico fino a 1184.
Gli elementi radioattivi sono usati in molte aree della scienza e della medicina. Ad
esempio la diagnostica per immagini (nuclear imaging), che consiste nella creazione di
immagini di specifiche parti del corpo, utilizzando un isotopo radioattivo somministrato
come elemento o incorporato in un
composto che si concentra nei
tessuti che devono essere analizzati.
Le emissioni radioattive vengono
rilevate e utilizzate per ricostruire un
immagine dei tessuti (fig.8). La
tabella
mostra
una
lista
di
radioisotopi normalmente utilizzati
nei processi di nuclear imaging. Tutti
gli isotopi emettono radiazione
Tabella 3 – Isotopi radioattivi utilizzati nella diagnostica
per immagini. Sono indicati i tempi di dimezzamento e i gamma. Questo tipo di radiazione è
principali aree analizzate
preferita
per
la
creazione
di
immagini perché, in piccole dosi, danneggia meno i tessuti delle radiazioni alfa o beta.
La tomografia ad emissione di positroni (PET) è un metodo di diagnostica per
immagini utilizzato per osservare la struttura e la funzione del cervello. Si inietta nel
flusso sanguigno una sostanza marcata con un isotopo che emette positroni
(decadimento beta) che viene trasportata fino al cervello. L’isotopo radioattivo emette
positroni che vengono annichiliti da elettroni con una simultanea emissione a 180°
l’uno dall’altro di due fotoni gamma. Una serie di sensori rilevano le zone di emissione
e mediante un computer viene costruita una mappa che mostra dove l’emissione è
localizzata nel corpo (fig.8). Due degli isotopi utilizzati sono l’15O, iniettato come H215O
per misurare il flusso del sangue e il 18F legato a una molecola simile al glucosio per
misurare l’assunzione di glucosio, un indicatore del metabolismo.
4
I nuovi elementi superpesanti - Chimica moderna – Treccani.it
Poiché, gli isotopi utilizzati hanno
tempi di dimezzamento brevi,
l’apparecchiatura per la PET deve
essere localizzata vicino ad un
ciclotrone dove sono preparati i
radionuclidi
che
vengono
incorporati nel composto di
trasporto.
Si può determinare la stabilità
termodinamica di un nucleo
calcolando l’energia nucleare di
Eb
cioè
l’energia
legame,
Figura 8 - La PET permette di vedere come il cervello utilizza
richiesta
per
separare
i
nuclei
di
il glucosio. A destra immagine di persona normale. Il colore
rosso mostra la più alta utilizzazione del glucosio. A sinistra, un atomo in protoni e neutroni.
immagine di persona che abusa di cocaina. Il cervello mostra Per esempio l’energia di legame
un utilizzazione minore del glucosio. Ci sono molte aree con
nucleare per il deuterio è
ridotta attività metabolica
l’energia richiesta per separare
una mole di deuterio in una mole di protoni e neutroni:
2,15 · 10
⁄
L’energie di legame nucleare è legata al fatto che quando i nucleoni si uniscono la
massa del nucleo è sempre minore di quella delle masse dei suoi componenti e la
differenza (difetto di massa) è quella che fornisce - con la famosa legge di Einstein l'energia di legame del nucleo5:
Figura 9 – energia di legame per nucleone in funzione del numero di
massa dell’atomo (espressa in MeV)
decomporre un nucleo) corrisponde al
5
Ad esempio considerando la formazione
dove c = 2,998 × 108m/s.
Per confrontare i valori
delle energie di legame che
intercorrono tra i nucleoni
di nuclidi diversi, si può
calcolare
l’energia
per
nucleone,
dividendo
il
valore
dell’energia
di
legame per il numero dei
nucleoni
che
lo
costituiscono (fig. 9).
Da notare che il valore più
stabile
(cioè
il
valore
maggiore di energia per
con energia di legame di 8,79 MeV.
di una mole deuterio da mole di protoni e neutroni, tendendo presente le
masse relative si calcola, per il difetto di massa, il valore: Δm =[1.007825 g/mol + 1.008665 g/mol] − 2.01410 g/mol
= 0.00239 g/mol
L’andamento del grafico mostra che i nuclei con numeri di massa più bassi del ferro
dovrebbero tendere ad unirsi, mentre quelli con numeri più alti a dividersi per
ottenere nuclei con valori attorno a 60. Le energie di attivazione richieste per queste
trasformazioni nucleari sono tali che nelle condizioni normali avvengono
spontaneamente solo per rari elementi radioattivi naturali. Le reazioni nucleari
possono essere provocate attraverso il processo di fissione nucleare (nuclei grandi che
si rompono per dare nuclei più piccoli) e di fusione nucleare (nuclei leggeri che si
uniscono per dare nuclei più pesanti).
La fissione nucleare fu scoperta alla fine degli anni ’30 a seguito del bombardamento
con neutroni dell’isotopo dell’uranio-235. Questo, inizialmente cattura il neutrone per
formare uranio-236 che è però instabile e successivamente si spezza dando due nuovi
nuclei che possono essere uguali (fissione simmetrica) o diversi (fissione
asimmetrica). Durante il processo si liberano nuovi neutroni che provocano a loro
volta altre fissioni determinando un
processo a catena. Ad esempio:
3
L’energia liberata è di 2,1. 1013 J per mole
di
. Il processo di fissione produce
un’energia 26 milioni di volte maggiore di
quella prodotta dalla combustione del
metano (8,0. 105 J). La reazione a catena,
fatta avvenire lentamente, può essere
sfruttata per produrre energia elettrica nei reattori nucleari.
Figura 10 - Rappresentazione del processo di
fissione in cui ogni evento produce tre neutroni
che
possono
provocare
altre
fissioni
determinando un processo a catena
In una reazione di fusione nucleare piccoli nuclei reagiscono per formare nuclei più
pesanti. Un esempio di fusione è quello tra i nuclei di idrogeno-2 (deuterio) e
idrogeno-3 (trizio):
1,7 · 10
⁄
Questa reazione richiede un’enorme energia di attivazione per superare la forza di
repulsione elettrostatica tra i nuclei di idrogeno e pertanto per realizzarla sono
necessarie temperature dell’ordine da 106 a 107 K, come quelle presenti all’interno del
sole. A queste temperature la materia non esiste come atomi o molecole ma nella
forma di plasma costituito da nuclei non legati ed elettroni.
Anche se c’è la speranza che in futuro le reazioni di fusione possano essere sfruttate
come fonte di energia per scopi civili, esistono ancora molti problemi tecnici che
devono essere risolti, soprattutto per quanto riguarda le temperature estremamente
alte richieste dalle reazioni e come confinare il plasma abbastanza a lungo da
permettere il rilascio di una quantità netta di energia. Poiché il plasma è un conduttore
elettrico, esso è soggetto alle forze magnetiche. Così, un approccio è confinare il
plasma caldo mediante un campo magnetico. Un altro metodo, detto a confinamento
inerziale, consiste nel riscaldare con fasci di raggi laser o fasci di particelle accelerate
la materia così rapidamente che le reazioni di fusione hanno luogo prima che questa
abbia il tempo di espandersi.
Ciononostante le enormi difficoltà, molte caratteristiche della fusione nucleare
incoraggiano a proseguire la ricerca in questo campo. Primo, l’idrogeno è un
propellente poco costoso e disponibile in quantità praticamente illimitata. Secondo,
molti isotopi radioattivi che si generano durante la fusione nucleare hanno tempi di
dimezzamento brevi e pertanto essi rimangono un pericolo per un tempo molto
limitato.