Principi di Termodinamica
Termometria
Calorimetria
Visione Microscopica e macroscopica
I principi della termodinamica
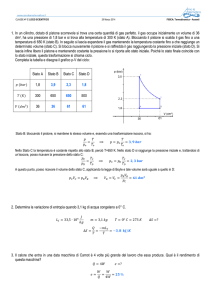
Il nostro esperimento
Breve storia della termodinamica
.
L’inizio della termodinamica
•
La termodinamica nasce prima in modo empirico trasformandosi poi in scienza. E’ il
progresso tecnologico a dettare i tempi delle scoperte scientifiche.
•
La termodinamica ha origine da un problema molto consistente all'epoca: l'eliminazione
dell'acqua delle miniere. La prima macchina termica dell'era moderna capace di sfruttare la
potenza del calore per produrre lavoro fu realizzata nel 1695 da un tecnico inglese, Thomas
Savery (1650-1715). Si trattava di una macchina senza cilindro e pistone, di rendimento
molto basso ma comunque capace di pompare l'acqua dal sottosuolo delle miniere
•
•
La macchina di Papin (da Denis Papin, 1647-1712) era costituita da un tubo chiuso nella
parte inferiore e contenente un pistone sotto al quale si trovava una piccola quantità di
acqua che, trasformata in vapore, spingeva il pistone fino in cima al cilindro dove si
fermava contro un dente di arresto. Raffreddando il cilindro il vapore condensava
producendo un vuoto parziale sotto il pistone. La pressione atmosferica costringeva il
pistone ad una rapida discesa (fase attiva). Il tubo svolgeva la triplice funzione di
caldaia, cilindro del motore e condensatore. La macchina a vapore sarà realizzata in
tappe successive separando queste tre parti.
La macchina di Newcomen
•
•
•
La prima vera e propria macchina a
vapore viene inventata e costruita da
Thomas Newcomen (1663-1729), un
fabbro inglese che si era interessato al
problema.
Questa era una macchina a pistone
che sfruttava il calore del fuoco. Aveva
un rendimento bassissimo e tempi
lunghi tra due fasi successive.
La prima macchina di Newcomen
viene messa in funzione nel 1705.
Attorno al 1725 la macchina di
Newcomen
era
impiegata
in
moltissime miniere ma anche per
rifornire di acqua le ruote idrauliche più
grandi. Il difetto principale di questa
macchina è il continuo raffreddamento
del cilindro che causa un enorme
consumo di carbone. Il suo rendimento
termico era solo dell'1%, cioè ogni 100
Kg di carbone bruciati solo 1 veniva
utilizzato per far muovere la pompa.
Nonostante questi gravi difetti la
macchina non ebbe rivali nelle miniere
inglesi
per
circa
60
anni.
La macchina di Watt
La macchina di Watt (da James
Watt 1736-1819).
In essa la
condensazione
del
vapore
avviene
in un contenitore
separato (il condensatore) che
permette di mantenere il cilindro
col
pistone
sempre
caldo
evitando
grandi
sprechi
di
carbone e rendendo il processo
più
veloce e di maggiore
rendimento.
•
Tale realizzazione rese evidente la
necessità di avere due sorgenti di
calore a temperature diverse, preludio
questo al secondo principio della
termodinamica. In questo modo si
aumentava il rendimento fino al 6 7%.
La macchina di Watt
• Per avere una macchina a vapore vera e propria, quella cioè che darà il via alla
rivoluzione industriale si deve attendere il genio di James Watt (1736-1819).
• Nel 1765 egli era impiegato come mantenitore di strumenti presso l'università di
Glasgow in Scozia. In tale veste egli dovette riparare un piccolo modello di macchina
di Newcomen che non aveva funzionato mai. Watt si rese conto che l'alternativo
riscaldamento e raffreddamento del pistone sprecava grandi quantità di calore e
quindi di combustibile. Intuì che se la condensazione del vapore fosse avvenuta in
un contenitore separato (il condensatore) si poteva mantenere il cilindro col pistone
sempre caldo evitando grandi sprechi di carbone e rendendo il processo più veloce e
di maggiore rendimento.
Calorico e flogisto
• Black (1728-1799) per primo comincia ad attuare la distinzione
tra il concetto di temperatura e quello di calore.
Per il calore anticamente erano state proposta varie teorie. Una
di queste, dovuta a J.J. Becher (1635-1682) era la teoria del
flogisto (dal greco=combustibile). Tale teoria postulava
l'esistenza di una sostanza che era contenuta in tutti i corpi, il
flogisto, e che veniva liberata per combustione di materiale
organico o per trattamento dei metalli con il calore in aria libera
(ossidazione)
• Tale teoria dovette poi soccombere alle idee di Lavoisier (17431794) tramite i suoi studi sulle reazioni chimiche ed all'uso di
una bilancia di precisione per pesare composti e reagenti.
Alla domanda su cose fosse il calore si potevano dare due
risposte legate a due correnti di pensiero. Per una di esse il
calore era una sostanza, il calorico o calore latente contenuto in
tutti i corpi e liberato durante tutti i processi mentre per l'altra il
calore
era
una
sorta
di
moto
o
vibrazione.
Sadi Carnot
•
•
Nonostante le varie migliorie apportate da Watt
alle macchine a vapore non se ne conoscevano i
principi fisici nel senso che le migliorie
aumentavano il rendimento ma nessuno fino ad
allora si era posto il problema del limite del
rendimento di una macchina.
Sadi Carnot (1796-1832), fisico ed ingegnere
francese formatosi all’Ecole Polytechnique è
considerato il fondatore della termodinamica.
Rèflexions sur la puissance motrice du feu et sur
les machines propres à développer cette
puissance (Riflessioni sulla forza motrice del fuoco
e sulle macchine in grado di svilupparla).
•
Carnot capi’ che era fondamentale conoscere i processi alla base delle macchine industrali
per scoprire i limiti del rendimento. Per rendimento si intende il rapporto tra il lavoro
compiuto e l’energia consumata per compierlo. Per arrivare a ciò Carnot postulò che, in
modo analogo a quanto avviene nelle macchine idrauliche (in cui il lavoro dipende dal
peso dell'acqua per l'altezza di caduta), nelle macchine termiche il lavoro dipendesse dalla
caduta di calore, cioè dal trasferimento di calorico (inizialmente Carnot era fedele alla
teoria del calorico, quindi di un fluido che si trasmetteva da corpo a corpo) da una sorgente
calda (caldaia) ad una più fredda (condensatore). Inoltre Carnot sosteneva che il
rendimento non fosse legato alle caratteristiche del fluido, ma esclusivamente alla
differenza di temperatura
•
•
Da queste considerazioni Carnot dedusse che il rendimento delle macchine
non poteva essere illimitato e che una macchina ideale è quella che ha il
rendimento massimo, sempre comunque inferiore al 100%. Enunciò inoltre
quello che viene conosciuto come il Ciclo di Carnot: si tratta di una macchina
termica ideale che trasforma il calore in lavoro operando ciclicamente.
Nessuna macchina termica reale può avere rendimento superiore ad una
macchina
di
Carnot
operante
tra
le
stesse
temperature.
Come ricordato Carnot inizialmente abbracciò la teoria del calorico. In seguito
si avvide del suo errore ma i suoi scritti postumi furono pubblicati quando
ormai altri si erano presi il merito della formulazione del primo principio della
termodinamica e della conservazione dell’energia. Il lavoro di Carnot tuttavia
non incontrò una capillare diffusione, anzi per moltissimo tempo rimase
sconosciuto.
•
Fu Emil Clapeyron (1799-1864) che nel 1834 riprese il lavoro di Carnot evitandogli
l'oblio e traducendo in forma matematica le argomentazioni discorsive di Carnot.
Nella sua memoria Sur la puissance motrice de la chaleur egli riprende appunto il
lavoro di Carnot e lo rende noto alla comunità scientifica. Tutto ciò avrà grandi
ripercussioni in Inghilterra dove ormai i tempi erano maturi per trattare in modo più
rigoroso la termodinamica.
•
Di ciò si occuperanno due persone in particolare: Joule e Kelvin
Rumford
•
La teoria del calorico venne messa in discussione da
Benjamin Thompson conte Rumford (1753-1814).
Nell'ambito del suo studio sull'alesatura dei cannoni, egli
nota che il calore che si sprigiona nel forare i cannoni
non deriva solo dal taglio del metallo, come richiedeva la
teoria del calorico che pensava che dal taglio si
liberasse il calorico. Utilizzando attrezzi smussati, quindi
non in grado di spezzare il metallo, il calore si produceva
lo stesso ed era proporzionale al lavoro compiuto.
Rumford fu tra i primi a rifiutare la teoria del calorico
come fluido che si trasmette da un corpo all’altro per
contatto per abbracciare una teoria che stava facendo
breccia in quel tempo, la teoria del calore come lavoro.
•
A tal proposito sempre nell'ambito dell'esperienza
dell'alesatura dei cannoni, misurò in modo molto
approssimativo il rapporto calore/lavoro ottenendo il
valore di 5.5 joule/caloria (naturalmente le unità di
misura utilizzate sono quelle attuali, ma il rapporto
rimane invariato: ogni unità di misura del calore si
trasforma in 5.5 unità di misura del lavoro.
Equivalente meccanico del calore
•
James Prescott Joule (1818-1889) era un fisico
dilettante di Manchester che di professione faceva il
birraio e si dedicava nel tempo libero alla fisica. Tra il
1841 ed il 1848 avvia tutta una serie di studi
sull'equivalenza tra calore e lavoro, da lui fortemente
sostenuta. La bontà delle misure da lui eseguite in molti
esperimenti diversi lo portano a ritenere che il rapporto
calore/lavoro sia di 4,186 joule/caloria. Questo è anche
il valore attuale utilizzato in fisica. Naturalmente in suo
onore l’unità di misura del lavoro o dell’energia è
chiamata joule. Questo valore ottenuto era
naturalmente molto soggetto a imprecisioni dovute alle
dispersioni di calore durante gli esperimenti di cui il più
celebre di tutti è quello del mulinello.
Il peso scendendo fa girare
le palette immerse in un
recipiente pieno di acqua.
La temperatura dell'acqua
aumenta a causa dell'attrito.
Paragonando il lavoro
eseguito dalla discesa
del peso con l'aumento
di temperatura dell'acqua,
Joule ricavò il valore
dell' equivalente
meccanico del calore.
1 Cal = 1000 cal = 4186 J
•
In Inghilterra William Thomson (1824-1907), più noto come
Lord Kelvin, viene a conoscenza dei lavori di Carnot tramite
l'articolo pubblicato in Francia da Clapeyron. In seguito
Thomson si recherà in Francia proprio alla ricerca del testo di
Carnot. Avutolo tra le mani affronterà i problemi legati al 2°
principio della termodinamica. Anche Thomson in un primo
momento abbraccia la teoria del calorico che poi abbandona
quando prende visione degli esperimenti e delle misure di
Joule.
•
Lord Kelvin conobbe Joule durante un congresso di
fisica e subito capì l'importanza del suo lavoro al punto
da abbandonare la teoria del calorico per appoggiare in
pieno l’equivalenza tra lavoro e calore. Questo diventa il
primo passo per una nuova concezione del calore e
della
termodinamica.
Tra la teoria del calorico e quella del calore come lavoro
esiste una sostanziale differenza. La teoria del calorico
prevedeva che tutto il calore assorbito da una sorgente
si trasformasse in lavoro. La teoria del calore come
lavoro invece mostra che solo una parte del calore
assorbito si trasforma in lavoro mentre il rimanente
viene ceduto all’ambiente e non c’è modo di usarlo. Il
rendimento del 100% è irrealizzabile in natura.
• Sull’equivalenza tra calore e lavoro è da ricordare anche Julius
Mayer (1814-1878), medico tedesco, che però non vedrà
riconosciuto il suo lavoro se non dopo molto tempo, quando
ormai era evidente che la teoria del calore stava soppiantando
quella del calorico. Già nel 1838 egli aveva calcolato il rapporto
tra calore e lavoro pari a 3.59 Joule/calorie, utilizzando delle
considerazioni sui gas. Tuttavia questi suoi lavori non vennero
accettati dalla rivista di fisica tedesca dell'epoca e poterono
essere pubblicati solo su una rivista di chimica. Il lavoro di
Mayer non si fermava qui. Egli aveva già intravisto quello che
poi sarà il primo principio della termodinamica e la
conservazione dell’energia. Egli sosteneva non solo che il
calore fosse equivalente al lavoro, ma che entrambi fossero
una forma di energia.
•
I tempi erano maturi anche per una formulazione
definitiva dell'equivalenza tra lavoro e calore.
Contemporaneamente anche la meccanica classica,
quella newtoniana, stava arrivando ai concetti di
•
energia e della sua conservazione.
•
Fu Hermann Helmholtz (1821-1894), fisiologo,
fisico e matematico tedesco, che nel 1847 nel suo
saggio Sulla conservazione della forza introdusse
un nuovo ente fisico: l'energia potenziale da lui
chiamata "forza di tensione". In questo saggio egli
enuncia il principio di conservazione dell’energia
per i sistemi meccanici conservativi.
•
Una volta che Helmholtz chiarisce il concetto di
conservazione dell’energia in meccanica, lo
estende anche ad altri campi della fisica, in
particolare alla termodinamica dove in quell’epoca
Joule aveva calcolato l’equivalente meccanico del
calore.
.
•
Nel 1857 Clausius diede un contributo importante
alla teoria cinetica del gas (di August Krönig)
introducendo i gradi di libertà molecolari
(traslazionali, rotazionali e vibrazionali). Nello stesso
lavoro introdusse il concetto di cammino libero medio
di una particella. Clausius si interessò inoltre di
elettrolisi e le sue ricerche furono riprese in seguito
da Arrhenius.
•
In realtà le prime formulazioni di una teoria cinetica
risalgono addirittura al 700, quando Daniel Bernoulli
(1700-1782) utilizzò concetti atomistici per elaborare
una prima teoria cinetica dei gas, spiegando in
termini molecolari e probabilistici probabilistici il loro
comportamento in condizioni di pressione e
temperatura variabili; questo studio, tuttavia, non
ebbe molto seguito all'epoca.
•
Di Clausius è la una delle formulazioni del
secondo
principio
della
termodinamica
e
l’introduzione del concetto di entropia
James Clerk Maxwell (1831-1879)
•
•
James Clerk Maxwell (1831-1879) è considerato
uno degli scienziati più importanti del XIX° secolo. Il
nucleo
principale
della
sua
ricerca
è
l'elettromagnetismo, inoltre sviluppò la teoria
cinetica dei gas e indagò sulla visione dei colori e
sui
principi
della
termodinamica.
Studiò presso le università di Edimburgo e
Cambridge; divenne poi professore di fisica
all'università di Aberdeen (1856-1860) e di
Cambridge (1871).
Ludwig Boltzmann (1844 - 1906)
• Boltzman fu il primo uomo a capire l'intima
struttura delle trasformazioni che si
verificano in natura e lo fece prima che
l'esistenza degli atomi venisse accettata da
tutti gli scienziati.
•
Carnot si era mosso verso la Termodinamica
partendo dalla macchina a vapore, Boltzman
si avvicinò alla Termodinamica dalla parte
opposta e cioè dalla parte della meccanica
statistica, cioè dagli effetti del movimento
degli atomi.
•
Le successive ricerche e i successivi
esperimenti confermarono che Boltzman
aveva ragione e adesso è universalmente
riconosciuto come uno dei massimi fisici
teorici della storia della scienza
•
.
La termodinamica
E’ la Termodinamica la scienza che si occupa di come il calore , una
particolare forma di trasferimento di energia, possa trasformarsi in
lavoro, un’altra forma di trasferimento di energia.
Come sfruttare il calore per produrre lavoro meccanico?
Il che corrisponde
a chiedersi
Da dove cominciamo?
• Esploriamo alcuni concetti di base:
• Lavoro
• Calore
• Temperatura
Il lavoro: una definizione operativa (già affrontato: si veda le lunghe lezioni
precedenti)
Una forza compie lavoro quando sposta il suo punto di applicazione; più forze
applicate allo stesso corpo compiono lavoro in modo indipendente l’una
dall’altra.
Una forza compie lavoro se produce uno
spostamento.
Se forza F e spostamento s sono vettori
paralleli, il lavoro L è il prodotto dei loro
moduli:
Se forza e spostamento non sono
paralleli, si considera solamente la
componente della forza parallela allo
spostamento:
Lavoro come modalità di trasferimento dell’energia
• Conosciamo già una modalità di trasferimento di energia, il
lavoro. Per esempio, applicando una forza F ad un corpo per un
determinato spazio s, si modifica l’energia cinetica del corpo. Il
corpo accelera, passando dalla velocità v1 alla velocità v2.
• La sua energia cinetica passa dal valore E1 = ½ m v12
al valore
E2 = ½ m v22
• Il teorema dell’energia cinetica ci assicura che tramite il lavoro L=
F· s si trasferisce energia al corpo cosicché la sua energia cinetica
aumenta da E1 a E2
Quando diciamo che si trasferisce calore?
• A) Quando un cubetto di ghiaccio si scioglie diciamo che passa
calore dall’ambiente, più caldo, al cubetto di ghiaccio, più
freddo
T = 0 °C
Q
T = 20 °C
Quando diciamo che si trasferisce calore?
B)
Quando mettiamo a contatto un
corpo caldo e uno freddo,
diciamo che il calore scorre da
quello più caldo a quello più
freddo
90 °C
10 °C
Q
T1
T2
T1>T2
Quando diciamo che si trasferisce calore?
Ma anche in altri fenomeni è in gioco il trasferimento di calore, per
esempio:
–
nei passaggi di stato (solido - liquido - gas)
–
nelle reazioni chimiche
–
nelle reazioni nucleari
Cosa significa trasferire calore?
• Per capire cosa significhi
trasferire calore, o energia
termica, ad un corpo,
bisogna
riuscire
a
descrivere
i
fenomeni
coinvolti da un punto di
vista
microscopico,
ricordando
che
la
materia, sia allo stato
solido che liquido che
gassoso è composta da
atomi e molecole in
continuo movimento
Come facciamo a saperlo?
• Ricordiamo almeno una prova del
movimento delle molecole, che
riguarda i fluidi: il moto
browniano
Il moto browniano
Se all’interno di un liquido si introducono particelle solide
di dimensioni molto piccole, dell’ordine di 1 micron (10-6)m
e si osserva al microscopio una goccia di liquido si può
vedere che le particelle solide si muovono in modo molto
irregolare. Questo fenomeno viene chiamato moto
Browniano perché descritto per la prima volta nel 1828 dal
botanico Robert Brown che aveva osservato al
microscopio il movimento di granuli di polline di licopodio
in acqua.
• Nel 1905 Einstein interpretò il moto dei granuli come dovuto
alle fluttuazioni del numero di urti delle molecole di liquido su
ogni granulo di polline.
L’energia interna
U Int = ∑ K i
•
Se è vero che le molecole si muovono incessantemente, esse
possiedono energia cinetica K (dovuta al movimento) ed energia
potenziale Ep( dovuta alla interazione tra le molecole)
• La somma di tutte le energie cinetiche e potenziali si chiama energia
interna U
• Nel modello che adotteremo per studiare il comportamento delle
molecole, in particolare nei gas( modello del gas perfetto), l’energia
potenziale è molto piccola rispetto a quella cinetica. In esso l’energia
interna è uguale alla somma delle energie cinetiche delle varie molecole:
Il calore e l’energia interna
• Il calore trasferito ad un sistema, attraversa la superficie di
contorno che separa il sistema dall’ambiente e si trasforma in
energia interna U accumulata.
• Ma tramite quale meccanismo microscopico il calore si
trasferisce?
Calore (Q)
Sistema
U aumenta
Il calore e l’energia interna
• Il calore trasferito da un sistema, attraversa la superficie di
contorno che separa il sistema dall’ambiente e “abbassa” l’
energia interna U posseduta.
• Ma tramite quale meccanismo microscopico il calore si
trasferisce?
Calore (Q)
Sistema
U diminuisce
Ipotesi di trasferimento del
calore a livello molecolare
• Supponiamo di porre una pentola sul
fuoco:
– Le molecole contenute nella fiamma interagiscono
con le molecole del metallo che costituisce la pentola
– nelle molecole del metallo aumenta l’energia cinetica,
cioè aumentano l’ampiezza e la la velocità di
vibrazione; questi aumenti si comunicano all’acqua
contenuta nell’interno
– anche le molecole dell’acqua aumentano la loro
velocità
Trasferimento
• Sperimentalmente si può verificare che
l’ipotesi fatta è corretta
• Vedremo (con la teoria cinetica dei gas)
che è possibile ricavare un modello in
grado di giustificare queste ipotesi. Da
esso ricaveremo il significato
microscopico di grandezze come
temperatura, energia interna,
pressione, ecc.
Sorgenti di calore
• Per trasferire calore è necessario avere a
disposizione una sorgente di calore, a
temperatura T2 maggiore della
temperatura T1 del corpo a cui tale
calore si deve trasferire
• Si dice TERMOSTATO una sorgente che
può trasferire calore ad un corpo senza
diminuire sensibilmente la propria
temperatura
Il concetto di termostato
• Termostato o riserva di calore
Dalla calorimetria è noto che più grande è la
capacità termica di un sistema e minore è la sua
variazione di temperatura per un dato flusso di
calore (Lo vedremo in seguito).
Si chiama riserva di calore (o sorgente ideale di
calore o termostato) un sistema a capacità
termica infinitamente alta: si può ritenere che la
temperatura di una riserva di calore non cambi
per quanto grande possa essere il flusso di
calore in uscita o in entrata. Il concetto di riserva
di calore è un’astrazione utilissima dal punto di
vista teorico. Esempi di sistemi che possono
ritenersi con buona approssimazione delle riserve
di calore: l’atmosfera, un lago, l’oceano...
La propagazione del calore
• La propagazione del calore può avvenire in tre modi
• Conduzione
• Convezione
• Irraggiamento
• Conduzione
Scambio di energia cinetica tra le mole
cole del sistema, in cui le particelle meno
energetiche guadagnano energia dagli urti
con quelle più energetiche. La conduzione
di calore avviene solamente se c’è una
differenza di temperatura tra due parti del mezzo conduttore
Conduzione
• La quantità di
calore che viene
trasferita nel
tempo t dalla
parte più calda
(T1) alla parte più
fredda (T0) è
• Q= k S(T1 - T0) t / x
K= coefficiente di conducibilità
T = tempo
X = spessore
S = superficie
x
T0
T1
Q
S
Convezione
Convezione:
• Il calore viene trasmesso mediante
trasporto di materia
Irraggiamento
L’energia viene trasmessa attraverso onde elettromagnetiche , senza
trasporto di materia. La trasmissione avviene anche nel vuoto. Ad esempio, la
radiazione solare che raggiunge la superficie terrestre trasporta in un secondo
una quantità di energia pari a circa 1.3 kJ su una superficie di 1 m2.
In fisica, il vettore di Poynting, il cui nome è dovuto a John Henry Poynting,
è un vettore che descrive il flusso di energia (energia per unità di superficie
per unità di tempo) associato alla propagazione del campo elettromagnetico.
Più precisamente, è definito come la quantità di irradianza trasportata dalla
radiazione elettromagnetica, e si misura pertanto in W/m^2
In che direzione va il calore?
• Proseguiamo nelle nostre osservazioni sulla natura del calore e
sulle sue proprietà:
• Abbiamo visto che il calore è un trasferimento di energia
meccanica a livello molecolare.
• Osserviamo che quando si trasferisce calore ad un corpo, questo
aumenta la sua temperatura. Cos’è la temperatura?
• La nostra esperienza ci dice che il calore passa sempre da un
corpo più caldo ad uno più freddo: una pentola di acqua
fredda posta sul fuoco si scalda, cioè il calore si trasferisce dalla
fiamma (ad alta temperatura) all’acqua ( a bassa
temperatura)e non succede il contrario, cioè che la pentola si
raffreddi e la fiamma si scaldi ulteriormente. Perché?
Due modi per descrivere la
termodinamica
• Per rispondere a queste (e ad altre
ulteriori domande) abbiamo a questo
punto due scelte:
• Affrontare il problema da un punto di
vista
macroscopico
(Termodinamica
classica)
• Affrontarlo da un punto di vista
microscopico (Termodinamica statistica)
Termodinamica classica
• La termodinamica classica si limita ad
osservare i fenomeni termici a livello
macroscopico e a determinare le leggi
che collegano tra loro le cosiddette
variabili di stato termodinamiche, per
esempio la temperatura T, la pressione P,
il volume V. Risulta più semplice da un
punto di vista matematico, almeno nei
suoi primi sviluppi, ma meno intuitiva.
Termodinamica al microscopio
• Esiste un altro modo di studiare questi
fenomeni, quello di cercare di capire che
succede a livello microscopico, il che
fornisce un maggiore supporto intuitivo.
• E’ il metodo che segue la meccanica
statistica. Noi seguiremo in parallelo i due
metodi, cercando di mettere in evidenza
soprattutto il significato microscopico
intuitivo delle grandezze macroscopiche
che si usano nella termodinamica
classica.
Termometria
Due corpi sono in equlibrio TERMICO se, posti in contatto, le
grandezze macroscopiche che li caratterizzano si approcciano a valori
uguali e COSTANTI nel tempo
Se due sistemi A e B sono in equilibrio TERMICO con un terzo corpo
C, allora essi sono in equilibrio TERMICO (Principio 0 della
Termodinamica).Equivalente a: Il calore fluisce spontaneamente da un
corpo a temperatura maggiore
ad un corpo a temperatura minore
Dilatazione termica
1 Cal = 1000 cal = 4186 J
Q è positivo se assorbito dal sistema, negativo se ceduto, L è positivo
se fatto sul sistema, negativo fatto dal sistema. La formula (1) rende
evidente il significato dei concetti fisici di calore e di lavoro
Il legame tra calore e
temperatura ; calore specifico
Lo stato di un copro può essere variato scambiando con esso calore o
eseguendo su di esso un lavoro.
Si definisce Capacita Termica (C’) la quantità di calore Q fornita al copro per
variare la sua temperature di ∆T cioè
C' =
Q
∆T
La capcità termica per unità di massa si chiama invece Calore Specifico (c) ed
è una proprietà del materiale di cui è costituito il corpo.
C'
Q
c=
=
m m∆T
Cambiamenti di stato
• Il cambiamento di stato avviene ad una
definita temperatura che dipende dalla
sostanza e dalla pressione esterna
• Il cambiamento di stato avviene
isotermicamente ed è accompagnato
da uno scambio di calore, legato alle
variazioni dell’energia chimica di legame
fusione
–
• Solido
solidificazione
ebollizione
liquido
vapore
condensazione
A TEMPERATURA
COSTANTE!
CAMBIAMENTI DI STATO
• Temperatura di un campione di acqua in funzione del tempo
quando viene somministrato un flusso costante di calore a
pressione costante (1 atm).
Temperatura (°C)
ebollizione
+100
fusione
0
P = 1 atm
-10
tempo
Lo stato gassoso
• Tra tutti i possibili stati della materia, per i
lo stato gassoso è lo stato più importante
per la termodinamica. Infatti le macchine
termiche, per esempio le macchine a
vapore, utilizzano le proprietà dello stato
gassoso per trasformare calore in lavoro.
• Ma come sono fatti i gas? Quali
leggi regolano il loro
comportamento?
Gas perfetti
Il caso più semplice di gas è quello con molecole
monoatomiche. E’ possibile costruire un modello
semplificato del gas monoatomico, quello del gas
perfetto, che si rivela un ottimo modello, molto vicino
alla realtà.
Nel modello del gas perfetto:
la massa gassosa è costituita da un numero enorme di
particelle indistinguibili e, per una stessa specie
chimica, identiche le particelle del gas sono
immaginate come sferette rigide indeformabili e di
dimensioni trascurabili (particelle puntiformi).
le particelle si trovano in continuo e disordinato
movimento (caos molecolare), sicchè tutte le direzioni
sono equiprobabili.
Le leggi dei gas perfetti
Immaginiamo un recipiente
chiuso sulla sommità da un
pistone che si può muovere
liberamente su e giù. Dentro
questo pistone c'è un gas, che
per semplicità consideriamo perfetto.
Possiamo descrivere lo stato del
sistema utilizzando tre grandezze
caratteristiche dei gas:
• pressione (P);
• volume (V);
• temperatura (T);
Trasformazioni termodinamiche
• A questo punto possiamo riscaldare il gas,
oppure comprimerlo o espanderlo muovendo il
pistone, e così lo stato complessivo del sistema
varia. Abbiamo operato una trasformazione
termodinamica DA UNO STATO INIZIALE (Ti,Pi,Vi)
A UNO STATO FINALE (Tf,Pf,Vf).
• Si può notare però che non è possibile
modificare a piacimento lo stato del gas, in
quanto vi sono delle relazioni tra le varie
grandezze: ad esempio non possiamo riscaldare
il gas facendo restare costante sia la sua
pressione
che
il
suo
volume.
Vediamo allora di individuare le leggi che
regolano le trasformazioni di un gas perfetto.
I diagrammi P-V ( di Clapeyron)
• È consuetudine rappresentare le trasformazioni e
i vari stati di un gas in un grafico che riporta in
ascissa il volume e in ordinata la pressione, detto
per questo diagramma P-V.
P
A
PA
VA
V
Trasformazione isoterma(T= cost)
Immaginiamo di immergere il
cilindro in un bagno di acqua a
temperatura costante, che così
mantiene anche il gas in
equilibrio a quella temperatura.
Possiamo quindi comprimere
oppure far espandere il gas
muovendo il pistone.
PV = cos tan te
In termodinamica una trasformazione isoterma (o semplicemente isoterma) è una
variazione dello stato di un sistema fisico durante la quale la temperatura rimane
costante.
La trasformazione isoterma di un gas perfetto è descritta dalla legge di Boyle che, in
un diagramma pressione-volume, è rappresentata da un ramo di iperbole equilatera.
Trasformazione isocora (V=cost)
Se blocchiamo il pistone in modo che questo non si possa muovere,
e quindi riscaldiamo o raffreddiamo il gas fornendo o
p=p0 (1+αt), dove p0 è la pressione a 0 °C e a un dato volume; p
la pressione alla temperatura di t °C e al medesimo volume V;
α=1/273,15 °C^(-1) è il coefficiente di dilatazione termica, uguale
per tutti i gas perfetti; nel piano di Clapeyron (piano V, p), le
linee i. sono le parallele all’asse p.
P=p0/T0*T (seconda legge di Gay-Lussac)
Trasformazione isobara (P= cost)
• Trasformazione isobara. Se manteniamo costante la pressione
del gas lasciando libero il pistone di muoversi, vediamo che
fornendo o assorbendo calore dal gas la sua temperatura varia
e proporzionalmente anche
il volume, secondo la
relazione:
V= V0 ( 1+ αt)
α=1/273.15
V= (V0/T0) T (prima legge di Gay-Lussac)
(con T temperatura assoluta CIOE’ IN KELVIN!)
Legge di stato dei gas perfetti
• Da queste tre relazioni si può ricavare un'espressione più
generale, che tenga anche conto della quantità di gas
contenuta nel cilindro. La legge di stato dei gas perfetti è quindi:
I diagrammi P-V ( di Clapeyron)
• È consuetudine rappresentare le trasformazioni e
i vari stati di un gas in un grafico che riporta in
ascissa il volume e in ordinata la pressione, detto
per questo diagramma P-V.
P
A
PA
VA
• Le trasformazioni prima considerate si
rappresentano facilmente:
V
Isoterma
(trasformazione a T= cost)
• l'isoterma è un ramo di iperbole
equilatera (PV= cost)
P
V
Isocora
(Trasformazione a volume cost)
• L’isocora è un segmento parallelo
all’asse P (V = cost)
P2
V = cost
P1
V1
Isobara
(Trasformazione a pressione cost)
• L’isobara è un segmento parallelo
all’asse V (P= cost)
P1
V1
V2
Trasformazioni possibili
• Queste non sono le sole trasformazioni possibili, perchè è
possibile qualsiasi percorso nel piano P-V, purchè rispetti la
legge di stato dei gas.
•
In ogni caso quelle presentate sono le trasformazioni più
semplici da descrivere e anche le più utilizzate
Se un gas ha volume V, per poter
rappresentare sul grafico la sua pressione
bisogna che ogni punto del gas abbia
quella pressione
Lo stesso vale per la temperatura
Se si varia rapidamente il volume di un gas
le condizioni precedenti non si realizzano:
si formano onde di compressione e
decompressione e la temperatura non è
omogenea. Perciò, per un dato V, non c’è
una sola P corrispondente. Il grafico non è
rappresentabile da una linea. Si dice che la
trasformazione è irreversibile.
Se invece si effettua la trasformazione
molto
lentamente,
pressione
e
temperatura possono essere mantenute
uniformi per tutto il volume. Al limite, se
la trasformazione è infinitamente lenta, il
che è una situazione ideale, ad ogni
valore di una delle variabili corrisponde
un valore perfettamente determinato
delle altre e si può rappresentare il
grafico della trasformazione: si dice che
la trasformazione è reversibile
Reversibile/irreversibile
• Se è possibile compiere una trasformazione che
passa per valori determinati:
• (V1,P1,T1)
(V2,P2,T2),
(V3,P3,T3) , …
è possibile anche ripercorrere all’inverso gli stessi
valori:
(V1,P1,T1)
(V2,P2,T2),
(V3,P3,T3), …
cioè che la trasformazione è reversibile
• Se ciò non è possibile, non possiamo dire per
quali punti passa la trasformazione, e perciò non
ha senso neanche invertirla:
la trasformazione è irreversibile
Teoria cinetica dei gas
Collisione Elastica
∆T=2L/vx
Teoria cinetica dei gas
Teoria cinetica
• Abbiamo così dimostrato che:
1) La pressione P è dovuta agli urti delle
molecole del gas sulle pareti
2) La temperatura assoluta T è una misura
dell’energia cinetica media delle
molecole
3) Il calore è un modo di trasferimento di
energia cinetica alle molecole : fa
variare così l’energia interna del gas
Gas reali
•
Il comportamento dei gas reali spesso si discosta anche sensibilmente da
quanto previsto dall’equazione dei gas perfetti. Per fornire una buona
descrizione dei gas reali sono state quindi proposte alcune modifiche alla
legge
PV=nRT.
Particolarmente utile e molto nota è la legge di Van der Waals:
•
(P + a/V2) (V - b) = nRT,
•
dove a e b non sono costanti universali, bensì due parametri ai quali devono
essere assegnati valori opportuni, ricavabili per via sperimentale.
Anche la legge di Van der Waals può essere interpretata a livello
microscopico: le molecole interagiscono tra loro per mezzo di forze a corto
raggio che sono fortemente repulsive a piccola distanza, diventano
debolmente attrattive a distanza media e si annullano a grande distanza. La
mutua repulsione tra molecole proibisce alle particelle di occupare posizioni
particolarmente ravvicinate e di conseguenza una parte dell’intero volume
non è disponibile al moto casuale: nell’equazione di stato questo volume
"proibito" (b), detto covolume, deve essere sottratto al volume del recipiente
(V), ottenendo nella formula la quantità (V - b).
Il nuovo principio di conservazione dell’energia
• ECCO SPIEGATO IL PRIMO PRINCIPIO
DELLA TERMODINAMICA
Q è positivo se assorbito dal sistema,
negativo se ceduto, L è positivo se
fatto sul sistema, negativo fatto dal
sistema. La formula (1) rende evidente
il significato dei concetti fisici di calore
e di lavoro
Primo principio della Termodinamica
• Il Primo principio della Termodinamica fornisce una precisa
definizione del calore identificandolo come una forma di
energia che può essere convertita in lavoro meccanico ed
essere immagazzinata sotto forma di energia interna.
• Il primo principio è dunque un principio di conservazione
dell'energia. Esso afferma che, poiché l'energia non può
essere né creata né distrutta, la somma della quantità di
calore ceduta a un sistema e del lavoro compiuto sul
medesimo deve essere uguale all'aumento dell’ energia
interna del sistema stesso.
• Calore e lavoro sono i mezzi attraverso i quali i sistemi si
scambiano
energia.
ESEMPIO
PER I CURIOSI: Hallyday, Resnik, Krane, 5°Edizione.
Applicazioni del primo principio
trasformazione isoterma
• In questo caso la temperatura del gas
non varia e quindi nemmeno la sua
energia interna. Possiamo quindi scrivere:
L=Q
Tutto il calore che viene fornito al sistema
si converte completamente in calore e
viceversa.
Applicazioni del primo principio (2):
trasformazione isocora ( V = cost)
In questa trasformazione il volume resta
costante, quindi il gas non compie
nessun lavoro. Il primo principio diventa:
ΔU = Q
Tutto il calore che viene fornito al gas va
a variare la sua energia interna e quindi
la sua temperatura. Viceversa se il
sistema cede calore, la sua energia
interna diminuisce e quindi il gas si
raffredda.
Applicazioni del primo principio (3):
trasformazione isobara( P = cost)
• Trasformazione isobara. In questa situazione non
vi è nessuna grandezza( tra L,U e Q) che si
conservi: infatti il sistema compie o subisce
lavoro, assorbe o cede calore e quindi la sua
energia interna e la sua temperatura variano. In
questo caso è però molto semplice calcolare il
lavoro, che è dato dal prodotto tra la variazione
di volume e la pressione costante:
L = P ΔV
Lavoro in una trasformazione isobara
F
A
B
P cost
Lavoro
P∆V
VA
∆V
VB
Applicazioni del primo principio (4):
trasformazione adiabatica (Q = 0)
Se il sistema è termodinamicamente
isolato dall'ambiente, ossia se non vi
sono scambi di calore con l'esterno(
Q = 0), si può scrivere:
L=ΔU
In questo caso tutto il lavoro
compiuto dal gas va a discapito
della sua energia interna.
Applicazioni I principio: Calori specifici dei gas perfetti (1)
Facciamo ricorso ad una trasformazione isocora
(V=cost ) per determinare la variazione di
energia interna al variare della temperatura.
Poiché in un’isocora il lavoro L è uguale a zero,
la variazione di energia interna DU è uguale al
calore Q scambiato dal sistema e pertanto
(ricordando la legge fondamentale della
termologia):
∆ U = Q = m cv ∆ T
Sostituendo al posto della massa (m) il prodotto
del numero di moli (n) per la massa molecolare
(mmol) e introducendo il calore molare a
volume costante Cv la formula precedente
diventa
∆U = n Cv ∆ T.
Calori specifici dei gas perfetti (2)
Invece in una trasformazione isobara (P = cost), il lavoro è dato
da
L = p ∆ V, la variazione di energia interna ∆ U da ∆ U = n Cv ∆ T e
il calore scambiato Q da Q = n Cp ∆ T
Pertanto il primo principio della termodinamica diventa:
p ∆ V+ n Cv ∆ T= n Cp ∆ T
Per i gas ideali dall'equazione di stato si ottiene p ∆ V = n R ∆ T,
quindi sostituendo e semplificando il numero di moli n, si ha
Cp=Cv + R (relazione di Mayer) che mette in relazione i calori
specifici a volume costante e a pressione costante per i gas
perfetti.
Questa relazione ci permette di valutare solo la differenza tra i
calori specifici.
La teoria cinetica ci consente di determinare (per un gas
perfetto monoatomico) il calore specifico a volume costante, in
quanto, per una mole di gas,
U = 3/2 R T e quindi Cv = Q/DT = ΔU/ ΔT = 3/2 R.
Poi semplicemente Cp=Cv + R = 3/2 R + R = 5/2R
Lavoro in un ciclo
• Lavoro utile in un ciclo= P2(V2-V1)B
P1(V2-V1)A
P2
Lavoro utile = area rettangolo
P1
D
V1
C
V2
Verso il Secondo principio
Il primo principio stabilisce la equivalenza tra le varie forme di
energia, cioè il principio generale di conservazione dell'energia:
è possibile che un corpo perda energia meccanica se acquista
energia per esempio sotto forma di energia termica.
Un blocco che scivoli su un piano inclinato con attrito perde energia
potenziale e non acquista una corrispondente quantità di energia
cinetica, ma si riscalda, in quanto la sua energia interna aumenta.
Si pone ora il problema seguente:
le varie forme di energia sono equivalenti da ogni punto di
vista? Per esempio è possibile riutilizzare l'energia termica
ottenuta con il blocco precedente per farlo
risalire alla
sua posizione originaria, senza alcuna altra modifica?
Secondo principio (1)
• Il primo principio della Termodinamica
non pone limitazioni alla trasformazione
reciproca di calore in lavoro e viceversa .
• Il secondo principio invece stabilisce dei
limiti alla trasformazione del calore in
lavoro:
• Non è possibile, in generale,
trasformare tutto il calore in lavoro.
Convertire calore in lavoro?
E’ consuetudine usare l’espressione
“convertire calore in
lavoro”.
Poiché abbiamo detto che calore e lavoro sono
solo metodi di trasferimento
dell’energia, una tale espressione non ha alcun
significato. In realtà avremmo dovuto dire:
“prelevare energia ad un dato
corpo mediante assorbimento
di calore Q e cedere energia
ad un altro corpo facendo
lavoro L su di esso”.
Verso il secondo principio
• E’ esperienza comune il fatto che un gas,
lasciato libero di espandersi, tenda ad occupare
tutto il volume che gli è accessibile. La
conservazione dell’energia non vieterebbe che
il gas, inizialmente distribuito su un ampio
volume, spontaneamente ne occupasse solo
una frazione, limitandosi spontaneamente.
• Due corpi, inizialmente a temperature diverse, se
vengono messi in contatto, dopo un certo
tempo raggiungono la stessa temperatura
all’equilibrio termico. Perché due corpi che
hanno la stessa temperatura non se ne
allontanano,
raggiungendo
stati
con
temperature diverse?
Energia in forma disordinata
• Quando
la
conversione
avviene da forme di energia
più
ordinate
a
più
disordinate,
si
ottiene
energia meno pregiata e
meno utilizzabile. Si dice che
aumenta l’entropia :
Per esempio, il calore che si
produce per attrito è una
forma
di
energia
più
disordinata, meno pregiata:
vedremo che è impossibile
riconvertirla tutta in lavoro
Sperimentalmente si
osserva che in natura
spontaneamente l’energia si
converte in forme a più
degradate
(con produzione
complessiva
di una variazione di entropia
positiva).
Tempo
Verso il secondo principio
• Questi esempi, apparentemente
scollegati fra loro, in realtà possono
essere ricondotti agli effetti di un
unico Principio fondamentale:
il Secondo
Principio della
Termodinamica
Secondo principio
• Esistono 2 formulazioni equivalenti:
• 1) formulazione di Kelvin:
• E’ impossibile realizzare una
trasformazione il cui unico risultato
sia quello di trasformare in lavoro
tutto il calore estratto da una sola
sorgente a temperatura costante
Secondo principio
• 2) formulazione di Clausius:
• È impossibile realizzare una
trasformazione il cui unico risultato
sia quello di far passare il calore da
una sorgente più fredda ad una più
calda
Macchine termiche
• Si chiama macchina termica un
dispositivo capace di trasformare calore
in lavoro, cioè in energia meccanica
(potenziale o cinetica).
• Una macchina termica a funzionamento
ciclico è una macchina che torna
periodicamente nello stato iniziale.
• una qualunque macchina termica per
poter essere utilizzata indefinitamente
deve essere a funzionamento ciclico.
Come funziona una macchina termica
• Il secondo principio stabilisce che una macchina termica possa
funzionare solo assorbendo calore Q2 ad alta temperatura T2 e
cedendo calore Q1 a bassa temperatura T1
• Il suo rendimento = Lavoro utile/ calore assorbito
Entra calore Q2 ad alta temperatura T2
Lavoro utile= Q2-Q1
Esce calore Q1 a bassa temperatura T1
Rendimento η
η= L/Q2 = (Q2-Q1)/Q2
+Q2 entra
A
B
P2
Lavoro utile = area rettangolo
P1
D
V1
-Q1 esce
C
V2
Reversibilità e irreversibilità: approfondimenti 1
Le limitazioni alla conversione di energia termica in lavoro
sono legate ad un importante concetto, quello già
incontrato di irreversibilità
La più importante classificazione delle trasformazioni
termodinamiche è quella che distingue le trasformazioni
cosiddette
reversibili
da
quelle
irreversibili.
Si dice reversibile un processo ciclico in cui sia il sistema
che l’ambiente ritornano nello stato di equilibrio
preesistente all’inizio del processo : perciò, una volta
tornato al punto iniziale, non deve rimanere nessuna
traccia del processo; il sistema è esattamente come
prima, e anche l’ambiente è esattamente come prima.
Nessun segno ci dice che è avvenuta la trasformazione.
E’ possibile?
• Se faccio cuocere un uovo, ho fatto una
trasformazione.
• Posso ora riportarlo al essere un uovo
crudo, intero, alla temperatura iniziale,
riportando contemporaneamente alle
condizioni iniziali tutto l’universo, me
compreso?
FINE???
.
SECONDA ESPERIENZA