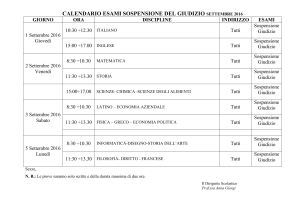
13-03-07
18:55
Da-DIREZIONE GEN, SANITA'-REGIONE LOMBARDIA
+0267653212
T-980
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON l'AIFA
ITALIANA OEL FARMACO)
P,12/13
F-863
(AGENZIA
IMPORTANTI
INFORMAZIONI
DI
SICUREZZA
KEN.ACORT
(TRI.AMCINOLONE ACETONIDE1) GRAVI DISTURBI OCULARI A SEGUITO DI
USO OFF -LABEL
Gentile Dottoressa. Egregio Dottore
In accordo con l'A IF A la Bristol-Myers Squibb desidera metterla a conoscenza di alcune
importanti informazioni di sicurezza che riguardano la specialità medicinale KENACORT
sospensione iniettabile a base di Triamcinolone Acetonide.
Sono stati segnalati casi di endoftalmite. infiammazione oculare, aumento della pressione
intraoculare e disturbi della vista, inclusa la perdita della vista, in pazienti sottoposti a
somminisuazione imraoculare (intravitreale) di Kenacort Sospensione iniettabil~.
La somministrazione
Kenncort sospensione
intraoculare
iniettabile.
non è una via di somministrQzione
approvatll
di
KENACORT 40 rng/ml sospensione iniettabile è approvato esclusivamente per l'uso
intramuscolare e intra-articolare.
Non è approvato per uso endovenoso, intradcrmico o intraoculare.
Non sono stati condotti studi adeguati per dimostrare la sicurezza dluso di KENACORT
sospensione inienabile somministrato per via intraturbinale.
sonocongiuntivale.
per
infiltrazione sotto la capsula di Tenoo. retrobulbare e intraoculare (jntravitreale) e quindi tali
vie di somministrazione non sono pertanto raccomandate.
A seguito delle informazioni di sicurezza sopra riportate il Riassunto delle Caratteristiche del
Prodotto è stato aggiornato nelle sezioni 4.2 e 4.4 come segue:
4.2 Posolol!ia e modo di somministr.-zione
Non usare KenQcort per iniezione endovenosa, intradermica,
sottocongiuntivale,
retrobuJbare o intravitrcnle.
sottotendinea,
endonasale,
4.4 Avvertenze speciali e ODDortunc prl.'Clluzioni di imnieeo
In seguito a somministrllzione
intravitreale
sono stati riportate ~endoftalmiti,
infiammazioni
dell'occhio,
aumento della pressione intraoculare,
disturbi della vista
inclusa la perdita della vista. Sono stati riportati numerosi episodi di cecità a seguito di
iniezioni di sospensioni corticosteroidee
nei turbinati nas~li e in lesioni del capo. La
somministrazione
di KenQcort (triamcinolooe
acetonide sospensione iniettabile) non è
raccomandata,
ne è indicata per nessuna di queste via di somministrazione.
lA'FA la informa che in Italia sono autorizzate altre specialità medicinali contenenti trimcinolonc: ac~tonide: TRIACORT e
TRIJ\MVIRGI.
13-03-07
18:55
Da-DIREZIONE GEN SANITA'-REGIONE LOMBARDIA
+0267653212
T-989
P.13/13
F-863
Bristol-Mycrs Squibb ha collaborato con l'Agenzia Italiana del Farmaco (AIFA) per quanto
attiene alla revisione del Foglio Illustrativo e del Riassunto delle Caratteristiche del Prodotto
(RCP) della specialità medicinale KENACORT 40 mglml sospensione illiettabile in modo
che rifletta le importanti informazioni sopra menzionate.
Bristol·Myers Squibb Compan)' si impegna nell'assicurare che KENACORT
sospensione iniettabilc sia impiegato con sicurezza e in accordo aIl'RCP.
L'AI FA coglie
segnalazione
indispensabile
reali condizioni
40 mg/ml
l'occasione per ricordare a tutti i medici l'importanza della
delle reazioni avverse da farmaci,
quale strumento
per confermare un rapporto beneficio rischio favorevole nelle
di impiego.
Le segnalazioni di sospetta reazione avversa da farmaci devono essere inviate
al Responsabile di Farmacovigilanza della Struttura di appartenenza.