DIAGNOSI DI LABORATORIO DELLE MALATTIE INFETTIVE
La diagnosi di laboratorio delle malattie infettive si basa sulla evidenziazione del
microrganismo o sue frazioni in tessuti o secreti dove normalmente non è presente
(diagnosi diretta) oppure tramite la determinazione di una risposta immunologica
operata dall’ospite nei confronti di un determinato microrganismo (diagnosi indiretta).
In linea di massima i metodi di diagnosi diretta sono più rapidi ed attendibili, quindi da
preferire.
DIAGNOSI DIRETTA
Comprende le seguenti metodiche:
Osservazioni al microscopio ottico di preparati a fresco o dopo adeguate colorazioni,
ottenuti in genere ponendo o strisciando su un vetrino portaoggetto (direttamente o
dopo adeguate preparazioni) sangue, essudati, trasudati, feci, urine, frammenti di cute,
unghia, capelli, tessuti etc. Utilizzando gli accessori per il contrasto di fase si possono
osservare meglio i preparati a fresco in genere feci ed urine. La metodica del campo
oscuro particolarmente utile per la ricerca della spirocheta della sifilide.
Possibili ed utilizzati prevalentemente in campo virologico, metodiche che prevedono
l’utilizzo di anticorpi coniugati con perossidasi, gli antigeni virali si evidenziaranno
come macchie brunastre.
Osservazione al microscopio a fluorescenza. Il fenomeno della fluorescenza viene
sfruttato per evidenziare alcuni tipi di batteri o protozoi mediante l’impiego di
fluorocromi che si legano direttamente alla cellula; più comunemente viene utilizzata
l’iimunofluorescenza diretta in cui anticorpi (spesso monoclonali) coniugati alla
fluoresceina sono in grado di svelare nei campioni la presenza di determinati
microrganismi.
Osservazione al microscopio elettronico direttamente o dopo adeguate colorazioni o
dopo l’aggiunta di antisieri specifici (immunoelettromicroscopia), è una metodica che
nonostante le ottime potenzialità, considerati i costi delle apparecchiature e la necessità
di personale addestrato resta confinata a pochi centri.
Indagini colturali: emocoltura, coprocotura, urinocoltura, coltura di liquido cefalo
rachidiano, di materiali provenienti da aspirati ipofaringei o dei liquidi di drenaggio etc.
1
Nonostante il tempo necessario per la crescita del microrganismo e la complessità delle
metodiche, l’isolamento dell’agente eziologico mediante coltura in terreni artificiali,
colture tissutali o in animali rappresenta la procedura diagnostica più attendibile. È
possibile la coltura non soltanto dei batteri, ma anche dei virus e dei protozoi e dei
miceti; in ogni caso sono di fondamentale importanza le modalità ed i tempi della
raccolta del campione, nonché eventualmente l’utilizzazione di adeguati terreni di
trasporto e di coltura. Sarà il nostro sospetto clinico ad indicare quali campioni
coltivare, quali terreni utilizzare, con quale modalità deve essere prelevato il campione
etc. Soltanto la nostra attenzione in tali fasi ed eventualmente un colloquio telefonico
col microbiologo che riceverà tali campioni saranno garanzia di un risultato attendibile.
Da ricordare che una tecnica di prelievo inadeguata può determinare l’inquinamento del
campione e che l’antibioticoterapia in atto o recente può determinare la negatività della
coltura o ritardare la crescita del microrganismo.
Alla coltivazione seguono l’identificazione dei germi sviluppatisi e successivamente le
prove di sensibilità ai diversi chemioterapici.
Identificazione di antigeni microbici o di porzioni genomiche: per ovviare alla scarsa
specificità di molte metodiche basate sull’esame microscopico diretto e alla lentezza
delle indagini colturali, sono state messe a punto metodiche che consentono la
dimostrazione di antigeni specifici di determinati microrganismi o di porzioni del loro
genoma. Per quanto riguarda la dimostrazione degli antigeni, le metodiche sono basate
fondamentalmente su tecniche immunulogiche come l’agglutinazione al latex, la
controimmunoelettroforesi, l’ELISA, il RIA, etc. Per quanto riguarda il riconoscimento
e la dimostrazione di determinate porzioni genomiche, vengono utilizzate metodiche di
biologia molecolare: Reazioni di ibridizzazione utilizzando sonde (probes) di DNA
che si legano specificamente a determinate porzioni del genoma (precedentemente
denaturato) del microrganismo ricercato; le sonde sono marcate con isotopi radioattivi
come il 32P oppure con marcatori enzimatici o sostanze luminescenti.
La PCR (polymerase chain reaction) permette, una volta conosciuto il genoma di un
determinato microrganismo, di evidenziarne la presenza di piccole porzioni anche se
presenti in quantità limitatissime nel campione in esame, utilizzando primers specifici
per determinate sequenze nucleotidiche da cui avrà inizio la replicazione di uno
specifico segmento di DNA, tale operazione verrà ripetuta n volte avendosi una crescita
2
esponenziale del DNA amplificato, tale amplificato viene quindi fatto migrare in un gel
di agarosio contente bromuro di etidio e quindi visualizzato al transilluminatore a raggi
UV. Più recentemente sono state messe a punto sistemi suscettibili ad automazione che
prevedono la visualizzazione dell’amplificato in piastre sfruttando metodiche
enzimatiche.
DIAGNOSI INDIRETTA
Si avvale di metodiche che evidenziano una risposta immunologica nei riguardi del
microrganismo sospettato di essere l’agente eziologico della malattia in questione. In
genere vengono raggruppati in questo capitolo le tecniche con le quali vengono ricercati
gli anticorpi delle diverse classi (IgM, IgG, IgA e IgE) nei liquidi biologici (in genere
nel siero), ma dovrebbero essere inserite in questo capitolo anche le prove che
evidenziano la formazione di una immunità cellulomediata specifica come le
intradermoreazioni (es. tubercolina, leishmanina, etc) o eventuali test di blastizzazione
linfocitaria in vitro nei confronti di antigeni specifici.
Le metodiche utilizzate al giorno d’oggi sono moltissime ed esula dagli scopi di questo
manuale il volere trattarle dettagliatamente e non è sempre vero che le più recenti e
costose siano più affidabili di quelle classiche.
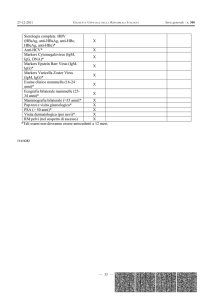
Per quanto riguarda i test sierologici si ricorda che:
la presenza delle IgM indica in genere un contatto recente con un determinato Ag,
ma talvolta le IgM possono essere evidenziate nel siero anche fin dopo 6-12 mesi
dall’infezione oppure in occasione del risveglio di virus entrati in latenza ponendo
non pochi problemi interpretativi;
il dosaggio delle IgM è bene che sia accompagnato da quello delle IgG, e una
eventuale loro assenza deve far dubitare della specificità delle IgM;
l’assenza delle IgM in taluni casi non può escludere un recente contatto con un
determinato Ag (soggetti cattivi produttori di IgM);
in linea di massima è bene avvalersi di test seriati (almeno due test a distanza di 1520 giorni) per evidenziare un innalzamento del titolo anticorpale (di 4 volte) e la
comparsa delle IgG specifiche.
Il dosaggio delle IgA specifiche può talora essere d’ausilio per confermare
un’infezione recente;
3
Il dosaggio delle IgE specifiche può essere utile nel monitoraggio di alcune
malattie parassitarie;
Sono stati messi a punto test per saggiare l’avidità delle IgG specifiche nei
confronti di determinati Ag (T. gondii, cytomegalovirus), la loro presenza è indice
di una infezione avvenuta non recentemente;
Nell’interpretazione di un test sierologico è molto importante informarsi se il
paziente ha praticato vaccinazioni nei confronti di quel microrganismo e tenere
presente le cross reattività esistenti fra numerosi batteri;
Quando possibile, è preferibile utilizzare metodiche sierologiche in cui vengano
utilizzati come Ag gli stessi microrganismi verso cui si vuole evidenziare una
risposta anticorpale, e non Ag cross reagenti (ad es. dovrebbe essere bandita la
reazione
di
Weil-Felix
una
volta
che
sono
disponibili
metodiche
in
immunoflurescenza indiretta che sfruttano come Ag le diverse rickettsie
responsabili dei diversi quadri clinici)
Un contatto recente con un determinato microrganismo può essere svelato anche
dalla evidenziazione di anticorpi diretti verso antigeni timo-indipendenti che non
evocano la formazione delle IgG, e la cui durata è limitata nel tempo (come ad es.
l’Ag O dei batteri Gram negativi) oppure verso Ag che vengono espressi
precocemente e soltanto durante le prime fasi delle infezione virale (come ad es.
l’Ag EA dell’ EBV)
Un eccesso di IgG specifiche può talvolta rendere la ricerca delle IgM meno
affidabile, problema ovviato con l’utilizzo di ELISA a cattura.
Per la diagnosi della brucellosi è bene ricordare il fenomeno della prozona (dovuto
ad un eccesso di Ab) e quello degli anticorpi incompleti o meglio bloccanti (Ab che
si legano alle brucelle in sospensione con scarsa capacità agglutinante)
bisogna diffidare di nuove metodiche e di eventuali kit diagnostici eventualmente
commercializzati, ma la cui sensibilità e specificità siano state studiate solo su un
numero limitato di campioni; tali metodiche dovrebbero essere sempre affiancate
da quelle tradizionali;
4
Altri esami
A parte la dimostrazione diretta o indiretta dell’agente eziologico, può essere d’aiuto
nella diagnosi differenziale delle malattie infettive la valutazione di alcuni parametri
quali le variazioni dell’emocromo, la velocità di eriotrosedimentazione e il dosaggio
quantitativo della proteina c reattiva. È chiaro che l’interpretazione di tali parametri
deve essere molto critica in quanto variazioni si verificano pure in corso di neoplasie e
malattie autoimmuni.
Tab. Modificazioni dell’emocromo in corso di malattie infettive
Neutrofili
Monociti
Eosinofili
Linfociti
Globuli rossi
Piastrine
Aumentati
Infezioni da Gram-positivi,
suppurazioni,
Sindrome di Kawasaki
Diminuiti
ascessi, Salmonellosi, tifo addominale, brucellosi,
leishmaniosi viscerale, maggior parte
infezione virali
Leucemia
Leucemie, tumori, farmaci mielotossici
TBC, brucellosi, endocardite bastterica Infezioni da HIV
subacuta, sifilide, leishmaniosi viscerale
Alcune neoplasie, malattie granulomatose
Infezioni parassitarie
Infezioni batteriche,
Stati atopici, patologie autoimmunitarie,
malattie
linfoproliferative,
leucemia stress, somministrazioni di corticosteroidi
eosinofila
Pertosse, brucellosi, TBC, sifilide, epatiti, Infezione da HIV
mononucleosi, parotite, infezioni da CMV
Tireotossicosi, ipoadrenalismo, colite
ulcerosa, malattie immunitarie, leucemia
linfoide
Pseudopoliglobulia
da
inspissatio
sanguinis in corso di disidratazione
Poliglobulia
Sindrome di Kawasaki
Malattie debilitanti, somministrazione di
corticosteroidi e immunosoppressivi
Leishmaniosi, infezione da parvovirus B
19, malattie ad andamento cronico, o in
seguito a episodi di emolisi complicanza di
alcune malattie come la mononucleosi o
l’infezione da M. pneumoniae.
Neoplasie,. leucemie, anemie
Leishmaniosi viscerale, infezioni virali
5