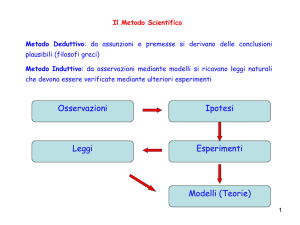
(460-370 a.C.): descrive un primo completo e
coerente sistema materialistico: esistono "atomi" (dal
greco atomos = indivisibile) immersi in uno spazio
vuoto; dal loro movimento derivano tutte le cose, in
modo meccanico e deterministico…..
Le prime "teorie
atomistiche" sono
puramente filosofiche.
L'atomismo influenzò sempre gli
studiosi, ma nel Medio Evo (Dante)
fu accettata la teoria aristotelica dei
"principi”, teoria più coerente con
le idee della Chiesa e non "atea" e
"materialistica".
Boyle e Newton
Robert Boyle (1627-1691), irlandese: in "The
Sceptical Chymist" afferma che le reazioni
avvengono quando atomi con minore "affinità"
sono sostituiti da atomi con affinità maggiore;
spiega le proprietà con le forme e il movimento dei
corpuscoli;
Isaac Newton (1642-1727), fisico inglese: i
corpi sono formati da particelle primordiali
(che chiama "minima") "tanto dure che non si
logorano mai e mai si rompono in frammenti";
"i corpi composti possono frammentarsi...
solo dove queste particelle sono a
contatto..."; "l'agganciamento delle particelle
è dovuto al fatto che esse si attraggono l'un
l'altra con una forza che è molto grande...
quando sono a contatto”.
Alla fine del 18° secolo, un dottore
inglese, Edward Jenner, notò che
quando si diffondevano epidemie di
vaiolo in Europa, le mungitrici
raramente contraevano tale malattia:
idea, chi sta a contatto di mucche,
contrae una malattia simile al vaiolo
meno nociva, il vaiolo vaccino, e
sviluppava poi un'immunità naturale al
vaiolo. Ipotesi: esposizione volontaria al
virus del vaiolo vaccino, avrebbe potuto
garantire immunità al vaiolo.
Esperimento: nel 1796 Jenner espose
James Phipps di 8 anni al virus del
vaiolo vaccino utilizzando del pus
prelevato dalle ferite di una mungitrice,
Sarah Nelmes, dovute al vaiolo vaccino.
Sei settimane dopo, quando Jenner
espone Phipps al virus del vaiolo, il
bambino non contrae la malattia.
Robert Boyle
Studiando
il comportamento della materia, Robert
Boyle (1627-1691) affermò che una sostanza poteva
essere considerata un elemento, se non era possibile
scomporla in sostanze diverse, più semplici. Egli
propose le seguenti definizioni, valide ancora oggi:
Un composto è formato dall’unione di due o più
elementi.
Un elemento non può essere scisso in sostanze
più semplici.
Per Boyle gli elementi chimici erano le sostanze più
semplici in cui è possibile scindere una sostanza
composta.
John Dalton
(1766-1844) scienziato inglese, fondatore
dell'atomistica chimica moderna.
Usando miscele gassose (inizia con lui quella che viene
chiamata "chimica pneumatica", dal greco "pneuma"
pneuma, aria), studia e chiarisce le relazioni ponderali
fra elementi;
…. è necessario determinare numero e peso di tutti gli elementi
…. gli atomi di elementi diversi sono diversi per qualità e peso
specifico
....atomi di una stessa sostanza sono identici
.…atomi diversi hanno la capacità di combinarsi in rapporti diversi
…. gli atomi sono inalterabili e indivisibili
….. atomi di sostanze diverse hanno pesi atomici diversi.
J. Priestley scopre l’ossigeno
Aria=1/5 ossigeno in volume
4/5 azoto in volume
La pianta e il topolino !!!
Experiments and Observations on different Kinds of Air
Antoine L. Lavoisier
Chimico francese, viene ghigliottinato alla fine
della Rivoluzione Francese; studia le reazioni
chimiche e formula il principio della conservazione
della massa nelle reazioni chimiche; crea le basi
della "chimica" propriamente detta.
Superamento della teoria
del flogisto.
Aggiungere ossigeno = togliere flogisto
Togliere ossigeno = aggiungere flogisto
Mercurio + Aria Ossido di mercurio
Metallo
2Hg
Mercurio
40 g
+
Solido rosso
O2
ossigeno
3,2 g
2HgO
Ossido di mercurio
43,2 g
“Nulla si crea nulla si distrugge”
La somma delle masse delle sostanze che reagiscono
nelle reazioni chimiche è uguale alla somma delle
masse delle sostanze che vengono prodotte, cioè la
materia nel corso delle reazioni non può essere creata
né distrutta.