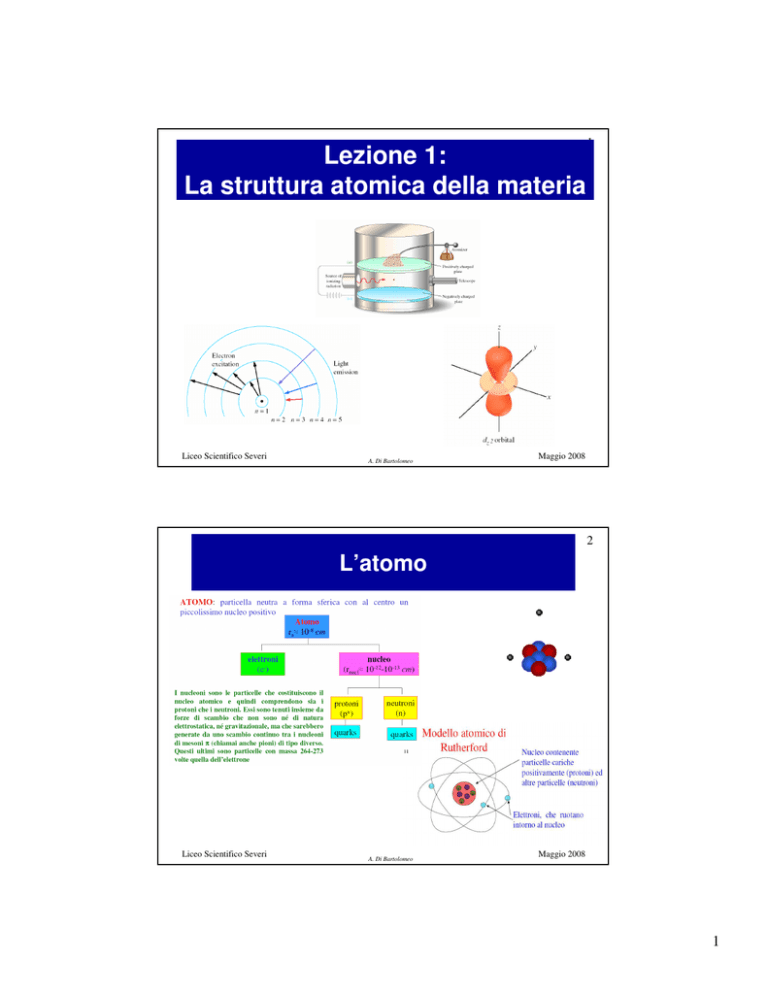
Lezione 1:
La struttura atomica della materia
Liceo Scientifico Severi
A. Di Bartolomeo
1
Maggio 2008
2
L’atomo
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
1
3
L’atomo della meccanica quantistica:
l’elettrone non è localizzato
Elettrone dell’atomo di idrogeno nello stato 2s
L’elettrone ha una certa probabilità di essere trovato in un posto
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
4
Alcuni dettagli sull’atomo
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
2
5
Alcuni dettagli sull’atomo
14
6
Liceo Scientifico Severi
A. Di Bartolomeo
C
Maggio 2008
6
Storia: La visione classica
della struttura atomica
v. quantistica
Visione classica
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
3
Investigando i Raggi Catodici
7
anodo
catodo
schermo
-
+
bagliore
I
V
Ciò che avviene in un televisore di vecchia generazione
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
8
Tubo a Raggi Catodici
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
4
9
Proprietà dei Raggi Catodici
1. I raggi catodici sono emessi dal catodo quando
elettricità viene fatta passare attraverso un tubo a vuoto.
2. I raggi sono emessi in linea retta, perpendicolarmente
alla superficie del catodo.
3. I raggi fanno in modo che un vetro o altri materiali
diventino fluorescenti.
4. I raggi sono deflessi da un magnete o da un
condensatore nella direzione attesa per particelle
cariche negative.
5. Le proprietà dei raggi catodici non dipendono dalla
composizione del catodo. Ad esempio, i raggi catodici
da un catodo di alluminio sono gli stessi di quelli da un
catodo di argento.
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
10
Investigando i Raggi Catodici
J. J. Thomson usò la deflessione dei raggi catodici e l’intensità di un
campo magnetico e di un campo elettrico contemporaneamente per trovare
il rapporto massa/carica delle particelle dei raggi catodici :
me /e = –5.686 × 10–12 kg/C
George Stoney: diede il nome di elettrone di alle particelle
di raggi catodici.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
5
Rapporto massa/carica dei Raggi Catodici 11
Il rapporto me/e per i raggi catodici è circa 2000 volte più
piccolo del più piccolo me/e conosciuto precedentemente
(per gli ioni di idrogeno).
1. se la carica su una particella dei raggi catodici è confrontabile con
quella su uno ione H+, la massa di una particella di raggio
catodico è più piccola della massa dell’ H+; oppure
2. se la massa di una particella di raggio catodico è confrontabile
con quella di uno ione H+, la carica di una particella di raggio
catodico è più grande della carica di un H+; oppure
3. La situazione è una via di mezzo tra 1. e 2.
Per risolvere la situazione dobbiamo conoscere o la massa o la
carica delle particelle dei raggi catodici.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
12
L’esperimento di Millikan delle gocce
di olio
Robert Millikan: determinò il valore
Unadella
goccia
carica
può
carica
dell’elettrone:
muoversi eo =
verso
l’alto
–1.602 × 10o–19 C
verso il basso o restare
sospesa, a seconda della
ddp tra le piastre.
La radiazione
ionizza la
gocciolina di olio
La massa delle goccioline
si determina misurando la
loro velocità limite di
caduta in assenza di ddp.
Liceo Scientifico Severi
La massa si determina misurando la velocità limite
della gicciolina quando le piastre sono scariche.
A. Di Bartolomeo
Maggio 2008
6
13
Proprietà dell’Elettrone
•
•
Thomson determinò il rapporto massa/carica; Millikan trovò la carica;
quindi possiamo determinare la massa dell’elettrone:
me = 9.109 × 10–31 kg/electron
Questa è circa 2000 volte più piccola della massa di un atomo di
idrogeno (1.79 × 10–27 kg)
• Alcuni scienziati pensavano che i raggi catodici (elettroni) fossero ioni
carichi negativamente.
• … ma la massa dell’elettrone è molto più piccola perfino di quella
dell’atomo di idrogeno, quindi un elettrone non può essere uno ione.
• Poiché gli elettroni sono gli stessi indipendentemente dal materiale del
catodo, queste minuscole particelle devono essere
costituenti di tutta la materia (la parte negativa di essa!).
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
14
J. J. Thomson: il suo
modello di atomo
•
Thomson propose un atomo
costituito da una sfera carica
positivamente contenente
all’interno elettroni ugualmente
spaziati.
•
Egli applicò questo modello ad
atomi contenenti fiono a 100
elettroni..
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
7
15
La maggior parte delle
Esperimento di
urto delle
particelle alfa:
particelle
alfa passa
le osservazioni
di Rutherford
attraverso
il foglio.
Le particelle alfa
venivano sparate
su un sottile
foglio metallico.
Poche particelle
sono
leggermente
deflesse dal
foglio.
Solo
pochissime
rimbalzano
indietro!
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
Se il modello di atomo di Thomson fosse corretto, la
maggior parte delle particelle alfa dovrebbe essere
deflessa in qualche
come proiettili
Esperimento
di urto modo,
delle particelle
alfa:che passano
le conclusioni
di Rutherford
attraverso
un bersaglio
di cartone.
16
La maggior parte
delle particelle alfa
attraversa il foglio
senza deflessione =>
un atomo deve essere
principalmente
costituito da spazio
vuoto.
Solo pochissime particelle
rimbalzano indietro =>
il nucleo deve essere
molto piccolo e massiccio.
Liceo Scientifico Severi
Il nucleo è molto più
piccolo di quanto è
rappresentato nella
figura.
A. Di Bartolomeo
Maggio 2008
8
17
Protoni e Neutroni
• Gli esperimenti di Rutherford permisero anche di
determinare la quantità di carica positiva del nucleo
• La carica positiva è trasportata da particelle denominate
protoni.
• La carica del protone è l’unità fondamentale di carica
positiva.
• Il nucleo di un atomo di idrogeno consiste di un solo
protone.
• Gli scienziati introdussero il concetto di numero atomico,
che rappresenta il numero di protoni nel nucleo di un
atomo.
• James Chadwick scopri i neutroni nel nucleo che hanno
quasi la stessa massa del protoni ma non hanno carica.
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
18
La Spettroscopia di Massa
• Ricerche sui raggi catodici mostrarono che un tubo
a raggi catodici produce anche particelle positive.
• Diversamente dai raggi catodici, queste particelle
positive erano ioni.
Particelle
positive
• Il metallo del catodo:
M
e– + M+
Raggi catodici
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
9
19
Atomi, ioni e isotopi
•
Modello di atomo di Rutherford (modello
planetario): nucleo con protoni e
neutroni, in cui è concentrata
praticamente tutta la massa dell’atomo,
ed elettroni orbitanti intorno al nucleo
•
Un atomo che perde o acquista uno o più
elettroni, diventa carico e si chiama ione.
M öM+ + e- , M öM++ + 2e-
•
Certi atomi possono avere lo stesso
numero atomico Z, ma un diverso
numero di massa A, cioè un diverso
numero di neutroni. Si parla in tal caso di
isotopi.
•
Gli isotopi si possono studiare con lo
spettrometro di massa
Liceo Scientifico Severi
Se l’elettrone viene “strappato” atomo,
l’atomo diventa uno ione positivo
Maggio 2008
A. Di Bartolomeo
20
Studio degli ioni: lo spettrometro di
massa
Gli ioni leggeri sono
deflessi di più.
Gli ioni pesanti sono
deflessi di meno.
Gli ioni sono deflessi
in accordo alle loro
masse
80
Hg
200,59
Fscio di ioni
positivi con
uguale velocità
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
10
21
La spettroscopia di massa (cont’d)
• Nella spettroscopia di massa un fascio di ioni
positivi di uguale velocità è mandato in un campo
magnetico.
• Tutti gli ioni sono deviati (deflessi) dal loro
cammino rettilineo.
• Gli ioni più leggeri sono deflessi di più; gli ioni più
pesanti sono deflessi di meno
• Gli ioni sono così separati a seconda della loro
massa.
– In realtà, la separazione è per rapporto massa/carica
(m/e), ma lo spettrometro di massa è progettato in
maniera che la maggior parte delle particelle riceva una
carica 1+ .
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
22
Lo spettro di
massa del
mercurio
Lo spettro di massa di un
elemento mostra l’abbondanza dei
suoi isotopi (stesso Z diverso A).
Quali sono i tre isotopi più
abbondanti del mercurio (Z=80,
<A>= 121)?
Lo spettro di massa di un
composto può dare
informazione sulla
composizione del composto.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
11
23
La Luce e la Teoria
Quantistica
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
24
La natura ondulatoria della luce
• Le Onde Elettromagnetiche traggono origine dal
movimento delle cariche elettriche.
• Il movimento produce fluttuazioni nei campi elettrici e
magnetici.
• Le onde elettromagnetiche non richiedono un mezzo.
• La radiazione elettromagnetica è caratterizzata da
λ
lunghezza d’onda ( ), frequenza (ν), e ampiezza (A).
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
12
25
Onda elettromagnetica
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
26
Onda elettromagnetica
Le frecce rappresentano i campi elettrici e magnetici
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
13
27
Lunghezza d’onda e frequenza
• Lunghezza d’onda (λ
λ) è la distanza tra
due punti identici in cicli consecutivi.
Lo zig-zag
rappresenta l’intensità
del campo elettrico e
magnetico.
• Frequenza (v) è il numero di cicli dell’onda
che passano attraverso un punto nell’unità di
tempo. Unità = onde/s or s–1 (hertz, Hz).
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
28
Lunghezza d’onda e frequenza
La relazione tra lunghezza d’onda e frequenza:
c = λv
dove c è la velocità della luce (3.00 × 108 m/s)
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
14
29
Example 7.1
Calculate the frequency of an X ray that
has a wavelength of 8.21 nm.
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
30
Lo spettro elettromagnetico
Le telecomunicazioni
avvengono a più lunga
lunghezza d’onda, e più
bassa frequenza.
I raggi UV ed X sono
radiazione a più corta
lunghezza d’onda e più
alta frequenza.
La luce visibile è
soltanto una
piccola parte dello
spetto.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
15
31
Lo spettro elettromagnetico
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
32
Example 7.2 A Conceptual Example
Which light has the higher frequency: the bright
red brake light of an automobile or the faint green
light of a distant traffic signal?
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
16
33
Uno spettro continuo
La luce bianca da
una lampada
contiene tutte le
lunghezze d’onda
della luce visibile.
Liceo Scientifico Severi
Quando tale luce passa
attraverso un prisma, le
diverse lunghezze d’onda
vengono separate.
Noi vediamo uno spettro di tutti i
colori dell’arcobaleno dal rosso al
violetto – uno spettro continuo.
A. Di Bartolomeo
Maggio 2008
34
Uno spettro a linee
La luce da una
scarica elettrica
attraverso un
elemento gassoso (es,
luce neon, lampada
ad idrogeno) non
contiene tutte le
lunghezze d’onda.
Lo spettro è
discontinuo, è a linee;
ci sono grandi gap.
Noi vediamo un insieme
di linee, immagini
multiple di una fenditura.
Questo modello è
chiamato uno spettro a
linee.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
17
35
Gli spettri a linee di alcuni elementi
Lo spettro di
emissione a linee di
un elemento è
l’”impronta” di
quell’elemento e
può essere usato
per identificare
l’elemento.
Come si può dire se
un campione
contiene mercurio?
Cadmio?
Gli spettri a linee
sono un problema;
non si possono
spiegare usando la
Fisica Classica …
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
36
Planck …
• … propose che gli atomi possono assorbire o emettere
energia elettromagnetica soltanto in quantità discrete.
• La più piccola quantità di energia, un quanto, è dato da:
E = hv
dove h, constant Planck, ha il valore di 6.626 × 10–34 J·s.
• L’ipotesi dei quanti di Planck stabilisce che l’energia può
essere assorbita o emessa dagli atomi soltanto come un
quanto o come multipli interi di un quanto, rendendo quindi
le variazioni di energia discontinue.
• I cambiamenti di energia possono avvenire soltanto in
quantità discrete.
• Il Quanto sta all’ energia come _______ sta alla materia.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
18
37
L’Effetto Fotoelettrico
La luce che colpisce un
catodo fotoemettitore causa
l’emissione di elettroni.
Gli elettroni emessi raggiungo
l’anodo, e il risultato è …
… un flusso di corrente
attraverso il circuito
esterno.
Ma non una luce “qualsiasi” causa l’espulsione di elettroni …
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
38
L’Effetto Fotoelettrico (cont’d)
Ciascun materiale
fotoemettitore ha una
frequenza di soglia
caratteristica della luce.
Quando luce sopra la
frequenza di soglia
colpisce il materiale
fotoemettitore, vengono
emessi elettroni e fluisce
una corrente.
Luce di frequenza
bassa non causa flusso
di corrente … affatto.
Liceo Scientifico Severi
Come lo spettro a linee,
l’effetto fotoelettrico non può
essere spiegato con la fisica
classica.
A. Di Bartolomeo
Maggio 2008
19
39
L’Effetto Fotoelettrico
• Albert Einstein vinse nel 1921 il Premio Nobel per aver
spiegato l’effetto fotoelettrico.
• Egli applicò la teoria quantistica di Planck : l’energia
elettromagnetica viene scambiata in piccoli “pacchetti” che
egli chiamò Fotoni.
Energia del Fotone (E) = hv
• L’effetto fotoelettrico si ha quando fotoni di luce che
colpiscono una superficie trasferiscono la loro energia agli
elettroni vicini alla superficie.
• Gli elettroni che hanno ricevuto l’energia possono superare
l’attrazione del nucleo e uscire dalla superficie …
• … ma un elettrone può sfuggire soltanto se il fotone
fornisce energia sufficiente.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
40
Spiegazione dell’effetto fotoelettrico
Gli elettroni di un
materiale fotoemettitore
hanno bisogno di un
certo minimo di energia
per essere emessi.
Fotoni di corta
lunghezza d’onda
(elevata frequenza, alta
energia) hanno energia
sufficiente perché gli
elettroni siano emessi.
Un fotone di lunga
lunghezza d’onda —bassa
frequenza —non ha
energia sufficiente per
espellere l’elettrone.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
20
41
Analogia dell’effetto fotoelettrico
• Imaginate un’auto bloccata in un fosso; c’è bisogno di una
certa quantità di “spinta” per “emettere” l’auto dal fosso.
• Supponete che voi spingete 10 volte, con una piccola quantità
di forza ogni volta. Questo farà uscire la macchina dal fosso?
• Allo stesso modo, 10 fotoni, o 1000, ciascuno con energia
troppo piccola, non espellerà l’elettrone.
• Supponete che voi spingete con più della forza richiesta; la
macchina si metterà in movimento, con l’eccesso di energia
come energia cinetica.
• Cosa accade quando un fotone di energia maggiore di quella
richiesta colpisce un materiale fotoemettitore. E’ emesso un
elettrone, ma con _____.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
42
Example 7.3
Calculate the energy, in joules, of a photon of violet light
that has a frequency of 6.15 × 1014 s–1.
Example 7.4
A laser produces red light of wavelength 632.8 nm.
Calculate the energy, in kilojoules, of 1 mol of photons
of this red light.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
21
43
Visione Quantistica
della Struttura
Atomica
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
44
L’atomo (di idrogeno) di Bohr
• Niels Bohr seguì Planck ed Einstein proponendo che
anche l’energia dell’elettrone nell’atomo (En) fosse
“quantizzata”.
• L’elettrone in un atomo può avere soltanto certi valori
permessi di energia (proprio come se l’energia stessa fosse
quantizzata).
• Ciascun specificato valore dell’energia è chiamato livello
energetico dell’atomo:
En = –B/n2
– n è un intero, B è una costante (2.179 × 10–18 J)
– Il segno negativo rappresenta una forza di attrazione.
• L’energia è zero quando l’elettrone è collocato
infinitamente lontano dal nucleo (elettrone libero).
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
22
45
Atomo di Bohr
Continuo
Zero
N
En = –B/n2
M
L
K
E
Per l’atomo di idrogeno
Z2e4m e 1
1
En = −
⋅ 2 = −13.6 2 eV
2 2
8h ε 0 n
n
Livelli energetici dell’ H (idrogeno):
-13.6 eV (K), -3.4 eV (L), -1.51 eV (M), -0.85 eV (N etc
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
46
Il Modello di Bohr dell’Idrogeno
Quando eccitato,
l’elettrone è in un livello
energetico più alto.
Emissione: l’atomo
cede (perde) energia,
sotto forma di un
fotone.
In seguito all’emissione,
l’elettrone cade ad un
livello di energia più
basso.
Eccitazione: l’atomo
assorbe energia che è
esattamente uguale alla
differenza tra due livelli
energetici.
Ciascun cerchio rappresenta
un livello energetico permesso
per l’elettrone. L’elettrone può
essere pensato come orbitante
ad una distanza fissa dal
nucleo.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
23
47
L’equazione di Bohr …
•
… ci permette di trovare il cambiamento di energia (∆Elevel) che
accompagna la transizione di un elettrone da un livello energetico
all’altro.
Livello di energia iniziale:
Livello di energia finale:
–B
Ei = ——
ni2
•
–B
Ef = ——
nf 2
Per trovare la differenza di energia, basta sottrarre:
–B
1
1
–B
∆Elevel = —— – —— = B — – —
nf 2
ni2
ni2
nf2
•
Insieme, tutti i fotoni che hanno questa energia (∆Elevel) producono una
sola linea spettrale.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
48
Lo spettro a linee si ha perché …
• … ciascun livello
energetico
dell’elettrone in un
atomo è quantizzato.
• Poichè i livelli sono
quantizzati, devono
essere quantizzati
anche i cambiamenti
trai livelli.
Transizione da
n = 3 to n = 2.
Transizione da
n = 4 to n = 2.
Liceo Scientifico Severi
A. Di Bartolomeo
• Un cambiamento
specifico rappresenta
quindi una specifica
energia, una specifica
frequenza e quindi una
specifica lunghezza
d’onda.
Maggio 2008
24
49
Livelli di energia e Liee Spettrali per l’Idrogeno
Qual è la (transizione che produce
la) linea a più lunga lunghezza
d’onda nella serie di Balmer? Nella
serie di Lyman? E nella serie di
Paschen?
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
50
Transizioni nell’Atomo di Idrogeno
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
25
51
Example 7.6
Calculate the energy change, in joules, that occurs
when an electron falls from the ni = 5 to the nf = 3
energy level in a hydrogen atom.
Example 7.7
Calculate the frequency of the radiation released by the
transition of an electron in a hydrogen atom from the n
= 5 level to the n = 3 level, the transition we looked at in
Example 7.6.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
52
Example 7.5
Calculate the energy of an electron in the second
energy level of a hydrogen atom.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
26
53
Assorbimento/Eccitazione
En = −
Z2e4 me 1
1
⋅ 2 = −13.6 2 eV
2 2
8h ε 0 n
n
Liceo Scientifico Severi
Ciascuna circonferenza rappresenta un livello
energetico permesso
per l’elettrone.
A. Di Bartolomeo
Maggio 2008
54
Emissione e Diseccitazione
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
27
55
Ionizzazione: effetto fotoelettrico
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
56
Assorbimento ed emissione di luce
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
28
57
Diagrammi di Energia degli Orbitali
I sottoshell
all’interno di
uno shell sono
allo stesso
livello di
energia
nell’idrogeno:
2s = 2p.
I sottoshells sono
separati in un
atomo a più
elettroni:
2s < 2p.
…che per
l’atomo di
idrogeno.
+
Liceo Scientifico Severi
n
Le energie degli+ n +
orbitali sono più basse
in un atomo a più
elettroni …
Maggio 2008
A. Di Bartolomeo
58
Livelli energetici dell’atomo di
idrogeno
Energia di legame (Binding energy BE): energia (negativa) che lega l’elettrone all’atomo
Energia di ionizzazione IK,L,… = − BE: quantità di energia necessaria a rimuovere l’elettrone
BE misurata in (unità negative di) elettronvolt (eV)
All’infinito, BE = 0
Atomi con più protoni hanno energie di
Continuum
legame di valore assoluto maggiore
N
(gli elettroni sono legati più fortemente)
Zero
M
L
• Energia di legame di
– H (idrogeno): -13.6 eV (K), -3.4 eV (L), -1.51 eV (M), -0.85 eV (N etc
– 53I (iodio): -33.2 keV (K), -4.3 keV (L), -0.6 keV (M)
• BE per elettroni di valenza: ~ -10 eV (H: -13.6 eV)
En = −
Liceo Scientifico Severi
A. Di Bartolomeo
K
E
Z2e4m e 1
1
⋅ 2 = −13.6 2 eV
2 2
8h ε 0 n
n
Maggio 2008
29
59
Unità di energia
Unità del SI: 1 Joule [J] = 1 Nm = 1 kg m2 s-2
Elettronvolt [eV]: energia potenziale di una carica elementare (e = 1.6×10-19 C)
quando attraversa una differenza di potenziale ddp di 1V
-
1V
+
1 eV = 1.6×10-19 C ×1 V = 1.6×10-19 [A s V] = 1.6×10-19 J
100 keV = 105 × 1.6×10-19 J = 1.6×10-14 J = 16 fJ
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
60
Stati Fondamentali e Stati Eccitati
• Quando un atomo ha i propri elettroni nei loro livelli
energetici più bassi possibili, l’atomo è detto nello stato
fondamentale (ground state).
• Quando un elettrone è stato promosso ad un livello più
alto, l’elettrone (e l’atomo) è in uno stato eccitato (excited
state).
• Gli elettroni sono promossi a livelli più alti tramite una
scarica elettrica, calore, o altre sorgenti di energia.
• Un atomo in uno stato eccitato prima o poi emette uno o
più fotoni mentre l’elettrone cade giù allo stato
fondamentale.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
30
61
Esempio
Un esempio concettuale
Senza fare calcoli dettagliati,
determinare quali delle transizioni
elettroniche mostrate nella figura
produce la linea di più corta
lunghezza d’onda nello spettro di
emissione dell’idrogeno.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
62
L’equazione di De Broglie
• L’ipotesi di Louis de Broglie stabilisce che un oggetto in
moto si comporta sia come una particella che come una
onda, proprio come fa la luce.
• Una particella con massa m che si muove ad una velocità V
ha una natura ondulatoria consistente con una lunghezza
d’onda data dall’equazione:
λ = h/mV
• Questa natura ondulatoria è di importanza solo a livello
microscopico (piccolissime m).
• La predizione di De Broglie delle onde di materia condusse
allo sviluppo del microscopio elettronico.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
31
63
Example 7.9
Calculate the wavelength, in meters and nanometers,
of an electron moving at a speed of 2.74 × 106 m/s.
The mass of an electron is 9.11 × 10–31 kg, and 1 J = 1
kg m2 s–2.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
64
Ma …
• de Broglie stravolse il modello atomico di Bohr.
• Infatti: un elettrone non può orbitare ad una “distanza fissa”
se l’elettrone è un’onda.
– Un’onda nel mare non ha una localizzazione esatta—né la può
avere l’onda elettronica.
• Peggio: non possiamo nemmeno parlare di “dov’è
l’elettrone” se l’elettrone è un’onda.
• Ancora peggio: la lunghezza d’onda dell’elettrone in
movimento è all’incirca la grandezza dell’atomo! Come
descriviamo un elettrone che è troppo grande per essere
nell’atomo??
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
32
65
Funzioni d’onda
• Erwin Schrödinger: possiamo descrivere
l’elettrone matematicamente, usando la meccanica
quantistica (meccanica ondulatoria).
• Schrödinger sviluppò una equazione d’onda per
descrivere l’atomo di idrogeno.
• Una soluzione accettabile dell’equazione d’onda
di Schrödinger è chiamata funzione d’onda.
• Una funzione d’onda rappresenta uno stato
energetico dell’atomo.
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
66
Il Principio di
indeterminazione
Werner Heisenberg: non
possiamo conoscere
contemporaneamente con
esattezza dove è una particella
in moto e quanto veloce si sta
muovendo.
Il fotone entra nel
microscopio , così che
possiamo vedere
l’elettrone…
… ha quantità di moto
sufficiente a deflettere
l’elettrone.
L’atto della misura
interferisce con il moto
dell’elettrone.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
33
67
Il Principio d’Indeterminazione
• Una funzione d’onda non ci dice dov’è l’elettrone. Il
principio d’indeterminazione ci dice che non
possiamo conoscere dov’è l’elettrone.
• Comunque, il quadrato della funzione d’onda ci
dà la probabilità di trovare l’elettrone in una data
posizione in un atomo.
• Analogia: Non possiamo dire dove una data foglia
dell’albero cadrà. Ma (vedendo tutte le foglie sotto
l’albero) possiamo descivere dove una foglia cadrà
con maggiore probabilità.
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
68
Funzione d’onda
•
La funzione d’onda di solito la
si indica con ψ:
Ψ
(x, y, z, t)
•
Il quadrato della funzione
d’onda è la probabilità di
trovare l’elettrone nella
posizione x,y,z, al tempo t:
Ψ
| (x, y, z, t)|2 = P(x,y,z,t)
•
La funzione d’onda dipende da
3 (o 4) parametri, detti i numeri
quantici:
Ψ
n,l,ml (x, y, z, t)
P(r) = 4πr2 ψ2 , probabilità di
trovare l’elettrone in un guscio sferico di
raggio r e spessor dr molto piccolo
Ψ
n = 1, l = 0, ml=0(x,
y, z, t)
Stato 1s
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
34
69
I Numeri Quantici e gli Orbitali Atomici
•
Le funzioni d’onda dell’atomo di idrogeno contengono 3 parametri
chiamati numeri quantici che devono avere valori interi (1, 2, … ed
eventualmente -1,-2,…) specifici.
Ψ
n,l,m (x,
y, z, t)
•
Una funzione d’onda con un dato insieme di questi 3 (n, l ed ml),
numeri quantici è chiamata orbitale atomico. Es: un orbitale atomico
può essere quello con n=2, l=0 ed ml=0 (orbitale 2s)
•
Questi orbitali ci permettono di visualizzare la regione nella quale
l’elettrone “spende la maggior parte del suo tempo”.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
70
Numeri Quantici: n
Assegnando dei valori ai 3 numeri quantici n, l ed ml, si
definisce un orbitale atomico specifico.
Il numero quantico principale (n):
• E’ indipendente dagli altri due numeri quantici.
• Può soltanto essere un intero positivo (n = 1, 2, 3, 4, …)
• La dimensione di un orbitale e la sua energia elettronica
dipende dal valore di n.
• Orbitali con lo stesso valore di n sono detti essere nello
stesso shell (strato) principale.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
35
71
Numeri Quantici: l
Il
•
•
•
numero quantico del momento angolare orbitale (l):
Determina la forma dell’orbitale.
Può avere valori interi positivi da 0, 1, 2, … (n – 1)
Gli orbitali che hanno gli stessi valori di n ed l sono detti
essere nello stesso sottoshell (sottostrato).
Valore di l
0
1
2
3
Sottoshell
s
p
d
f
• Ciascuna designazione dell’orbitale rappresenta una
diversa regione dello spazio ed una diversa forma.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
72
Numeri Quantici: ml
Il numero quantico magnetico (ml ):
• Determina l’ orientazione nello spazio degli
orbitali di qualsiasi dato tipo in un sottoshell.
• Può essere un qualsiasi intero tra –l e +l
• Il numero di possibili valori per ml è (2l + 1), e
questo determina il numero di orbitali in un
sottoshell.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
36
73
Notare: un solo orbitale s in ciascuno shell principale
tre orbitali p nel secondo shell (e in quelli più alti)
five orbitali d nel terzo shell (e in quelli più alti)
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
74
Example 7.10
Considering the limitations on values for the various
quantum numbers, state whether an electron can be
described by each of the following sets. If a set is not
possible, state why not.
(a) n = 2, l = 1, ml = –1
(c) n = 7, l = 3, ml = +3
(b) n = 1, l = 1, ml = +1
(d) n = 3, l = 1, ml = –3
Example 7.11
Consider the relationship among quantum numbers and
orbitals, subshells, and principal shells to answer the
following. (a) How many orbitals are there in the 4d
subshell? (b) What is the first principal shell in which f
orbitals can be found? (c) Can an atom have a 2d
subshell? (d) Can a hydrogen atom have a 3p subshell?
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
37
75
L’orbitale 1s
• L’orbitale 1s (n = 1, l = 0, ml = 0) ha simmetria sferica.
• Un elettrone in questo orbitale spende la maggior parte del
suo tempo vicino al nucleo.
Simmetria sferica; la
probabilità di trovare
l’elettrone è la stessa in
ciascuna direzone.
Liceo Scientifico Severi
La nuvola
elettronica non
finisce qui …
… l’eletrrone spende
un piccolissimo
tempo più lontano.
Maggio 2008
A. Di Bartolomeo
76
Analogia all’Orbitale 1s
Più elevata “densità
elettronica” vicino
al centro …
… ma la densità
elettronica non va mai
a zero; essa decresce
soltanto con la
distanza.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
38
77
L’orbitale 2s
• L’orbitale 2s ha due regioni concentriche e sferiche di
elevata probabilità elettronica.
• La regione vicino al nucleo è separata dalla regione
esterna da un nodo—una regione (uno shell sferico in
questo caso) nel quale la probabilità elettronica è zero.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
78
I tre Orbitali p
I tre valori di ml
danno tre orbitali p
nel sottoshell p.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
39
79
I Cinque Orbitali d
Cinque valori di ml
(–2, –1, 0, 1, 2) danno
cinque orbitali d nel
sottoshell d.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
80
Lo Spin dell’Elettrone: ms
• Il numero quantico di spin elettronico (ms) spiega alcune delle
strutture più fini degli spettri di emissione atomica.
• Il numero può avere due valori: +½ and –½.
• Lo spin si riferisce ad un campo
magnetico indotto dalla carica
elettrica dell’elettrone in
movimento mentro questo ruota.
• I campi magnetici di due
elettroni con spin opposto si
cancellano l’un l’altro; non c’è
un campo magnetico netto per la
coppia.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
40
81
L’esperimento di Stern-Gerlach
dimostra lo Spin dell’Elettrone
Questi atomi di argento 47Ag
hanno ciascuno 24 elettroni di
spin +½ e 23 elettroni di spin –½
Il magnete
separa il fascio.
L’argento ha 47 elettoni
(numero dispari). In
media, 23 elettroni
avranno uno spin e 24
avranno lo spin opposto.
Liceo Scientifico Severi
Questi atomi di argento
47Ag hanno ciascuno 23
elettroni di spin +½ e 24
elettroni di spin –½
A. Di Bartolomeo
Maggio 2008
82
Dipolo magnetico in un campo
magnetico
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
41
83
CUMULATIVE EXAMPLE
Which will produce more energy per gram of hydrogen:
H atoms undergoing an electronic transition from the level
n = 4 to the level n = 1, or hydrogen gas burned in the
reaction:
2 H2(g) + O2(g)
2 H2O(l)?
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
84
Configurazione elettronica,
Proprietà Atomica, e Tavola
periodica
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
42
Diagrammi di Energia degli Orbitali
I sottoshell
all’interno di
uno shell sono
allo stesso
livello di
energia
nell’idrogeno:
2s = 2p.
I sottoshells sono
separati in un
atomo a più
elettroni:
2s < 2p.
…che per
l’atomo di
idrogeno.
+
85
Liceo Scientifico Severi
n
Le energie degli+ n +
orbitali sono più basse
in un atomo a più
elettroni …
A. Di Bartolomeo
Maggio 2008
86
Le configurazioni elettroniche
• Una configurazione elettronica descrive la distribuzione
degli elettroni tra i vari orbitali nell’atomo.
• La configurazione elettronica è rappresentata in due modi.
La notazione spdf usa
numeri per indicare lo shell
principale e lettere (s, p, d,
f) per identificare un
sottoshell; un apice indica
il numero di elettroni in un
dato sottoshell.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
43
87
Configurazioni Elettroniche
In un diagramma degli orbitali (scatole) una scatola
rappresenta ciascun orbitale all’interno di un sottostrato e le
frecce rappresentatno gli elettroni. Le direzioni delle freccie
rappresentano gli spin degli elettroni; spin opposti sono
accoppiati.
7N:
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
Regole per le Configurazioni Elettroniche
88
• Gli elettroni in condizioni normali occupano gli orbitali disponibili
di energia più bassa (cioè con n più piccolo).
• Due elettroni nello stesso atomo non possono avere tutti e quattro i
numeri quantici uguali, cioè non possono avere lo stesso stato
quantico (n, l, ml, ms) . Un orbitale (n, l, ml ) contiene due stati
quantici:
(n, l, ml, ½) e (n, l, ml, -½)
• Principio di esclusione di Pauli: un solo orbitale atomico può
accomodare non più di 2 elettroni e questi elettroni devono avere
spin opposti, +1/2 e -1/2. Uno stato quantico può essere
occupato al più da un solo elettrone.
• Di un gruppo di orbitali di energia identica, quando possibile, gli
elettroni accedono gli orbitali vuoti (Regola di Hund).
• Elettroni in orbitali mezzi pieni hanno spin paralleli (stessa
direzione).
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
44
89
Ordine delle Energie dei Sottoshell
• Seguire la freccia da
sopra: 1s, 2s, 2p, 3s, 3p,
4s, 3d, 4p, etc.
• Sottoshell che sono
lontani dal nucleo
possono esibire
eccezioni all’ordine di
riempimento.
Liceo Scientifico Severi
Maggio 2008
A. Di Bartolomeo
90
Il principio dell’ Aufbau (costruzione)
• Il principio di Aufbau descrive un’ipotetica
costruzione di un’atomo da uno che lo precede nel
suo numero atomico.
Per ottenere He,
aggiungere un
1
(Z = 1) H 1s
elettrone a H.
(Z = 2) He 1s2
Per ottenere Li,
(Z = 3) Li 1s2 2s1
aggiungere un
elettrone a He.
• Abbreviazione del “core” dei Gas Nobili: rimpiazziamo la
porzione che corrisponde al core di un gas nobile con il
simbolo chimico in parentesi. E’ più facile scrivere …
Liceo Scientifico Severi
(Z = 3) Li
[He]2s1
(Z = 22) Ti
[Ar]4s2 3d2
A. Di Bartolomeo
Maggio 2008
45
91
Example 8.1
Write electron configurations for sulfur, using both the spdf
notation and an orbital diagram.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
92
Gruppi Principali ed Elementi di
Transizione
• Gli elementi dei gruppi principali sono quelli
nei quali l’orbitale che viene riempito nel
processo di aufbau è un orbitale s o p dello shell
più esterno.
Negli elementi di
transizione, il
sottoshell che viene
riempito nel processo
di aufbau è in uno shell
principale interno.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
46
Uso della Tavola Periodica per scrivere le Configurazioni
Elettroniche
93
La configurazione
elettronica del 14Si finisce
con 3s2 3p2
La configurazione
elettronica del 45Rh
finisce con 5s2 4d7
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
94
Tavola periodica degli elementi
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
47
95
Periodic Table of the Elements
IA
1
1
3
4
5
6
7
III B
IV B
VB
VI B
VII B
VIII B
IB
II B
III A
IV A
VA
VI A
VII A
1
VIII A
2
H
H
He
1.008
1.008
4.0026
10
3
2
II A
4
5
6
7
8
9
Li
Be
B
C
N
O
F
Ne
6.939
9.0122
10.811
12.011
14.007
15.999
18.998
20.183
11
12
13
14
15
16
17
18
Na
Mg
Al
Si
P
S
Cl
Ar
22.99
24.312
26.982
28.086
30.974
32.064
35.453
39.948
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
39.102
40.08
44.956
47.89
50.942
51.996
54.938
55.847
58.932
58.71
63.54
65.37
69.72
72.59
74.922
78.96
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
85.468
87.62
88.906
91.224
92.906
95.94
* 98
101.07
102.91
106.42
107.9
112.41
114.82
118.71
121.75
127.61
126.9
131.29
55
56
57
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
Cs
Ba
**La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
132.91
137.33
138.91
178.49
180.95
183.85
186.21
190.2
192.22
195.08
196.97
200.29
204.38
207.2
208.98
* 209
* 210
* 222
87
88
89
104
105
106
107
108
109
110
111
112
Fr
* 223
Ra ***Ac
226.03 227.03
116
Ha
Sg
Ns
Hs
Mt
* 262
* 263
* 262
* 265
* 268
* 269
* 272
* 277
58
59
60
61
62
63
64
65
70
71
Ce
Pr
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
140.12
* 145
150.36
151.96
157.25
158.93
162.51
164.93
167.26
168.93
Series
Uuq
118
Rf
*** Actinium
Series
Uun Uuu Unb
83.8
* 261
* Designates that **Lanthanum
all isotopes are
radioactive
114
79.909
Uuh
*285
*289
Based on symbols used by ACS
66
67
68
69
Uuo
*293
S.M.Condren 1999
140.91
144.24
173.04
174.97
90
91
92
93
94
95
96
97
98
99
100
101
102
103
Th
Pa
U
Np
Pu
Am
Cm
Bk
Cf
Es
Fm
Md
No
Lr
232.04
231.04
238.03
237.05
* 244
* 243
* 247
* 247
* 251
* 252
* 257
* 258
* 259
* 260
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
96
Example 8.2
Give the complete ground-state electron configuration of a
strontium atom (a) in the spdf notation and (b) in the
noble-gas-core abbreviated notation.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
48
97
Eccezioni al Principio di Aufbau
Il sottoshell d semipieno
più il sottoshell s
semipieno ha energia
leggermente inferiore
che s2 d4.
Il sottoshell d pieno più il
sottoshell s semipieno ha
energia leggermente
inferiore che s2 d9.
Altre eccezioni avvengono
nella tavola periodica. Esse
non sono sempre predicibili,
perché I livelli energetici
divengono più vicini.
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
98
Elettroni di Valenza ed Elettroni del Core
• Lo shell di valenza è lo shell principale occupato più
esterno. Lo shell di valenza contiene gli elettroni di
valenza.
• Per gli elementi del gruppo principale, il numero di
elettroni dello shell di valenza è lo stesso del numero di
gruppo della tavola periodica (elementi 2A: due elettroni di
valenza, etc.)
Il numero periodico è identico al numero quantico
principale n degli elettroni nello shell di valenza.
• Gli elettroni negli shell più interni sono chiamati elettroni
di core.
Cinque elettroni di valenza, per i quali n = 4
Esempio:
33As
[18Ar] 4s2 3d104p3
28 elettroni di core
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
49
99
Elettroni di Valenza ed Elettroni di Core
Liceo Scientifico Severi
A. Di Bartolomeo
Maggio 2008
50