APPARATO CARDIO-CIRCOLATORIO
9
FUNZIONI DELLE ARTERIE E DELLE ARTERIOLE
Caratteristiche elastiche e funzioni delle grandi arterie. Funzioni delle arteriole, metarteriole e sfinteri
precapillari. Polso arterioso centrale ce periferico. Legge di Laplace applicata ai vasi. Tono basale della
muscolatura dei vasi. Regolazione umorale (ormoni e meccanismi di regolazione locale) e regolazione
nervosa del tono della muscolatura vasale.
Il sistema arterioso può essere considerato come un impianto idraulico con tubi in serie di calibro
decrescente e tubi in parallelo di calibro simile composto principalmente da due tipi di condotti: le grandi
arterie (aorta e sue diramazioni per il circolo sistemico, arterie polmonari e loro diramazioni per il circolo
polmonare) sono costituite da endotelio che poggia su una membrana basale, rivestito da una tonaca
muscolare e da una avventizia. In queste arterie è ingente il contenuto in collagene ed elastina
soprattutto nello strato sottoendoteliale, queste risultano ampiamente distendibili. Per valutare le
capacità elastiche delle arterie possiamo usare come indice la compliance, definita come il rapporto tra
l'incremento di volume e l'incremento pressorio ad esso corrispondente, o meglio come la pendenza in un
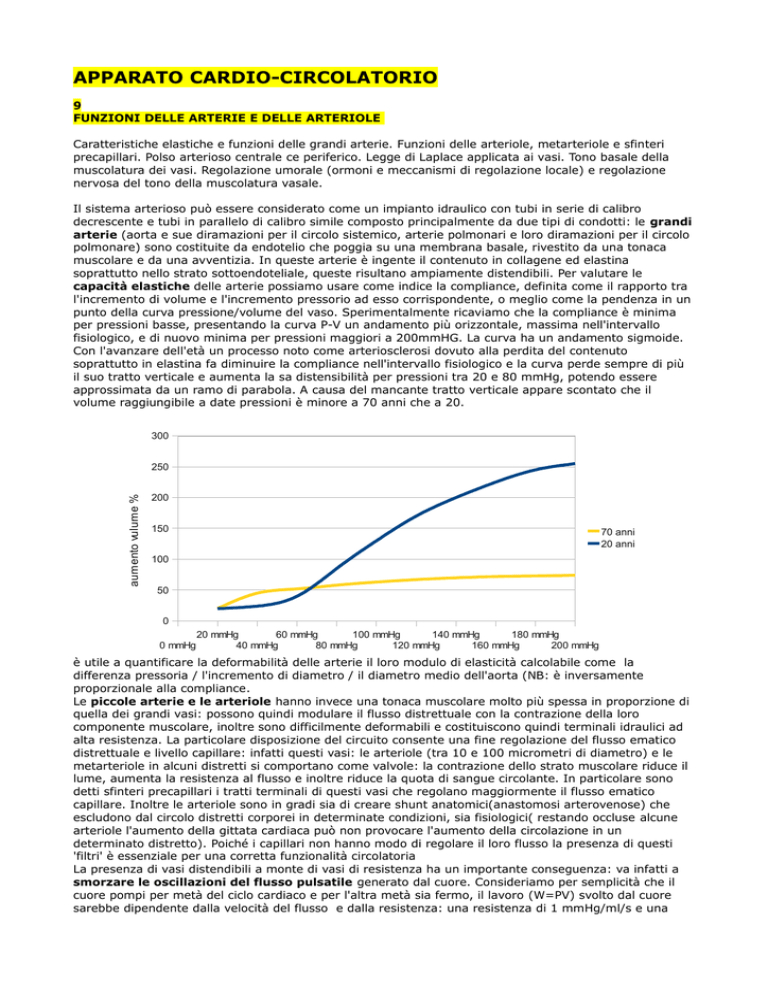
punto della curva pressione/volume del vaso. Sperimentalmente ricaviamo che la compliance è minima
per pressioni basse, presentando la curva P-V un andamento più orizzontale, massima nell'intervallo
fisiologico, e di nuovo minima per pressioni maggiori a 200mmHG. La curva ha un andamento sigmoide.
Con l'avanzare dell'età un processo noto come arteriosclerosi dovuto alla perdita del contenuto
soprattutto in elastina fa diminuire la compliance nell'intervallo fisiologico e la curva perde sempre di più
il suo tratto verticale e aumenta la sa distensibilità per pressioni tra 20 e 80 mmHg, potendo essere
approssimata da un ramo di parabola. A causa del mancante tratto verticale appare scontato che il
volume raggiungibile a date pressioni è minore a 70 anni che a 20.
300
aumento vulume %
250
200
150
70 anni
20 anni
100
50
0
0 mmHg
20 mmHg
60 mmHg
100 mmHg
140 mmHg
180 mmHg
40 mmHg
80 mmHg
120 mmHg
160 mmHg
200 mmHg
è utile a quantificare la deformabilità delle arterie il loro modulo di elasticità calcolabile come la
differenza pressoria / l'incremento di diametro / il diametro medio dell'aorta (NB: è inversamente
proporzionale alla compliance.
Le piccole arterie e le arteriole hanno invece una tonaca muscolare molto più spessa in proporzione di
quella dei grandi vasi: possono quindi modulare il flusso distrettuale con la contrazione della loro
componente muscolare, inoltre sono difficilmente deformabili e costituiscono quindi terminali idraulici ad
alta resistenza. La particolare disposizione del circuito consente una fine regolazione del flusso ematico
distrettuale e livello capillare: infatti questi vasi: le arteriole (tra 10 e 100 micrometri di diametro) e le
metarteriole in alcuni distretti si comportano come valvole: la contrazione dello strato muscolare riduce il
lume, aumenta la resistenza al flusso e inoltre riduce la quota di sangue circolante. In particolare sono
detti sfinteri precapillari i tratti terminali di questi vasi che regolano maggiormente il flusso ematico
capillare. Inoltre le arteriole sono in gradi sia di creare shunt anatomici(anastomosi arterovenose) che
escludono dal circolo distretti corporei in determinate condizioni, sia fisiologici( restando occluse alcune
arteriole l'aumento della gittata cardiaca può non provocare l'aumento della circolazione in un
determinato distretto). Poiché i capillari non hanno modo di regolare il loro flusso la presenza di questi
'filtri' è essenziale per una corretta funzionalità circolatoria
La presenza di vasi distendibili a monte di vasi di resistenza ha un importante conseguenza: va infatti a
smorzare le oscillazioni del flusso pulsatile generato dal cuore. Consideriamo per semplicità che il
cuore pompi per metà del ciclo cardiaco e per l'altra metà sia fermo, il lavoro (W=PV) svolto dal cuore
sarebbe dipendente dalla velocità del flusso e dalla resistenza: una resistenza di 1 mmHg/ml/s e una
velocità di 200 ml/s dovrebbero essere spinti da una pressione di 200mmHg. Considerando il volume
sistolico costante vediamo che una pompa continua , utilizzando tutto il ciclo, potrebbe spingere il fluido a
una velocità dimezzata per ottenere lo stesso spostamento, questo la porterebbe a generare una
pressione costante di 100 mmHg, e un lavoro pari alla metà di quello della pompa pulsatile. Le arterie
distendibili immagazzinano la metà dell'energia cinetica fornita dal cuore in sistole per muovere il volume
sistolico sotto forma di energia pressoria(potenziale) deformando le loro pareti. Il ritorno elastico in
diastole libererà l'energia immagazzinata rendendo il flusso continuo. In realtà il lavoro è maggiore di
quello di una pompa continua (non trattandosi di condotti a distensibilità illimitata, ma consente un
guadagno del 45% sul lavoro di una pompa pulsatile (nel Ventricolo sinistro).
Poiché come detto sopra l'effetto di filtro idraulico operato dal sistema arterioso non è perfetto all'interno
delle arterie si genera una pressione oscillante. Nel tempo la variazione della pressione genera una curva
caratteristica . Possiamo notare un primo picco
corrispondente alla fase di eiezione in sistole, un incisura
corrispondente alla chiusura della valvola aortica e un
secondo picco più smorzato con un plateau e una discesa
piuttosto docile che corrispondono all'energia fornita dal
ritorno elastico dei grandi vasi. L'onda di pressione
(sfigmica) rilevabile in aorta non corrisponde allo
spostamento di sangue ma solo a variazioni pressorie che si
propagano nel sistema arterioso con velocità molto più alte
di quella del sangue e che sono palpabili nei vari 'polsi'. In
particolare nel suo percorso centro-periferia (consideriamo
polsi centrali quelli rilevabili in aorta ascendente,
discendente e carotide esterna, periferici gli altri) subisce modificazioni importanti: la velocità di
trasmissione aumenta in idrezione centrifuga essendo inversamente proporzionale alla compliance
(nell'anziano la velocità di trasmissione è aumentata) [NB:i vasi più piccoli hanno compliance minore], ciò
provoca uno smorzamento delle componenti ad alta frequenza, dovuto appunto alle proprietà
viscoelastiche dell'arteria. Inoltre i picchi raggiunti sono più elevati nei polsi periferici, poiché vari
fenomeni di risonanza, riflessione, il restringimento dell'arteria etc. La misura accurata dell'onda sfigmica
in polsi centrali e periferici può fornire un valido indicatore dello stato del sistema arterioso del paziente.
Volendo valutare la forza a cui la parete di un vaso deve resistere a date pressioni possiamo utilizzare la
legge di Laplace. Questa teorizza che in un ellissoide pieno di fluido ci sarà una forza definita Tensione
della parete che si opporrà a una lacerazione della parete altrimenti provocata dalla pressione interna (in
realtà trans murale, ma in un vaso la pressione esterna può considerarsi nulla). Inoltre questa forza sarà
inversamente proporzionale alla somma del reciproco dei raggi.
T=P/(1/r1+1/r2)
essendo in un vaso (cilindrico) un raggio idealmente infinito T=Pr. Questi calcoli sono stati fatti
considerando infinitesimo lo spessore della parete vasale: in aorta questa approssimazione non è
realistica e alla formula bisogna aggiungere un fattore di correzione che tenga conto dello spessore della
parete W. S=Pr/W. In aorta S=120mmHg*0,015m/0,002m=900mmHg [NB: uso la S xkè includendo il
fattore di correzione la formula non da valori dimensionalmente = T]
T=120mmHg+0,015m=1,8mmHg/m. I capillari saranno trattati separatamente(tesina successiva). La
tensione della parete ci fornisce un utile indice poiché per tensioni normali non si rischiano danni al
sistema arterioso (in un aneurisma le tensioni sono molto aumentate aumentando il raggio e diminuendo
lo spessore della parete. Tensioni alte si avvicinano a carichi di rottura. Inoltre gli stessi vasi hanno
reazioni intrinseche alla tensione e riescono a modularla. Il muscolo liscio vasale svolge l'essenziale
funzione di opporsi alla pressione e di mantenere funzionale il vaso; inoltre può rispondere a meccanismi
di regolazione esterni che modulando la sua contrazione possono modulare il flusso ematico (ciò è vero
soprattutto per i piccoli vasi).i vasi di resistenza hanno una componente muscolare più ingente. Per
rispondere alla pressione il muscolo liscio vascolare usa un meccanismo detto miogenico. Preparati di
arterie privati anche dell'endotelio rispondono a aumenti della pressione con aumento della contrazione
della tonaca muscolare. Quest meccanismo tende a smorzare l'iniziale incremento del flusso dovuto a un
repentino aumento di pressione (se si passa dalla stazione supina a quella eretta agli arti inferiori ci sarà
un aumento di pressione pari alla colonna di liquido sovrastante, i vasi di resistenza ridurranno il loro
calibro e il flusso dopo un breve picco tornerà alla normalità). Questo effetto non è mediato ma si ritiene
sia una proprietà intrinseca del muscolo liscio vascolare rispondere con una contrazione all'aumento di
pressione: si ritiene che ci siano canali meccanici per il calcio che stirandosi provocano l'ingresso di
questo ione e un aumento del tono muscolare. Il meccanismo è così eficace che per pressioni tra 20 e
160 mmHg il flusso dopo l'iniziale varazione si ristablisce intorno al valore di normalità.Anche la
stimolazione dell'endotelio provoca una risposta muscolare vasoattiva:l'aumento della forza di taglio
provoca la liberazione di una sostanza vasodilatatrice (NO) la forza di taglio può essere dimostrata
aumentando il flusso mantenendo costante la pressione(altrimenti il muscolo si contrarrebbe). La
dilatazione che segue ha lo scopo di prevenire l'aumento pressorio che andrebbe a causare la fuoriuscita
di fluido nell'interstizio e l'edema. Il muscolo liscio vasale inoltre risponde anche a particolari situazioni
metaboliche: qualsiasi intervento provochi il diminuito apporto di ossigeno a un tessuto provocherà
anche la liberazione cellulare di metaboliti attivi che agiranno localmente rilassando le arteriole. Ciò
previene l'ischemia. Tali metaboliti possono essere CO2 acido lattico potassio Pi o osmolarità del liquido
interstiziale, responsabili sicuramente dell'iperemia attiva(un tessuto sotto sforzo richiede più sangue). In
realtà osmolarità CO2 sono presenti nel sangue venoso non provocando dilatazione, acido lattico e pi non
sempre si osservano durante gli esperimenti. Il metabolita favorito è l'adenosina: Sicuramente non viene
rilevata Po2 poiché si osserva un fenomeno noto come iperemia reattiva: per intervalli di tempo definiti,
maggiore è il tempo in cui il vaso resta occluso maggiore sarà la sua dilatazione e il tempo per cui questa
permarrà poi. Neki muscoli vasali assistiamo a un tono basale indipendente dall'innervazione. Questo
tono è dovuto allo sforzo miogenico, o alla presenza di metaboliti, o all'alta pressione dell'ossigeno nelle
arterie, a cellule “ pacemaker ”. L'innervazione è più importante a livello dei vasi di resistenza, e gran
parte delle arterie è innervata solo dal sistema simpatico. Hanno un effetto tonico sui vasi (una loro
resezione provoca un modesto aumento di flusso). La liberazione di adrenalina aumenta la resistenza
vascolare. Il parasimpatico innerva solo limitati vasi e ha un effetto opposto.
10
FUNZIONI DEI CAPILLARI, DELLE VENE E DEI LINFATICI
Funzione dei capillari. Regolazione del flusso capillare. Diffusione tra plasma e liquido interstiziale. Scambi
idrici tra plasma e liquido interstiziale secondo l’ipotesi di Starling-Landis. Struttura e funzione dei vasi
linfatici. Funzione dei vasi venosi. Pressione venosa centrale. Fattori che determinano il ritorno del sangue
venoso al cuore.
I capillari non sono costanti ne per diametro (alcuni sono più stretti degli eritrociti, che per attraversarli
devono temporaneamente deformarsi, ne per flusso, che in media è di 1mm/s ma può arrivare a essere
retrogrado per brevi momenti. Sono i vasi a livello dei quali avviene lo scambio tra sangue e cellule
tissutali: l'endotelio, loro unico costituente, è ricco di fessure tra cellule endoteliali continue del diametro
di 4 nm. In alcuni distretti troviamo fenestrature più ampie. I capillari formano fitte retti anastomotiche a
partenza dalle arteriole da cui dipartono, il loro diametro non è costante e sono composti dal solo strato
di cellule endoteliali ciò facilita gli scambi). In particolari distretti l'endotelio può addirittura essere
fenestrato. La loro disposizione garantisce l'apporto di o2 e nutrienti ad ogni cellula dell'organismo.
L'esiguo spessore della parete lo facilita. L'endotelio nonostante la sua sottigliezza offre un valido
sostegno strutturale: esso sopporta le elevate pressioni extramurali: secondo la legge di Laplace la
tensione della parete = Pr. Essendo il raggio di un capillare molto piccolo anche la tensione della parete
sarà ridotta, tra 12000 e 3500 volte minore di quella dell'aorta (correggendo per lo spessore della parete
la tensione capillare è un decimo. I capillari non avendo uno strato muscolare non hanno capacità
contrattili e non regolano il flusso al loro interno. Questo viene regolato dai vasi di resistenza: una
costrizione dell'arteriola provoca una diminuzione del flusso. Le arteriole possono anche occludere il loro
lume: la contrazione del muscolo liscio fa diminuire la pressione fino al raggiungimento della pressione
critica di chiusura alla quale il flusso si arresta nonostante il gradiente pressorio positivo. L'endotelio
capillare ha però un ruolo vasoattivo potendo rispondere con la liberazione di specifiche sostanze
vasodilatatrici ( NO e prostaciclina in risposta a sollecitazioni di taglio) o vasocostrittrici (endotelina).
L'endotelio nel regolare lo scambio sangue-tessuti ha sia un ruolo attivo che uno passivo: attivamente si
limita ad assorbire alcune sostanze tramite pinocitosi, questo processo sebbene essenziale, è
quantitativamente poco significativo; passivamente si comporta come una barriera attraversabile da
determinate sostanze, quindi selettiva, e tra queste non tutte la attraversano con la medesima facilità.
Per quantificare questo processo si studia lo scambio capillare-tissutale come diffusione semplice,
essendo appunto la diffusione il fattore chiave che determina tale scambio. Come descrisse Fick la
quantità di sostanza che si muove nell'unità di tempo attraverso una barriera selettivamente permeabile
(J) = - il coefficente di diffusione di una data molecola (per piccole molecole sferiche è inversamente
proporzionale alla radice quadrata del peso molecolare) (D) * l'area della sezione trasversa della via di
diffusione (A) * il gradiente di concentrazione (dc/dx)
J=-DA(dc/dx)
la legge può essere espressa anche considerando che J= - la
permeabilità capillare alla sostanza (P) * la superficie capillare (S) * la
differenza delle concentrazioni (Cext-Cint).
J=-PS(Cext-Cint)
la diffusione è limitata nei capillari dalla presenza dei pori: piccole
molecole idrosolubili e acqua non trovano ostacoli nell'attraversare i
pori endoteliali e quindi la loro diffusione è limitata dal flusso:
l'equilibrio di concentrazione tra l'ambiente extra e intra capillare è
raggiunto facilmente, vicino al capo arteriolare (ciò è dovuto al basso
coefficiente di riflessione); se però la velocità del flusso è troppo
elevata le molecole raggiungono l'equilibrio più a valle. Per grosse
molecole idrosolubili fino a 60 KDalton con alto coefficiente di
riflessione il trasporto appare limitato dalla diffusione: nonostante
l'aumento del flusso il numero di molecole a oltrepassare l'endotelio
non varia poiché i pori (lo 0,02% della superficie) non sono sufficienti a
far passare un numero maggiore di molecole. Le molecole liposolubili
attraversano la membrana con estrema facilità; il coefficiente di
partizione olio/acqua, ovvero l'indice della loro solubilità lipidica,
fornisce una buona quantificazione della loro velocità di diffusione, non legata peraltro alla barriera
endoteliale. L'ossigeno (come la CO2) è così diffusibile che è dimostrabile una diminuzione della
saturazione dell'emoglobina all'80% in fondo all'arteriola poiché sia attraversa alche l'endotelio
arteriolare, sia avviene uno scambio diretto arteriole-venule per prossimità. Ciò a bassi valori di flusso
può limitarne l'apporto tissutale. Per descrivere il movimento di fluidi tra plasma e interstizio definiamo, in
accordo con Starling-Landis, come spinti da una forza che sia per direzione e entità uguale alla somma
delle pressioni idrostatica e osmotica transmurali. Il movimento di liquido Q = alla costante di filtrazione
pre la membrana capillare (K) moltiplicata la differenza tra la pressione oncotica transmurale e la
pressione idrostatica transmurale:
Q=K*(Δπ-ΔP)=K*[πext - πint - (Pext-Pint)]
NB(la pressione colloidoosmotica nella formula può essere piu verosimilmente corretta moltiplicata per il
coefficente di riflessione dell'albumina (sigma))
la pressione idrostatica può considerarsi normalmente nulla nell'interstizio, dipendente dalla pressione
sistemica nel capillare e da altri fattori tipicamente distrettuali(ad es. è maggiore nei capillari glomerulari
renali). La pressione osmotica del plasma è di 6000 mmHg; di questi 25 sono di natura oncotica(ovvero
dovuti a proteine che non diffondono attraverso l'endotelio, di cui la principale è l'albumina, con le sue
cariche negative, gli ioni cloro che lega e le cariche positive che trattiene) NB: la pressione osmotica di un
soluto si calcola come coefficente di riflessione (σ ) * la costante dei gas R * la temperatura assoluta * la
differenza tra la concentrazione interna e l'estrerna. La filtrazione non dipende solo dalle forze pressorie
ma anche dalla viscosità (η) , dallo spessore dell'endotelio(Δx), dall'area di filtrazione (A) e dalla costante
di filtrazione (K). Possiamo descrivere inoltre la filtrazione capillare attraverso un coefficiente che invece
delle forze di starling-landis tenga conto degli altri fattori: K t=k*A/(η*Δx ). La k tissutale è tessutospecifica e riflette il numero di capillari pervi(con densità costante, spessore tessuto-specifico e k
costante). la pressione idrostatica dell'interstizio e la pressione oncotica dell'interstizio possono ritenersi
nulle. La pressione idrostatica del sangue va dai 32 mmHg del capo arterioso ai 15 del capo venoso (con
ampie variazoni) ciò provoca l'sucita di fluidi nel capo arterioso e il rientro della maggior parte di questi
nel capo venoso. In mancanza di ciò si creerebbe edema tissutale.
I capillari linfatici drenano la porzione di liquido fuoriuscito dal capillare per la filtrazione a causa della
pressione idrostatica leggermente maggiore delle forze di richiamo, hanno struttura simile ai capillari ma
non presentano giunzioni serrate. Si riuniscono in vasi che scaricano i fluidi alla giunzione tra succlavia e
giugulare interna. Cartilagine osso e cervello sono sprovvisti di vasi. Se non drenassero il liquido si
formerebbe edema tissutale: il liquido che circola nelle 24h è circa 2,5L. Rappresentano inoltre l'unica via
attraverso la quale proteine come l'albumina che lascia in piccolissima parte il circolo può tornare al
sangue. Inoltre hanno un importante funzione immunitaria nel ricircolo linfocitario e nel trasporto di
antigeni. Il flusso è spinto dalle contrazioni dei muscoli vicini e quindi varia in modo considerevole.
Le vene hanno struttura simile alle grandi arterie, solamente la loro
compliance è molto maggiore. Il sistema venoso raccoglie il sangue
deossigenato dai distretti con le venule e lo indirizza verso il cuore (nel circolo
sistemico) con vasi via via di calibro maggiore che confluiscono nella vena cava
superiore o in quella inferiore. La pressione venosa centrale è la pressione
rilevata in atri destro. La variazione della pressione venosa centrale
conseguente alla variazione della gittata cardiaca è descritta in una curva detta
della funzione vascolare. Con la gittata che all'improvviso diventa 0 il sangue
verrà spinto attraverso le resistenze periferiche fino a che le pressioni arteriose
e venose non si equivarranno. Se con una gittata di 1L/min abbiamo una
pressione arteriosa media di 100mmHg e una venosa di 2 la pressione venosa
in arresto non andrà però verso i 51 mmHg poiché, essendo le vene circa 20
volte più distensibili delle arterie la pressione venosa avrà peso 20 volte
maggiore nella media e il valore su cui si assesterà la pressione sarà 7mmHg.
Ciò si può anche spiegare con il fatto che una diminuzione della pressione
arteriosa provoca un aumento della pressione venosa centrale 20 volte
minore. Con una gittata cardiaca critica invece la pressione venosa diventerà
negativa e ciò provocherà il collasso dei vasi; un non adeguato ritorno
ematico farà stabilizzare la gittata su un valore soglia. Un aumento del volume
ematico fa corrispondere a valori di gittate cardiache medesimi pressioni
venose più alte. Uno stato di vasodilatazione rende invece la curva meno
ripida e aumenta la gittata soglia.
Il ritorno venoso al cuore oltre che dalla pressione venosa è favorito anche da altri fattori: le vene
sottoposte a elevate pressioni anche a seguito della postura sono dotate di valvole anatomiche che
consentono il flusso solo verso il cuore. Se nella vena safena il flusso si arresta per il passaggio ala
stazione eretta l'apparato valvolare impedirà il flusso retrogrado, inoltre nei momenti in cui la pressione
torna ad essere positiva le valvole saranno aperte e la pressione nel segmento sopravalvolare sarà
aumentata e verrà favorito il flusso. Durante un esercizio fisico i muscoli stessi premono sulle vene e il
particolare orientamento delle valvole fa si che la colonna di sangue sia spinta verso il cuore. La normale
attività respiratoria si comporta per le vene cave come un fattore favorente il flusso. In inspirazione c'è
una diminuita pressione intratoracica, che si trasmette ai vasi: ciò provoca l'aumento del gradiente
pressorio intra e extra toracico che promuove il ritorno venoso dalle vene periferiche a quelle intratoracica
(il flusso va da 5 a 11 ml/s nella vena cava inferiore). In espirazione accade l'opposto e il flusso rallenta.
Il normale ciclo respiratorio è comunque vantaggioso rispetto all'apnea. Anche la gravità fornisce ha
effetti sul ritorno venoso:nelle gambe favorisce la discesa del sangue arterioso e sfavorisce quella del
sangue venoso; un adeguata considerazione fisica impone che le due forze si annullino, ma le vene sono
molto più distensibili delle arterie e quindi l'impedimento del flusso generato dalla forza di gravità
comporta la stasi del sangue a livello dei piedi. Nel passaggio dalla posizione supina a quella eretta si
accumulano negli arti inferiori fino a 800ml si sangue e ciò provoca una decisa riduzione della gittata
cardiaca. In compenso il deflusso dal cranio e dalle parti sopracariache è favorito. (per ulteriori
approfondimenti e storiella dei tubi a u consultare cap. controllo della gittata cardiaca verso la fine)
11
PRESSIONE ARTERIOSA E SUA REGOLAZIONE
Regolazione riflessa della pressione arteriosa: localizzazione, struttura e caratteristiche funzionali dei
barocettori aortici e carotidei; riflessi cardiaci e vasomotori a partenza dai barocettori aortici e carotidei.
Riflessi a partenza dai recettori atriali e dai vasi toracici. Sistema renina-angiotensina-aldosterone.
La pressione arteriosa è facilmente misurabile e fornisce una rapida indicazione dei fattori che la
determinano, invece non facilmente quantificabili. Nel tempo la pressione arteriosa oscilla e quindi si
parlerà di pressione arteriosa diastolica relativamente alla pressione minima registrabile, di
pressione arteriosa sistolica relativamente alla pressione massima registrabile e di pressione
arteriosa media, ovvero la media nel tempo della pressione, calcolabile semplicemente come pressione
diastolica + (pressione sistolica-pressione diastolica)/3con una buona approssimazione(nella media
influisce il tempo per cui si mantengono i valori; la massima dura di meno.)
P
120 mmHg
pressione sistolica
80 mmHg
pressione diastolica
0
1
T(s)
i fattori determinanti la pressione possono essere divisi in fisici e fisiologici: i fattori fisici sono la
compliance del sistema e il volume arterioso; i fattori fisiologici sono la portata cardiaca (ovvero la
frequenza * il volume sistolico) e le resistenze periferiche. La compliance si può ritenere costante. Per
quanto riguarda il volume arterioso questo è la principale causa della pressione: ricordiamo infatti che
la compliance può essere calcolata come dV/dP: un aumento di volume provocherà di riflesso un aumento
pressorio. Esprimendo l'equazione della compliance nel tempo abbiamo che
dV C⋅dP
=
dt
dt
essendo la
variazione di volume nel tempo dipendente dal prevalere del afflusso di sangue tramite il cuore e del
deflusso di sangue tramite le resistenze periferiche
Q ingresso−Q uscita dP
=
C
dt
. la pressione media è
aumento vulume %
dovuta quindi al divario tra sangue in entrata e sangue in uscita che è diretta conseguenza dell'aumento o
diminuzione della portata cardiaca e del tono delle resistenze periferiche. L'aumento di portata non
accoppiato a vasodilatazione periferica provoca un aumento di pressione la cui repentintà dipende dalla
compliance: un alta compliance arteriosa provocherà una più dolce ascesa verso valori di equilibrio per la
nuova portata. Il valore di equilibrio raggiunto invece dipenderà solo dalla portata e dalle resistenze
periferiche: la pressione di equilibrio si avrà quando l'aumento di pressione bilancerà la resistenza al
flusso in modo che la quantità immessa dal cuore nel circolo arterioso eguagli quella fuoriuscita
attraverso le resistenze periferiche. Da ciò risulta chiaro che non modulando la portata l'organismo può
far abbassare la pressione arteriosa inducendo vasodilatazione delle resistenze periferiche: un maggior
flusso periferico ridurrà il volume arterioso. In sostanza la pressione è diretta dipendenza del solo volume
arterioso, un fattore fisico; questo fattore fisico viene modulato attraverso 2 fattori fisiologici: la portata
cardiaca che agisce sul volume in ingresso e la resistenza periferica che agisce sul volume in uscita.
Il polso pressorio, inteso come la variazione della pressione in aorta nel tempo, può essere inteso come
un rapido aumento dalla portata non bilanciato dalla diminuzione del tono periferico seguito da una rapida
diminuzione della stessa: il divario tra la pressione in diastole e quella in sistole è dipendenza di un unico
fattore: il volume sistolico. In aorta viene immesso un volume di
sangue che provoca un aumento pressorio in parte bilanciato dalla
80
compliance arteriosa. Compliance minore provoca aumenti
70
60
pressorio maggiori a parità di volumi immessi (nb: per volumi
C a 70
anni
50
piccoli la cosa si inverte per l'andamento sigmoide della curva della
Regres40
compliance normale) (vedi tesina 9 per polsi centrali e periferici e
sione lo30
descrizione onda sfigmica) il polso pressorio si spiega anche come
garitmica
20
diretta conseguenza dell'aumento di volume arterioso. È inoltre
per C a
10
influenzato dalle resistenze periferiche: per ugual aumento di
70 anni
0
volume in stato di vasodilatazione si avrà un minor aumento di
60 mmHg
180 mmHg
pressione. Una ridotta compliance fornirà inoltre un polso pressorio
0 mmHg
120 mmHg
più ampio: ciò si spiega facendo appello al fatto che arterie meno
distensibili presentano una curva della compliance che diventa più orizzontale per livelli di pressione
maggiori: un piccolo aumento di volume nel tratto orizzontale della curva della compliance provocherà un
aumento di pressione maggiore che nel tratto verticale. L'aumento pressorio negli arteriosclerotici incide
maggiormente sulla pressione sistolica.
La circolazione, ovvero il flusso, è controllato da due meccanismi: uno proprio del vaso (trattato in tesina
9) e uno di natura centrale. In alcuni distretti, come il cuore o il cervello, il meccanismo centrale riveste
poca importanza: il flusso viene garantito anche nel caso in cui segnali esterni provochino
vasocostrizione. Il controllo di natura centrale è anche detto estrinseco. Nel bulbo si individua una
regione detta pressoria: la stimolazione della parte dorsolaterale provoca vasocostrizione e aumento di
frequenza cardiaca e contrattilità del miocardio. Caudalmente e ventromedialemente a questa è situata
una ragione depressoria. Questa agisce inibendo sia il midollo che la regione pressoria bulbare. Le regioni
vasocostrittrici sono tonicamente attive e un inibizione della loro scarica provoca vasodilatazione; una
diminuzione dell'inibizione alla loro scarica vasocostrizione.
Neuroanatomia del controllo della pressione: dalla regione vasocostrittrice le fibre discendono
nella formazione grigia mediolaterale formando sinapsi da t1 a l2 e uscendo con le corna
anteriori. Si separano quindi dalle fibre ventrali motrici per raggiungere la catena paravertebrale
di gangli simpatici con rami comunicanti bianchi. Dal ganglio esce il ramo comunicante grigio che
si unisce ai nervi segmentali e innerva vene e arterie.
Le vene sono più sensibili delle arterie alla stimolazione nervosa: rispondono a frequenze più basse;
inoltre non presentano recettori beta-adrenergici e ciò esclude un controllo ormonale adrenergico. Come
già detto l'influenza nervosa sui grandi vasi è poco significativa.
Il parasimpatico ricopre un ruolo di modesta entità nella regolazione del tono vasale e specificatamente
locale: ad es. la stimolazione delle fibre craniale parasimpatiche che controllano la salivazione stimola
anche la liberazione di bradichinina e un ingente vasodilatazione locale.
L'adrenalina liberata dal surrene ha effetti decisamente minori della Nor-A simpatica, dosi massive
provocano vasocostrizione del letto cutaneo, effetti principalmente vasocostrittori negli altri letti vascolari.
Le afferenze alla zona pressoria e depressoria bulbare sono a partenza da specifici 'sensori' quali i
barocettori (e chemocettori periferici, l'ipotalamo, la corteccia e la cute, che però sono inseriti in altri
processi come il controllo della respirazione e saranno trattati in separata sede..
I barocettori periferici, aortico e carotideo, sono situati nell'arco aortico e nella carotide comune
vicino al punto di biforcazione tra carotide esterna e interna, nel seno carotideo (a volte il glomo
carotideo può essere reperito in posizione leggermente ectopica in carotide interna subito dopo la
biforcazione). Sono pressocettori di forma elissoide ricoperti da una membrana fibrosa che ricevono una
ricca vascolarizzazione. Al loro interno le arterie irroranti si risolvono in una fitta maglia di sinusoidi
immersi nello stroma. Gli elementi cellulari sono di due tipi: il primo è rappresentato da grosse cellule
epitelioidi poliedriche che ricevono assoni con cui formano giunzioni citoneurali e fibre efferenti, il secondo
è di sostegno. I nervi sono disposti anche a manicotto intorno ai sinusoidi, e il loro comportamento è
simile a quello dei recettori di stiramento. Le fibre efferenti a partenza dai due glomi carotidei
raggiungono il bulbo attraverso la branca del seno carotideo del glossofaringeo, i vari glomi aortici
attraverso il nervo vago. I glomi rispondono con un aumento di scarica allo stiramento delle pareti indotto
dall'aumento pressorio. La risposta massimale si ha ad una pressione di 200mmHg con impulsi continui
sia in sistole che in diastole. La scarica dei loro recettori giunge al bulbo e stimola l'nts(nucleo del tratto
solitario). La sua stimolazione inibisce la scarica tonica del simpatico (a partenza dalla parte dorsolaterale
del bulbo). Provoca vasodilatazione. Inoltre la bradicardia indotta dalla stimolazione delle regioni vagali
contribuisce alla caduta pressoria. I recettori carotidei sono più sensibili di quelli aortici e vengono
stimolati maggiormente da un aumento della pressione media; i due recettori rispondono però in maniera
simile ad aumenti pressori pulsatili. I glomi mostrano inoltre un grado di adattamento e cessano di
svolgere la loro funzione regolatrice se sottoposti a pressioni stazionarie sebbene elevate. Inoltre la loro
scarica può essere modulata con la scarica delle fibre simpatiche afferenti ai glomi che li vasocostringe e
ne riduce la distendibilità.
I recettori cardiopolmonari sono situati negli atri, ne ventricoli e nei vasi polmonari. La loro scarica è
tonicamnete attiva e possono produrre importanti adattamenti alla modificazione dalla pressoine venosa,
intracardiaca o dei vasi polmonari. Gli atri contengono due tipi di recettori, uno attivato dalla tensione
parietale in contrazione, l'altro dallo stiramento della parete nella fase di riempimento. Gli impulsi
vengono inviati attraverso i nervi vaghi ai centri bulbari. Un'aumentata frequenza di scarica provoca la
diminuzione del tono simpatico renale (che riceverà un flusso maggiore e aumenterà l'escrezione,
diminuirà la sintesi di renina e aldosterone) e un aumento del tono simpatico del nodo del seno, ciò
aumenterà la frequenza cardiaca. Per via riflessa questi recettori inibiscono anche il centro vasocostrittore
bulbare. Una diminuita frequenza di scarica provocherà effetti opposti.
In realtà i glomi aortici e carotidei rispondono meglio a repentini sbalzi pressori ma non consentono una
regolazione efficiente per lunghi periodi. I recettori polmonari fanno leva su sistemi renali per regolare la
pressione a lungo termine.
La pressione sistemica è conseguente al bilancio idrico e l'organo che ne consente la regolazione è il rene.
Il più potente regolatore pressori dell'organismo è il sistema renina-angiotensina-aldosterone. Le
cellule muscolari lisce delle arteriole renali producono e immagazzinano renina. Quest'ultima viene
liberata
a) a causa di una segnalazione paracrina della macula densa dovuta al rilevamento di una
diminuita quantità di sale(vedi feedback tubulo-glomerulare)
b) con la riduzione della pressione di perfusione renale
c) con la scarica simpatica delle fibre innervanti le arteriole renali.
La renina è in realtà una proteasi che degrada l'angiotensiogeno(un sostrato proteico plasmatico di
produzione epatica) in un oligopeptide di 10 aa., l'angiotensinaI. Questa viene a sua volta degradata in
angiotensinaII da una proteasi (ACE=enzima convertente l'angiotensina) presente nell'endotelio renale e
polmonare nella forma biologicamente attiva: l'angiotensina II (8 aa.). L'angiotensina II aumenta la
pressione stimolando la secrezione di aldosterone, la vasocostrizione generale, la secrezione di adh e la
sete(agendo sull'ipotalamo), il riassorbimento di sale nel tubulo prossimale. Aumenta la pressione in
maniera molto potente ed ha un emivita relativamente bassa. L'aldosterone, stimolato soprattutto
dall'angiotensina II, media molti effetti che comportano un aumento pressorio:stimola il riassorbimento di
sale da parte dell'ansa di henle, del tubulo distale e del dotto collettore (solo NaCl, non acqua).
L'aldosterone stimola tramite fattori di trascrizione citoplasmatici la traduzione di proteine deputate al
riassorbimento di sale.
L'ipertensione cronica è da attribuirsi a un aumentato tono del sistema nervoso simpatico e a un lento
adattamento dei barocettori, a diminuita capacità del rene di eliminare sodio, nonchè a fattori genetici,
alimentari, condizioni di stress socialee, sedentarietà, e non ultimo l'invecchiamento e la conseguente
ateriosclerosi.
12
DETERMINAZIONE DELLA PRESSIONE ARTERIOSA (Laboratorio)
Determinazione della pressione arteriosa mediante il metodo sfigmomanometrico di Riva-Rocci. Pressione
sistolica, diastolica e differenziale.
La rilevazione della pressione arteriosa nel tempo da una curva caratteristica definita sfigmogramma
P
120 mmHg
pressione sistolica
Pressione media
Pressione differenziale
Psistolica-Pdiastolica
80 mmHg
pressione diastolica
0
1
T(s)
per la trattazione della pressione sistolica diastolica e media si rimanda alla tesina precedente, per
quanto riguarda la pressione differenziale quest'ultima può essere usata come buon marker della
funzionalità del sistema arterioso: infatti a seguito della variazione nel processo di arteriosclerosi della
curva della compliance(cfr.) l'ipertensione di natura arteriosclerotica produrrà un aumento pressorio in
sistole non proporzionato a quello in diastole, bensì molto maggiore.
Per costruire lo sfigmogramma e poterne così ricavare tutti gli utili dati clinici occorre poter rilevare la
pressione arteriosa.
Usando un metodo diretto invasivo e poco, detto dalla prof. jnoes cruento, pratico sarà necessario
inserire un catetere in aorta; è conveniente poiché fornisce una misura istantanea della pressione e della
funzionalità cardiaca( altrimenti bisognerebbe aspettare per ogni misurazione che il manicotto si sgonfi).
Ha molti inconvenienti e risulta invasivo, si usa in clinica durante interventi. Inserendo un catetere in un
arteria che continui con un tubo ad u pieno di mercurio a flusso chiuso il mercurio subirà pressione
atmosferica, mentre la pressione arteriosa spingerò il mercurio verso l'alto a flusso aperto. Il dislivello tra
le due anse del tubo darà la pressione in mmHg istantanea. (In realtà vengono usati sensori elettronici
come il ponte di wheatstone o circuiti microfabricati a resistenze variabili le cui resistenze variano in
funzione della pressione e la traducono in un impulso elettrico amplificato e poi stampato).
In circostanze abituali in clinica viene utilizzato il metodo indiretto di Riva-Rocci (Riva Rocci era una
sola persona con due cognomi, si chiamava Scipione) che pur non consentendo di apprezzare lo
sfigmogramma, non è invasivo e ci restituisce i valori di massima e di minima pressoria. Questo metodo
parte dalla considerazione che il moto turbolento è rumoroso, mentre quello laminare non produce toni.
[ricordiamo che si ha moto turbolento per numeri di reynold > 2000 con
R=
r⋅v⋅
]
si può generare moto turbolento in una qualsiasi arteria provocando una strozzatura: riduciamo il raggio,
il che provoca anche un parallelo aumento di velocità. Questa turbolenza cesserà quando la pressione con
cui occludiamo l'arteria eguaglierà la pressione minima e sorgerà quando la pressione eguaglierà la
massima (per pressioni maggiori l'arteria avrebbe una pressione transluminare negativa che impedirebbe
il flusso).
Praticamente:
Intorno al braccio, due dita sopra al gomito con
l'avambraccio flesso o comunque posizionato
all'incirca all'altezza del cuore per non creare dislivelli
e gradienti pressori, viene posto un manicotto si
stoffa indistensibile contenente una camera d'aria
collegata a una pompetta e a un tubo a U contenente
mercurio. Col manicotto che non esercita pressioni il
mercurio sarà a livello 0. Gonfiando la camera d'aria
la pressione prodotta si trasferirà all'arteria e sarà
visualizzata al contempo dall'altezza della colonna di
mercurio in mm sopra lo 0.
Nella piega del gomito, sopra all'arteria omerale,
verrà posizionato un foneidoscopio per la valutazione
dei toni prodotti dalle turbolenze detti Toni di Korotkof.I
toni sono dovuti alla colonna di sangue che attraversa in
sistole il manicotto con moto turbolento e alta velocità e impatta contro la colonna a valle generando
vibrazioni udibili.
I toni si dividono in 5 fasi, senza rilievo clinico se non per la prima e l'ultima. Nella prima compare un
suono pulsante, nella seconda fase si assiste a un suono molto basso, nella terza a un suono simile alla
prima ma più crepitante, nella quarta il suono si affievolisce progressivamente, nella quinta scompare.
Raggiunta una pressione di 160mmHg iniziamo a sgonfiare a 2-3 mmHg al secondo agendo su una
valvola della pompetta, (se a 160 già sentiamo dei toni aumentiamo la pressione iniziale) intorno ai 120
mmhg ci aspettiamo di sentire il primo tono e registriamo il valore come pressione sistolica. Subito dopo
si può osservare una pausa dei toni, che presto riappaiono. Intorno alla pressione minima i toni si
affievoliscono fino a scomparire. La pressione a cui scompaiono è la pressione diastolica.
Per evitare grossolani errori di misura è necessario non essere ne troppo distanti dalla colonna di
mercurio e non guardarla con un'angolazione troppo ampia. Inoltre bisogna sincerarsi che la colonna sia
verticale, che il braccio non sia costretto e si trovi all'altezza del cuore, che il paziente non sia in alcun
modo turbato.
Di solito la misura della pressione è accoppiata in clinica alla valutazione dalla frequenza e della ritmicità
del polso.
13
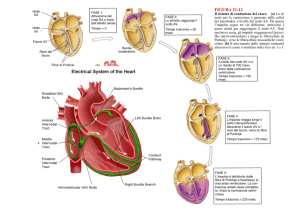
ATTIVITA’ ELETTRICA DEL CUORE
Attività elettrica del miocardio specifico (tessuto nodale e fibre del Purkinje) e del miocardio comune.
Correlazione tra eventi elettrici ed eventi meccanici nella cellula del miocardio comune. Generazione e
conduzione dell’eccitamento cardiaco. Effetti della stimolazione vagale e simpatica sulla attività elettrica e
meccanica del miocardio.
Nel tessuto cardiaco sono osservabili potenziali di azione singolari e specifici per le due classi cellulari
(miocardio comune + cellule di purkinje e miocardio specifico) adatti alla loro funzione.
Un primo tipo di potenziale analizzabile può essere registrato ponendo due elettrodi uno dentro e uno
fuori una cellula del miocardio specifico. Questo tipo di potenziale è definito risposta lenta ed è
responsabile della genesi del ritmo cardiaco naturale e di particolari modalità di conduzione
dell'eccitamento quali quelle osservabili nel nodo AV.
Potenziale
transmembrana (mV)
ica
0
if
ik
Overshot
if
-30
ikl
-65
Potenziale di riposo
0
100
200
300
Tempo (ms)
le membrane cellulari delle cellule che mostrano una risposta lenta mostrano una differenza di potenziale
inferiore di quelle a risposta rapida. La loro permeabilità al sodio risulta maggiore a riposo e quindi il
potenziale si avvicina più a quello di equilibrio del sodio.
[ ricordiamo l'eq. Di Nernst per il calcolo del potenziale di eq. per uno ione.
R⋅T⋅[lnX esterno ]
=z Ḟ⋅ E esterno −E interno E l'eq. Per il calcolo del potenziale cellulare
[ X interno ]
g
g
g
g
E= K ⋅E K Na ⋅E Na Cl ⋅E Cl Ca ⋅E Ca da :genesi e conduzione potenziali
∑g
∑g
∑g
∑g
all ' equilibrio
complessivo
sul libro].
Innanzi tutto bisogna fare una preconsiderazione: le cellule a risposta lenta non possiedono canali per il
sodio voltaggio-dipendenti. Il loro potenziale d'azione dipende dall'entrata di calcio.
Per descrivere il potenziale d'azione lento risulta utile dividerlo in fasi. La prima fase è di ascesa del
potenziale e mostra un leggero overshoot detta fase 0, a questa fase ne segue una di discesa docile detta
fase 2 , tra 0 e -30 mV di potenziale, una di discesa più marcata detta fase 3 e un'ultima tra -55 mv e il
nuovo potenziale in cui vengono ristabiliti gli equilibri ionici e si innescano i meccanismi per la neogenesi
spontanea di un nuovo potenziale detta fase 4.
la fase 0 vede la depolarizzazione cellulare e si deve principalmente a una corrente in ingresso
detta if, ovvero funny, poichè per i ricercatori risultava inaspettata: una corrente di sodio in entrata viene
attivata dall'iperpolarizzazione, a valori di ddp inferiori di 50mv, e ovviamente questa corrente si oppone
alla ripolarizzazione; attraversa canali detti funny diversi da quelli utilizzati nella risposta rapida. Inoltre
raggiunti i -40 mv si aprono i canali ca detti l, ovvero lasting: questi canali cal si inatvano molto
lentamente, si innesca una corrente che velocizza la depolarizzazione. La corrente kl contrastera e
modula l'effetto depolarizzante delle correnti funny e ca. la stimolazione vagale aumenta la conduttanza
al k e rallenta la depolarizzazione e quindi la neogenesi del potenziale.
La fase 2 inizia raggiunto il picco di depolarizzazione, picco dipendente dalla specifica conduttanza
al calcio (farmaci calcio-agonisti abbassano la depolarizzazione massima registrabile). Le correnti in
ingresso di calcio registrabili nella fase di ascesa sono dovute a specifici canali che si aprono e si
inattivano lentamente. Queste correnti permangono durante la fase di discesa lieve, e vengono bilanciate
dalla corrente di potassio in uscita. I veri responsabili della ripolarizzazione sono i canali ik, ovvero i
canali a rettificazione ritardata. Questi canali vengono attivati a ddp prossime allo 0, ovvero a quelle
registrate verso la fine di fase 0, e si attivano molto lentamente. Sono responsabili della corrente in uscita
di potassio, ripolarizzante. ikl è una corrente detta rettificante in ingresso: i canali ikl hanno una peculiare
caratteristica: quando il potenziale è minore di Ek si aprono e consentono un massivo ingresso di
potassio, che cresce linearmente con la diminuzione del potenziale, per potenziali prossimi a quelli di fase
4 consentono invece una modesta uscita di ioni potassio, che si annulla per ddp prossime a quelle di fase
2. per questa facilitazione della corrente k in ingresso e la disfacilitazone della corrente k in uscita
vengono detti rettificanti in ingresso. La corrente ikl consente una discreta uscita di k.I canali kl si rendono
direttamente responsabili invece della diminuita conduttanza al potassio in fase 2, che previene una
massiva uscita di K spinti sia dalla forza osmotica che da quella elettromagnetica, che avrebbe effetti
ripolarizzanti e bloccherebbe il plateau.
La fase 3 e caratterizzata da una ripolarizzazione più marcata: la cinetica di attivazione dei canali
ik prevede infatti che questi si aprano lentamente e che il maggior numero sia aperto in fase 3. Inoltre a
voltaggi intorno a -35mV si inattivano i canali che consentivano la corrente ca in ingresso, ciò facilita la
ripolarizzazione.
Nella fase 4 l'eccesso di Ca entrato nella cellula è pompato fuori da uno scambiatore 3na/1ca e da
un atp-asi calcio specifica. La corrente ikl consente una modesta uscita di potassio, ripolarizzante, mentre
si attiva la corrente if .
Le cellule a risposta lenta non possiedono canali peculiari: un bloccante dei canali Na, la tetrodotossina,
rende i potenziali del miocardio di lavoro uguali a risposte lente.
Le cellule a risposta rapida quindi risentono nel loro potenziale d'azione anche del peso della corrente
sodio in entrata. Questa passa attraverso canali rapidi per il sodio. Detti canali hanno una costituzione
peculiare: sono provvisti di due barriere, m e h, che possiedono diverse soglie di apertura e chiusura. La
chiusura di una dola delle 2 barriere impedisce la corrente sodio. Al potenziale di riposo la barriera m si
trova chiusa e la barriera h aperta. Per un potenziale di -65mV la barriera m si apre e consente l'ingresso
di sodio. (questo provoca il picco). A valori di potenziale tra +20 e +30 mV la barriera h si chiude e
questa verrà riaperta solo una volta raggiunto il potenziale di riposo, allorqundo si ripristinerà la
conformazione proteica iniziale per il canale. Ciò rende raggone del fatto che una stimolazione prematura,
in periodo refrattario assoluto per la cellula, provocherà un potenziale simile a quello della risposta lente;
inoltre per un breve periodo, nel periodo refrattario relativo, alcuni canali dovrannoi, statisticamente,
ancora riprendere la loro conformazione, e il potenziale prodotto sarà quindi di minor ampiezze, essendo
disponibile un numero minore di canali per il sodio.
Potenziale
transmembrana (mV)
iNa
ikto
icaL
ik
+25
0
Overshot
ikl
-95
Potenziale di riposo
0
100
200
300
Tempo (ms)
possiamo dividere il potenziale di azione veloce in 5 periodi.
Il fase 0 è molto breve e corrisponde alla rapida ascesa della curva fino a valori di ddp di +30mV.
Questa fase è dovuta all'ingente corrente di sodio opra descritta, inoltre apre i canali Ca l che saranno
significativi in fase 2.
La fase 1 è dovuta all'apertura di canali ikto:la corrente Kto (ossia transient outward) si innesca al
raggiungimento di ddp positive e genera una depolarizzazione momentanea che permane fintanto che i kto
non viene bilanciata dall'ingresso di Ca++ tramite la corrente Cal. È particolarmente marcate nelle fibre di
purkinje e in laboratorio a condizioni sperimentali con cicli di 8000ms.
La fase 2 vede l'equilibrio tra le correnti ikto, la corrente ik e la corrente icaL. Le catecolammine
aumentano l'ingresso di calcio legandosi ai recettori b-adrenergici e stimolando l'adenilato-ciclasi che
aumenta i livelli di amp-ciclico, che apre i canali caL. L'aumentato afflusso di calcio aumenta la forza
contrattile del miocardio.
La fase 3 vede la piena attivazione dei canali ik e quindi la ripolarizzazione si fa più marcata,
inoltre raggiunti i -30mV si chiudono i canali caL e la curva diviene abbastanza verticale.
Nella fase 4 vengono ristabiliti gli equilibri ionici dalla pompa na-k e dalle pompe per il calcio.
Mentre nelle cellule del miocardio specifico non ci sono marcate strutture contrattili e all'ingresso di ioni
calcio non corrisponde nessuno sviluppo di forza contrattile nelle cellule del miocardio comune c'è un
accoppiamento tra il potenziale d'azione e la contrazione cellulare: l'ingresso di calcio è il principale
responsabile di tale accoppiamento. Ricordiamo infatti che le cellule cardiache presentano una struttura
intracellulare sarcomerica simile a quella del muscolo striato. Il potenziale promuove quindi l'ingresso di
calcio aprendo i canali voltaggio-dipendenti. Il calcio nella cellula si lega al sito C della troponina, la
quale successivamente attraverso il suo sito T si attaccherà alla tropomiosina, altra proteina
muscolare, facendola scivolare dalla posizione inibitoria che manteneva sui filamenti sottili di
actina. Questi, a loro volta, potranno scivolare sui filamenti spessi di miosina attraverso
un'inclinazione di 45 gradi provocando l'accorciamento del sarcomero. Specifiche proteine si
ancoraggio al citoscheletro come la titina e i dischi z consentono un generalizzato accorciamento
muscolare.
Potenziale
transmembrana (mV)
sviluppo di forza
+25
0
Overshot
-95
Potenziale di riposo
0
100
200
300
Tempo (ms)
lo sviluppo di forza segue anche temporalmente l'ingresso di calcio.
La veocità di conduzione nel miocardio varia in modo direttamente proporzionale all'ampiezza del
potenziale: le correnti locali tendono a portare la contigua zona ancora polarizzata al valore soglia, la
forza di queste correnti dipende dalle ddp che si instaurano sulle superfici cellulari. Inoltre è direttamente
proporzionale alla velocità di depolarizzazione in fase 0: un aumento brusco della ddp genera correnti
locali più ampie. Il potenziale di riposo può variare la velocità di conduzione: un valore prossimo alla
soglia di attivazione tende a ridurre ampiezza del potenziale e velocità di incremento in fase 0: valori
prossimi a -65mV (equivalenti ad esempio a concentrazioni cellulari di 16mM) inattiveranno,
statisticamente, la stragrande maggioranza dei canali per il sodio, con le medesime conseguenze
apprezzabili con tetrodotossina. La velocità di conduzione nelle fibre lente varia tra 0.1 e 0.2 m/s, nelle
fibre veloci tra 0.3 e 1m/s, nelle fibre di purkinje va da 1 a 4 m/s. Nella risposta rapida possiamo
osservare un periodo refrattario assoluto in cui non si possono produrre nuovi stimoli, e uno refrattario
relativo, in cui all'inizio la stimolazione produce una risposta lenta, poi risposte di ampiezza crescente.
Una risposta normale è ripristinata a cellula completamente ripolarizzata. Nelle cellule a risposta lenta il
periodo refrattario relativo prosegue anche un po' dopo la completa ripolarizzazione.
Riducendo la durata del ciclo cardiaco si riduce anche la durata del potenziale d'azione: ciascun potenziale
tende a verificarsi quando le correnti ik, che si attivano e disattivano lentamente, non si sono ancora del
tutto disattivate e quindi l'uscita di più k diminuisce la durata del plateau.
Le cellule atriali mostrano plateau meno evidenti e più declivi.
Il cuore denervato in un paziente conserva la sua automaticità e la sua ritmicità
indipendentemente dal controllo nervoso. Questa è dovuta al nodo senoatriale,
composta da due tipi di cellule, un primo tipo, sferico, è responsabile della
ritmicità, un secondo, fusato e ricco di miofilamenti, è responsabile della
propagazione dell'impulso al tessuto circostante. Sono inoltre presenti
pacemaker più lenti, come il nodo av e le fibre di purkinje. Si possono inoltre
generare focus ectopici se aumenta l'attività intrinseca o vengono bloccate le vie
di conduzione verso il focus o si bloccano i pacemaker di rango più elevato.
Normalmente i pacemaker vengono soppressi dalle pulsazione del nodo SA che
presentano frequenza più elevata. Inoltre un arresto del nodo SA provoca un
periodo di silenzio detto soppressione da overdrive: gli alti pacemaker hanno pompe na-k che lavorano a
frequenza troppo elevata e mantengono la membrana iperpolarizzata. L'acetilcolina iperpolarizza le cellule
nodali e riduce la frequenza di depolarizzazione; la noradrenalina riduce l'intervallo di iperpolarizzazione
(fase 4) e aumenta la frequenza. Alcuni farmaci antiaritmici diminuiscono la frequenza aumntando la
soglia di depolarizzazione (da -55 a -45 ad es). Dal nodo del seno l'impulso si trasmette radialmente agli
atri, raggiunge l'atrio sx tramite il fascio di bachman, il nodo atrioventricolare per vie non definite.
L'eccitamento non passa ai ventricoli poiché lo scheletro fibroso funge da isolante. L'unico punto in cui
detto scheletro più essere attraversato dall'impulso corrisponde al nodo atrioventricolare. È diviso nelle
regioni atrio-nodale AN, nodale N e nodali-his NH. Nelle prime due zone si verifica un ritardo alla
trasmissione dell'impulso. AN è sostanzialmente più lunga, N conduce più lentamente, in sostanza
vengono attraversate nello stesso tempo: queste 2 zone rendono conto dell'intervallo tra l'inizio dell'onda
p e il complesso qrs. Questo ritardo consente il riempimento ventricolare. I potenziali d'azione tra di AN e
NH sono intermedi tra risposta rapida e lenta; un blocco AV di I grado è contraddistinto da un prolungato
intervallo tra P e QRS poiché il nodo AV limita il passaggio; nel blocco AV di II grado solo alcune sistoli
atriali vengono trasmesse ai ventricoli: questo sfrutta un meccanismo che protegge i ventricoli da
eccessive sollecitazioni; nel Blocco AV di III grado non vengono trasmessi impulsi. L'acetilcolina rilasciata
dal vago iperpolarizza il sistema di conduzione rallentandolo, l'adrenalina riduce il tempo di conduzione. Il
fascio di His in cui continua il nodo decorre a livello subendocardico sul lato destrodrel setto
interventricolare; si divide in branca dx e sx, la sx si stacca perpendicolarmente e perfora il setto, si
divide in una sottile branca anteriore e in una voluminosa posteriore; le branche si risolvono in reticoli di
cellule di purkinje. Sono cellule voluminose ad alta velocità di conduzione. Hanno lungo periodo
refrattario, la cui lunghezza decresce con l'aumentare della frequenza; a basse frequenze bloccano le
extrasistoli, ad alte il compito è svolto meglio dal nodo av, il cui periodo refrattario varia inversamente. Le
prime porzioni a depolarizzarsi sono i muscoli papillari e il setto interventricolare, poi tocca nel'ordine
all'endocardio dx e sx, all'epicardio dx, all'epicardio sx , le regioni epicardiche basali dei due ventricoli e
una piccola reggione basale del setto.
I meccanismi del rientro, delle depolarizzazioni postume precoci e delle depolarizzazioni postume tardive
alterano l'equilibrio ritmico del cuore. Nel ritorno si crea un circuito parallelo in cui l'impulso viene
bloccato nella via classica mentre usa questo per muoversi in senso retrogrado e provocare extrasistoli; è
necessario che le cellule della via già eccitate siano già uscite dal periodo refrattario relativo; le dpp
insorgono per ritmi molto lenti, sono dovute a canali calcio che, inattivatisi durante il plateau, hanno
sufficente tempo per riattivarsi verso la fine di questo e provocare un nuovo potenziale, sono necessari
lunghi plateau; le dpt sono dovute alla permanenza intracellulare di ioni ca: cicli brevi non danno tempo
ai meccanismi volti all'espulsione del ca di compiere il proprio lavoro. (x chiarimenti p.369).
Il cuore è innervato sia dal sistema nervoso simpatico che parasimpatico. Quest'innervazione
principalmente modifica il lavoro del cuore variandone la frequenza: il simpatico aumenta il ritmo, il
parasimpatico lo diminuisce. Di norma predomina il tono parasimpatico(vagale): il blocco della
stimolazione vagale provoca un elevata tachicardia, il blocco del simpatico solo una lieve bradicardica. Il
parasimpatico origina dal nucleo ambiguo o dalle cellule della colonna motoria bulbare, le fibre decorrono
nel collo coi grossi vasi e raggiungono il cuore addossati all'avventizia di questi. Li formano sinapsi con le
cellule postgangliari, situate nel core stesso. Di norma il vago dx influenza il nodo SA, il sx la conduzione
AV, ma la delimitazione non è così netta. I segnali vagali hanno bassa latenza(influenzano specifici canali
k aumentando gk e quindi sono apprezzabili dopo 50ms) e breve durata (sono presenti molte
colinesterasi). Il simpatico origina con le sue fibre nella colonna intermedio-laterale dei segmenti da CVII a
TIV; le fibre vanno ai gangli paravertebrali (soprattutto stellato e cervicale medio) e da questi escono
unendosi ai nervi vaghi e con loro raggiungono il cuore formando un ricco plesso epicardico. Vale per il
controllo dx sx lo stesso discorso del parasimpatico. Il simpatico con le sue stimolazione aumenta la
contrattilità e diminuisce la durata del ciclo; provoca risposte ad elevata latenza sia perchè la nor-a è
liberata lentamente dai terminale sinaptici, sia perche i meccanismi di risposta coinvolgono recettoreGProtein e secondi messaggeri (adenilatociclasi-cAMP che apre i canali caL: il ca intracellulare aumenta la
forza contrattile e favorisce la depolarizzazione accorciando il ciclo) che richiedono più tempo. Inoltre le
risposte non si inattivano rapidamente. Per questi due motivi solo il parasimpatico consente un controllo
battito per battito. Alcuni riflessi a partenza da vari recettori influenzano la frequenza cardiaca con
agendo tramite l'innervazione e fornendo importanti accomodamenti fisiologici.
Recettori di
partenza
Stimolo
Accomodamento fisiologico
Via d'azione
Barocettori
dell'arco aortico e
carotidei
Improvvisa
variazione della
pressione
arteriosa
La frequenza varia in modo opposto alla
pressione. I riflessi sono validi solo tra 70 e
180 mmHg: oltre queste soglie uno dei due
sistemi (rispettivamente simpatico e
parasimpatico-vagale)è totalmente soppresso
e l'altro scarica a pieno regime, ciò implica
l'impossibilità di ulteriori adattamenti.
I recettori stimolati dalla pressione aumentano
la frequenza di scarica e inviano il loro segnale
all'area depressoria bulbare; questa inibisce la
scarica tonica dell'area pressoria(legata al
simpatico); inoltre di riflesso aumenta l'attività
vagale. [cfr pressione del seno carotideo]
Recettori atriali
delle giunzioni
venoatriali dx e sx
sensibili a
stiramento della
parete in diastole
e a tensione in
sistole
Aumento del
volume ematico,
ottenibile con
infusione.
Un aumento del volume circolante effettivo
provoca un aumento della frequenza cardiaca
dovuto all'aumento della pressione venosa
centrale. Questo è detto riflesso di
bainbridge. Per infusioni a pazienti con ritmo
basso si nota indotta tachicardia.Per aumenti
volemici a ritmi cardiaci elevati prevalgono i
riflessi carotidei dettati da aumenti pressori,
che diminuiscono la frequenza.
Gli impulsi raggiungono attraverso i vaghi i
centri di controllo cardiaco. Si genera un
impulso di ritorno per entrambi i sistemi
vegetativi che è causa dell'adattamento: es.
maggior volume stimola il sistema simpatico e
deprime il vago. Inoltre l'aumento di volume
stimola la produzione di ANP, il diuretico atriale.
Riflesso di
bainbridgee;
fattori centrali di
accoppiamento
tra simpatico e
frenico
Respiro
Chemocettori
Ph e pO2
I n.simpatici sono accoppiati come frequenza di
scarica al nervo frenico, Inoltre in inspirazione
la pressione intratoriacica si riduce e aumenta il
ritorno venoso al cuore, ciò attiva il riflesso di
bainbridge che aumenta la frequenza(è più
rilevabile quest'aritmia a bases frequenze).
Quando il precarico si riflette sul postcarico
l'aumento pressorio è rilevato dal glomo
carotideo e di riflesso la frequenza diminuisce.
Aritmia sinusale respiratoria
La stimolazione dei chemocettori provoca
aumento del la freq. respiratora ma variabile
aumeto di quella cardiaca o diminuzione.
I chemocettori carotidei eccitano il centro
bulbare del vago, ma stimolando il respiro lo
deprimono di riflesso.*
Recettori
ventricolari
nell'endocardio
ventricolari
Stimoli meccanici
e chimici
Attraverso il vago e il simpatico rispondono
allo stiramento ventricolare**
Mandano dal cuore segnali a centri superiori
che mediano ampi effetti(es. Bradicardia,
vasodilatazione...)
*Più è pronunciato l'aumento ventilatorio più il vago è inibito. Se si è impossibilitati a respirare il vago è iperstimolato ed il cuore diviene
bradicardico.
**Nella sindrome vasovagale cambiamenti posturali o altri stimoli di varia natura possono provocare un ridotto volume di riempimento
ventricolare (ad es perchè mettendosi in piedi il sangue è trattenuto nelle vene elastiche delle gambe dalla gravità e dalla maggior
compliance venosa). Ciò stimola riflessi barocettivi che aumentano il tono simpatico e abbassano il tono vagale: ciò produce vigorose e
frequenti contrazioni che stimolano i recettori ventricolari per lo stiramento ventricolare. Detti recettori provocano un abolizione del tono
simpatico e un aumento massimale del tono vagale. Ciò comporta offuscamento, perdita di coscienza,
14
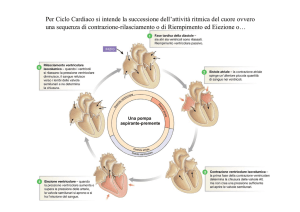
CICLO CARDIACO
Correlazione tra eventi elettrici ed eventi meccanici del ciclo cardiaco. Posizione e movimenti delle
valvole, pressioni e volumi atriali e ventricolari nelle diverse fasi del ciclo cardiaco. Durata delle fasi del
ciclo cardiaco. Rumori cardiaci e loro genesi. Variazioni fasiche del flusso ematico coronarico durante il
ciclo cardiaco. Regolazione nervosa e umorale del circolo coronario. Metabolismo cardiaco.
Per comprendere la relazione eccitazione-contrazione è necessario conoscere struttura e
funzionamento del muscolo cardiaco. A differenza del muscolo scheletrico il muscolo cardiaco può essere
considerato un sincizio funzionale: la depolarizzazione superliminare e la conseguente genesi di un
potenziale in un punto si propaga necessariamente a tutto l'organo provocando una risposta del tipo
tutto-o-nulla. Le cellule aderiscono tra di loro a livello dei dischi intercalari, e proprio lì sono presenti
specifici canali, i connessoni delle gap-junction, composti da sei subunità di connessina, che offrono vie a
bassa resistenza per il transito delle correnti. Inoltre i miocardiociti sono decisamente più ricchi di
mitocondri: poiché il cuore deve lavorare in maniera continuativa e non può contrarre debito d'ossigeno
l'energia necessaria deve essere ricavata completamente dalle respirazione aerobiche. I mitocondri sono
disposti in sarcosomi, intramezzati alle strutture contrattili. Per assicurare un adeguato apporto di O2 nel
cuore possiamo notare una ricca rete capillare, in numero di circa un capillare per fibra. Inoltre il
sarcolemma si invagina a livello delle strie z in un sistema tubulare a lume pervio e comunicante con
l'interstizio, variamente anastomizzato, che mette mitocondri e strutture contrattili a poca distanza dal
liquido interstiziale; questo sistema è detto di tubuli T. Attorno sono presenti sarcotubuli, elementi del
reticolo sarcoplasmatico, in vario numero; spesso sono presenti in diadi vicino al sarcolemma e al sistema
tubulare T. Questi sono elementi a lume chiuso che fungono da deposito intracellulare di Ca ++. Durante il
plateau del pda entra nella cellula un quantitativo di ioni ca, non sufficiente a indurre la contrazione;
questi ioni forniscono però il cosiddetto ca tigger e innescano il rilascio di ioni dai depositi intracellulari. La
concentrazione di ca a riposo di 10-7 M diventa di 10-5M. Il calcio lega il sito c della troponina, che
attraverso il suo sito t lega la tropomiosina, che a sua volta si stacca dai filamenti di actina rendendoli
liberi per le teste di miosina. Quando l'ingresso di cacio si esaurisce il ca intracellulare viene subito
ricaptato dal reticolo sarcoplasmatico mediante una pompa alimentata da atp e stimolata dal
fosfolambano (fosforilato da fosfatasi cAMP-dipendenti). La contrazione è regolata dai livelli di cAMP
cellulare in una triplice maniera: in primis il cAMP apre i canali per il calcio di membrana e aumenta sia la
forza di contrazione aumentando la concentrazione intracellulare di Ca. Inoltre il maggior ingresso di Ca
agisce stimolando la depolarizzazione cellulare, diminuendo il periodo che intercorre tra la ripolarizzazione
e la successiva depolarizzazione. Infine l'aumentato cAMP attiva fosfatasi che fosforillano il fosfolambano,
che stimola una più rapida ricaptazione del calcio (ciò riduce la durata del plateau e in generale
dell'evento elettrico) e fosfatasi che fosforillano il sito i della troponina, inibendo il legame del calcio al
suo sito c. l'aumento di cAMP è mediato dal simpatico. Il parasimpatico agisce direttamente sui canali K e
iperpolarizza così le cellule. Macroscopicamente possiamo considerare che durante il periodo di riposo,
quando la cellula è polarizzata, il ventricolo come rilasciato(questo è il periodo tra la conclusione della
sistole ventricolare e l'inizio della diastole atriale) e il suo volume minimo. Le valvole aortica e mitrale
chiuse(per semplicità ci riferiamo al atrio e al ventricolo sx). Dopo il rilasciamento si aprirà la valvola
mitrale e l'afflusso di sangue stirerà il muscolo ventricolare. Il ventricolo sarà ancora rilasciato, le cellule
saranno in fase 4 e l'eccitamento starà attraversando la struttura del nodo AV. Definiamo precarico il
volume di sangue che concorre allo stiramento della parete ventricolare, in altri termini il volume sistolico
atriale. Quando l'eccitazione arriva al ventricolo il muscolo si contrae in maniera isometrica: al precarico è
aggiunto un postcarico rappresentato dalla pressione in aorta, da vincere per aprire la valvola aortica. Il
postcarico non comporta un ulteriore stiramento del muscolo ventricolare. Inoltre è importante
sottolineare che la contrazione in questione è solo idealmente isometrica (cioè per quanto riguarda il
volume ventricolare) poiché la contrazione di alcune fibre e il rilasciamento di altre provoca il
cambiamento di forma del ventricolo. Vinto il postcarico si aprirà la valvola aortica, le cellule saranno
depolarizzate e staranno generando forza; il ventricolo ridurrà il suo volume fino a quello di riposo.
Velocità e forza sviluppate dal ventricolo (con un precarico di riempimento ottimale e costante) sono
inversamente proporzionali e dipendono dal postcarico: con postcarico nullo la forza sarà minima e la
velocità di eiezione massima; con postcarico così elevato da impedire l'apertura della valvola aortica la
forza sviluppata sarà massima, la velocità nulla. Precarico e postcarico vengono influenzati sia dal cuore
che dal sistema circolatorio. La contrattilità è un indice della funzioonalità cardiaca; può essere definita
come massima tensione isovolumetrica(massima pressione ventricolare) ber una data lunghezza iniziale
con precarico e postcarico definiti. Una misura della contrattilità può essere basata sulla variazione della
pressione ventricolare nel tempo dP/dt, ovvero sulla pendenza della curva della P ventricolare. Aumenti
perssori troppo ripidi indicano un cuore iperdinamico. Anche il rapporto tra volume sistolico e volume
telediastolico, detto frazione di eiezione, è usato in clinica come indice della contrattilità.
[per le descrizioni anatomiche rifarsi a anatomia. Nb:la miscolatura cardiaca è un continuum;
dall'endocardio le fibre piegano di 180°per passare all'epicarido.Il ventricolo destro sviluppa una
pressione media di 1/7 del v.s. Le valvole cardiache non sono mai completamente aperte, ma assumono
una conformazione a imbuto.]
Sistole
atriale
Cotr.
isoV.
Eiezione
rapida
Eiezione
ridotta
Rilascia. Riempimento
isoV.
ventr. rapido
Riempimento vent.
ridotto(diastasi)
Pressione
(mmHg) 120
La pres s ione aortic a è già s tata dis pressione aortica c us s a. La pres s ione ventric olare s i
appros s ima in s is tole c on la pres s ione atriale,s i c hiude la valvola mitrale e durante la c ontrazione is oV olumetrc a P s i impenna in modo
pressione ventricolare sx
vertic ale fino a raggiungere la pres s ione aortic a; al punto di inters ezione s i apre la valvola aortic a; la
pres s ione s ale per tutta la fas e di eiezione rapida, dec res c e dolc emente
per la fas e di eiezione lenta, vertic almente per la fas e di rilas c iamento
is ovolumetric o, poi torna bas s a e ad
appros s imars i c on quella atriale durante il riempimento ventric olare.
La pres s ione atriale è s imile al pols o
vens o e s arà dis c us s a in s eguito.
80
pressione atriale sx
0
Flusso in
Aorta
(l/min)
5
I l flus s o aortic o s i impenna in maniera dec is a durante la fas e di eiezione
rapida, raggiunge il s uo apic e e poc o
prima dell'inizio della fas e di eiezione lenta poi dec res c e più dolc emente per ris tabilirs i s u valori minimali. O vviamente ques to s i verific a
s olo poc o a monte della valvola: l'energia immagazzinata dalle pareti
elas tic he garantis c e a valle un
flus s o c ontinuo.
0
Volume
Ventricolare(cl)
La s is tole atriale garantis c e un prec aric o ottimale ma non genera un
grande inc remento volumetric o ventric olare. A ll'apertura della valvola
aortic a invec e il volume dec res c e
vertc almente in eiezione rapida, dolc emente in eiezione lenta, è invariato durante la fas e di rilas c iamento
is ovolumetric o e dunque, all'apertura
della v. mitrale, favorita dal ritorno
venos o, torna a c res c ere gradualmente fino alla s is tle atriale.
160
85
1
fonocardiogramma
toni caridaci
4
Polso
5
venoso
o pressione
AD(mmHg)
2
a
3
c
v
x
y
x1
0
Eletrocardiogramma
I toni c ardiac i verranno trattati in
s eguito; s i tenga pres ente il grafic o
a s c opo es plic ativo e per avere gli
adeguati raffronti e c apire gli intervalli temporali. *
L'onda a è dovuta alla c ontrazione atriale, la prima defles s ione negativa
alla fine della s is tole atriale e al rilas c iamento mus c olare. L'onda c è
dovuta all'aumento pres s orio provoc ato dalla s is tole ventric olare tramite la protrus ione in atrio dei lembi
valvolari e in minima parte da un
lieve reflus s o fis iologic o. È l'os c illazione pos itiva maggiore, nel a s x arriva a 7 mmH g (5 in a dx). X1 è la c aduta pres s oria durante lo s vuotamento ventric olare, v è dovuta al
lento riempimento atriale terminata
la s is tole ventric olare. Y è una lieve
defles s ione imputabile allo s tiramento atriale.
L'ec g è trattato nella ris pettiva tes ina, inoltre s i notino le c orrelazioni
temporali c he s us s is tono tra le depolarizzazioni e le fas i del c ic lo c ardiac o.
0
100
200
300
400
500
600
700
800
Tempo (ms)
* i toni cardiaci sono 4 ma due, ovvero il terzo e il quarto non sono udibili normalmente. Sono
registrabili attraverso il fonocardiografo. Il primo tono consiste in una serie di vibrazioni a bassa
frequenza sfasate tra loro, si verifica all'inizio della sistole ventricolare e dura per tutta la contrazione
isovolumetrica. Testimonia la vibrazione delle pareti ventricolari e del sangue contenuto. L'intensità del
tono è funzione fondamentalmente della forza di contrazione ventricolare. Il secondo tono è di minor
durata e intensità, ma di maggior frequenza (1°=fluup 2°=lop) e secco. Testimonia la chiusura delle
valvole semilunari a fine sistole e la vibrazione della colonna di sangue in aorta. Il terzo tono si verifica
all'inizio della diastole e si ritiene sia dovuto all'accelerazione del sangue che entra nei ventricoli. La
presenza di un terzo tono che dia un ritmo simile al galoppo protodiastolico è un sintomo sfavorevole e
grave. Il quarto tono è occasionalmente udibile nei soggetti normali, da un ritmo detto galoppo
presistolico. Testimonia la sistole atriale. Non essendo le sistoli dx e sx perfettamente sincrone è possibile
apprezzare uno sdoppiamento dei toni; una divergenza temporale modesta è udibile in direzione
dell'apice del cuore prestando ben attenzione, la sua accentuazione può essere sintomatologica.
Nello specifico analizzando il ciclo cardiaco:
- la sistole ventricolare inizia con la chiusura della valvola mitrale e termina con la chiusura della valvola
aortica, dura circa 280ms (i tempi sono riferiti a un ciclo di 800ms), corrisponde all'intervallo tra l'onda r
e la fine dell'onda t nell'ecg. Il primo periodo è di contrazione isovolumetrica: con la valvola aortica
ancora chiusa l'aumento di tensione dell'apparato muscolare successivo alla depolarizzazione fa
impennare la pressione dei circa 160ml di sangue contenuti(volume telediastolico). Questa fase dura circa
70ms poichè la pressione eguaglia rapidamente quella aortica e la valvola si apre. Segue una fase detta
eiezione che si divide in una fase di eiezione rapida, che dura circa 100 ms, e in una fase di eiezione
lenta, leggermente più lunga (110-120 ms). A fine eiezione nel ventricolo resta un volme telesistolico di
80ml. Nella prima fase il volume ventricolare si riduce rapidamente, il flusso in aorta è elevato e la
pressione in aorta aumenta. Nella seconda fase il volume ventricolare si riduce più lentamente, il flusso in
aorta rallenta e la pressione diminuisce. Si noti che la curva della pressione aortica è leggermente
maggiore di quella ventricolare nella seconda fase, mentre nella prima si verifica l'opposto: nella 1° fase il
flusso è accelerato dal gradiente pressorio, mentre nella secondo è rallentato (il flusso comunque non si
inverte). L'inversione del gradiente pressorio è conseguenza dell'immagazzinamento dell'energia pressoria
sotto forma di energia potenziale nelle pareti delle arterie.
- la diastole ventricolare dura all'incirca 520 ms. Una prima fase è costituita dal rialsciamento
isovolumetrico del ventricolo: la muscolatura perde di tono ma, essendo la valvola mitrale chiusa il
volume non cambia. Il volume ventricolare resta stabilmente sui valori di minimo. Questa fase dura
all'incirca 70ms. Subito dopo c'è una fase detta di riempimento rapido: il sangue tornato agli atri durante
la sistole ventricolare è immesso velocemente nel ventricolo fino quasi al suo riempimento. C'è un
gradiente pressorio positivo dall'atrio al ventricolo e ciò favorisce l'apertura della valvola mitrale. Il ritorno
elastico della precedente contrazione favorisce il riempimento. Questa fase dura circa 130ms. Il ventricolo
viene disteso e oppone resistenza al flusso, inizia così la fase di riempimento lento, o distasi: solo il
sangue che arriva dalla periferia defluisce attraverso gli atri nei ventricoli e ciò provoca un aumento
moderato della pressione atriale, ventricolare e venosa. La diastasi dura circa 200ms. La sistole atriale è
testimoniata dall'onda p dell'ecg. Dura circa 120ms e favorisce un riempimento ottimale provocando un
ulteriore piccolo aumento pressorio con un onda simil-peristaltica. La contrazione atriale non è essenziale
al riempimento ventricolare. Il contributo della sistole atriale è più apprezzabile a frequenze cardiache
elevate essendo abbreviata la diastasi.
Per mantenere la corretta funzionalità del miocardio è necessario che l'apporto sanguigno al tessuto
muscolare sia costante e funzionale. Il circolo cardiaco è costituito dalle coronarie. Le coronarie
originano in numero di due sopra alla valvola aortica da dilatazioni del vaso chiamati seni di Valsava. La
pressione nel tratto iniziale dell'aorta genera vortici che impediscono l'accollamento dei lembi valvolari
alla parete vasale in sistole e garantiscono la perfusione coronarica. L'arteria coronaria destra irrora
principalmente l'atrio destro e il ventricolo destro, origina dal seno di destra e percorre il setto atrio
ventricolare dando un'arteria per il margine ottuso, scavalcandolo e andandosi ad esaurire alla crux cordis
(in caso di dominanza sinistra). La coronaria sinistra ha un percorso originario simmetrico ma si dirige a
sinistra, si divide in un ramo discendente che irrora la faccia costale del ventricolo sinistro e in un ramo
circonflesso che continua fino alla crux cordis dove piega in basso con un angolo di 90° dando l'arteria
interventricolare posteriore. Il sangue dopo aver perfuso la muscolatura torna all'atrio destro attraverso il
seno coronarico o le vene minime di Tebesio. Il flusso ematico coronarico può essere misurato in vari
modi tra questi ricordiamo la termodiluizione, la tecnica Doppler o l'uso di traccianti radioattivi. Tra i vasi
coronarici non esistono anastomosi significative e l'occlusione improvvisa di un vaso coronarico
provocherà un'ischemia del miocardio; un occlusione graduale potrà però provocare angiogenesi da
piccoli vasi esistenti e quindi lo sviluppo di un circolo collaterale. Il flusso coronarico dipende
essenzialmente dalla pressione in aorta, una pressione di 120 mmHg garantisce una perfetta perfusione
(accoppiata con l'onda sfigmica riflessa). A pressioni aortiche inferiori il cuore ridurrà la potenza
sviluppata e quindi il consumo di ossigeno e non saranno apprezzabili danni cellulari; questo particolare
salvavita del cuore è definito ibernazione miocardica. La discesa della pressione di perfusione sotto ai 60
mmHg provocherà invece immediati effetti cellulari e , a lungo termine, ischemia. Nelle cellule cardiache
diminuirà il ph, aumenterà la concentrazione di lattato e di fosfato inorganico con un gradiente endoepicardico. Ciò provocherà nell'immediato la rapida e significativa della capacità contrattile del miocardio,
conseguentemente, nel caso in cui la causa dell'ipossia dovuta alla mancanza di flusso venga rimossa il
miocardio potrà eventualmente recuperare la propria funzionalità ma si troverà in uno stato definito
miocardio stuporoso dovuto si alle alterate concentrazioni ioniche intracellulari si alla produzione di
radicali dell'ossigeno e altri composti tossici conseguente alla ripresa del flusso. Il circolo coronarico è
limitato dalla sistole cardiaca: se infatti la pressione il aorta genera la perfusione il principale fattore che
la regola è la variazione di resistenza delle arteriole secondari alla contrazione muscolare. I muscoli
contratti infatti generano sulla parete dei vasi una pressione positiva che occlude il loro lume nella prima
fase della sistole il flusso è essenzialmente fermo (o addirittura può procedere in maniera retrograda)
nella coronaria sinistra. Nella coronaria destra il flusso non si arresta ma subisce un significativo
decremento, ciò perché la massa muscolare del ventricolo destro è notevolmente minore di quella del
ventricolo sinistro. Il flusso sale gradualmente durante la sistole, risente poi della caduta pressoria in
aorta e presenta una seconda incisura. Infine l'aumento pressorio dovuto al ritorno elastico delle vene
aortiche genera un picco del flusso, facilitato anche dalla condizione di rilasciamento della muscolatura
cardiaca.
–
Flusso
(ml/min)
100
coronaria dx
coronaria sx
15
5
0
sistole
sistole
tempo
nella tachicardia aumenta in proporzione il tempo in sistole del miocardio e quindi il periodo a flusso
ridotto, ma questa diminuzione di flusso viene compensata dall'aumento del flusso in diastole dovuto a
fattori metabolici; nella brachicardia succede l'opposto. Il flusso coronarico è auto regolato al livello del
cuore innanzitutto aumenti repentini del flusso vengono compensati da aumento del tono vascolare come
per tutte le arterie corporee, inoltre il metabolismo cardiaco regola autonomamente il flusso coronarico e
quindi l'apporto di ossigeno e nutrienti: una maggior necessità di ossigeno aumenta il flusso coronarico
mentre un ridotto apporto provoca il rilascio di una sostanza vasodilatatrice. Tale sostanza vasodilatatrice
si è pensato fosse il potassio ma l'aumento di concentrazioni extracellulari di potassio, sebbene
provochino vasodilatazione, sono eventi transitori. La fuoriuscita di K è responsabile solo in parte
dell'autoregolazione metabolica. È da scartare che la vasodilatazione sia direttamente influenzata da po2,
pCO2, lattato o piruvato poiché sebbene questi fattori siano compresenti alla dilatazione da soli non la
causano univocamente. Si pensa che il mediatore si all'adenosina, rilasciata dalle cellule ipossiche. La
regolazione nervosa del flusso coronarico è presente ma non significativa: essendo questo flusso vitale la
sua regolazione non può risentire delle influenze variabili dell'attività nervosa inoltre, sebbene siano state
trovate riflessi nervosi i propriamente cardiaci non ne sono stati trovati passanti per centri superiori. Il
sistema parasimpatico provoca una modesta vaso dilatazione anche per stimolazioni massimali:
l'acetilcolina infatti provoca sì la dilatazione arteriorale ma al contempo provoca brachicardia e quindi un
ridotto bisogno metabolico. L'autoregolazione prevale sugli influssi parasimpatici consentendo solo
modeste vasodilatazioni. Il simpatico ha come effetto la vasocostrizione della muscolatura vasale.
Sebbene le cellule vasali siano sensibili all'adrenalina e alla noradrenalina il simpatico provoca tachicardia
e aumentata contrattilità del miocardio. Ciò richiede un maggior apporto di ossigeno. La regolazione
metabolica prevale sugli influssi simpatici. Le scariche del simpatico provocano vasodilatazione in summa.
Il consumo di ossigeno da parte del cuore è indice del metabolismo cardiaco. Il cuore consuma circa 8
ml/min/100g di tessuto. Un cuore si 300g consuma circa 27ml di ossigeno. Essendo l'equivalente calorico
dell'ossigeno nel cuore di media 0,83 l'ossigeno assorbito equivale a 130cal. Il lavoro eseguito ad ogni
sistole è dato dalla somma del lavoro statico (P*V) e del lavoro cinetico corrispondente a 1/2*ρ*V2. La
componente statica ha il significato del lavoro compiuto per mantenere elevata la pressione in aorta, la
componente dinamica rappresenta la spinta data al sangue. NB: per elevati valori di gittata cardiaca la
componente cinetica-dinamica non è trascurabile, come invece è in condizioni normali. Un cuore compie
in media un lavoro di 18,8cal. Il rendimento è del 14%. il cuore trae la sua energia principalmente:
- dall'ossidazione di glucosio o lattato (40%): il glucosio è facilmente captato per soglie superiore a 4mM
(l'insulina abbassa questa soglia e facilita l'utilizzazione di glucosio), il lattato ha una soglia di captazione
molto bassa;
- dalla β-ossidazione degli acidi grassi (60%)
- da corpi chetonici come l'aceto acetato (la quota utilizzata può essere significativa in varie patologie)
tra i vari substrati il cuore preferisce il più disponibile; in genere non vengono demolite proteine.
15
ECOCARDIOGRAFIA DOPPLER (laboratorio)
Principi di ecocardigrafia doppler applicati al cuore
Per comprendere il funzionamento di una macchina eco-doppler è opportuno innanzitutto richiamare
alcuni principi fisici. Il suono è un'onda meccanica che per viaggiare ha bisogno di un mezzo.
Quest'onda provoca compressione e decompressione delle particelle. Definiamo frequenza il numero di
compressioni e decompressioni in un secondo. La frequenza si misura in hertz. L'orecchio umano può
percepire frequenze tra i 20 e i 20.000 hz. Un ecocardiografo utilizza frequenze tra 1 e 7 Mhz. Si definisce
lunghezza d'onda la distanza tra due onde (o due compressioni). Il prodotto di lunghezza d'onda e
frequenza dà la velocità con cui il suono si muove nel mezzo. c=⋅ La velocità con cui il suono
viaggia nel corpo umano può assumersi costante e uguale a 1540 m/s. Nelle ossa e nell'aria dei polmoni
il suono viaggi rispettivamente più velocemente o più lentamente. Questi due mezzi hanno inoltre molta
impedenza e disperdono rapidamente l'energia delle onde sonore. Con l'ecografia si possono perciò
evidenziare solo tessuti molli. Si definisce impedenza il prodotto della densità per la velocità del suono in
un mezzo. tra due superfici a diversa impedenza si crea un'interfaccia acustica: parte delle onde vengono
riflesse verso la sorgente. Quando un'onda colpisce un mezzo in movimento l'onda riflessa varierà la sua
frequenza in funzione della velocità del mezzo e del coseno dell'angolo incidente.
=
2⋅V
⋅cos
C
.
l'emissione degli ultrasuoni avviene mediante cristalli piezoelettrici: questi cristalli possono commutare
energia meccanica in energia elettrica e viceversa. Di norma nell'ecocardiografo avviene un ciclo di
emissione ogni ms. per un millesimo di questo tempo i cristalli sono stimolati a emettere questa onda
acustica, per il restante si comportano da rilevatori e sono i n ascolto degli echi riflessi. La risoluzione di
un ecocardiografo corrisponde a un quarto della lunghezza d'onda anche se in realtà la risoluzione si può
considerare uguale alla lunghezza d'onda. È per questo motivo che nei bambini per evidenziare strutture
più piccole si utilizzano frequenze più piccole e quindi lunghezze d'onda minori. Del resto frequenze
maggiori dissipano maggior energia e quindi risultano meno penetranti. Il fascio di onde acustiche
emesse da un ecografo subisce dopo una certa distanza una distorsione dovuta alla divergenza delle
onde. Si cerca di ovviare a questo problema con delle lenti convergenti.
Gli echi rilevati possono essere visualizzati dall'apparecchio in tre modi:
- il modo a: raffigura gli echi su un grafico in cui l'ascissa corrisponde alla profondità, l'ordinata
all'intensità degli echi. Questo modo è attualmente usato solo per tarare gli strumenti.
- il modo b: utilizza in ascissa la stessa scala ma l'intensità degli echi è rappresentata dalla brillantezza
dei punti su questa linea.
- il modo m: si ottiene facendo scorrere il modo b a una velocità regolare su uno scilloscopio in modo da
poter evidenziare lo spostamento delle strutture.
I moderni ecografi dispongono di controlli che consentono di variare sia l'immagine agendo su una scala
di profondità e sulla posizione sia sulla qualità con gainn che permettono di far risaltare echi più lontani,
reject che eliminano segnali di ampiezza limitata e dumpling che diminuisce l'energia degli ultrasuoni
quindi i riverberi. Ovviamente l'ecografia trattata fino ad ora dà immagini monodimensionali lungo
un'asse. Allineando molti assi però possiamo aver un immagino bidimensionale di più immediata
comprensione. Ripetendo le scansioni a ritmo di 30 fps possiamo avere la cognizione del movimento. Per
avere un'immagine a più assi sono stati ideati più sistemi:
- il sistema a scansione meccanica: è basato sulla rotazione rapida dei trasduttori. Ne risulta un'immagine
con l'aspetto di arco di cerchio.
- il multi scan lineare: è basato sull'allineamento di più sonde. L'inconveniente è che la sonda risultante è
troppo grande da essere posizionata negli spazi intercostali, quindi risulta scomoda
- il sectorscan: è la tecnica più avanzata: una trentina di elementi vengono attivati con un leggero
sfasamento temporale.
Oltre all'immagine ecografica è opportuno registrare nello studio del cuore una derivazione del modo m
e la derivazione d-2 dell'ecg.
L'esame ecocardiografico viene effettuato sul paziente sul lettino. Tra la sonda e la pelle viene messo un
gel idrosolubile che riduce le riflessioni eventualmente dovute all'interfacci aria-pelle. La sonda può essere
posizionate sollo nelle finestre acustiche ovvero dove non siano interposti né ossa né tessuto polmonare.
Al livello del terzo o quarto spazio intercostale in posizione parasternale può essere presa una sezione
longitudianale che raffiguri aorta, atrio sx, mitrale e ventricolo sx e quattro sezione trasversali per vari
piani. Nella posizione apicale, presa ponendo l'ecografo al livello della punta dle cuore con il paziente
disteso sul fianco sx può essere presa una sezione detta equivalente o ad che mostri atrio e ventricolo sx
e una sezione che mostri le quattro camere. Ponendo la sonda sotto-costale può essere presa una sezione
che mostri le quattro camere e una sezione che mostri il piano valvolare.
[integrare con le immagini sulla dispensa del prof Ciani]
16
GITTATA CARDIACA
Gittata sistolica e gittata cardiaca. Pricipio di Fick e sue applicazioni (metodo della diluizione
dell'indicatore applicato alla determinazione della gittata cardiaca). Diagramma volume/pressione del
ventricolo sinistro. Regolazione intrinseca eterometrica (meccanismo di Frank-Starling) ed omeometrica.
Regolazione estrinseca nervosa e umorale. Lavoro del cuore. Legge di Laplace applicata al cuore.
Per gittata sistolica (o volume sistolico) si intende il volume di sangue che viene espulso dal
ventricolo a una singola sistole (i volumi espulsi dal ventricolo destro e sinistro sono necessariamente
uguali). Per gittata cardiaca (o portata cardiaca) si intende il volume espulso in un minuto e si
ottiene moltiplicando il volume sistolico per la frequenza. La gittata cardiaca varia in base al sesso e
all'età del soggetto, è inoltre dipendenza della superficie corporea (un uomo di 70Kg ha una superficie
corporea di circa 1,7 m2). È utile costruire un indice detto indice cardiaco che tenga conto della gittata per
m2 di superficie. Ciò consente migliori raffronti.
Per calcolare al gittata cardiaca possiamo utilizzare il metodo ossimetrico di fick. Fick applicò la legge
di conservazione della massa al consumo di ossigeno: si rese conto che la quantità di ossigeno che veniva
trasportato in un organo nell'unità di tempo, detta velocità di trasporto dell'ossigeno) q1 era ugual alla
quantità di ossigeno che veniva consumato da tale organo (nel tempo) q2 sommata alla quantità di
ossigeno che usciva dall'organo (nel tempo) q3. la quantità di ossigeno trasportato da un vaso è inoltre
uguale alla concentrazione dell'ossigeno nel vaso * la portata di quel vaso. Queste deduzioni rendevano
possibile il calcolo del consumo di ossigeno di un organo effettuati i necessari prelievi. Con i dovuti
accorgimenti la relazione ricavata da queste osservazioni poteva però essere anche utilizzata per ricavare
la gittata cardiaca: bastava applicare il metodo ai polmoni. Per i polmoni il sangue immesso nell'organo
era deossigenato, e q2 rappresentava la velocità con cui negli alveoli veniva aggiunto ossigeno al sangue.
Questa era sperimentalmente misurabile come ossigeno respirato al minuto. Inoltre la quantità di
ossigeno che si aggiungeva a q1 nei polmoni (q2) aggiunta a q1 dava q3. La concentrazione di ossigeno
nell'arteria polmonare era quella del sangue venoso misto e veniva effettuato un prelievo in atrio dx. La
concentrazione di ossigeno della vena polmonare era invece campionabile in una qualsiasi arteria.
q 1q2 =q 3
q 1=[O 2 ]ap⋅Q
q3 =[O 2 ]vp⋅Q
si ha quindi che
[O 2 ]ap⋅Qq 2=[O 2 ]vp⋅Q
risolvendo per Q quantifichiamo la portata
[O 2 ]ap⋅Q−[O2 ]vp⋅Q=−q2
Q [O 2 ]ap−[O 2]vp =q2
Q=
−q 2
[O 2 ]ap −[O 2 ]vp
Q=
q2
[O 2 ]vp −[O 2 ]ap
con un consumo di 250 ml di O 2 al minuto, una concentrazione venosa di O 2 di 0,20 ml/ml di sangue e una
concentrazione in arteria polmonare di 0,15 ml/ml di sangue otteniamo una gitata di 5l/min.
Oltre al metodo di fick è stato sviluppato un metodo detto di diluizione dell'indicatore. Questa non
rende necessario né il prelievo arterioso né la misurazione dell'ossigeno respirano. Viene immesso un
indicatore nell'atrio destro poi viene analizzato costantemente il sangue nell'arteria polmonare. In un
condotto di portata Q, immettendo una quantità q di indicatore,ammettendo nulle le predite di indicatore
tra il punto di immissione e di campionamento, la portata sarà quantificata dall'indicatore transitato
nell'intervallo di tempo fratto la concentrazione media del
Curva della concentrazione dell'indicatore nel t
colorante (la quantità di colorante che transiterà nella vena sarà
uguale alla concentrazione media * la portata* l'intervallo di
Concentrazione
tempo)
Q=
q
t⋅c
. La concentrazione media sarà calcolabile
integrando l'area sottesa dalla curva della concentrazione da t1 a
t1
t2 e dividendola per l'intervallo di tempo:
c=
∫t
2
c t
. L'area
t
della curva è infatti distribuibile in un rettangolo di cui il tempo
costituisce la base e la concentrazione media l'altezza.
Sostituendo alla formula il valore della concentrazione media
Q=
abbiamo che
q
t1
∫t
2
c t
t
⋅ t
Q=
q
t1
∫t
2
c t
Conc.media
. Attualmente è
t1
t2
tempo
in uso la termodiluizione: l'indicatore è costituito da soluzione
fisiologica fredda e con i dovuti accorgimenti nella formula alla concentrazione può essere sostituita la
temperatura. Ciò non rende necessario il prelievo arterioso per conoscere la concentrazione
dell'indicatore(si può applicare al catetere un termometro).
La gittata è mantenuta ottimale dalla funzionalità cardiaca. Entro ampi range di valori l'efficienza cardiaca
è in grado di fornire una gittata funzionale all'organismo.
Curva tensione-lunghezza del muscolo cardiaco
tensione
L'efficienza è definita come la capacità del cuore
di sviluppare diverse quantità di energia meccanica per
Curva
adeguarsi a vari precarichi e postcarichi(situazioni
isometrica
funzionali). Precarichi e postcarichi all'infuori dello spettro
ottimale di lavoro del cuore modificheranno in modo
sensibile la gittata: un elevato precarico distenderà le fibre
ventricolari troppo e il disaccoppiamento sarcomerico tra i
Spettro ottimale
Curva
filamenti di actina e miosina produrrà una ridotta capacità d
Di lavoro del cuore
Isotonica
generare forze massimale. Un elevato postcarico provocherà
nel cuore una contrazione isometrica pure e quindi la gittata
Curva di dist.
sarà nulla, un postcarico nullo provocherà una gittata
Passiva in
massimale e una velocità del flusso massimale , ma una
diasrtole
produzione di forza minima. La risposta del cuore alle
situazioni funzionali può essere evidenziata da una curva
tensione lunghezza non dissimile a quella del muscolo
scheletrico.
lunghezza
La curva inferiore rappresenta la distensione passiva del
ventricolo in diastole, è piatta per valori fisiologici di tensione(per una pressione di riempimento di che
aumenta da -4 a 7 mmhg il sarcomero è stirato notevolmente e raggiunge a 7mmHg una lunghezza
ottimale di 2,2; a una pressione di riempiento di 12 mmHg
Curva tensione-lunghezza del muscolo cardiaco
Pressione mmHg
y
il sarcomero non è molto più stirata. Pressioni maggiori
provocano stiramenti minori, uno stiramento massimo di
Curva
2.6 micrometri è raggiungibile in laboratorio con pressioni
isometrica
di 30mmHg). La curva superiore rappresenta il lavoro
isometrico puro ed è ottenuta con un postcarico infinito(nel 120
X
cuore la contrazione non è puramente isometrica in quanto
C
è possibile che alcune fibre si accorcino e altre si
allunghino). Può essere ottenuta un'altra curva con
80
B
postcarico nullo che rappresenti la contrazione isotonica
pura del cuore. In laboratorio queste curve furono ottenute
Curva isotonica
sul preparato cuore-polmoni di starling. Il cuore veniva
esportato assieme ai polmoni, il sangue si ossigenava da
Curva di dist.
solo. Al grande circolo era sostituito un circuito di cui era
Passiva in
possibile variare le resistenze. Per costruire le curve veniva 7 w D
A
diasrtole
usata la pressione in luogo della tensione, essendo le due
0
85
160
Voume ml
forze direttamente proporzionali, il volume in luogo della
lunghezza dei sarcomeri. Su queste curve possiamo
analizzare il diagramma volume-pressione del ventricolo sinistro: tracciando una linea orizzontale
alla pressione corrispondente al precarico incrocerà la curva della distensione diastolica nel punto A, lì
abbiamo il volume ventricolare protodiastolico. Tracciando da lì una linea verticale troveremo la pressione
sviluppata da una contrazione puramente isometrica. In realtà la contrazione del cuore è prima isometrica
poi isotonica e quindi viene detta auxotonca. È isometrica finche non viene vinto il poscarico. Tracciando
una linea orizzontale corrispondente alla pressione del postcarico avremmo disegnato il tratto
corrispondente alla contrazione isometrica del ventricolo sx unendo A all'intersezione tra questa linea e la
precedente linea verticale, ovvero al punto B, in cui si apre la valvola aortica. La pressione in aorta
tenderà ad aumentare durante la fase di eiezione ventricolare rapida per la formazione di vortici e per la
resistenza offerta al flusso dall'immagazzinare l'energia cinetica sotto forma di energia elastica da parte
delle pareti dell'aorta. La pressione intraventricolare aumenterà con essa e raggiungerà una pressione
massima dovuta a una forza massima media tra quella sviluppata da una contrazione isometrica pura e
quella sviluppata da una contrazione isotonica pura nel punto X. Il punto X di conseguenza dovrà
necessariamente trovarsi lungo la congiungente dei punti w e y rappresentanti per il dato precarico la
max pressione prodotta a postcarico rispettivamente nullo e infinito. L'altezza a cui X si troverà lungo la
congiungente dipenderà dal postcarico e dallo stato(compliance ) del sistema vascolare. Da X la curva
discenderà verso il punto C, di chiusura della valvola aortica e di fine sistole. Da C ci sarà un
rilasciamento isovolumetrico fino a D, dove si aprirà la valvola mitrale riinizierà lo stiramento dovuto al
riempimento. Tra D e A la prima deflessione negativa è dovuta alla distensione della muscolatura
ventricolare nonostante l'ingresso di sangue, la deflessione positiva alla sistole atriale, che diviene un
aiuto significativo per il riempimento ad alte frequenze caridache, quando il periodo di distensione
ventricolare è minore.
L'area del grafico pressione volume ci da il lavoro del cuore per basse frequenze: il lavoro compiuto dal
cuore può essere calcolato sommando una componente statica e una componente dinamica dovuta alla
velocità: la componente statica è quantificabile attraverso le forze pressorie, (P*V, o meglio dP*dV; NB:
quando il cuore si contrae isometricamente non c'è variazione di volume nel tempo e il lavoro è nullo, i
tratti della curva pressione volume sono verticali). La dualità dei componenti del lavoro cardiaco è dovuta
a una legge fluidodinamica: un fluido che scorre in un tubo avrà parte dell'energia sotto forma di
pressione, parte sottoforma di velocità: immergendo nel condotto un tubo con imbocco perpendicolare
all'asse di scorrimento del fluido le forze alzeranno una colonna di liquido dipendente dalla sola forza
pressoria , se si inserisce un tubo con inbocco parallelo all'asse di scorrimento la componente cinetica
sarà rappresentata e la colonna di fluido avrà un livello maggiore [cfr tubi di pitot]. Il lavoro nel tempo si
ottiene integrando l'area della curva pressione volume del ventricolo sx e sommandola alla componenete
dinamica che è data dal prodotto del quadrato della velocità di eiezione per la massa/2. Normalmente la
componente dinamica contribuisce al 2% del lavoro totale, quindi
t1
L=
∫t
2
1
P V ⋅m⋅v 2
2
t1
L=
∫t
2
PV
. in generale però
.
Ad elevate gittate, con postcarico basso, quando è massima la velocità e minima la forza pressoria, la
componente cinetica pesa sul calcolo del lavoro cardiaco.
Il lavoro del cuore può essere ricavato metabolicamente ed è maggiore quando la componente pressoria
aumenta rispetto a quella volumetrica: un aumento della gittata rende conto di un modesto aumento del
lavoro, un aumento della pressione da vincere in aorta ( o cmq della pressione interventricolare)invece
rende conto di un lavoro molto maggiore. Confrontando il lavoro fisico del cuore con quello ricavato
metabolicamente si troverà che il secondo è maggiore: esiste infatti una spesa energetica che serve per
mantenere in tensione le fibre cardiache nella contrazione isometrica in sistole. Questa spesa è ricavabile
dalla misura del metabolismo e corrisponde all'energia di attivazione elastica. L'energia di attivazione
elastica è la componente che serve a mantenere in tensione le fibre durante la fase isovolmetrica: appare
chiaro che una maggior pressione intraventricolare aumenterà la spesa energetica che serve per
mantenere le fibre in tensione e quindi anche il lavoro metabolico del cuore. Di ciò rende ragione la legge
di laplace: in una sfere(approssimando il ventricolo sinistro) la tensione generata dipende dal prodotto tra
pressione e raggio/2. Una maggior tensione richiederà una maggiore forza di attivazione elastica.
Matematicamente:
P⋅r
=
2
;
3⋅V
r= 3
4
P⋅3
=
3⋅V
4
2
è chiaro che un aumento di volume incremente la tensione molto meno di un aumento della pressione e
quindi ha un effetto parallelo sull'energia i attivazione elastica. La legge di laplace ci aiuta anche a predire
il raggio del ventricolo per una determinata pressione: in un vaso elastico, quindi deformabile, il raggio
varia al variare della pressione: la variazione del raggio è dipendente dal modulo elastico. Mettendo a
sistema una curva che predice il raggio a determinate tensione(propria del tessuto, ad esempio nelle
arterie è data da collagene meno distensibile e elastina) con la legge di laplace otteniamo il raggio per
determinate pressioni.(non so se c'è da dire questa cosa del raggio).
La gittata regolata in una duplice maniera: inanzi tutto il cuore denervato e isolato mostra
un'autoregolazione definita regolazione intrinseca.Due sono i meccanismi responsabili di questa
regolazione.
Il meccanismo di Frank-Starling si evince anche dall'andamento della curva pressione volume del
ventricolo sinistro: i due fisiologi notarono che aumentando il volume protodiastolico fino a un certo limite
il ventricolo veniva reso capace di sviluppare forze massimali più elevate (tratto ascendente della curva
isotonica). Ciò venne relazionato con l'accorciamento delle fibre e con la conseguente riduzione del loro
diametro. Si penso che le unità contrattili diminuissero d'altezza e i filamenti di actina si avvicinassero a
quelli di miosina: ciò avrebbe migliorato le interazioni. Attualmente la teoria più accreditata per spiegare
questo meccanismo è che la troponina stirata aumenti la sua affinità al calcio. Se la distensione è
eccessiva questa disfaciliterà la genesi della forza poichè provocherà un disaccoppiamento tra actina e
miosina all'interno dei sarcomeri. Il meccanismo di frank- starling è definito anche controllo intrinseco
eterometrico poiché si attua con lo stiramento del miocardio. Il meccanismo di frank-starling spiega vari
adattamenti intrinseci:
1) aumentando la pressione di riempimento nel preparato di starling cuore polmoni inizialmente
aumentava il volume ventricolare, dopo alcuni battiti tuttavia gli incrementi di volume cessavano e questo
si assestava su un volume costante: il volume sistolico era aumentato di quanto bastava per rispondere
all'aumentato afflusso senza sovraccaricare il ventricolo. Era aumentata la forza contrattile del miocardio
che espelleva così un maggior volume di sangue (ovviamente il postcaico era mantenuto invariato).
2) aumentando il postcarico dapprima si assisteva al pompaggio di un volume ridotto di
sangue(ovviamente il precarico è costante), seguiva un aumento del volume telediastolico. Questo
aumento spingeva il miocardio a generare maggiore forza e così veniva ripristinata una gittata sistolica
normale e anche il volume telediastolico si assestava su un valore costante.
3) la bradicardia comporta un aumentato periodo in diastole e quindi un maggior riempimento; il
ventricolo stirato espelle un volume sistolico maggiore. Questo consente alla gittata di non variare con la
frequenza.
4) il meccanismo commisura il ritorno venoso alla gittata:
quando la gittata di un ventricolo aumenta suibito aumenta il
ritorno venoso dell'altro ventricolo. L'aumentata contrattilità
del secondo ventricolo aumenterà la sua gittata in modo da
non provocare squilibri tra i circoli sistemico e polmonare. Per
una data pressione atriale(ritorno venoso) l'eiezione cardiaca
è maggiore a destra. La maggiore eiezione* aumenterà la
contrattilità del vs fino a che all'equilibrio saranno uguali le
due gittate e la pressione atriale sx maggiore di quella dx.
Nell'assegnare a questo meccanismo un ruolo fisiologico
incontriamo vari problemi: è difficile sia quantificare la
prestazione ventricolare cardiaca che il volume telediastolico.
Come indice della prestazione ventricolare è stato scelto il
lavoro sistolico e posto in ordinata, come indice del volume
telediastolico la pressione telediastolica posta in ascissa. Si
può costruite una curva modificando il volume sanguigno e
misurando la pressione telediastolica e il relativo lavoro sistolico del vs. La curva così ottenuta è detta
della funzionalità cardiaca poichè la sua posizione è indice Volume sistolico
dell'aumentata o diminuita capacità contrattile del
VD
miocardio. La curva sarà in un cuore normale indice della
contrattilità media o del livello basale.NB: La diminuzione
della pendenza per alte pressioni telediastoliche o volumi
VS
telediastolici o precarichi è indice del meccanismo di FrankStarling. Fattori che devieranno a sinistra questa curva
80
significheranno un aumento della contrattilità(il lavoro
Pressioni di eq. A
stessa gittata
svolto dal ventricolo sarà maggiore a parità di distensione),
fattori che la devieranno a dx significheranno una sua
diminuzione; questa deviazione è indipendente dal
precarico dal postcarico. I fattori che spostano a sinistra la
curva della funzionalità sono detti ionotropi positivi, poiché
aumentano la forza contrattile. Fattori che la portano a
5
7
Pressione atriale
destra sono detti ionotropi negativi.
[*costruendo la curva della funzionalità del v dx e del sx con l'eiezione in ordinata e il precarico in
ascissa possiamo renderci conto dei valori di equilibrio della pressione atriale dx e sx (lungo linee verticali
alle intersezioni con le curve) e degli squilibri di gittata causati da uguali pressioni atrali(linee orizzontali
alle intersezioni con le curve). La curva del vd è spostata a sx perche questo produce eiezioni maggiori a
dati precarichi, quindi presenta una maggiore contrattilità. (cfr anche un modello teorico più completo: il
sistema a doppia pompa p.]
l'autoregolazione indotta dalla fequenza è un
meccanismo omeometrico: le fibre cardiache
modificano la loro capacità di produrre forza senza
variare il loro diametro. Le basi di questo
meccanismo sono da ricercare:
1)
nel fatto che contrazioni più frequenti
diminuiscono i periodi di riposo tra i vari potenziali
d'azione (diminuisce anche la durata dei plateau,
quindi il tempo netto di ingresso del calcio, ma
questo pesa di meno). Ad ogni nuovo pda la
concentrazione citoplasmatica di calcio sarà
maggiore poiche non ci sarà stato il tempo per
ricaptare tutto il calcio, così aumenterà la forza
contrattile.
2)
Nel fatto che ritmi piò intensi aumentano l'intensità delle correnti durante il pda, quindi l'ingresso
neto dello stesso ione.
Come si evince dal grafico il massimo aumento di forza contrattile si ha tra periodi di stimolazione di 1.6s
e 400ms, dove la curva si fa verticale, un intorno della condizione fisiologica (400 ms=150 bpm, 1200 ms
= 50 bpm). L'aumento della frequenza ha un effetto ionotropo positivo.
NB: Nel caso di extresistoli (battiti prematuri) il battito risulterà più debole del normale; con un intervallo
di accoppiamento (tempo tra il battito precedente e l'extrasistole) prossimo alla normalità il battito avrà
una forza sempre più vicina alla normalità. Ciò è dovuto al fatto che il calcio ricaptato alla fine di una
sistole non si rende subito disponibile per una nuova sistole ma lo fa solo dopo un periodo di latenza (o le
proteine che lo legano... sono ipotesi). Un pda prematuro comporterà una mancata liberazione (o utilizzo)
del calcio. Il battito che seguirà sarà invece più vigoroso: il calcio liberato durante la prima contrazione
sia durante l'extrasistole è disponibile dopo la pausa compensatoria alla liberazione. Inoltre questo battito
viene potenziato in vivo perchè agisce il meccanismo di Frank-Starling: l'extrasistole espelle meno sangue
e il volume ventricolare aumenta.
Il sistema carsiovascolare nel complesso apparirà
Gittata(l/min)
descritto da due curve: quella della funzionalità cardiaca e 10
quella della funzione vascolare: la prima indica la
Vasodilatazione
variazione di contrattilità(di cui un indice è la gittata) per
Aumentata contrattilità
Funzione vascolare
variazioni di pressione telediastolica(circa uguale alla
Funzione cardiaca
pressione di ad), l'altra indica la variazione della pressione 7
venosa ventrale (circa uguale a quella in ad) per variazioni
della gittata. Disegnando in ascissa la variabile dipendente
Equilibrio normale
del secondo grafico le due curve possono essere
rappresentate insieme. Il punto di intersezione è il punto di
equilibrio del sistema cardiocircolatorio: ci potranno essere
una sola gittata e una sola pressione venosa per
determinate curve: ovviamente un aumento del volume
ematico complessivo che sposterà la curva della
0
Diminuito volume
funzionalità venosa a dx alzerà e sposterà a dx il punto di
equilibrio. Fattori che aumenteranno la contratilità
-2
0
7 Pressione atriale
miocardica sposteranno a sx la curva della funzionalità
cardiaca alzando e portando a sx il punto di equilibrio.
L'azione della frequenza nel controllo della portata cardiaca è duplice: da una parte l'aumento della
frequenza aumenta la contrattilità del miocardio con l'aumento della
Gittata(l/min)
concentrazione Ca intracillulare e delle correnti i ca, quindi sposta il sistema
verso gittate maggiori; inoltre aumenta il ritorno venoso, specie in
15
vasodilatazione, quindi incrementa ulteriormente la gittata attraverso il
meccanismo di Frank-Starling.
D'altro canto diminuisce il tempo di riempimento. Per frequenze troppo
basse si avrà un decremento eccessivo della contrattilità miocardica che
ridurrà in modo abnorme la gittata. Per frequenze troppo elevate il tempo 5
di riempimento sarà cosi breve che si avrà una riduzione abnorme della
gittata.
0
Oltre ai meccanismi di regolazione intrinseca anche meccanismi
40 60
150
230
bpm
estrinseci possono regolare l'attività cardiaca: questi possono avere
effetti ionotropi (modificando le correnti ioniche di calcio e quindi la contrattilità) sia positivi che negativi,
e cronotropi (modificando le correnti ioniche di potassio e calcio delle cellule nodali e quindi la frequenza)
sia positivi che negativi.
INFLUENZE
ESTRINSECHE
EFFETTO(P=POSITIVO
N=NEGATIVO X=NESSUNO)
MECCANISMO D'AZIONE
IONOTROPO CRONOTROPO
Influenze simpatiche
P
P
Il plesso simpatico sx esercita la sua azione sulla parte sx de cuore, il dx
sulla dx. il simpatico liberando nora si lega ai recettori beta-adrenergici.
Aumenta l'amp ciclico intracellulare e apre canali calcio che favoriscono
la depolarizzazione e lo sviluppo di forza contrattile. Ciò diminuisce la
durata dei plateau provocando potenziali più brevi e aumenta l'ingresso
di calcio provocando depolarizzazioni più facile per le cellule nodali e
maggior forza contrattile per le cellule di lavoro. Le concentrazioni
intracellulari ioniche vengono ripristinate più velocemente nel miocardio
stimolato dal simpatico.
Influenze
parasimpatiche(vagali)
N
N
Esercitano effetti depressivi sul pacemaker aumentando le correnti k di
specifici canali leganti l'acetilcolina e provocando iperpolarizzazione,
inoltre l'acetilcolina abbassa il c-AMP intracellulere e ciò è responsabile
di un effetto ionotropo negativo.
Adrenalina della
midollare del surrene
X
X
Aumenta solo la velocità di incremento della pressione, quindi un
aspetto della contrazione cardiaca. Non aumenta la ofrza massima: gli
influssi simpatici sono molto più significativi
Ormoni cella corticale
del surrene(cortisolo)
X
(La mancanza
cronica
provoca
ipotensione)
X
Non ci sono prove dirette dell'influenza di questi ormoni. La crisi
addisoniana(provocata da un assenza prolungata di cortisolo) si
distingue però per la grave iportensione e per il collasso vascolare.
Ormoni tiroidei
P
riflesso
Insulina
P
X
Aumenta il trasferimento di glucosio nella cellula. Anche se questa non
pare una spiegazione sufficiente l'effetto ionotropo positivo è rapido e
significativo.
Glucagone
P
P
Aumenta l'adenilatociclasi legatosi ai recettor, quindi i suoi effetti sono
sovrapponibili a quelli delle catecolammine; non ha significato fisiologico
nei termini della regolazione.
Aumentano sia la velocità di captazione dell calcio sia dell'idrolisi
dell'atp, quindi la forza contrattile. Stimolano la sintesi proteica e
inducono ipertrofia.aumentano il metabolismo generale e di
conseguenza anche la frequenza cardiaca
pO2
P
P
Gradi moderati di ipossia aumentano frequenza e contrattilità del
miocardio tramite riflessi chemocettiv passanti per il simpatico.
pCO2 (aumento)e
acidosi
P
P
Aumento della pCO2 nel sangue coronarico è stimolante iono e
cronotropicamente.
P
P
Aumento della pCO2 arteriosa provoca riflessi passanti per il simpatico
che causano aumonto pressorio sistemoico, effetto ionotropo positivo e
effetto cronotropo positivo.NB: La diminuzione e la conseguente alcalosi
hanno effetti opposti!
N
N
Il corretto ph intracellulare garantisce lo svolgimento di tutte le funzioni
contrattili in maniera adeguate: una sua riduzione riduce l'affinità della
troponina al calcio e le interazioni tra actina e miosina, e quindi lo
sviluppo di forza contrattile. Un suo aumento aumenta la forza
contrattile
pH intracellulare dei
miocardiociti
(riduzione)
17
ELETTROCARDIOGRAFIA (laboratorio)
Fondamenti fisici dell'elettrocardiografia: concetto di volume conduttore, dipolo elettrico equivalente e
vettore elettrico. Tecniche di registrazione dell'attività elettrica cardiaca: derivazioni bipolari, aumentate e
precordali. Interpretazione delle forme d'onda nelle diverse derivazioni. Calcolo del vettore cardiaco
medio o asse ventricolare.
La depolarizzazione dei miocardiociti del cuore non avviene simultaneamente: questa infatti si propaga
nell'organo con tempistiche precise. Nel dato intervallo di tempo una parte dei miocardiociti si troverà ad
essere polarizzata e una parte, quella che si trova nel pieno del pda, ad essere depolarizzata. L'onda
depolarizzante partirà dal nodo senoatriale e si propagherà radialmente ai due atri. Raggiunto il nodo av
l'onda subirà un ritardo. Le depolarizzazioni provocate nel nodo saranno di poche cellule, quindi non
daranno segni macroscopici. Superata tale zona l'eccitamento si propaga ai ventricoli: per primo
depolarizza il setto interventricolare(che darà sostegno alla restantemuscolatura), poi i muscoli papillari
che tendono i lembi valvolari e ne impediscono il ribaltamento, infine depolarizza l'apice; la restante
massa muscolare viene depolarizzata in direzione apice-base(ciò consente un miglior svuotamento verso
il cono arterioso) e endo-epicardica. La ripolarizzazione procede esattamente in modo opposto: le ultime
cellule a depolarizzarsi saranno le prime a ripolarizzarsi. In ogni momento la distribuzione delle elettriche
nel cuore può essere semplificata in un dipolo elettrico
equivalente che abbia la carica positiva nei territori depolarizzati,
la carica negativa in quelli polarizzati.(in generale un dipolo è
costituito da due cariche uguali opposte nel segno e da una linea
ideale che le unisce detta asse di dipolo). Un dipolo unito da un
conduttore metallico provoca un trasferimento netto di cariche dal
polo positivo a quello negativo.
Inserito in una soluzione elettrolitica(come il corpo umano) il
dipolo provoca il movimento di elettroliti lungo specifiche linee
dette linee di corrente che sono espressione del campo elettrico
del dipolo
oltre alle linee di corrente sono individuabili linee dette di
isopotenziale, ovvero che raccolgono punti che hanno la stessa energia potenziale nel campo.(es: quelle
in rosso in figura). Il volume conduttore corrisponde alla soluzione elettrolitica.
Un dipolo ha intensità(data Q*δ con q che rappresenta la carica e δ la lunghezza dell'asse); verso dalla
carica negativa alla positiva; direzione (l'asse del dipolo) questo può essere reppresentato quindi da un
vettore, detto vettore elettrico equivalente.
Nelle varie fasi della contrazione questo vettore
modifica direzione e intensità. Per quantificare
queste modificazioni dobbiamo costruirci un
opportuno sistema di riferimento: il triangolo di
einthoven. Questo triangolo si otterrà ponendo tre
derivazioni e circondare il cuore. Gli elettrodi
saranno BS BD e GS. Gli elettrodi si troveranno su
specifiche linee di corrente a partenza dal cuore e
rileveranno il potenziale elettrico. La derivazione da
bs a bd sarà chiamata D I e provocherà deflessioni
positive con il polo positivo del dipolo più vicino a
bs. La derivazione bd gs sarà chiamata D II e
provocherà deflessioni positive con il polo positivo in
basso. La derivazione bs gs sarà chiamata D III e provocherà deflessioni positive con il polo positivo in
basso.
Per rendere fisicamente valido l'ecg
POSTULATI DI EINTHOVEN
• Il torace è un conduttore sferico omogeneo con al centro il cuore
• Le forze elettriche cardiache si generano al centro del conduttore
• La risultante in ogni momento di queste forze può essere rappresentata da un vettore unico
• I punti di unione arti-tronco sono i vertici di un triangolo equilatero inscritto nella sezione longitudinale
del torace sferico (Triangolo di Einthoven), perché equidistanti e giacenti sullo stesso piano
• Possiamo così analizzare le proiezioni del vettore cardiaco sul piano frontale
L'entità delle deflessioni è data dalla componente del vettore cardiaco lungo la derivazione. Queste
derivazione sono dette bipolari (o aumentate) poiché registrano le differenze di potenziale tra due poli.
Oltre a queste sono ottenibili con gli stessi elettrodi 3 derivazioni dette unipolari. Registrano le variazioni
elettriche in un punto rispetto ad un altro che durante la sistole cardiaca non presenta modificazioni
dell’attività elettrica (elettrodo indifferente). Sono:
VR o aVR= elettrodo esplorante sul braccio destro
VL o aVL= elettrodo esplorante sul braccio sinistro
VF o aVF= elettrodo esplorante sulla gamba sinistra
Nelle derivazioni unipolari l’elettrodo indifferente è costituito da due resistenze di 5*103 ohm e collegato
di volta in volta con i due arti non esploranti, in quelle potenziate con tutti e tre gli arti.
Possono essere posizionati inoltre per avere una maggior definizione dell'attività cardiaca degli elettrodi
che siano abbastanza vicini al cuore, al contrario di quelli delle derivazioni uni e bipolari che si trovano
lontane. Questi elettrodi costituiranno le derivazioni precordali e saranno unipolari registrando la
differenza tra il loro potenziale e l'elettrodo di Wilson.In particolare questi nuovi elettrodi serviranno per
identificare e localizzare, in maniera molto precisa, delle lesioni che potrebbero sfuggire con l'uso delle
altre derivazioni, e per analizzare il vettore della depolarizzazione cardiaca sul piano trasversale, diverso
da quello frontale precedentemente analizzato. Si usa allora un elettrodo di riferimento, detto di Wilson,
ottenuto come media dei potenziali di Einthoven(consideriamo che BS+BD+GS=0), e sei elettrodi
esploranti posti rispettivamente:
• V1: nel 4° spazio intercostale sulla linea parasternale destra
• V2: nel 4° spazio intercostale sulla linea parasternale sinistra
• V3: tra V2 e V4
• V4: nel 5° spazio intercostale sulla linea emiclaveare sinistra
• V5: nel 5° spazio intercostale sulla linea ascellare anteriore sinistra
• V6: nel 5° spazio intercostale sulla linea ascellare media sinistra
l'asse elettrico ventricolare è definito il vettore medio per il periodo qrs
sul piano frontale, ossia dalla media degli infiniti vettori istantanei. Questo
vettore definisce con la sua direzione l'asse anatomico del cuore e
normalmente ha un angolo con la linea orizzontale che congiunge le
derivazioni alle braccia tra 90° e -30° angoli diversi possono risultare
patologici.
per calcolare il vettore cardiaco si disegna la componente del vettore
dell'onda r sulle derivazioni bipolari e si tracciano le perpendicolari alle
estremità.
Compresi i principi fisici su cui si basa l'elettrocardiogramma, le derivazioni che colgono le differenze di
potenziale dobbiamo analizzare il tracciato elettrocardiografico:
O nda p
È dovuta alla depolarizzazione dell'atrio des tro e poi
Sinis tro. E alla s uc c es s iva
Ripolarizzazione, dura c irc a
6 0 ms
D II
0
I ntervallo p-r
È dovuto al trans ito dell'impuls o nel nodo av, dura
C irc a 6 0 ms .
O nda r
È dovuta alla depolarizzazione
V entric olare endo-epic ardic a
100
200
300
400
O nda s
È dovuta alla depolarizzazione
della bas e dei ventric oli,
il vettore c ardiac o è orientato
vers o l'alto. L'intero c omples s o
V entric olare Q RS dura meno di
6 0 ms .
O nda q
I ndic a la depolarizzazione
del s etto dal bas s o vers o
l'alto
NB: le 12 derivazioni
L'onda t
È l'onda di ripolarizzazione
V entric olare. È pos itiva
perc hè proc ede all'invers o
della depolarizzazione.
Dura c irc a 1 4 0 ms .
L'intervallo s t
Dura c irc a 1 2 0 ms ed è
l'intervallo in c i il venric olo è
Depolarizzato.
500
600
700
800
Tempo (ms)
NB: la sistoleatriale inizia subito dopo la fine dell'onda s e finisce con la fine dell'onda t
NB: depolarizzazioni e vettori cardiaci
[integrare con disegni e i concetti sulla dispensa del prof ciani]
APPARATO RENALE
18
ANALISI DELLA FUNZIONE RENALE
Clearance renale. Processo di ultrafiltrazione Velocità di ultrafiltrazione glomerulare: clearance
dell’inulina; creatinina plasmatica. Frazione di filtrazione. Determinazione dei flussi plasmatico ed ematico
renali. Regolazione del flusso ematico renale e della velocità di filtrazione glomerulare.
La clearance renale fisicamente ha le dimensioni di una portata [Q=V/t] e rappresenta il volume di
sangue che viene completamente “ripulito”, ovvero da cui viene completamente rimossa una sostanza X
ad opera dell'apparato di filtraggio glomerulare, nell'unità di tempo. Ovviamente per la maggior parte
delle sostanze dal volume filtrato non viene mai completamente rimossa la sostanza ma si apprezzano
sempre dei residui. La clearence descrive quindi un volume immaginario che rappresenta la parte del
volume filtrato totale nell'unità di tempo che sarebbe completamente priva di X se il rene rimuovesse da
detta parte comletamente X e non rimuovesse affatto X dalla restante parte.
Es: se il rene filtra 100ml/min e da questi viene rimosso il 40% di X allora la clearence di X sarà
40ml/min
il calcolo teorico della clearence renale per la sostanza x si basa sulla semplice applicazione del principio
di conservazione dela massa: noi sappiamo infatti che il flusso plasmatico (FPR) in entrata con l'arteria
renale deve essere uguale al flusso in uscita (plasmatico nella vena renale+urunatio nell'uretere).
Anche la sostanza X in entrata deve essere uguale a quella in uscita( N.B.: se non viene secreta dalle
cellule renali o da esse assorbita e utilizzata).
Ora sappiamo che la presenza di una sostanza in un fluido è descritta quantitativamante dalla sua
concentrazione. Per lo stesso principio di cui sopra la concentrazione di X in arteria [x]a= alla
concentrazione di X nella vena renale [x] v+la concentrazione urinaria di X [x]u. Inoltre:
FPRa*[x]a=FPRv*[x]v+V*[x]u
N.b.: il flusso urinario FU è rappresentato dalla velocità di escrezione dell'urina V
dall'equazione si evince che esiste una diretta proporzionalita tra [x] a e [x]u*V; possiamo quindi
formulare l'equazione
[x]a*Cx=[x]u*V
infatti per relazionare la concentrazione di x nale plasma con la concentrazione urinaria di x * la velocità
di escrezione urinaria occorre la velocità con cui il rene rimuove X dal plasma: la Clearance, appunto.
Cx=[x]u*V/[x]a
Riguardo al filtraggio glomerulare si viene a costituire una barriera altamente selettiva che lascia filtrare
molecole in base al diametro (<40 Armstrong) alla carica (x diametri tra i 22 e i 40 Armstrong sono
favorite le molecole con carica positiva cfr. destrani) e alla forma(le proteine globulari passano con facilità
maggiore rispetto a quelle filamentose).
Riferimento anatomico:
i corpuscoli renali sono formati da una rete
mirabile arteriosa accolta in un doppio foglietto
cellulare detto capsula di Bowman. Questo
foglietto è formato da uno strato parietale e da
uno viscerale(interno) che si riflettono l'uno
nell'altro a livello del polo vascolare.
Il foglietto viscerale a livello del polo urinifero
continua senza soluzioni nel tubulo contorto
prossimale
i capillari all'interno sono rivestiti da endotelio
fenestrato con fori da 7micrometri (solo le cellule
non possono attraversarlo) e da membrana
basale, contente collageno e di tipo IV e proteine
a carica negativa, all'esterno i Poidociti si
interdigitano con tre ordini di processi e
costituiscono le ceosidette fessure di filtrazione. Ogni fessura è coperta da un diaframma spesso 4 nm
che presenta fenestrature di 400*1400 nm.
Le cellule del mesangio intracellulare sono situate intorno ai capillare e oltre a svolgere funzione
fagocitaria forniscono supporto strutturale e secernono la matrice.
Intorno al glomerulo, in posizione extracapsulare, troviamo inoltre il mesangio extraglomerulare con
funzione magrofagica tra arteriola afferente ed efferente, la macula densa, un tratto morfologicamente
distinto del tubulo contorto distale in contatto con il polo vascolare del corpuscolo del proprio nefrone, le
cellule granulari, sensibili allo stiramento secernenti renina.
Questa barriera costituisce una barriera detta sangue-urina e al passaggio del sangue si produce un
ultrafiltrato in cui sono assenti le particelle corpuscolate e quasi completamente le proteine, ma in cui
sono presenti oligopeptidi soluti e acqua. In particolare fisicamente il processo di ultrafiltrazione può
essere descritto con la legge di starling secondo la quale la somma delle pressioni idrostatica e oncotica
dell ambiente extra e intra capillare costituiscono la forza netta che muove il solvente dai capillari allo
spazio di bowman. In particolare essendo il coefficente di riflessione delle proteine=1 la forza osmotica
generata dal liquido dello spazio di Bowman=0, la pressione di ultrafiltrazione è = alla pressione
idrostatica dei capillari glomerulari – la pressione idrostatica dello spazio di bowman – la pressione
osmotica dei capillari(le due forze che si sottraggono richiamano solvente ai capillari) N.B.: nel glomerulo
umano le pressioni nette di ultrafiltrazione sono state stimate come 17mmHg (60 – 15 -28) nel capo
prossimale e 8 mmHg (58-15-35) in quello distale; questo divario è creato sia dalla riduzione della
pressione idrostatica nei capillari glomerulari sia dall'aumentata pressione osmotica del sangue(le
proteine non filtrano!!).
La velocità di filtraggio glomerulare è proporzionale alle forze di staling moltiplicate per il coefficente
di filtrazione kf che tiene conto della permeabilità propria del capillare e della superficie filtrante.
VFG=kf*[Pcg-Psb-σ*πcg]
VFG è elevata poichè kf è cento volte maggiore rispetto ai capillari sistemici, e la pressione capillare è
circa doppia.
Per conoscere la VFG, non essendo le forze di starling empiricamente misurabili, possiamo impiegare la
clearence di una particolare sostanza tale che: 1) non sia né riassorbita né secreta dal nefrone 2) non
deve essere né metabolizzata né prodotta dal rene 3) non deve alterare la VFG 4) deve essere
liberamente filtrata a livello del glomerulo. Per detta sostanza il valore della VFG si sovrapporrà a quello
della clearance poichè tutto il volume depurato sarà indice del volume filtrato e l'esatta quantità di
sostanza filtrata è campionabile nell'urina. Questa sostanza è l'inulina, un polimero di fruttosio, per le
misure sperimentali. Poiché questa sostanza è esogena e il metodo di calcolo(indice della funzionalità
renale) è indaginoso in clinica si preferisce utilizzare una sostanza endogena, la creatinina, derivante dal
metabolismo della creatina. La velocità di produzione è costante (e proporzionale alla massa muscolare).
Tuttavià questa è secreta dalle cellule del tubulo prossimale (ciò sovrastma la sua concentrazione urinaria
del 10%). inoltre il metodo di misurazione della concentrazione plasmatica di creatinina sovrastima del
10%. poiche VFG=[cre]u*V/[cre]p i due errori si annullano e la clearence della creatinina, come quella
dell'inulina fornisce una misura sufficentemente accurata della VFG.
Non tutta l'inulina che arriva al rene viene comunque filtrata, di norma solo il 15,20% del palsma che
arrica ai glomeruli viene filtrato. Questa percentuale, detta frazione di filtrazione, è ricavabile
dividendo vfg per il flusso plasmatico renale. Per conoscere il flusso plasmatico renale fpr utilizziamo
un anione inorganico: il pai (acido p-amminippurico). Questo composto ha la peculiarità di essere
immesso nell'urina tramite filtrazione e tramite escrezione nel tubulo prossimale(escrezione quest'ultima
che avviene con una cinetica satura a 80 mg/min) per concentrazioni non saturanti il pai viene
completamente rimosso dal sangue e non c'è residuo nella vena renale(in linea teorica). Per qesto motivo
la sua clearance è indice del flusso che attraversa il rene: il volume completamente depurato = al volume
totale che transita.
FPR=[pai]u*V/[pai]a
in realtà nella vena renale troviamo il 10% [pai] a,questo non per un
difetto del filtraggio, ma per la conformazione del circolo ematico
renale: l'arteria renale fornisce arterie interlobari, che danno le
arciformi, che danno le interlobulari, che danno i vasa recta, da cui
dipartono le arteriole afferenti.
Oltre a questo circolo però si crea un circolo in parallelo che perfonde
l'ilo, la capsula renale e la midollare , a questo è destinato il 10% del
sangue che perfonde l'organo; questo sangue non è però in alcun modo
filtrato. È più corretto quindi parlare di FPR effettivo, cioè di plasma che
può subire il filtraggio. Conoscendo l'ematocrito possiamo risalire anche
al flusso ematico renale(dato scarsamente utilizzato).
La VFG nei soggetti sani è regolata attraverso la pressione capillare.
In situazioni patologiche vfg aumenta o si riduce con proporzionalità diretta assieme a k f;
aumenta con un aumento della pressione arteriosa, si riduce con una sua riduzione(emorrargia);
si riduce in modo inversamente proporzionale a πcg; varia in modo inversamente proporzionale a
Psb (un'ostruzione acuta delle vie urinarie può provocare un aumento della pressione idrostatica
nello spazio di bowman).
La funzionalità renale è controllata attraverso la resistenza dei vasi renali nel sogetto sano. I principali
vasi di resistenza sono l'arteriola afferente, l'arteriole efferente e l'arteria interlobulare. Il flusso in un
organo Q è descritto dalla differenza tra la pressione in arteria entrante e quella in vena uscente, fratto la
resistenza vascolare offerta dall'organo. Il rene regola la resistenza in relazione della pressione arteriosa
riuscendo così a mantenere costanete il fer per pressioni che in sistole variano tra 90 e 180 mmHg.
Nell'ambito di queste variazioni rimendo costante il flusso rimane costante VFG. Questa capacità è nota
con il nome di autoregoalzione e si deve a 2 meccanismi: il primo tiene conto della pressione arteriosa:
un aumento della pressione entra in opera il meccanismo miogenico (proprietà intrinseca del muscolo
liscio vascolare che tende a contrarsi se stirato); il secondo, noto come feedback tubulo-glomerulare, è
dovuto a un fattore non ancora chiarito(come l'aumento del flusso tubulare o del riassorbimento di NaCl)
che viene rilevato dalla macula densa, che a sua volta manda un segnale (NO o ATP) in grado di ridurre la
resistenza dell'arteriola efferente.
NB: il meccanismo di autoregolazione è un salvavita situato sul rene, peraltro inefficiente per pressioni
>180 mmHg o <90mmHg, e non perfetto; nonostante l'auto regolazione FER e VFG possono essere
modificati liberamente in risposta a diversi stimoli.
L'innervazione simpatica Nor-a(di norma con tono minimo) e l'adrenalina circolante possono in
situazioni di emorragia o forti stimoli emozionale ridurre VFG costringendo selettivamente l'arteriola
afferente.
Le prostaglandine vengono liberate in seguito a forte costrizione dell'arteriola afferente e provocano
vasodilatazioni: in caso di emorragia prevengono il blocco della circolazione renale e la conseguente
ischemia del tessuto.
L'NO è iun vasodiatatore di origine endoteliale la cui produzione è stimolata dall'aumento della forza di
taglio, da ach-co, istamina, bradichinina e ATP
L'angiotensina è un potente vasocostrittore che innalza la pressione arteriosa di tutto l'organismo e
l'enzima che lo attiva (ACE) degrada la Bradichinina. Nel rene costringe entrambe le arteriole e riduce sia
fer che vfg.
Inoltre:
Sostanza
Prodotto da
Effetto
Endotelina
Cellule endoteliali dei vasi renali, del mesangio e del tubulo
distale
vasocostrittore(presente soprattutto in vari
stadi patologici)
Bradichinina
La callicrenina prodotta dal rene scinde il chinogeno in B
Vasodilata stimolando prostaglandine e NO
Adenosina
Cellule endoteliali
Vasocostrittore dell'arteriola afferente
Peptide atriale
natriuretico ANP
Atrio
Dialta l'arteriola afferente costringendo quella
efferente(NB: aumente VFG con scarsi effetti su
FER)
ATP
Ubiquitariamente
Può stimolare la produzione di NO o costringere
in modo selettivo l'arteriola(come nel feed-back
glomerulotubulare)
Glucocorticoidi
A dosi terapeutiche
Vasodilatazioni
Istamina
Rilascio locale
Aumenta fer senza modificare VFG riducendo l
resistenza delle arteriole
Dopammina
Tubulo prossimale
Incrementa il fer e inibisce il rilascio di renina
19
FUNZIONI TUBULARI
Meccanismi di riassorbimento e secrezione tubulari. Trasporto di acqua e soluti nel nefrone. Regolazione
del riassorbimento di acqua e NaCl. Controllo renale dell’omeostasi del potassio, calcio e fosfato.
Le cellule del nefrone sono tutte tra loro unite da tight junctions, questo disfacilita il passaggio di varie
sostanze. La particolare conformazione dell'apparato di giunzione fa si che determinati tratti
morfologicamente distinti del tubulo o del
dotto collettore possano essere
selettivamente permeabili o impermeabili a
determinate sostanze.
Le tight junctions creano infatti un cordone
impermeabile tra le cellule In generale
esistono due sistemi di trasporto nel
nefrone: il trasporto trans-cellulare e il
trasporto para-cellulare. Nel paracellulare il
soluto e l'acqua attraversano gli spazi delle
tight junction per giungere agli spazi
intercellulari laterali, nel transcellulare
invece passano attraverso la cellula
attraversando prima la membrana apicale
poi quella basale. Questi trasporti possono
essere passivi(secondo gradiente), facilitati
o attivi, i trasporti paracellulari sono invece
sempre secondo gradiente di
concentrazione per ovvi motivi.
Ora vediamo come si svolgono il riassorbimento e la secrezione nei diversi segmenti del nefrone:
tubulo prossimale
nel tubulo prossimale circa il 70% di H2O, Na, K, Cl, glucosio, amminoacidi e degli altri soluti filtrati
vengono riassorbiti. Il riassorbimento di tutte queste sostanze è legato all'attività dell'Na/K ATP-asi.
Espellendo sodio dalla membrana baso-laterale riduce la concentrazione citoplasmatica di sodio e crea un
gradiente che ne favorisce l'ingresso attraverso la membrana apicale. La forza che spinge il sodio ad
entrare è inoltre utilizzata per trasportare anche altri soluti; poiché nei vari segmenti del nefrone ci sono
trasportatori per il sodio differenti che sono adatti alla composizione del liquido tubulare(che varia con
l'attività dei trasportatori) la summa degli effetti del trasporto di sodio varia per la parte prossimale e per
la parte distale del tubulo, e distalmente, vicino all'ansa il sodio è trasportato passivamente attraverso la
via paracellulare.
Nel primo segmento il sodio viene riassorbito in
simporto con glucosio fosfato lattato e amminoacidi o in
antiporto con idrogenioni
Nello specifico l'antiporto con H + provoca un ingresso netto di sodio e Hco3-. L'anidride carbonica si
combina nella cellula con 1 H2O facilitata dal'anidrasi carbonilica, creando un H + e un HCo3-, lo ione
carbonato viene messo in circolo da uno specifico trasportatore, ovviamente del lato basolaterale,
l'idorgenione entra nel liquido tubulare. In realtà sono presentianche i meccanismi del secondo tratto, ma
non sono quantitativamente rilevanti.
Nel secondo segmento il sodio viene riassorbito sia attraverso la via trascellulare ce
paracellulare: [N.B: nel frattempo la concentrazione di Cl- nel liquido tubulare, poco riassorbito, è salita
a 140 mEq/L]
nella via trans-cellulare avvengono due antiporti paralleli: Na+/H* e Cl-/anione(OH-,HCo3-, solfat o
ossalato).
Poiche idrogenione e anione una volta giunti nel liquido tubolare si combinano e tornano nella cellula,
dove dissociano, la somma di questi meccanismi è un trasporto netto nella cellula di NaCl, che escono, il
sodio attraverso l'Na/K ATP-asi, il cloro in antiporto con K +.
nella via paracellulare vengono riassorbiti Na e Cl.
Il passaggio degli ioni cloro nell'interstizio (sia per la descritta via transcellulari sia per la via paracellulare
causa un gradiente di concentrazione tubulo-interstizio di 140-105 mEq/L) genera un gradiente
elettrico(voltraggio trans-epiteliare positivo) che richiama ioni Na +. L'aumentato concentrazione di queste
specie ioniche genera un gradiente osmotico che muove il solvente. Alcuni soluti rimangono nel liquido e
vengono con questo riassorbiti (da qui il termine drenaggio del solvente).
La via paracellulare è responsabile di un terzo del riassorbimento del tubulo prossimale.
L'acqua, essendo il tubulo prossimale estremamente permeabile, segue per tutto il tubulo il gradiente
osmotico generato dai processi di riassorbimento, causa il drenaggio del solvente.
Le proteine vengono prima parzialmente degradate da proteasi sulle superfici cellulari tubulari, poi
endocitate. Nella cellula si fondono coi lisosomi e vengono completamente idrolizzate ad amminoacidi,
che escono dalla membrana baso-laterale. La proteinuria è associata a saturazione di questo meccanismo
per eccessiva filtrazione (glomerulonefrite). Nelle urine è normale però trovare la proteina di TammHorsfal, che, prodotta a valle dei meccanismi di riassorbimento delle proteine dalle cellule del tratto
ascendente spesso dell'ansa di Henle, lascia il corpo con le urine.
Anioni e cationi organici vengono secreti dal tubulo prossimale (prodotti finali del metabolismo come la
creatinina). Anche prodotti esogeni come il PAI vengono secreti qui assieme a farmaci come la penicilina..
essendo in genere legati a protene plasmatiche non filtrano nel glomerulo, e la loro elevata velocità di
escrezione è da attribuire alla secrezione tubulare. Gli anioni inorganici hanno un singolo trasportatore ad
alta saturabilità e bassa specificità, come del resti i cationi. Due anioni possono competere per il
trasportatore(PAI usato per non far espellere velocemente la penicillina), cosi come due cationi (la
cimetidina, un H2 antistaminico, e la procainammide, un antiaritmico, assunti contemporaneamente
restano a lungo in circolo perchè espulsi più lentamente).
I cationi lasciano il circolo entrando nella cellula, negativa, secondo gradiente, e uscendone grazie a un
antiporto con H+.
Gli anioni entrano nella cellula dal circolo grazie a un antiporto con l'alfaketogluturato, che a sua volta
entra in simporto col sodio, ne escono tramite un meccanismo ignoto.
Ansa di Henle
nel tratto discendente non vengono assorbite quantità significative di soluti, ma il 15% circa dell'acqua
filtrata.
Il tratto ascendente è impermeabile all'acqua ma permeabile ai soluti, che vengono qui riassorbiti in
modo più ingente nel segmento spesso. Circa il 25% di NaCl e di K + vengono riassorbiti. Il simporto Na2Cl-K porta nella cellula queste specie ioniche assieme a un antiporto NA-H (responsabile anche del
riassorbimento di carbonato), che poi lasciano la cellula il sodio attraverso una la pompa sodio-potassio,
il cloro e il potassio abbandonando secondo gradiente la membrana basolaterale entrando in circolo.
Il voltaggio transepiteliare positivo fa si inoltre che vari soluti com sodio potassio magnesio e calcio
escano dall'ansa attraverso la via paracellulare nel tratto ascendete spessa. Questo non provoca
movimento d'acqua(impermeabile) e aumenta l'osmolarità dell'interstizio. La via paracellulare è
responsabile del 50% del riassorbimento di soluti del'ansa.
La furosemide inibisce il simporto 2cl-na-k e provoca un aumento dell'escrezione di sodio, diminuendo il
potenziale positivo del lume inibisce anke il riassorbimento di Ca e K paracellulare. Incrementa inoltre
l'escrezione di h2o (passivo di x un grasiente di 1200 mosmoli /Kg nell'interstizio contro le 290 del lume.
Tubulo distale e dotto collettore
riassorbono circa il 7% di sodio, secernendo quantità variabili di potassio e idrogenioni e riassorbendo
quantità variabili di acqua.
Il tratto iniziale riassorbe NaCl e Calcio essendo impermeabile all'acqua. È presente un simporto sodiocloro. Il sodio è poi immesso nell'interstizio dalla pompa na-k, il cloro uscendo secondo gradiente da
specifici pori.
I diuretici tiazinici bloccano il simporto na-cl
Il tratto finale del tubulo distale e il dotto collettore sono invece costituiti da 2 tipi di cellule: le intercalate
e le principali.
Le cellule principali riassorbono sodio(canali enac) e acqua secernendo potassio
le cellule intercalate riassorbono idrogenioni secernendo ioni bicarbonato o viceversa e regolano
l'equilibrio acido-base. Riassorbono inoltre potassio.
Il riassorbimento di sodio genera nel lume un potenziale negativo, e il voltaggio trans-epiteliare spinge il
cloro verso l'interstizio per la via paracellulare, specie nell'ultimo tratto del dotto collettore.
L'amiloride è un diuretico che risparmia il potassio: inibisce i canali enac, quindi il riassorbimento di
sodio, quindi diminuisce lo scambio na-k, inoltre inibisce il riassorbimento di cloro lasciando il lume
positivo.
Il riassorbimento di acqua e sale regola il volume del lec e il bilancio idrico dell'organismo. Per questo
è finemente controllato.
Fattori che influenzano
il riassorbimento
Meccanismi d'azione
Angiotensina II
Una riduzione del volume circolante stimola la produzione di ace, che attiva l'angiotensina I ad
angiotensina II. Questa stimola il riassorbimento di sale e acqua nel tubulo contorto prossimale.
Aldosterone
Sintetizzato dalla glomerulare della corticale surrenale stimola il riassorbimento di sale dal tratto
ascendente spesso dell'ansa di henle del tubulo distale e del dotto collettore, aumentando anche il
riassorbimento d'acqua in quest'ultimo, e la secrezione di k dal dotto collettore.*
Peptide atriale
natriuretico ANP
Ormone a 28 amminoacidi secreto dalle cellule del cuore in roisposta a aumenti di pressione
sistemica e del volume circolante effettivo. Agisce inibendo il riassorbimento di sale a livello della
porzione midollare del dotto collettore; da inoltre un feed-back negativo per la produzione di ADH
Urodilatina
Ha 4 amminoacidi in posizione ammino terminale in più dell'ANP ma il resto della sequenza è
identico. È prodotto dalle stesse cellule del tubulo e del dotto, pertanto agisce con modalità
paracrina; media gli stessi effetti dell'ANP ma li potenzia non essendo degradato nel rene da
endopeptidasi neutre.
Nervi simpatici
(NorA) e adrenalina
Stimolano il riassorbimentodi acqua e sale da parte del tubulo prossimale, del tratto ascendente
spesso dell'ansa, del tubulo distale e del dotto collettore. Es. di attivazione: emorragia
Dopammina
Liberata dalle terminazioni parasimpatiche e sintetizzata dal rene stesso inibisce il riassorimento di
acqua e sale nel tubulo prossimale(effetti opposti agli adrenergici)
ADH
Secreto in risposta aun aumento dell'osmolarità del plasma o a una riduzione del vlume circolante
effettivo aumenta la permeabilità del dotto collettore all'acqua e quindi il suo riassorbimento grazie
al grediente della zona midollare.
Forze di Starling
Mediano il passaggio di sostanze dall'interstizio ai capillari peritubulari.
La forza che favorisce il passaggio nei capillari =pressione oncotica capilare+pressione idrostatica
intercellulare-pressione oncotica intercellulare-pressione idrostatica capillare.
Di norma il passaggio nei capillari è favorito ma parte delle sostanze retrodiffonde nel tubulo. {NB:
il discorso vale solo per il tubulo prossimale poiché per la maggiore impermeabilità degli altri
segmenti non c'è retrodiffusione in questi}.
- La dilatazione dell'arteriola efferente aumenterà la pressione capillare e inibirà il riassorbimento di
acqua e soluti aumentando la retrodiffusione.
- La pressione oncotica del sangue capillare crescera con la velocità di ultrafiltrazione(o meglio con
la frazione di filtrazione). Questa fornirà una spinta maggiore a sostanze dell'interstizio a entrare
nei capillari e diminuirà la retrodiffusione.
Le forze di S. sono responsbili anche dell'equilibrio glomerulo-tubulare: esso scollega il
riassorbimento di acqua e sodio dalla variazione del vfg: con un bilancio di sodio normale la
quantità riassorbita è una frazione costante di quella filtrata, quindi si può considerare che vfg e
riassorbimento di sodio aumentino in parallelo. Questo equilibrio si deve:
1. aumentando la frazione di filtrazione aumenta la pressione oncotica del sangue peritubulare e
quindi c'è un maggior riassrbimento;
2. essendo nel tubulo prossimale il riassorbimento di na legato a quello di glucosio fosfato e
amminoacidi l'aumento del carico filtrato di queste sostanze aumenta il riassorbimento di sodio.**
*alcuni farmaci come il Captoril inibiscono l'enzima ace. Questo causa il mancato riassorbimento di sodio nel tubulo prossimale, tramite la
mancata produzione di aldosterone(stimolata da angiotensina II) il mancato riassorbimento di sale nel tubulo contorto distale e nel dotto
collettore. Tramite la mancata azione vasocostrittrice dell'angiotensina II una diminuzione della resistenza periferica e della pressione
sistemica.
** l'equilibrio glomerulotubulare coadiuva il feedback tubuloglomerulare!
Oltre all'acqua e al sodio il rene regola anche l'omeostasi di fosfato calcio e potassio, agendo sul loro
riassorbimento e sulla loro secrezione.
Il potassio ingerito entra subito nel lec e nel giro di minuti è captato all'interno delle cellule. La sua
escrezione urinaria invece è lenta e avviene nel giro di ore.
Il potassio plasmatico è regolato:
mantenendo costante la sua concentrazione nel LEC
quando aumenta la kalemia, ad esempio nei periodi postprandiali, aumenta l'assunzione da parte delle
cellule muscolari, epatiche, ossee e dei globuli rossi mediata da un aumentato turn-over dell'na-k atpasi
(o nel caso di ipercaptazione cronica da un aumento di nmero delle pompo na-k)
insulina adrenalina[attraverso i recettori beta-2 adrenergici] (in minuti) e aldosterone (in un ora circa)
aumentano l'assunzione cellulare di k.
Inoltre l'acidosi aumenta la kalemia (promuove l'ingresso cellulare di H + e di compenso l'uscita di ioni K+;
l'acidosi di origine organica non ha questo effetto o perchè gli anioni entrano nella cellula con gli
idrogenioni non rendendo necessaria l'uscita di potassio o preche gli anioni promuovono la produzione di
insulina); un aumentata osmolartà plasmatica aumenta la kalemia ( l'iperosmolarità fa uscire acqua,
aumenta la concentrazione cellulare di potassio, lo spinge ad uscire dalla cellula); la lisi cellulare libera
potassio; l'esercizio fisico promuove la liberazione di K +
facendo in modo che l'escrezione renale (assieme a una quota variabile tra il 5 e il 10% di potassio
espulsa con le feci e la sudorazione) sia commisurata all'assunzione dietetica.
Il potassio passa dal sangue al lume tubulare essenzialmente nel tubulo contorto distale e nel dotto
collettore. Il potassio è secreto poiché captato dalla pompa na-k dall'interstizio esce dalla membrana
apicale delle cellule che è ad esso permeabile secondo il suo gradiente elettrochimico. Anche la
membrana baso-laterale è permeabile, ma il gradiente e l'aumentata permeabilità della membrana
apicale favoriscono la sua uscita nel lume tubulare. La kalemia e l'aldosterone sono i principali regolatori
fisiologici dell'escrezione di potassio. L'iperkalemia aumenta l'attività della pompa na-k, stimola la
secrezione di aldosterone e aumenta il flusso del liquido tubulare che aumenta la secrezione di K +.
l'aldosterone aumenta la quantità di na-k atpasi presenti nelle cellule principali e quindi aumenta la
secrezione, però agisce anche sul riassorbimento di sodio, quindi un picco non ha alcun effetto riducendo
il flusso tubulare, d'altro canto una stimolazione cronica provoca ipokalemia. La stimolazione da adh ha
un effetto parallelo: stimola la secrezione di potassio ma diminuendo la secrezione d'acqua; questo non
incide sulla quantità di potassio secreta, ma ha l'essenziale finalità di disaccoppiare bilancio idrico e
omeostasi del potassio. I glucocorticoidi aumentano l'escrezione,ma agendo sulla vfg. Un aumento del
flusso tubulare stimola rapidamente un aumentata secrezione di potassio, modificando il gradiente
elettrochimico: per flussi maggiori è minore la concentrazione di potassio tubulare, quindi anche la forza
che spinge il potassio nel tubulo; l'alcalosi acuta incrementa la secrezione di K +, cronica ha effetti opposti
poiché stimola indirettamente la secrezione di aldosterone.
{NB: qesti ultimi 2 non possono essere considerati fattori che regolano l'omeostasi, ma fattri che la
turbano}.
Il cacio viene mantenuto dall'organismo entro limiti ristretti intorno a 2.5 mM. Poiche la maggior parte
del CA++ è contenuto nel tessuto osseo questo né è anche il principale serbatoio. Di norma la quantità di
calcio assorbita dal tratto intestinale, 1000 mg/die = alla quantità espulsa con le feci (800 mg/die, ovvero
la frazione che sfugge all'assorbimento) + la frazione espulsa con le urine. È chiaro che tutto il calcio
assorbito nell'adulto è espulso. L'assorbimento intestinale avviene grazie a uno specifico vettore stimolato
dal calcitriolo. Il pth invece stimola il riassorbimento renale e osseo, nonché la produzione di calcitriolo. È
prodotto in risposta a bassa concentrazione di calcio plasmatica. La calcitonina è prodotta con uno stimolo
opposto e agisce stimolando l'osteogenesi. Il calcio legato alle proteine non può essere filtrato e quindi
per la filtrazione risulta disponibile circa il 50% del calcio plasmatico. [NB: l'acidosi aumenta il calcio
legato!]. Del calcio filtrato viene riassorbito il 70 dal tubulo prossimale, il 20 dall'ansa, il 9 dal dotto e dal
tubulo distale. Nel tubulo prossimale il calcio viene riassorbito per i 4/5 tramite drenaggio del solvente,
per la restante parte entra nelle cellule secondo gradiente tramite trasportatori passivi dedicati e ne esce
contro gradiente tramite un ca-atp-asi o tramite un antiporto 3na-ca. Nell'ansa nel tratto ascendente il
calcio viene riassorbito in parallelo con il sodio a causa del voltaggio trans-epiteliare con il lume positivo.
Il meccanismo transcellulare è invece simile. Nel tubulo distale e nel dotto invece il riassorbimento è
attivo(con meccanismo simile al tubulo prossimale), ed è disaccoppiato da quello del sodio.
Il pth (anche se inibisce il riassorbimento del tubuo prossimale) stimola fortemente il riassorbimento di
calcio nell'ansa e nel tubulo distale. Anche calcitonina e calcitriolo stimolano un simile riassorbimento con
effetti quantitativamente meno rilevanti.
L'equlibrio del calcio è alterato da >[Pi] plasmatica che stimolando pth stimola anche l'ipercalcemia.
L'aumento del carico filtrato aumenta la secrezione di sodio e acqua e con questi anche di calcio. L'acidosi
incrementa l'escrezione di calcio.
Il fosfato inorganico è presente nel plasma in concentrazione di 4mg/dL. L'assorrbimento intestinale
aumenta con il Pi ingerito ed è stimolato dal calcitriolo. Il rilascio dall'osso è accoppiato con quello del
calcio. L'escrezione di Pi è regolata dall'assunzione dietetica. Poiche il rene riassorbe Pi a velocità
massimale ogni aumento del carico filtrato condiziona un aumentata escrezione del Pi. Il tubulo
prossimale riassorbe l'80% del Pi e quello distale il 10%. nel tubulo prossimale il Pi è riassorbito in
simporto con 2 Na, esce poi nell'interstizio con uno scambiatore aspecifico in antiporto con vari anioni.
L'escrezione del Pi è regolata nel tubulo prossimale, aumentata dal pth che aumentando cAMP inibisce il
simporto 2NaPi. Aumenta inoltre all'aumentare del carico filtrato, acidosi, espansione del lec,
glucocorticoidi. Diminuisce in presenza di GH.
20
CONCENTRAZIONE E DILUIZIONE DELLE URINE
Compartimenti idrici dell’organismo. Meccanismi della concentrazione e diluizione delle urine. Clearance
osmolare e clearance dell’acqua libera
Nell'adulto circa il 60% del peso corporeo è costituito da acqua, divisa nei 2 compartimenti idrici
dell'organismo. Di questi i due terzi sono intracellulari e compongono il liquido intracellulare, LIC, un
terzo si trova nel liquido extracellulare, diviso tra plasma e liquido interstiziale.il plasma è separato dal
liquido interztiziale dall'epitelio capillare, estremamente permeabile, quindi le 2 concentrazioni in specie
ioniche si possono supporre simili, il contenuto proteico è decisamente maggiore nel plasma, e questo
richiama leggermente più cationi rispetto all'interstizio. Questo effetto, detto di Gibbs-donnan, è
quantitativamente modesto di fatto trascurabile. Diverse sono invece le concentrazioni ioniche del lic e
del lec, essendo le membrane cellulari selettivamente permeabili.
Componente
Concentrazione intracellulare
(mM)
Concentrazione extracellulare
(mM)
Na+
K+
Mg2+
Ca2+
H+
5-15
140
0,5
10-4
7x10-5 (10-7.2 M o pH 7,2)
145
5
1-2
1-2
4x10-5 (10-7,4 M o pH 7,4)
ClHCO3Pi
5-15
12
100
110
25
2
Cationi
Anioni*
Una stima accurata dell'osmolarità plasmatica efficace si ottiene raddoppiando la concentrazione del
sodio: infatti questa è data dal sodio e dagli anioni che lo accompagnano (cloro e carbonato).
Una stima dell'osmolarità chinica richiede invece di sommare anche il contributo di glucosio e urea.
Lo scambio di liquido con l'ambiente esterno avviene sempre attraverso il lec.
Nb: l'infusione di una soluzione isotonica non genera cambiamenti della pressione oncotica e il liquido
infuso rimane nel lec, se si vuol far aumentare il plasma a discapito dell'interstizio bisogna cercare una
soluzione con soluto non permeabile rispetto all'endotelio, come l'albumina.
Per mantenere costante osmolarità e volume del lec è necessario che nel rene l'escrezione d'acqua e di
soluto sono disaccoppiate (in condizioni normali). Esso è infatti in grado di attuare sia concentrazione
che diluizione delle urine espellendo urine - a seconda delle necessita - ipo- o iperosmotiche.
Principalmente per questo processo è determinante il segmento ascendente spesso dell'ansa di Henle,
che ricordiamo attua in modo massivo il trasporto di soluti ma è impermeabile all'acqua.
La prima parte del nefrone non regola la concentrazione dell'urina.
Dal tubulo prossimale si immette nell'ansa liquido isoosmotico col plasma, essendo il tubulo permeabile
all'acqua. Il tratto discendente sottile è molto permeabile all'acqua e impermeabile a urea e sale.
Scendendo nella midollare il liquido diventa isoosmotico con la papilla raggiungendo 1200 mOsm/KgH2O.
Il tratto ascendente sottile è al contrario impermeabile all'acqua e permeabile a urea e sale. In questo
tratto le [] di sale e urea vanno all'equilibrio con l'ambiente midollare: assistiamo a un'uscita netta di sale
e a un entrata nel lume di urea. Esce più sale di quanta urea entra e il liquido diluisce. Il tratto
ascendente spesso è anche detto tratto diluente: genera liquido ipoosmotico a 150 mOsm/KgH2O, è
impermeabile a acqua e urea ma riassorbe attivamente sale.
La seconda parte in caso di diuresi idrica, ovvero l'espulsione di urina ipoosmotica, che avviene quando
i livelli ematici di ADH sono bassi:
nel tubulo contorto distale e nel dotto collettore corticale viene riassorbito attivamente NaCl ma la parete
è impermeabile all'acqua(in assenza di ADH). Avviene un'ulteriore diluizioni fino a 100 mOsm/Kg H2O;
il dotto collettore corticale continua a riassorbire NaCl anche in assenza di ADH è lievemente permeabile a
acqua e urea:viene riassorbita H2O e urea in piccole quantità.
In caso di antidiuresi i meccanismi della seconda parte tendono a formare urina concentrata:
nel dotto collettore corticale al riassorbimento di sale si accompagna un'elevata permeabilità
all'acqua(ADH ematico alto): il liquido diventa isoosmotico con l'ambiente circostante e raggiunge una
concentrazione di 300 mOsm/KgH2O; a comporre le osmoli efficaci non c'è più sodio come nel plasma,
ma potassio urea e creatinina etc., nel dotto collettore midollare avviene un ulteriore riassorbimento
d'acqua fino a 1200mOsm/KgH2O, essendo anche questa porzione resa impermeabile all'acqua;inoltre
essendo il dotto collettore distale impermeabile ai soluti le specie molecolari da espellere rimngono
confinate nel lume duttale.
Ovviamente l'ADH non ha un effetto del tipo tutto o nulla ma modula finemente la permeabilità della
membrana: tra i due estremi della diuresi idrica (con una produzione di 18L/die di urina a bassa
osmolarità) e dell'antidiuresi troviamo le sfumature fisiologiche.
Per un corretto riassorbimento di acqua il rene deve essere in grado di generare e mantenere il
gradiente osmolare midollare. Questo gradiente viene generato da un meccanismo noto come
moltiplicazione controcorrente: il riassorbimento attivo d soluti da parte dei segmenti dell'ansa provoca
un loro accumulo nell'interstizio anche perchè il tratto ascendente spesso è impermeabile all'acqua e
quindi il liquido tubulare tornando nella midollare non può diluire il liquido interstiziale. Nello specifico il
tratto ascendente provoca un riassorbimento di soluti che aumenta l'osmolarità dell'interstizio(questo è
detto effetto singolo della moltiplicazione controcorrente). [Questo provoca un riassorbimento di acqua
dal tratto discendente poiché questo e permeabile all'h2o ma non ai soluti.] L'elevata osmolarità a livello
delle papille renali è dovuta per 600mOsm/KgH2O a sale, per altre 600 all'urea(che si comporta nel rene
da osmole efficace).
L'NaCl si accumula grazie al già descritto processo di moltiplicazione controcorrente, l'urea invece
soprattutto in condizioni di antidiuresi con alto ADH trova una barriera permeabile nel dotto collettore
midollare e quindi trova il suo equilibrio intra e extratubulare. (in diuresi idrica la permeabilità all'urea è
bassa e diminuisce il gradiente midollare proprio per la diminuzione dell'urea interstiziale)
Il gradiente viene mantenuto in due modi: in primis la maggior quantità d'acqua viene riassorbita nelle
zone corticali e midollari esterne, essendo il dotto collettore midollare distale scarsamente permeabile.
Inoltre l'irrorazione sanguigna dell'ansa e del dotto è formata dai vasa recta, disposti a forcina( altrimenti
si rischierebbe di lavare via il gradiente)nella loro parte discendente perdono acqua e lavano il gradiente
midollare, ma risalendo verso la midollare recuperano l'acqua persa in precedenza. Un sostanziale
aumento del flusso provoca comunque un lavaggio poiché, non essendo infinita la permeabilità all'acqua
dell'endotelio, per portate elevate lo scambio idrico appare limitato dal tempo.
NB:le cellule della midollare per non raggrinzire hanno un elevato contenuto di proteine citoplasmatiche
osmoticamente attive.
Per quantifcare come il rene tratti l'H2O, la sua capacità di produrre acqua priva di soluto, e quindi le
situazioni di diuresi, è stato adottato il concetto di clearance dell'acqua libera. La diluizione operata dal
segmento ascendente dell'ansa di henle genera un volume d'acqua completamente privo di soluto; in
antidiuresi questo volume viene riassorbito, in diuresi idrica escreto. L'urina può essere idealmente
suddivisa in due volumi di cui uno sia isotonico col plasma, l'altro completamente depurato. La clearance
osmolare è la clearance di tutti i soluti : Cosm=Uosm*V/Posm ovvero il volume di filtrato che viene espulso
alla stessa osmolarità del palsma. La clearance dell'acqua libera è calcolabile quindi come V-Cosm (per
convenzione quando questo valore è negativo è chiamata conservazione tubulare dell'acqua libera).
Essendo CH2O=V(1-Uosm/Posm) la clearance dell'H2O libera sarà negativa quando l'osmolarità delle urine
sarà maggiore di quella plasmatica. Un valore negativo indica che viene conservata acqua. Un valore
positivo che viene espulsa.
NB: Per comprendere il bilancio idrico dell'organismo si preferisce far riferimento alla clearance delle
osmoli efficaci: nel sangue infatti l'urea non è un osmoticamente efficace, e quella che può apparirci
un'adeguata conservazione d'acqua a fronte di un'iperosmolarità ematica considerando le osmoli totali
può non rivelarsi tale per le osmoli effettive. Se un paziente espelle per le osmoli effettive un urina
isotonica col plasma non sta conservando H2= anche se l'osmolarità dell'urina risulta maggiore per
l'inclusione del contributo dell'urea che di fatto ci dà un minor valore di clearance dell'acqua libera.