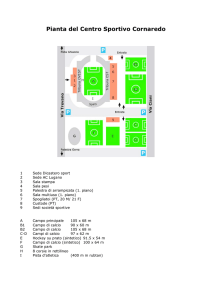
Esame Federale di Maturità
.......................
Gennaio 2014
Cognome e nome: . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
________________________________________________________________________________
Materia Fondamentale:
Scienze sperimentali: CHIMICA
Docente estensore:
Dario Leonardi
Tempo a disposizione:
80 minuti
Materiale ausiliario autorizzato:
CRM, CRP, CRC, Formulari e tavole (trad. CMSI),
Ed. G d'Encre
CRM, CRP, CRC, Formulaires et tables, Editions du
Tricorne
DMK/DPK, Formeln und Tafeln, Orell Füssli Verlag
La tavola periodica degli elementi è allegata
Calcolatrice non programmabile
Indicazioni:
Tutte le risposte sono da riportare direttamente sui
fogli delle domande.
Ciò che risulta illeggibile non viene corretto e di
conseguenza non valutato.
Il punteggio massimo è indicato per ogni domanda.
Nei calcoli bisogna mostrare l’impostazione algebrica e
dare il risultato con la dovuta precisione (numero
adeguato di cifre significative).
Risposte incomplete o imprecise comportano una
riduzione dei punti assegnati.
Se è richiesta la formula di struttura completa devono
comparire tutti gli elettroni di valenza degli atomi
coinvolti.
Le equazioni chimiche devono presentare le formule
chimiche delle sostanze coinvolte (ev. le formule
condensate), devono essere bilanciate e se possibile
presentare accanto alle formule lo stato delle sostanze.
Punteggio massimo:
106 pti. su 115
________________________________________________________________________________
Corretto da:
Cognome e nome: . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Firma: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
PARTE PRIMA: Domande a scelta multipla
15 pti.
Indica con una crocetta l’unica affermazione corretta.
a. Quale di queste è una trasformazione chimica:
□
□
□
□
la formazione invernale della brina sulle foglie degli alberi
la cera che cola dai bordi di una candela
la brace che arde nel camino
il ghiaccio secco (anidride carbonica) che sublima
b. L’acqua potabile è:
□
□
□
□
una sostanza semplice
una sostanza composta
una emulsione
una soluzione
c. Quando una grondaia di rame esposta all’aria e alle intemperie si ossida, la sua massa:
□
□
□
□
aumenta
diminuisce
rimane invariata
prima diminuisce e poi aumenta
d. Se i numeri Z e A hanno lo stesso valore l’atomo:
□
□
□
□
possiede tanti nucleoni quanti elettroni
possiede tanti neutroni quanti elettroni
possiede tanti neutroni quanti protoni
è un atomo di idrogeno
e. Se un composto è costituito dal 74,84% di carbonio e dal 25,16% di idrogeno si tratta di:
□
□
□
□
C2H4 (etilene)
C2H6 (etano)
CH4 (metano)
C2H2 (acetilene)
2
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
f. Quale delle sostanze semplici seguenti si ossida con maggiore facilità:
□
□
□
□
il ferro (Fe)
il carbonio (C)
il sodio (Na)
il neon (Ne)
g. Gli elementi che appartengono allo stesso gruppo del sistema periodico possiedono proprietà
fisiche e chimiche simili:
□
□
□
□
perché possiedono la stessa configurazione elettronica esterna
perché sono tutti elettricamente neutri
perché possiedono lo stesso numero di protoni ed elettroni
perché possiedono la stessa configurazione elettronica
h. La molecola del silano (SiH4) ha una forma:
□
□
□
□
triangolare
quadrata
tetraedrica
ottaedrica
i. Lo zolfo presenta il maggiore stato di ossidazione nel seguente composto:
□
□
□
□
esafluoruro di zolfo (SF6)
acido triossosolforico (H2SO3)
solfuro di idrogeno o acido solfidrico (H2S)
zolfo ortorombico o zolfo-α (S8)
j. Quale sarebbe il valore della pressione atmosferica rispetto al valore reale se l’atmosfera
terrestre fosse composta esclusivamente da CO2:
□
□
□
□
uguale
maggiore
minore
non lo si può stabilire
3
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
k. Quale delle seguenti reazioni libera energia:
□
□
□
□
Na+ (g) + Cl¯ (g)
NaCl (s)
Na+ (g) + e¯
Na (g)
Cl (g)
+ e¯
Cl¯ (g)
2 Na (l) + Cl2 (g)
2 NaCl (s)
l. Quando 0,020 mol di CaCl2 vengono disciolte in acqua per preparare 500 ml di soluzione la
concentrazione ottenuta è:
□
□
□
□
0,010 M
0,020 M
0,040 M
0,060 M
m. In una reazione chimica, all’aumentare della temperatura la velocità di reazione:
□
□
□
□
rimane uguale
diminuisce
aumenta
può sia aumentare sia diminuire, dipende se endotermica o esotermica
n. Nella reazione
2 NO (g) + O2 (g)
2 NO2 (g)
quale delle seguenti azioni fa
diminuire la quantità di NO presente all’equilibrio in un recipiente?
□
□
□
□
l’uso di un catalizzatore
un aumento del volume totale
l’aggiunta di NO2
l’aggiunta di O2
o. La reazione di addizione tra iodio (I2) e etilene (CH2CH2) porta alla formazione di:
□
□
□
□
CI2CI2
CHICI2
CH2ICH2I
CHI2CHI2
4
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
PARTE SECONDA: Esercizi
Esercizio 1
25 pti.
L’idrossido di calcio è un composto con formula chimica Ca(OH)2. È un cristallo incolore o una
polvere bianca, scarsamente solubile in acqua, tradizionalmente chiamato calce spenta. In
sospensione acquosa in edilizia, è noto anche con il nome di grassello di calce e viene impiegato
come componente di malte, intonaci e stucchi.
L’idrossido di calcio può essere ottenuto dal calcio in due reazioni consecutive:
•
reazione con ossigeno molecolare per dare ossido di calcio (CaO; nome comune calce viva)
•
reazione dell’ossido di calcio con l’acqua
a. Scrivi le due reazioni complete e bilanciate.
•
•
b. Calcola la quantità chimica massima di ossido di calcio che si può ottenere dalla
reazione completa di 0,120 g di calcio
c. Calcola la massa di idrossido di calcio che si può ottenere dalla reazione completa di
0,120 g di calcio realizzando in modo completo le due reazioni consecutive.
5
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
L’aggiunta del calcio all’acqua permette di ottenere direttamente l’idrossido di calcio con
formazione di idrogeno gassoso.
d. Scrivi la reazione completa e bilanciata.
•
e. Calcola la massa di calcio necessaria per ottenere 3.00·10-4 mol di idrossido di calcio.
f. Calcola in litri il volume di idrogeno prodotto (densità 0,0899 kg/m³) da questa reazione.
g. Identifica gli ioni nei due composti del calcio:
idrossido di calcio Ca(OH)2
catione
ossido di calcio CaO
anione
catione
6
anione
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
Analogamente al calcio anche il potassio (K) può reagire per dare l’idrossido di potassio (potassa
caustica), che però ha una formula chimica diversa KOH.
h. Spiega esaurientemente questa differenza, anche a livello elettronico.
i. Scrivi le tre reazioni analoghe alle precedenti che permettono di ottenere l’idrossido di
potassio KOH dal potassio elementare.
•
•
•
Esercizio 2
16 pti.
a. Il carbonio naturale è costituito da 12C (12,0000 u) per il 99.989% e da 13C (13.0034 u) per
lo 0.0111%
Calcola la massa atomica media dell’elemento.
b. Il rame naturale è costituito da 63Cu (62.929 u) e da 65Cu (64.928 u). Se la massa atomica
media è 63.54 u, quali sono le abbondanze relative dei due isotopi del rame?
7
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
c. Scrivi la composizione del nucleo e la notazione isotopica di un atomo che contiene
•
12 protoni, 13 neutroni e 12 elettroni
•
122 neutroni, 80 protoni e 81 elettroni
d. Un elemento sconosciuto contiene 35 protoni, 36 elettroni e ha numero di massa 80.
•
Qual è il numero atomico dell’elemento?
•
Qual è il suo simbolo?
•
Quanti neutroni contiene?
Esercizio 3
24 pti.
Un olio di oliva di ottima qualità ottenuto per spremuta a freddo delle olive si presenta purtroppo
molto torbido per la presenza di una piccola quantità di acqua e di fibre vegetali provenienti dalla
polpa delle olive.
a. Come può essere definito un tale sistema da un punto di vista chimico.
b. Qual è o quali sono il metodo o i metodi che ritieni più adatti per renderlo limpido. Descrivi
brevemente il procedimento seguito.
Con l’olio così ottenuto si vuole preparare un olio aromatizzato al peperoncino, da usare come
condimento. Nel peperoncino è presente una sostanza responsabile del gusto piccante detta
capsaicina. Come sostanza pura è un solido bianco, ha una temperatura di fusione di 63 °C e densità
1,04 g/cm3. È poco solubile in acqua, si scioglie meglio in alcol e bene nell’esano.
c. Spiega perché l’olio di oliva è particolarmente adatto per la preparazione di un additivo alimentare
aromatizzato al peperoncino e precisa quale tecnica di separazione chimica sta alla base di questa
preparazione
8
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
La capsaicina è irritante nei
mammiferi, incluso l'uomo, e
produce una sensazione di bruciore
nelle mucose, bocca inclusa.
Per neutralizzare il bruciore nella
bocca, uno dei metodi efficaci si
basa sull’ingestione di olio o di
grassi. Bere acqua non è molto
d’aiuto, mentre lo è di più bere
bevande alcoliche.
d. Come spieghi la diversa efficacia dei metodi usati per lenire il bruciore causato dalla masticazione di
un peperoncino? (Considera anche le caratteristiche strutturali della sostanza)
e. Sulla formula di struttura della capsaicina identifica i gruppi funzionali, elencali nel riquadro
sottostante specificandone il loro nome e il nome della classe di sostanze organiche che
caratterizzano.
f. Un chimico vuole testare l’efficacia farmacologica di un derivato della capsaicina e procede alla sua
esterificazione con l’acido acetico (CH3COOH; acido etanoico). Illustra le particolarità di questa
reazione, specificando il punto esatto dove avviene questa modifica ed evidenziando le modifiche
ottenute nella formula di struttura del prodotto ottenuto.
9
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
Esercizio 4
15 pti.
Considera una soluzione acquosa dell’acido forte HClO4 in concentrazione 0,050 M.
a. Scrivi l’equazione della sua ionizzazione (protolisi) in acqua.
b. Calcola il pH di tale soluzione.
c. Scegli tra le seguenti soluzioni:
CH3COOH 0,100 M
NaCl 0,100 M
Ba(OH)2 0,100 M
HNO3 0,100 M
quella che ti permette di neutralizzare la sudetta soluzione, Scrivi l’equazione bilanciata di tale
neutralizzazione e calcola il volume richiesto per la neutralizzazione completa di 0.100 L di HClO4.
Equazione:
Calcolo:
d. Stabilisci i valori di pH della soluzione usata per la neutralizzazione dell’ HClO4 (A.) e della
miscela ottenuta a neutralizzazione avvenuta (B.). Motiva le risposte.
A.
B.
10
Esame Federale di Maturità
Gennaio 2014
Materia Fondamentale: Scienze sperimentali
Parte di Chimica
________________________________________________________________________________
Esercizio 5
10 pti.
Il processo di corrosione elettrochimica di un metallo avviene solo se il metallo è a contatto con
ossigeno e acqua. Quindi il ferro in presenza di ossigeno O2 e H2O dà origine ai prodotti di
corrosione tra cui vari ossidi e idrossidi di ferro dove il ferro si trova nello stato di ossidazione +III.
Se però a stretto contatto dell'oggetto di ferro, anche gli scafi delle navi, si applica un pezzo o un
blocco di magnesio, sarà questo metallo a ossidarsi e consumarsi, lasciando il ferro non modificato.
a. Usando esclusivamente i termini riduzione e/o potere riducente spiega il principio che sta alla
base dell’impiego di questi pezzi di magnesio, chiamati anodi sacrificali, per la protezione del
ferro dall’arrugginimento.
b. Sapendo che nella reazione del magnesio con l’acqua si forma idrossido di magnesio e idrogeno
gassoso formula la equazione bilanciata della reazione.
Esercizio 6
10 pti.
Il metanolo, CH3OH, bolle a 64,7 °C mentre l’etanale, CH3CHO, bolle a 20,4 °C.
a. Determina la massa molare delle due sostanze e rappresenta le loro strutture di Lewis.
Massa molare
Formula di struttura
CH3OH
CH3OH
b. Spiega le differenze nelle temperature di ebollizione tra metanolo e etanale.
11