UNIVERSITÀ POLITECNICA DELLE MARCHE
FACOLTÀ DI MEDICINA E CHIRURGIA
_______________________________________
DOTTORATO DI RICERCA IN
MEDICINA, PREVENZIONE E PERINATOLOGIA
XII ciclo
Sviluppo post-natale del recettore della
Sostanza P (NK1) nella corteccia
somatosensoriale del ratto
Tesi di Dottorato di:
Emanuela Mensà
Triennio 2011-2013
Relatore:
Prof. Paolo Barbaresi
RIASSUNTO
Il recettore NK1 è ampiamente distribuito nel sistema nervoso centrale e periferico
dei mammiferi; nel SNC regola le funzioni respiratoria e cardiovascolare, è implicato
nell’attivazione del riflesso emetico, in varie risposte comportamentali e nella
regolazione della sopravvivenza e degenerazione neuronale. Nel presente lavoro, al
fine di estendere le attuali conoscenze sul recettore NK1, si sono studiate la presenza,
la distribuzione e l’espressione di tale recettore nella corteccia somatosensoriale di
ratto durante lo sviluppo post-natale, mediante reazioni di immunocitochimica e
biochimico-molecolari. Il recettore NK1 è presente nella corteccia parietale di ratto
sin dalla nascita e la sua distribuzione varia durante lo sviluppo post-natale. Gli studi
di immucitochimica hanno permesso di evidenziare che a P0 e P5 i neuroni positivi
per l’NK1 sono di piccole dimensioni e tutti localizzati nella sub-cortical plate; a
partire da P10 fino a P30, invece, i neuroni sono più grandi, numerosi e si
distribuiscono in tutti i sei strati della corteccia, in percentuali diverse; negli strati
infragranulari sono più numerosi raggiungendo percentuali che oscillano tra il 57 ed
il 60% (in media il 35% nel VI strato e il 24% nel V strato), mentre negli strati
sovragranulari (II - IV strato), la percentuale dei neuroni NK1 positivi oscilla tra il 36
e il 39%. Un esiguo numero di neuroni è presente nel primo strato con percentuali
che variano tra il 2 e il 4%. Tale risultato coincide con quanto ottenuto con il
Western Blotting in cui si è osservato un aumento dell’espressione proteica dell’NK1
in funzione dell’età. Questi risultati, rivelano quindi un’ampia distribuzione di tale
recettore nella corteccia somatosensoriale di ratto, in accordo con i dati ottenuti
mediante autoradiografia.
I
INDICE
Capitolo I : La corteccia cerebrale
1.1 Il neurone
1.1.2 Tipi cellulari
3
3
1.1.2.1 Neuroni piramidali
5
1.1.2.2 Neuroni non-piramidali
6
1.2 Laminazione della corteccia cerebrale
6
1.3 L’isocorteccia del ratto
8
1.3.1 Sviluppo pre-natale e post-natale della corteccia cerebrale di
9
ratto
1.3.2 Formazione della corteccia cerebrale
10
1.3.3 Migrazione dei neuroni
13
1.3.4 Crescita post-natale della corteccia cerebrale
14
1.3.5 Asimmetria cerebrale durante lo sviluppo post-natale
15
1.3.6 Sviluppo post-natale dei dendriti corticali
16
1.3.6.1 Coni di accrescimento
16
1.3.6.2 Spine dendritiche e somatiche
20
1.4 Corteccia parietale
21
Capitolo II: Le tachichinine
2.1 Struttura delle tachichinine
23
2.2 Localizzazione
28
2.3 Azioni farmacologiche delle tachichinine
32
II
Capitolo III: La sostanza P
3.1 Scoperta della SP
35
3.2 Sintesi e metabolismo della SP
36
3.3 Distribuzione della SP
38
Capitolo IV: L’ NK1
4.1 Struttura del recettore
40
4.2 Distribuzione e funzioni dell’NK1
43
Capitolo V: Scopo del lavoro
47
Capitolo VI: Materiali e metodi
6.1 Animali
49
6.2 Immunocitochimica
49
6.2.1 Anticorpi utilizzati
50
6.2.2 Procedura
50
6.3 Colorazione di Nissl
51
6.4 Analisi dei dati
51
6.5 Raccolta dei campioni di corteccia cerebrale per analisi biochimiche -
52
molecolari
6.6 Preparazione degli estratti proteici da tessuto
52
6.7 Determinazione della concentrazione proteica
53
6.8 Western Blotting sui tessuti di corteccia
53
6.8.1 Elettroforesi in condizioni denaturanti (SDS-PAGE)
53
III
6.8.2 Trasferimento su membrana di nitrocellulosa
54
6.9 Preparazione e sviluppo delle lastre
55
6.10 Densitometria
55
6.10.1 Analisi statistica
55
Capitolo VII: Risultati
7.1 Distribuzione corticale dei neuroni positivi per il recettore NK1
57
7.2 Morfologia dei neuroni
62
7.3 Western Blotting dei tessuti di corteccia cerebrale
69
7.4 Analisi semiquantitativa dell’NK1
70
Capitolo VIII: Discussione
71
Bibliografia
75
IV
INTRODUZIONE
Capitolo I
LA CORTECCIA CEREBRALE
La corteccia cerebrale, detta anche neocorteccia o isocorteccia, rappresenta la
porzione più esterna del cervello; essa consta di uno strato sottile ed altamente
convoluto di sostanza grigia. Le circonvoluzioni originano da solchi e giri che
permettono all’ampio volume di sostanza grigia di poter essere contenuto all’interno
della scatola cranica. La corteccia cerebrale che ha uno spessore variabile in
relazione alla localizzazione rappresenta la regione più evoluta del cervello e l’ultima
che si è sviluppata, svolge le funzioni cerebrali più elevate e notevolmente evolute in
quanto ci permette di poter avere percezioni relative all’ambiente che ci circonda, di
formulare pensieri, vivere esperienze emozionali, ricordare eventi passati ed infine
rappresenta l’area da cui partono tutti i comandi per l’esecuzione dei movimenti. Per
svolgere tutte queste funzioni, la corteccia agisce come un centro integratore in
quanto riceve molti segnali sensoriali di differente origine, li elabora e li utilizza per
formulare pensieri ed azioni.
Ciascun emisfero cerebrale è diviso in quattro regioni note come lobi. Il lobo frontale
rappresenta la parte anteriore del cervello; posteriormente ad esso si trova il lobo
parietale. Questi due lobi sono separati dal solco centrale, che percorre ciascun
emisfero del cervello. Localizzato posteriormente ed inferiormente al lobo parietale
vi è il lobo occipitale. Il lobo temporale è localizzato inferiormente ai lobi frontali e
parietale del cervello; esso è separato dal lobo frontale da un profondo solco, il solco
laterale o scissura di Silvio. All’interno di ciascun lobo, la corteccia cerebrale è
suddivisa in aree specializzate per differenti funzioni. Il lobo occipitale è anche noto
1
INTRODUZIONE
come corteccia visiva, in quanto l’elaborazione dei processi visivi avviene a tale
livello. Un altro esempio di specializzazione funzionale è fornito dalla corteccia
uditiva, un’area localizzata nella porzione superiore del lobo temporale dove si
svolgono le elaborazioni delle funzioni uditive. Nel lobo parietale vi è un’altra area
specializzata, definita come corteccia somatosensoriale primaria, implicata nei
processi relativi all’elaborazione delle informazioni sensoriali somatiche, associate
con sensazioni tattili, del prurito, della temperatura, del dolore (definite come
sensazioni somestesiche); alla corteccia somatosensoriale primaria arrivano anche
informazioni della tensione muscolare, sui legamenti e sulla posizione degli arti
(propriocezione). Il lobo frontale contiene la corteccia motoria primaria coinvolta
nella generazione di comandi discendenti che producono i movimenti volontari ed
anche aree implicate nella funzione del linguaggio, nella progettazione di compiti
motori e nella determinazione della personalità.
Molte aree della corteccia cerebrale sono organizzate topograficamente in base alla
loro funzione. Esempi di organizzazione topografico-funzionale sono rappresentati
dalla corteccia motoria primaria nel lobo frontale, dalla corteccia somatosensoriale
primaria nel lobo parietale, dalla corteccia visiva e da quella uditiva.
Le mappe dell’organizzazione somatotopica di queste due aree corticali, in cui parti
del corpo vicine sono rappresentate sulla superficie corticale in regioni vicine, sono
definite come omuncolo motorio e omuncolo sensoriale. Negli omuncoli la
rappresentazione del corpo appare grottesca e sproporzionata. In quello sensitivo
alcune regioni, soprattutto la mano e la bocca, sono ingrandite, perché la grandezza
di una regione è proporzionale al numero di recettori cutanei in essa presenti; allo
stesso modo in quello motorio mano e volto sono ingranditi proporzionalmente al
numero di placche motorie, che permettono un movimento più fino.
2
INTRODUZIONE
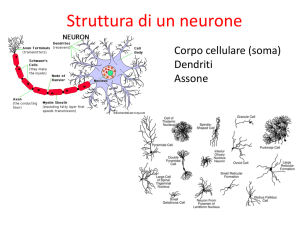
1.1 Il neurone
I neuroni, le cellule del sistema nervoso, hanno un corpo cellulare (denominato anche
soma o pericario) e almeno due processi: un assone o neurite e uno o più dendriti. Il
pericario dei neuroni per diversi aspetti assomiglia a quello delle altre cellule del
corpo; contiene un nucleo, il citoplasma, diversi organuli come mitocondri e apparato
del Golgi. Attraverso il citoplasma dei neuroni si notano sottili filamenti denominati
neurofibrille. Microtubuli e microfilamenti sono componenti addizionali del
citoscheletro del neurone. Oltre a fornire il supporto strutturale, il citoscheletro dei
neuroni forma una sorta di “binario” utilizzato per il rapido trasporto di molecole da
e per le parti terminali di un neurone.
Il reticolo endoplasmatico ruvido (RER) del corpo cellulare ha dei ribosomi che si
presentano in forma di strutture marcatamente colorabili, denominate corpi di Nissl,
che forniscono le molecole proteiche necessarie alla trasmissione degli impulsi
nervosi da un neurone ad un altro e forniscono le proteine utili per mantenere e
rigenerare le fibre nervose.
I dendriti ramificano dal pericario e conducono gli impulsi nervosi verso il pericario.
L’assone è un processo singolo che ha inizio da una parte assottigliata del pericario
denominata cono di emergenza dell’assone e conduce gli impulsi in direzione
centrifuga rispetto al corpo cellulare.
1.1.2 Tipi cellulari
Tradizionalmente, i neuroni della corteccia cerebrale sono stati classificati sulla base
di criteri strettamente morfologici: forma del loro corpo, lunghezza dell’assone,
ampiezza e distribuzione spaziale dell’albero dendritico.
Sotto un profilo prettamente morfologico è possibile classificare i neuroni in base a:
3
INTRODUZIONE
1) Numero e modalità di ramificazione dei prolungamenti:
-Neuroni unipolari: se presentano un tipo di prolungamento. Nei suddetti neuroni il
prolungamento ha valore di assone e il pirenoforo ha valore di sito recettore. Esempi
di neuroni unipolari sono i neuroni embrionali e i neuroni sensitivi primari (olfattivi e
visivi) nell'adulto.
-Neuroni bipolari: se presentano un assone e un solo dendrite. I due prolungamenti si
dipartono dagli antipodi del soma e dunque si parla più correttamente di neuroni
oppositopolari.
-Neuroni multipolari: se presentano un assone e molteplici dendriti, questi ultimi di
solito presentano aspetto arborescente. A questa classe appartengono anche i neuroni
di tipo I e II del Golgi.
-Neuroni pseudounipolari: se sembrano presentare un solo tipo di prolungamento.
Essi derivano da un neurone oppositopolare in cui si è verificato un accrescimento
eccentrico del pirenoforo con conseguente confluenza del prolungamento assonico e
dendritico, i quali continuano a mantenere la propria individualità (da qui il termine
pseudounipolare), e la caratteristica forma a "T". Esempi di neuroni pseudounipolari
sono i neuroni gangliari.
2) Aspetto formale (sono descritti solo i tre tipi più rappresentativi):
-cellule piramidali: a forma di piramide, i dendriti alla base si distribuiscono in senso
orizzontale, mentre il dendrite apicale si sviluppa in altezza. L'assone in genere si
dirige verso le zone più interne della corteccia, entrando nella sostanza bianca
sottocorticale, raggiungendo aree distanti del SNC. Collaterali dell’assone rimangono
invece all’interno della corteccia. Queste cellule, infatti, si comportano sia come
neuroni di proiezione che come interneuroni.
-cellule stellate: a forma di stella, definite anche granuli, i dendriti si ramificano nelle
4
INTRODUZIONE
immediate vicinanze del soma e l'assone può contattare cellule adiacenti oppure
finire in uno strato inferiore o superiore della corteccia cerebrale.
-cellule fusiformi: a forma di fuso con alle estremità due ciuffi dendritici. L'assone in
genere abbandona la corteccia, ma in alcuni casi può ascendere a strati più
superficiali.
Numerosi altri parametri sono stati successivamente utilizzati, come per esempio la
sede di terminazione dell’assone, il tipo di terminale sinpatico, la presenza o
l’assenza di spine dendritiche, il neurotrasmettitore prodotto e liberato, l’espressione
di altre molecole attive alla sinapsi (come i neuropeptidi) e di recettori per i
neurotrasmettitori e infine, le loro proprietà biofische. Schematicamete tutti i neuroni
della corteccia cerebrale possono essere distinti in due grandi famiglie, quella dei
neuroni piramidali e quella dei neuroni non piramidali.
1.1.2.1 Neuroni piramidali
Evidenziati mediante impregnazione argentica secondo il metodo di Golgi,
ampiamente utilizzato da Cajal, i neuroni piramidali costituiscono circa tre/quarti di
tutti i neuroni della corteccia e sono localizzati quasi esclusivamente negli strati II/III
e V-VI. Morfologicamente i neuroni piramidali sono caratterizzati da un corpo
triangolare a base inferiore, un dendrite apicale di lunghezza variabile che nella
maggior parte dei casi raggiunge gli strati superficiali e dendriti basali che emergono
dal corpo e si dirigono orizzontalmente. Dai dendriti dei neuroni piramidali possono
emergere numerose spine che rappresentano siti di contatti sinaptici. Gli assoni dei
neuroni piramidali rappresentano il canale efferente della corteccia cerebrale poiché
proiettano a regioni lontane del SNC; prima di uscire dalla sostanza grigia, emettono
numerosi rami collaterali che rimangono all’interno dell’area corticale. I terminali
5
INTRODUZIONE
assonici dei neuroni piramidali formano esclusivamente contatti sinaptici di tipo
asimmetrico (sinapsi eccitatorie) e utilizzano l’aminoacido glutammato come
neurotrasmettitore.
1.1.2.2 Neuroni non-piramidali
I neuroni non-piramidali si suddividono a loro volta in due gruppi, quelli provvisti di
spine (le cosiddette cellule stellate spinose) e quelli che ne sono sprovvisti (neuroni
non-piramidali senza spine). I neuroni non-piramidali senza spine costituiscono un
gruppo eterogeneo di cellule, formano sinapsi simmetriche e liberano GABA come
neurotrasmettitore; sono perciò interneuroni inibitori; in molti casi producono e
liberano anche un neuropeptide (per esempio sostanza P, colecistochinina,
somatostatina o polipeptide intestinale vasoattivo).
1.2 Laminazione della corteccia cerebrale
La particolarità più evidente della neocorteccia è la sua laminazione in sei differenti
strati le cui diverse caratteristiche sono rilevate con l’utilizzo di differenti metodi di
colorazione, come illustrato in figura 1.
I sei strati, dalla periferia al centro, sono così definiti:
-I strato (strato molecolare): è situato immediatamente al di sotto della pia, è spesso
chiamato anche strato acellulare. Infatti come si può osservare dalla colorazione
Nissl esso contiene poche cellule.
Questi neuroni sono tutti inibitori e fanno sinapsi principalmente su dendriti di
neuroni degli strati più profondi. Le principali strutture trovate nel I strato sono
dendriti ed assoni dei neuroni degli strati più profondi;
6
INTRODUZIONE
-II strato (strato granulare esterno): è
costituito da cellule piccole e fittamente
addensate; alcune sono piramidali (con
dendrite apicale diretto verso l’alto), altre
rotondeggianti o stellate;
-III strato (strato piramidale esterno): è
costituito prevalentemente da cellule di
forma piramidale (con dendrite apicale
verso l’alto) e di medie dimensioni; le più
grosse sono situate nella parte più profonda;
Figura 1
Laminazione della corteccia cerebrale.
-IV strato (strato granulare interno): è l’esclusiva locazione di una classe di piccole
cellule eccitatorie chiamate cellule stellate spinose. Esso contiene anche una varietà
di cellule inibitorie. Questo è il principale strato che riceve segnali afferenti che dal
talamo entrano nella neocorteccia;
-V strato (strato piramidale interno): è costituito prevalentemente da cellule
piramidali di medie o grosse dimensioni con ampie arborizzazioni dendritiche basali
e dendriti apicali che ascendono verso il primo strato e da una piccola popolazione di
cellule inibitorie: le cellule a candelabro. Queste sono cellule inibitorie che fanno
connessioni sinaptiche solo con gli assoni di altri neuroni.
-VI strato (strato multiforme): strato eterogeneo che contiene cellule di varie forme,
piramidali, piramidali invertite (con dendrite apicale diretto verso il basso),
rotondeggianti, stellate e fusate. Sono spesso distinguibili uno strato VIa (esterno e
più ricco di cellule) e uno strato VIb (interno e scarsamente popolato) che
gradualmente si fonde con la sostanza bianca.
7
INTRODUZIONE
1.3 L’isocorteccia del ratto
L’isocorteccia del ratto è stata oggetto di numerosi studi (Burwell, 2001;
Droogleever Fortuyn, 1914; Krieg, 1946a, b; Paxinos e Watson, 1986; Paxinos et al.,
1999; Schober, 1986; Svetukhina, 1962; Swanson, 1992, 1998; Von Volkmann,
1926; Zilles, 1985, 1990; Zilles e Wree, 1985; Zilles et al., 1980). Comunque le
mappe risultanti differiscono considerevolmente per il numero e la dimensione delle
aree corticali identificate. Esistono considerevoli discrepanze riguardo la
nomenclatura delle regioni isocorticali. Un metodo contiene numerosi termini
formulati in accordo con la classificazione della corteccia umana di Brodmann
(Krieg, 1947). Sebbene non sono state dimostrate omologie tra il cervello di un
primate e quello di un ratto, l’uso dei termini come aree “striate” e “peristriate”
(Montero, 1973, 1981; Montero et al., 1973) suggerisce similitudini architettoniche
tra le aree corticali dei primati e dei roditori. Zilles e Wree (1985), hanno proposto,
per l’isocorteccia del ratto, una divisione topografica in regione frontale (Fr),
parietale (Par), temporale (Te) e occipitale (Oc), che a loro volta possono essere
suddivise in parecchie aree, designate da un numero. Molte di queste aree possono
essere inoltre ulteriormente suddivise, come per esempio la corteccia visiva primaria
Oc1, che viene divisa nei sottogruppi monoculare e binoculare Oc1M e Oc1B (Zilles
et al., 1984).
Le mappe di studio sono basate su diversi metodi che includono il trasporto assonale,
l’elettrofisiologia e l’immunoistochimica. Comunque, gli studi classici si sono
affidati per lo più su osservazioni dettagliate di sezioni contenenti corpi cellulari
marcati e su criteri citoarchitettonici. Di recente, l’autoradiografia quantitativa in
vitro del recettore è stata dimostrata essere un potente strumento di mappaggio
(Zilles et al., 2002a, b). Recettori per il GABA, glutamato, acetilcolina,
8
INTRODUZIONE
noradrenalina e serotonina sono eterogeneamente distribuite in tutta la corteccia
cerebrale e mostrano differenze regionali sia per quanto riguarda la loro densità che
per quanto riguarda la distribuzione laminare. Inoltre, l’autoradiografia rivela
l’organizzazione chemoarchitettonica del cervello che è correlata con la sua cito e
mieloarchitettonica così come con la sua organizzazione funzionale (Zilles et al.,
2002a). Dato che un singolo neurone esprime molti sottotipi recettoriali relativi a
diversi sistemi neurotrasmettitoriali, una singola area architettonica potrà contenere
molti sottotipi diversi di recettore. L’isocorteccia del ratto è caratterizzata dalla tipica
organizzazione laminare in 6 strati che corrono parallelamente alla superficie
corticale, come descritto al paragrafo 1.2.
Aree con funzioni motorie sono caratterizzate da un sviluppo minimo o quasi assente
dello strato granulare interno (Brodmann, 1909); al contrario, le aree sensoriali hanno
un cospicuo strato granulare interno che è il bersaglio di numerose afferenze di
nuclei talamici specifici.
1.3.1 Sviluppo pre-natale e post-natale della corteccia cerebrale di ratto
Una serie di affascinanti processi portano allo sviluppo della corteccia cerebrale,
struttura vitale per l’integrazione degli input sensoriali e per le funzioni cognitive e
comportamentali. Sebbene la corteccia cerebrale possa essere divisa, sulla base delle
caratteristiche strutturali e funzionali, in differenti aree corticali, la sua generale
uniformità e composizione cellulare tra regioni e specie è cospicua (Rockel et al.,
1980). Le differenze tra le aree corticali sembrano essere basate principalmente sulle
variazioni nei modelli di connettività che inducono differenze nelle funzioni. Nei
primi anni settanta si pensava che si sapesse quasi tutto sulla formazione morfologica
degli strati corticali (Boulder Committee, 1970); negli ultimi due decenni invece,
9
INTRODUZIONE
diverse sono state le scoperte da parte dei ricercatori, grazie all’utilizzo di tecniche
morfologiche e molecolari.
1.3.2 Formazione della corteccia cerebrale
Differenti definizioni sono utilizzate in letteratura per indicare i tempi dello sviluppo
pre-natale del ratto. Molti studi riguardo lo sviluppo pre-natale del sistema nervoso,
definiscono la notte dell’accoppiamento come E0 e il giorno seguente, per esempio,
il giorno in cui lo sperma è visto per la prima volta negli strisci vaginali, come E1
(Hicks e D’Amato, 1968; König et al., 1975; Chronwall e Wolff, 1981; Raedler e
Raedler, 1978; Van Eden, 1986; Miller, 1987; Cavanagh e Parnavelas, 1988;
Kalsbeek et al., 1988). Un altro sistema di descrizione, usato meno frequentemente
nella neuroembriologia del ratto, è quello proposto da Witschi (1962). Questo
sistema in cui l’età è espressa in giorni dopo quello della fecondazione, è stato
utilizzato da altri autori come Derer (1979), Beaudoin (1980), Gardette et al. (1982) e
Floeter e Jones (1985). In questo sistema la conta comincia 8 ore dopo la
copulazione, e, di conseguenza, il giorno in cui si trova la presenza di sperma per la
prima volta negli strisci vaginali è chiamato E0. La neocorteccia di un ratto adulto
contiene circa 34 milioni di neuroni , che sono prodotti principalmente durante gli
ultimi dieci giorni di gestazione (Rickmann et al., 1977; Raedler et al., 1980; Miller,
1988). È stato stimato che in media si formano circa 2400 neuroni corticali al minuto
nella seconda metà del periodo pre-natale, sebbene l’attività mitotica nel telencefalo
durante questo periodo non è costante (Raedler et al., 1980).
La struttura dell’ectoderma specializzata dalla quale origina il sistema nervoso
centrale è la piastra neurale. Da E10 a E11 la piastra neurale nel ratto comincia a
fondersi per formare il tubo neurale che si chiude a E12 (Witschi, 1962). La corteccia
10
INTRODUZIONE
cerebrale origina dalla parete del tubo neurale come un’estensione delle due
vescicole telencefaliche. Durante i primi stadi dello sviluppo del telencefalo, la
parete del tubo neurale mostra una struttura omogenea. I fusi mitotici delle cellule
germinali in divisione sono visibili vicino al ventricolo o alla membrana interna
(Sauer, 1935). Dopo la sintesi del DNA, il nucleo delle cellule germinali ritorna al
ventricolo, per cominciare la configurazione dei fusi mitotici. Questo movimento
nucleare è chiamato migrazione intercinetica nucleare. Il ciclo cellulare delle cellule
germinali corticali della corteccia cerebrale del ratto dura 11 ore ad E12 e aumenta
gradualmente a circa 19 ore a E18 e così via (Waechter e Jaensch, 1972). Sulla base
di questi dati si stima che nel ratto il numero di cellule germinali richieste per la
produzione di 2400 neuroni corticali al minuto deve essere da circa 1,5 milioni a 2,8
milioni. Da E13 la parete neurale del telencefalo perde la sua struttura omogenea e si
sviluppa la laminazione fetale. A E13 il plexiform primordium (PP), anche chiamato
preplate (Rickmann e Wolff 1981; Smart 1983; Stewart e Pearlman, 1987), inizia a
formarsi nella parte più
laterale
della
parete
neurale del telencefalo
(Fig. 2), che delimita lo
sviluppo dello striato e
della paleocorteccia. In
Figura 2
Schema di quattro differenti stadi nella laminazione fetale della corteccia cerebrale. V = zona
ventricolare; PP = plexiform primordium (preplate); IZ = zona intermedia; MZ = zona marginale;
CP = cortical plate; SP (SCP) = subplate; SV = zona sub ventricolare.
questa zona esterna della
parete
cerebrale,
fibre
tangenziali entrano poco prima dell’arrivo dei primi neuroni corticali (Marin-Padilla
1971; Raedler e Raedler, 1978). Il PP è separato in due zone, la zona marginale (MZ)
e la sub-cortical plate (SCP) (Kostović e Molliver, 1974) dalla formazione della
11
INTRODUZIONE
cortical plate (CP) da E15 a E17. A E15 le prime vere cellule della CP sono visibili
nella parte più laterale della corteccia e due giorni dopo, a E17, nella parete mediale
del telencefalo. Dalla CP si formeranno più tardi gli strati corticali dal VIa al II.
Prima che la CP diventi visibile, la zona sub-ventricolare (SV) è discernibile sopra la
VZ, approssimativamente a E15 (Raedler et al., 1980; Rakic, 1982). La zona
intermedia (IZ), più tardi, diventa la sostanza bianca sottocorticale, anche chiamata
sostanza bianca fetale, sebbene la mielinizzazione non cominci se non a parecchi
giorni dopo la nascita. Inizialmente la IZ ha una densità cellulare leggermente
inferiore a quella della SV e della VZ. In aggiunta ai neuroni che migrano
radialmente, essa contiene corpi cellulari orientati che sono piuttosto piccoli rispetto
a quelli della SV e della SP e fibre
che corrono tangenzialmente. Le
cellule della CP iniziano ad essere
prodotte ad E13, con un picco da
E16 a E17 (Berry e Rogers, 1965;
Raedler et al., 1980; Miller, 1988).
Molti
Figura 3
Tempo di origine dei neuroni di proiezioni cortico-corticali nella corteccia visiva
di ratto, determinato da tecniche di double-labeling.
studi
neurogenesi
dettagliati
della
della
corteccia
cerebrale di ratto (Berry e Rogers, 1965; Hicks e D’Amato, 1968; Brücker et al.,
1978; Raedler et al., 1980, Miller, 1985) hanno riportato che i neuroni che sono
generati prima sono depositati negli strati più bassi della CP, mentre quelli prodotti
più tardi, negli strati più superficiali (con l’eccezione del I strato) (Fig. 3). Quasi tutti
i neuroni corticali del ratto sono prodotti prima della nascita con la sola eccezione di
pochi neuroni nello strato IV (Kaplan, 1981). Nei primati tutti i neuroni neocorticali
sono generati molto prima della nascita (Rakic, 1988), nella corteccia cerebrale di
12
INTRODUZIONE
ratto, invece, si generano anche molte cellule gliali. Le cellule della glia radiale sono
generate nei primi mesi dello sviluppo pre-natale insieme ai neuroni corticali
(Rickmann e Wolff, 1985; Gadisseux e Evrard, 1985); gli astrociti non radiali
vengono prodotti poco più tardi. Il numero degli astrociti, mentre nella sostanza
grigia corticale aumenta fino alla seconda o terza settimana dopo la nascita (Ling e
Leblond, 1973; Parnavelas et al., 1983), nella sostanza bianca aumenta
continuamente (Sturrock, 1986). Gli oligodendrociti sono l’ultimo tipo di cellule
gliali che compaiono e crescono in numero significativo nel corpo calloso 12 giorni
dopo la nascita, immediatamente prima dell’inizio della mielinizzazione (Valentino e
Jones, 1982; Sturrock, 1976).
1.3.3 Migrazione dei neuroni
I neuroni migrano dalla VZ verso la loro destinazione nella corteccia cerebrale.
Queste cellule si pensa che si muovano lungo le fibre della glia radiale (Rakic, 1972;
1988) più o meno radialmente (Fig. 4). La migrazione diretta radialmente dei neuroni
corticali è stata recentemente discussa da Sane (1989) sulla base dei recenti studi che
hanno utilizzato la tecnica di trasferimento genico mediata da retrovirus. Fibre
afferenti da diversi siti sottocorticali e da altre aree corticali stanno temporaneamente
nella SCP e nella MZ prima di entrare nella CP (Molliver et al., 1973; Kristt e
Molliver, 1976; König e Marty, 1981; Lund e Mustari, 1977; Wise e Jones, 1978;
Schlumpf et al., 1980; Crandall e Caviness, 1984; Van Eden, 1986).
13
INTRODUZIONE
Figura 4
Migrazione dei neuroni secondo l’ipotesi di Rakic (1988) e Smart e McSherry (1982).
A questo stadio i neuroni che migrano verso gli strati superiori della CP passano
questo sistema di fibre afferenti. L’ipotesi dell’unità radiale (Smart e McSherry,
1982; Rakic, 1988) postula che le unità proliferative (ad esempio un piccolo numero
di cellule staminali) producono coorti di neuroni che migrano lungo la glia radiale;
queste unità proliferative, inoltre, guidano queste coorti di cellule all’interno della
corteccia. Quello che ne consegue è la parcellazione corticale in differenti aree
citoarchitettoniche, legata molto probabilmente anche a differenze negli input
afferenti.
1.3.4 Crescita post-natale della corteccia cerebrale
La crescita post-natale della corteccia cerebrale di ratto, escludendo l’ippocampo, è
mostrato in figura 5.
14
INTRODUZIONE
Figura 5
Sviluppo della corteccia cerebrale (peso in relazione all’età).
Si può notare che a 30 giorni c’è una chiara differenza di peso della corteccia sia per
quanto riguarda i ratti maschi che i ratti femmina e c’è un piccolo cambiamento dopo
il 60° giorno quando si raggiungono i valori dell’adulto. Quando si comparano i dati
della corteccia cerebrale con il peso del corpo si notano 3 fasi: la prima fase di rapida
crescita (dalla nascita fino all’ottavo giorno), la fase di transizione (dall’ottavo
giorno al diciassettesimo) e la fase matura (dal diciassettesimo giorno al
centoottantesimo).
1.3.5 Asimmetria cerebrale durante lo sviluppo post-natale
La corteccia cerebrale del ratto appare asimmetrica (Diamond, 1987; Kolb et al.,
1982) sia durante lo sviluppo, che in età adulta. Per esempio Diamond (1987) ha
trovato che i ratti maschi Long-Evans mostrano un maggiore significativo spessore
nell’emisfero destro rispetto a quello sinistro e che questa differenza è visibile dal
sesto giorno. Nelle femmine Long-Evans invece non sono state trovate differenze
nello spessore tra i due emisferi, né durante lo sviluppo, né durante l’età adulta
(Diamond 1987). Questo dimorfismo sessuale nello spessore corticale è stato
15
INTRODUZIONE
confermato da Stewart e Kolb (1988) per i ratti Sprague-Dawley. Inoltre gli studi
condotti da Stewart e Kolb (1988) e da Fleming e colleghi (1986) indicano che nel
periodo pre-natale, gli ormoni testicolari, impediscono l’aumento dello spessore della
corteccia cerebrale sinistra, causando differenze destra-sinistra nello spessore
corticale dei ratti maschi.
1.3.6 Sviluppo post-natale dei dendriti corticali
Molto del volume della corteccia cerebrale è occupato dai dendriti. Alla nascita le
cellule corticali piramidali e non, hanno un piccolo albero dendritico.
La maturazione dei dendriti dei neuroni è principalmente un fenomeno postnatale.
D’altra parte i neuroni corticali piramidali di proiezione hanno dei lunghi processi
assonali che discendono da molte aree corticali come per esempio dalla corteccia
visiva (Stanfield e O’Leary, 1985) e prefrontale (Van Eden et al., 1990; Joosten e
Van Eden., 1989), ad altre regioni, midollo spinale e tronco encefalico. Differenti
ipotesi possono essere proposte sullo sviluppo dendritico: neuroni localizzati in strati
ontogeneticamenete più vecchi, maturano più precocemente, neuroni di proiezione
(piramidali) maturano più precocemente dei neuroni del circuito locale (nonpiramidali), o il fatto che cellule più grandi si differenziano prima di quelle piccole
(Jacobson, 1978; Lund, 1978).
1.3.6.1 Coni di accrescimento
Terminata la fase di generazione delle cellule nervose, gruppi di neuroni devono
interconnettersi per costituire i circuiti nervosi alla base delle funzioni del sistema
nervoso. Il primo passo di questo processo porta al differenziamento di assoni e
dendriti sulle cellule nervose neoformate. Il fatto che fin dall’inizio in un neurone si
16
INTRODUZIONE
formi tipicamente un singolo assone e molteplici dendriti dipende dalla
polarizzazione cellulare, un processo che, a sua volta, dipende dall’interazione tra
proteine presenti in regioni diverse del citoscheletro di un neurone. Una volta che gli
assoni si sono formati, crescono per raggiungere gli appropriati bersagli cellulari,
situati in prossimità o a distanza, e giunti a destinazione, iniziano a stabilire le
connessioni sinaptiche che formeranno i circuiti nervosi. Il corretto orientamento
dell’accrescimento degli assoni e il riconoscimento degli appropriati bersagli
sinaptici dipendono dalle funzioni delle strutture apicali specializzate dell’assone, i
coni di accrescimento. Questi coni sono strutture specializzate, presenti
transitoriamente durante lo sviluppo neuronale, responsabili della crescita degli
assoni e del loro orientamento verso i relativi bersagli. La principale caratteristica
morfologica di un cono di accrescimento è un’espansione laminare della punta
dell’assone detta lamellipodio. Quando i coni di accrescimento vengono esaminati in
vitro, si nota che dalla superficie dei lamellipodi, chiaramente visibili, si estendono
numerosi esili prolungamenti, detti filopodi (Bunge, 1973). Le proprietà di motilità
dei coni di accrescimento permette loro di avvicinare, selezionare o evitare un
bersaglio grazie alle funzioni dell’actina e dei microtubuli del citoscheletro modulate
da numerosi meccanismi di segnalazione, molti dei quali comportano cambiamenti di
concentrazione del Ca2+ intracellulare. Le istruzioni che regolano queste risposte dei
coni di accrescimento sono dettate da molecole ad azione adesiva, chemiotropica,
chemiorepellente e trofica, presenti nella matrice extracellulare, sulle superfici
cellulari o sono secrete per diffondere negli spazi extracellulari.
Una possibile spiegazione per la crescita preferenziale dei dendriti all’interno della
zona marginale proviene dall’osservazione che la predominante, anche se non
esclusiva, risorsa di potenziali elementi presinaptici nella regione dei neuroni motori,
17
INTRODUZIONE
durante il primo periodo della sinaptogenesi, è localizzato nella zona marginale
(Vaughn e Grieshaber, 1973; Vaughn et al., 1975). La relazione temporale tra le
proporzioni dei contatti sinaptici che coinvolgono i coni di accrescimento dendritici e
i dendriti differenziati possono essere interpretati nel senso che gli assoni
presinaptici, in maniera predominante, fanno sinapsi con i filopodi non appena la
crescita dendritica entra nella zona marginale e che, non appena le sinapsi si
formano, i dendriti motori continuano a crescere lateralmente lasciando le sinapsi
neoformate dietro sui loro segmenti progressivamente più differenziati. Questo tipo
di crescita dendritica potrebbe avvenire con questa sequenza: un filopode dendritico
contattato sinapticamente si espande mediante un flusso protoplasmatico dal suo
stesso cono di accrescimento e non appena questo filopode diventa un nuovo cono di
accrescimento, l’originale inizia a sviluppare le caratteristiche di un dendrite
differenziato. Il nuovo cono di accrescimento formato, poi, dà luogo a nuovi filopodi
e la ripetizione di questi eventi produce sinapsi che inizialmente sono localizzate sui
filopodi, poi sui coni di
accrescimento e quindi
sui dendriti differenziati
senza cambiare le loro
posizioni
nella
zona
marginale (Fig. 6).
Inoltre, nei primi stadi
Figura 6
Rappresentazione della sequenza temporale per la formazione di giunzioni sinaptiche sui dendriti
di neuroni motori. I numeri indicano la stessa giunzione sinaptica a differenti stadi della crescita
dendritica.
della crescita dendritica in
una determinata regione
sinaptogenica, si dovrebbero trovare più sinapsi sulle parti di dendriti in crescita,
mentre molti meno dovrebbero essere i dendriti differenziati.
18
INTRODUZIONE
I dendriti neuronali motori appaiono crescere nella zona marginale in associazione
con le fibre della glia radiale.
Comunque, una volta che essi arrivano nel campo sinaptogenico fornito dalla zona
marginale, molti dendriti si ramificano lontano dai processi della glia radiale. Questo
potrebbe essere causato da un contatto sinaptico con un filopode dendritico che si
estende lontano dai processi radiali, permettendo così ad esso di diventare un nuovo
cono di accrescimento, con seguente crescita, deviata lontano dai procesi della glia
radiale (Henrikson e Vaughn, 1974).
Se, al contrario, un filopode sondando il piano dei processi radiali, è il primo a
ricevere un contatto sinaptico, esso potrebbe diventare il nuovo cono di
accrescimento e la crescita dendritica potrebbe continuare lungo i processi gliali. Una
combinazione di questi due eventi che si verificano nello stesso momento potrebbe
portare ad una ramificazione dendritica, con un ramo che viene deviato dai processi
della glia radiale e l’altro che continua lungo il piano radiale (Fig. 6).
Cajal (1909) ha notato che i coni di accrescimento contengono neurofibrille rese
visibili con nitrato di argento. Studi successivi di microscopia elettronica condotti da
Bodian (1966), Bodian et al. (1968) e da Del Cerro e Snider (1968) danno maggiore
enfasi ai coni di accrescimento di assoni e dendriti.
Essi hanno notato la presenza di complessi del reticolo endoplasmatico liscio ma
hanno dato poca attenzione ai filopodi che sono stati scoperti solo recentemente da
Tennyson (1970).
Le sue varicosità con estensioni simili a dita sembrano
corrispondere a ciò che è stato descritto da Cajal come “giganteschi coni di
accrescimento” sebbene le punte più sottili dei filopodi sono al di sotto del potere di
risoluzione di un microscopio ottico. Lo studio di Kawana et al., (1971) in ratti e
gatti è in pieno accordo con le scoperte di Tennyson. I coni di accrescimento sono
19
INTRODUZIONE
stati osservati nei pericaria così come nei processi nervosi di crescita e consistono in
un gonfio citoplasma dal quale sporgono sottilissimi filopodi. Come dimostrato in
colture di tessuto nervoso da Pomerat et al., (1967) i coni di accrescimento
contengono cospicue quantità di vacuoli.
1.3.6.2 Spine dendritiche e somatiche
Molte sinapsi nel cervello coinvolgono piccole protrusioni delle ramificazioni
dendritiche note come spine; queste possono anche essere presenti sul soma. Le spine
si distinguono per la presenza di estremità globulari chiamati corpi delle spine,
connessi allo stelo principale dei dendriti attraverso sottili connessioni chiamate
peduncoli delle spine. Appena al di sotto del sito di contatto tra i peduncoli e i corpi
del spine, ci sono strutture intracellulari definite addensamenti postsinaptici.
Il numero, la grandezza e la forma delle spine dendritiche sono molto variabili e
possono, almeno in alcuni casi, cambiare dinamicamente nel tempo. Dalla prima
descrizione di queste strutture da parte di Santiago Ramón y Cajal verso la fine del
diciannovesimo secolo, le spine dendritiche hanno affascinato generazioni di
neuroscienziati, generando molte supposizioni sulla loro funzione. Una delle ipotesi
iniziali era che lo stretto peduncolo della spina isolasse elettricamente le sinapsi dal
resto nel neurone. Dal momento che le dimensioni dei peduncoli delle spine si
possono modificare, questo meccanismo potrebbe far sì che le singole sinapsi
possano cambiare fisiologicamente nel tempo, fornendo quindi un meccanismo
cellulare per forme di plasticità sinaptica (Bhatt et al., 2009).
Attualmente un’altra teoria, concettualmente più attendibile dal punto di vista
funzionale, sostiene che le spine possano costituire compartimenti biochimici.
Quest’idea è basata sulla supposizione che il peduncolo della spina possa prevenire
20
INTRODUZIONE
la diffusione di segnali biochimici dal corpo della spina al resto del dendrite. Diverse
osservazioni sono a favore di questo concetto. Innanzitutto prove sperimentali
mostrano che il peduncolo della spina serve effettivamente da barriera alla
diffusione; inoltre le spine sono presenti solo sulle sinapsi eccitatorie dove è noto che
la trasmissione sinaptica genera molti segnali che diffondono il Ca2+ (Sabatini et al.,
2002).
Un’altra e meno controversa teoria è che le spine abbiano un significato di serbatoio
dove possono essere concentrate proteine segnale come i bersagli molecolari del
Ca2+, dell’IP3 e della ras. A sostegno di questa ipotesi, sui corpi delle spine, è
presente un’elevata concentrazione di recettori del glutammato e l’addensamento
post-sinaptico è costituito da dozzine di proteine coinvolte nella trasduzione del
segnale intracellulare (Sheng e Kim, 2002).
1.4 Corteccia parietale
La corteccia parietale comprende quattro aree: Par1, Par2; FL (area dell’arto
inferiore), e HL (area dell’arto posteriore) (Zilles, 1985; Zilles e Wree, 1985). Queste
aree sono circondate medialmente dalla corteccia motoria primaria (Fr1, Fr3),
rostralmente dalla corteccia visiva secondaria (Oc2ML, Oc2L), caudalmente dalla
corteccia uditiva e basalmente dalla corteccia insulare.
La regione parietale ha uno strato granulare interno altamente visibile e rappresenta
la corteccia somatosensoriale. Par1, FL e HL costituiscono l’area primaria e Par2
l’area somestesica seconda (Welker, 1971, 1976; Welker e Sinha, 1972; Woolsey e
LeMessurier, 1984). Le aree parietali ricevono input dai meccanocettori (Welker
1971, 1976) ed hanno collegamenti associativi e callosali con le aree motorie e
21
INTRODUZIONE
somatosensoriali (Akers e Killackey, 1978; Ivy e Killackey, 1981; Jacobson, 1970;
Wise, 1975).
22
INTRODUZIONE
Capitolo II
LE TACHICHININE
2.1 Struttura delle tachichinine
La famiglia delle tachichinine (TKs) rappresenta una delle più vaste famiglie di
peptidi descritte negli animali. Finora sono state isolate più di 40 tachichinine dagli
invertebrati (insetti, vermi e molluschi), protocordati e dai tessuti dei vertebrati
(pelle, tratto gastrointestinale, sistema nervoso centrale e periferico). La sostanza P
(SP), isolata in forma pura dall’ipotalamo bovino nel 1931 e la cui struttura è stata
definita molti anni dopo il chiarimento della struttura dell’eledoisina dai tessuti di
mollusco (Anastasi e Erspamer, 1962; Erspamer e Falconieri Erspamer, 1962) e della
fisalemina dalla pelle degli anfibi (Anastasi et al., 1964; Erspamer et al., 1964),
potrebbe essere considerata il prototipo delle tachichinine. Altre 19 tachichinine sono
state isolate dal tegumento degli anfibi e altri 8 peptidi sono stati isolati dallo
stomaco e dal cervello degli anfibi. Per quanto riguarda le tachichinine del
mammiferi finora solo tre ne sono state isolate e sequenziate: SP, NKA
(neuromedina L, neurochinina e sostanza k) e NKB (neurochinina e neuromedina k).
L’NKA è presente anche in altre due forme: neuropeptide K e neuropeptide γ
(Tabella 1).
Le tachichinine, tuttora definite come peptidi avente il caratteristico pentapeptide
all’estremità C terminale Phe-Xaa-Gly-Leu-Met-NH2, sono state identificate come
“tachichinine aromatiche” quando Xaa è un residuo aminoacidico aromatico (Phe o
Tyr) e come “tachichinine alifatiche quando Xaa è un residuo aminoacidico alifatico
(Val o Ile).
23
INTRODUZIONE
Peptide/ Fonte
SP
Ipotalamo bovino
NKA
Midolllo spinale
porcino
NKB
Midollo spinale
porcino
Neuropeptide –γ
Intestino del coniglio
Neuropeptide K
Cervello porcino
Struttura primaria
Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-GlyLeu-Met-NH2
His-Lys-Asp-Ser-Val-Phe-Gly-Leu-MetNH2
Referenza
Chang et al., 1971
Asp-Met-His-Asp-Phe-Phe-Val-Gly-LeuMet-NH2
Kangawa et al., 1983
Asp-Ala-Gly-His-Gly-Gln-Ile-Ser-HisLys-Arg-Lys-Asp-Ser-Val-Phe-Gly-LeuMet-NH2
Asp-Ala-Asp-Ser-Ser-Ile-Glu-Lys-GlnVal-Ala-Leu-Leu-Lys-Ala-Leu-Tyr-GlyHis-Gly-Gln-Ile-Ser-His-Lys-Arg-HisGly-Gln-Ile-Ser-His-Lys-Arg-Lys-AspSer-Val-Phe-Gly-Leu-Met-NH2
Kage et al., 1988
Kimura et al., 1983
Tatemoto et al., 1985
Tabella 1
Sequenze aminoacidiche delle tachichinine dei mammiferi.
Tutte le tachichinine naturali sono amidate al loro C terminale e questa caratteristica
è fondamentale per la loro attività biologica. I peptidi deamidati sono praticamente
inattivi (Erspamer, 1994). Gli studi sulla relazione struttura/attività hanno stabilito
che il pentapeptide al C terminale è essenziale ma non sufficiente per l’attività
biologica delle tachichinine. Per garantire l’attività la catena deve avere una
lunghezza minima di 6 aminoacidi.
Studi hanno anche riconosciuto cruciali per l’attività biologica, il residuo Phe in
posizione 5 dall’estremità C-terminale e l’amidazione al C-terminale, presenti
entrambi in tutte le tachichinine dei vertebrati e degli invertebrati.
L’attività biologica delle tachichinine dipende dalla loro interazione con tre recettori
accoppiati a proteine G: l’NK1, l’NK2 e l’NK3 piccole proteine di 350-500 residui
aminoacidici, che condividono una notevole omologia strutturale che riflette il loro
comune meccanismo di azione. La maggiore affinità per la SP è data dal recettore
NK1, mentre i recettori NK2 e NK3 mostrano una più alta affinità rispettivamente per
l’NKA e l’NKB. Quindi tutte le tachichinine potrebbero agire come agonisti su tutti e
24
INTRODUZIONE
tre i tipi di recettore, sebbene qualche volta con considerevoli differenti affinità
(Regoli et al., 1987, 1994; Maggi et al., 1993).
Biosaggi paralleli su un numero di sistemi isolati e test in situ, utilizzando le
tachichinine naturali e analoghi selettivi sintetici, studi di legame con radioligandi e
l’uso di antagonisti con crescente potenza e selettività hanno portato alla conclusione
che tutti e tre i principali recettori sono entità eterogenee con sottotipo NK1, NK2 e
NK3 (Maggi et al., 1993; Quartara e Maggi, 1997, 1998). Il principale sistema di
secondo messaggero accoppiato per attivare i tre recettori conosciuti, è la
stimolazione della fosfolipasi C, che porta alla rottura del fosfoinositolo e
all’aumento del calcio intracellulare (Guard e Watson, 1991). Ad alte concentrazioni
di tachichinine, potrebbero entrare in gioco anche la stimolazione dell’adenilato
ciclasi e la formazione dell’cAMP (Nakajima et al., 1992). I loops extracellulari di
questi recettori accoppiati alla proteina G probabilmente hanno la specifica funzione
di selezionare un ligando, mentre l’interazione del ligando con i domini
transmembrana è responsabile dell’attivazione del recettore. Le tachichinine quindi,
presumibilmente, contengono una sequenza che interagisce con i loops extracellulari
del recettore e una sequenza che interagisce con i domini transmembrana. Uno studio
recente ha permesso di chiarire l’importanza cruciale e l’influenza di molti
aminoacidi chiave nella sequenza delle tachichinine sulla selettività e attività del
recettore (Severini et al., 2000):
-residui occupanti la posizione 7 dall’estremità C terminale: dall’estremità C
terminale l’aminoacido in posizione 7 sembra dirigere il peptide ligando verso il
recettore. La SP e le tachichinine con un residuo neutro o basico in questa posizione
hanno una preferenza per il recettore NK1. I residui neutri sono generalmente
25
INTRODUZIONE
idrofilici e la prolina in posizione 8 dal C terminale può aumentare l’affinità per il
recettore NK1. Le tachichinine con un residuo acido in posizione 7 o una coppia di
residui acidi in posizione 6 e 7 dal C terminale dirigono i peptidi verso i recettori
NK2 e NK3. In modo interessante il secondo loop extracellulare ha 4 residui acidici e
4 residui basici nel recettore NK1 del ratto, tre acidici e due basici nel recettore NK2 e
uno acidico e 5 basici nel recettore NK3;
-residui occupanti la posizione 4 dal C-terminale: in tutte le tachichinine naturali la
posizione 4 dal C terminale è occupata da un aminoacido aromatico (Phe, Tyr) nelle
tachichinine aromatiche o da uno alifatico (Val, Ile) nelle tachichinine alifatiche. La
presenza di un residuo aromatico, invariabilmente, determina la selettività o
l’aumento della selettività del peptide verso il recettore NK1. Questo è vero non solo
quando un residuo aminoacidico neutro o basico occupa la posizione 7 dal C
terminale ma anche quando un residuo acidico occupa la posizione 7. La coppia di
residui aromatici (Phe-Tyr o Phe-Phe) presente nel “message domain” delle
tachichinine determina il legame specifico con il dominio transmembrana del
recettore NK1;
-residui occupanti la posizione 6 dal C terminale: la presenza di un residuo di prolina
in posizione 6 dal C terminale causa una profonda diminuzione dell’attività
biologica;
-residui di prolina nella sequenza N terminale: nella maggior parte delle tachichinine
che preferiscono il legame con l’NK1 è presente un residuo di prolina nella posizione
8, adiacente al cruciale residuo neutro o basico occupante la posizione 7. La prolina
26
INTRODUZIONE
in questa posizione potrebbe modificare la conformazione della sequenza C
terminale delle tachichinine e aiutare ad aumentare la loro affinità e selettività per il
recettore NK1. Cascieri ad altri (1992) hanno suggerito che tutte le tachichinine
contenenti la prolina in posizione 8 dal C terminale, come per esempio la SP,
riducono di gran lunga l’affinità per i recettori NK2 e NK3 e hanno attribuito questo
comportamento al fatto che i peptidi contenenti prolina hanno una conformazione
preferita per l’NK1 e sfavorevole per i recettori NK2 e NK3.
Le tachichinine dei mammiferi derivano da due geni (preprotachichinine): il gene
PPT-A che codifica per la SP, NKA, neuropeptide K e neuro peptide-γ e il gene PPTB che codifica per l’NKB (Nawa et al., 1983; Kotani et al., 1986; Bonner et al.,
1987; Krause et al., 1987). Le tachichinine vengono liberate dai loro precursori in
seguito all’azione di specifiche proteasi. I tipici punti di rottura sono Lys-Arg, ArgArg, Arg-Lys e il taglio è effettuato da sei gruppi di enzimi proteolitici chiamati
convertasi (Chretien et al., 1989; Steiner et al., 1992; Marcinkiewicz et al., 1993).
L’amidazione del terminale COOH dopo il taglio è prodotta dalla sequenza
precursore Gly-Leu-Met-Gly-Lys-Arg, in cui la glicina agisce da donatore. Come
tutti i neurotrasmettitori conosciuti, anche le tachichinine neuronali sono rilasciate
dalla
fibra
nervosa
dopo
un
meccanismo
calcio-dipendente
in
risposta
all’applicazione di stimoli fisiologici e non (stimolazione elettrica, depolarizzazione
con potassio o dopo legame con la capsaicina) (Maggi et al., 1993). Per quanto
concerne il rilascio, due sono i punti fermi stabiliti. Il primo punto è il fatto che,
come le amine biogene che sono considerate “trasmettitori rapidi” e che in certe
condizioni possono essere rilasciate massivamente, il rilascio dei neuropeptidi,
considerati “trasmettitori lenti” o modulatori, è probabilmente discreto e duraturo. Il
27
INTRODUZIONE
secondo punto fermo è che, a livello dei terminali delle fibre, specialmente nel
cervello e nel sistema nervoso autonomo, il rilascio di un singolo trasmettitore è
improbabile e in ogni caso, deve rappresentare un’eccezione. Il concetto di corilascio di differenti peptidi, amine, aminoacidi e purine, ora, è generalmente
accettato dopo la dimostrazione immunoistochimica dell’accumulo di più sostanze
attive nel materiale granulare dei singoli neuroni (Hökfelt et al., 1986). Una volta
rilasciate, le tachichinine potrebbero essere attaccate, tagliate e inattivate da
numerosi
enzimi
proteolitici
che
comunque
agiscono
con
intensità
considerevolmente differenti sulle diverse tachichinine. Il peptide più vulnerabile
sembra essere la SP, mentre i peptidi che hanno al loro N-terminale il residuo pGlu
sembrano essere molto più resistenti all’attacco enzimatico. Nella degradazione
proteolitica della SP, tre enzimi sembrano avere un ruolo predominante: dipeptidilamino peptidasi, endopeptidasi postprolina e catepsina D. (Regoli et al., 1994).
2.2 Localizzazione
Le tachichinine possiedono un’ampia distribuzione nel SNC e nel SNP che è
decisamente la maggior sorgente di questi peptidi. Comunque le tachichinine hanno
anche, come numerosi altri peptidi e come tutte le amine biogene, una distribuzione
limitata e specie-dipendente, ma non trascurabile nelle strutture non neuronali in cui
essi dimostrano funzioni più o meno conosciute. Nella prima localizzazione (cellule
neuronali) i composti attivi agiscono come neurotrasmettitori/neuromodulatori, nella
seconda (cellule non neuronali) come regolatori autocrini, paracrini o endocrini. Per
molti anni, le tachichinine sono state considerate quasi esclusivamente come peptidi
di origine neuronale. L’NKB è presente nel sistema nervoso centrale e nel midollo
spinale (Kangawa et al., 1983; Moussaoui et al., 1992; Goubillon et al., 2000;
28
INTRODUZIONE
Patacchini et al., 2000), mentre la SP e la NKA sono state trovate nel sistema
nervoso centrale ed anche nei neuroni primari afferenti sensoriali fornendo un
numero di tessuti periferici (Holzer, 1988; Maggi e Meli, 1988; Lundberg, 1996;
Patak et al., 2000). La SP e l’NKA sono rilasciati dai terminali nervosi sia nel
midollo spinale che a livello periferico e agiscono da neurotrasmettitori eccitatori
(Lembeck e Holzer, 1979; Maggi, 1991a; Otsuka e Yoshioka, 1993; Meini e Maggi,
1994; Patacchini et al., 1998; Patak et al., 2000).
I dati sulla distribuzione e localizzazione delle tachichinine neuronali nel SNC e in
periferia, sono state ottenute con una combinazione di HPLC e saggi
radioimmunologici e/o tramite tecniche di immunoistochimica (Hökfelt et al., 1975,
1977; Pernow, 1983; Maggio, 1985). La distribuzione delle tachichinine nel SNC è
stata ampiamente studiata solo nel ratto (Otsuka e Yoshioka, 1993). I dati riguardo le
altre specie sono scarsi. Come ci si aspettava la SP è generalmente cosintetizzata,
colocalizzata e cosecreta con l’NKA. I valori della SP immunoreattiva nelle varie
aree cerebrali sono (Kanazawa e Jessell, 1976; Douglas et al., 1982) :
tubercoli olfattori
amigdala
nucleo caudato
globo pallido
setto
ipotalamo
abenula
neuroipofisi
nucleo talamico
substantia nigra
PAG
locus ceruleus
nuclei parabrachiali
medulla oblungata
corno dorsale del midollo spinale
corno ventrale del midollo spinale
300 pmol/g di tessuto secco
383 pmol/g di tessuto secco
247 pmol/g di tessuto secco
332 pmol/g di tessuto secco
116 a 405 pmol/g di tessuto secco
208 a 626 pmol/g di tessuto secco
377 pmol/g di tessuto secco
489 pmol/g di tessuto secco
25 pmol/g di tessuto secco
1725 a 2580 pmol/g di tessuto secco
590 a 994 pmol/g di tessuto secco
332 pmol/g di tessuto secco
546 pmol/g di tessuto secco
65 a 436 pmol/g di tessuto secco
1070 pmol/g di tessuto secco
134 pmol/g di tessuto secco
29
INTRODUZIONE
Nei ratti, sia la densità che la distribuzione dei neuroni contenenti la SP cambia
durante lo sviluppo. Le cellule e le fibre presentano alti livelli di SP tra P5 e P15. Poi
la loro densità generalmente decresce (Inagaki et al., 1982; Sakanaka et al., 1982). La
distribuzione dell’NKA è meno conosciuta e nel cervello del ratto sembra essere
simile a quella della SP, comunque con diversa localizzazione in parecchie regioni.
Come rilevato tramite immunistochimica i corpi cellulari contenenti NKB sono
detectabili nel bulbo olfattivo principale e in quello accessorio, in alcune regioni
corticali, nel tubercolo olfattorio, nel nucleo accumbens, nel setto, nel neostriato, in
parecchi nuclei ipotalamici, nel collicolo superiore, nella sostanza nigra, nella
formazione reticolare della medulla e nel nucleo caudato esterno (Kanazawa et al.,
1984; Merchenthaler et al., 1992).
L’NKB è anche localizzato nel midollo spinale, principalmente nel corno dorsale,
mentre è presente in quantità trascurabili nei gangli delle radici dorsali e nelle radici
dorsali (Ogawa et al., 1985).
Nel cervello umano le aree più ricche in SP sono: l’amigdala, da 25 a 340 pmol/g di
tessuto secco, il nucleo caudato, da 113 a 370 pmol/g di tessuto secco; il putamen da
81 a 380 pmol/g; il globus pallidus da 518 a 1800 pmol/g; l’ipotalamo da 125 a 135
pmol/g; la sostanza nigra da 1264 a 4720 pmol/g e il locus ceruleo 199 pmol/g (Gale
et al., 1978; Emson et al., 1980; Cooper et al., 1981).
Le principali fonti di tachichinine nel tratto gastrointestinale sono i neuroni enterici
intrinseci del plesso mienterico, i neuroni enterici intrinseci del plesso sottomucoso e
le fibre estrinseche afferenti primarie. La più importante fonte quantitativa delle
tachichinine nel tratto gastrointestinale è il sistema nervoso enterico (Holzer e
Holzer-Petsche, 1997 a, b) che ha le stesse cellule nella parete dell’intestino e
provvede a tutti i sistemi effettori gastrointestinali. Il tratto gastrointestinale dei
30
INTRODUZIONE
mammiferi contiene sia la SP che NKA e diverse forme estese di queste tachichinine.
In molte specie, le più alte concentrazioni di tachichinine nel tratto gastrointestinale
sono state trovate nel piloro, nel fondo gastrico, duodeno e digiuno (Pearse e Polak,
1975; Lazarus et al., 1980; Hunter et al., 1985; Gates et al., 1989). Per quanto
riguarda l’NKB, il peptide è generalmente ritenuto assente nell’intestino dell’uomo,
del maiale della Guinea e del ratto.
Metodi RIA e immunoistochimici hanno dimostrato la presenza della SP e dell’NKA
in fibre del tratto respiratorio di diversi mammiferi. Nella trachea e nei bronchi le
fibre positive alla SP sono state trovate nello strato di muscolatura liscia e intorno
alle cellule locali gangliari. Nell’albero bronchiale molte delle fibre positive alla SP
sono di origine vagale, ma nel polmone le fibre sono sia di origine vagale che spinale
toracica (Nilsson et al., 1977; Lundberg et al., 1983; Saria et al., 1985; Manzini et al.,
1989).
Le distribuzioni della SP e dell’NKA sono state ampiamente studiate nella pelvi
renale e nell’uretere e specialmente nella vescica urinaria di diverse specie (Sharkey
et al., 1983; Gibbins et al., 1985; Maggi et al., 1987). Il trattamento con la capsaicina
porta ad una quasi totale scomparsa di fibre immunoreattive alle tachichinine,
suggerendo che la maggior risorsa di tachichinine nella vescica urinaria sono fibre
sensoriali (Maggi e Meli, 1988; Maggi et al., 1988).
Nella pelle dell’uomo l’immunoreattività alla SP e all’NKA è presente nei terminali
liberi dei nervi nelle papille dermiche e nell’epidermide (Dalsgaard et al., 1985;
Bjorklund et al., 1986). Fibre immunoreattive alla SP sono state trovate anche nella
pelle di ratto e gatto (Hökfelt et al., 1977).
La SP appare essere presente anche in differenti tipi di cellule infiammatorie ed
immunitarie dell’uomo, del ratto e del topo (Aliakbari et al., 1987; Pascual e Bost,
31
INTRODUZIONE
1990; Ho et al., 1997; Lai et al., 1998).
La SP e/o l’NKA sono anche espresse in cellule enterocromaffini (Simon et al.,
1992), cellule epiteliali (Chu et al., 2000), fibroblasti (Bae et al., 2002), cellule
muscolari lisce intestinali e delle vie respiratorie (Khan e Collins, 1994; Maghni et
al., 2003) e in vari tipi di organi riproduttivi femminili (Patak et al., 2003; Pintado et
al., 2003). Studi recenti hanno anche indicato la presenza dell’mRNA dell’NKB nella
placenta dell’uomo e del ratto (Page et al., 2000) e nell’utero (Pinto et al., 2001;
Patak et al., 2003) così come in altri tipi di cellule riproduttive non neuronali dei topi
(Pintado et al., 2003). Inoltre, i nuovi membri della famiglia emochinina 1 (HK-1) e
i suoi ortologhi umani HK-1 e le endochinine (EKs) A, B, C, e D sono
primariamente espresse in cellule non nervose (Zhang et al., 2000; Kurtz et al., 2002;
Page et al., 2003).
2.3 Azioni farmacologiche delle tachichinine
Le tachichinine dimostrano diverse potenti azioni farmacologiche sia in periferia
(sistema cardiovascolare, tratto gastrointestinale, secrezioni, sistema respiratorio,
tratto urogenitale, sistema immunitario) che nel SNC.
Nel sistema cardiovascolare agiscono da agenti ipotensivi nel cane (Erspamer, 1981;
Bertaccini et al., 1965), nel coniglio (Bianchi Porro et al., 1965; Holzer-Petsche et
al., 1985) e nell’uomo (Sicuteri et al., 1963; Eklund et al., 1977; Evans et al., 1988).
Nel tratto gastrointestinale dei vertebrati le tachichinine inducono, con rare
eccezioni, una risposta contrattile. Gli effetti motori eccitatori sono evidenti in tutte
le sezioni del tratto gastro-intestinale, dall’esofago al retto e in tutti gli strati
muscolari, incluso il muscolo longitudinale, circolare e la muscolaris mucosae.
Comunque, gli effetti motori sono differenti nelle varie specie animale, in zone
32
INTRODUZIONE
diverse del tratto gastrointestinale, in relazione ai differenti tipi di recettore attivati e
al meccanismo implicato nella risposta motoria (Holzer-Petsche, 1995; Holzer e
Holzer-Petsche, 1997a, 1997b; Maggi et al., 1997).
Per quanto riguarda le secrezioni, il potente effetto sialogico della SP (Haefeli e
Hurlimann, 1962) e delle tachichinine degli anfibi (Bertaccini e De Caro, 1965;
Emmelin e Lenninger, 1967), è stato riconosciuto parecchi anni prima del principio
sialogico nell’estratto ipotalamico bovino identificato poi come sostanza P da Chang
e Leeman (1970).
Le tachichinine influenzano anche altre secrezioni come quella intestinale nei cani
(McFadden et al., 1986) nei felini (Brunsson et al., 1995) e la secrezione pancreatica
nei cani (Bertaccini et al., 1967) e nei ratti (Thulin e Holm, 1977; Konturek et al.,
1981).
Nel sistema respiratorio di molte specie animali (ratto, porcellino d’India, furetti,
criceti e uomo) (Frossard e Advenier (1991)), le tachichinine contribuiscono in
qualche misura alla regolazione del tono della muscolatura delle vie aeree.
Nel tratto urogenitale le tachichinine esogene, a concentrazioni extrafisiologiche,
stimolano la muscolatura liscia, specialmente quella della vescica urinaria e agiscono
in maniera differente sia nelle diverse specie animali, sia nei vari segmenti del tratto
urinario (Maggi e Meli, 1986; Maggi et al., 1986a, b; Maggi 1991b).
Studi neurofisiologici hanno dimostrato che nel SNC questi peptidi svolgono un
ruolo come neurotrasmettitori/neuromodulatori (Otsuka e Yoshioka, 1993). Nel SNC
le tachichinine si trovano particolarmente in aree coinvolte nel controllo centrale di
parecchie funzioni autonome (pressione sanguigna, respirazione, minzione, motilità
gastrointestinale, ecc.), di importanti funzioni affettive/emotive (comportamenti
stereotipati, motilità, ansietà, aggressione e dolore) e di più alte funzioni cerebrali
33
INTRODUZIONE
(comprensione e memoria).
Recenti scoperte nel campo delle tachichinine hanno considerevolmente aumentato
l’interesse per questa famiglia di peptidi. Un ruolo patofisiologico dell’NKB è stato
largamente studiato, ma un report recente ha stabilito una correlazione tra l’eccessiva
secrezione placentare dell’NKB e la pre-clampsia (Page et al., 2000). Altri studi
suggeriscono che le tachichinine potrebbero facilitare la crescita delle cellule
cancerose (Singh et al., 2000; Friess et al., 2003). Studi in topi knockout SP/NKA o
in topi in cui il recettore delle tachichinine è stato eliminato, hanno confermato
l’importante ruolo di questi neuropeptidi come mediatori dell’infiammazione
neurogenica (Cao et al., 1998; De Felipe et al., 1998). La disponibilità del modello
knockout SP/NKA ha dimostrato che l’espressione della tachichinina, sia nei neuroni
sensoriali, che nelle cellule ematopoietiche, è necessaria per lo sviluppo
dell’infiammazione (Chavolla-Calderon et al., 2003). Le tachichinine sembrano
essere coinvolte nella regolazione dell’ematopoiesi (Rameshwar et al., 1993;
Rameshwar, 1997; Zhang et al., 2000; Bandari et al., 2003a,b), inoltre i livelli di TK
sono aumentati nei macrofagi e nei linfociti in pazienti HIV (Ho et al., 2002). Molti
studi hanno dimostrato l’influenza delle tachichinine sul sistema immunitario
(Hartung e Toyka, 1989; McGillis et al., 1990; Eglezos et al., 1991; Maggi, 1997).
34
INTRODUZIONE
Capitolo III
LA SOSTANZA P
3.1 Scoperta della Sostanza P
La sostanza P (SP), identificata per la prima volta nella prima parte del secolo
scorso, è stata isolata inizialmente come estratto crudo dal cervello e dall’intestino
equino ed è stato scoperto essere un potente ipotensivo ed avere proprietà contrattile
della muscolatura liscia (Von Euler e Gaddum, 1931). Gaddum e Schild (1934)
hanno chiamato questa nuova sostanza, sostanza P, dove P si riferisce alla polvere
ottenuta dopo la procedura di estrazione. Il lavoro all’avanguardia di Lembeck
(1953) ha portato alla proposta che la SP fosse un neurotrasmettitore sensoriale
associato alla trasmissione del dolore, dovuto all’alta concentrazione di questo agente
localizzato nella radice dorsale del midollo spinale. Prove ulteriori riguardo il suo
ruolo, sono state effettuate più avanti con studi da parte di Otsuka e Konishi (1976)
che hanno mostrato che l’immunoreattività della SP aumentava nel perfusato
ottenuto da midollo spinale di ratti appena nati, dopo l’applicazione di stimoli
elettrici. L’espressione della SP è confinata al SNC e al SNP.
Oggi è pienamente riconosciuto che la SP è liberata dai terminali dei neuroni
afferenti primari sia centrali che periferici e funziona da neurotrasmettitore (Otsuka e
Konishi, 1976).
La SP è la neurochinina più abbondante nei mammiferi ed è ampiamente distribuita
nel sistema nervoso centrale, periferico ed enterico di molte specie (Pernow, 1983;
Severini et al., 2002).
35
INTRODUZIONE
3.2 Sintesi e metabolismo della SP
Nel 1971 Chang et al (1971) hanno identificato nell’ipotalamo bovino la struttura
aminoacidica di questo undecaptide come H-Arg-Pro-Lys-Pro-Gln-Gln-Phe-PheGly-Leu-Met-NH2 (Fig. 7).
La sequenza C terminale della SP è essenziale per l’affinità, il minimo frammento
della SP che conserva una buona affinità per il recettore NK1 è la SP 6-11 (Lee et al.,
1986).
Dieci anni dopo essa è stata
introdotta come appartenente alla
famiglia
delle
tachichinine
(Erspamer, 1983), insieme con la
neurochinina A (NKA) e la
Figura 7
Struttura della sostanza P.
neurochinina
B
(NKB)
con
ognuna delle quali condivide la stessa sequenza carbossiterminale, Phe-X-Gly-LeuMet-NH2 dove X è Phe o Val. La conformazione della SP sembra dipendere
fortemente dal solvente utilizzato e dall’ambiente lipidico in cui il peptide si trova. In
metanolo la struttura contiene una mescolanza di conformazioni beta-turn, sebbene in
acqua c’è una estesa struttura a catena (Sumner et al., 1990). Con l’utilizzo della
spettroscopia magnetica nucleare appaiono le seguenti caratteristiche: un core ad alfa
elica da Pro a Phe che è stabilizzato da due legami idrogeno tra Phe-NH/Lys-CO,
Phe-NH e Pro-CO; un’estesa parte terminale altamente flessibile e un turn centrale
sulla Gly (Lavielle et al., 1988; Regoli et al., 1994). La SP dei mammiferi deriva dal
gene della pre-protachichinina-A (PPT-A), che origina da un comune gene ancestrale
mediante duplicazione (Carter e Krause, 1990). Il gene PPT-A codifica anche per
altre tachichinine, inclusa la neurochinina A, il neuropeptide K (NPK) e il
36
INTRODUZIONE
neuropeptide
(NPγ) (Carter e Krause, 1990). Meccanismi di splicing alternativo
del trascritto del gene PPT-A risulta in tre distinti mRNA (Carter e Krause, 1990).
Tutti e tre questi mRNA codificano per la sequenza precursore della SP, anche se la
sequenza precursore dell’NKA è presente solo sugli mRNA αPPT-A e βPPT-A, NPK
e NPγ sono con l’N terminale derivati estesi dell’NKA che appare essere il prodotto
finale nel processo post-traduzionale di αPPT-A e βPPT-A (Nakanishi., 1987) (Fig.
8). Ogni mRNA del PPT-A differisce per l’esone corrispondente alla regione
codificante la proteina: l’mRNA del gene βPPT-A contiene tutti i 7 esoni del gene
PPT-A, mentre l’αPPT-A e il γPPT-A mancano rispettivamente del sesto e del quarto
esone (Carter e Krause, 1990). Il gene PPT-B origina anche dallo stesso gene
comune ancestrale come PPT-A. Comunque il gene PPT-B codifica solo per l’NKB
(Nakanishi., 1987).
SP
NKA
NPK
Geni
2
1
3
4
5
6
7
PPTA
mRNAs
Peptidi
αPPT-A
(CNS)
S
P
βPPT-A
(CNS/PNS
)
SP/NKA/NP
K
PPT-B
(CNS/PNS)
γPPT-A
(CNS/PN
S)
SP/NKA/NP
γ
NK
B
Figura 8
Rappresentazione schematica della biosintesi della SP e dei relativi peptidi
L’espressione della SP e dei suoi mRNA è molto abbondante sia nel SNC che in
quello periferico. L’espressione dell’mRNA del PPT (Noguchi et al., 1988) e
l’mRNA del recettore della SP (McCarson, 1999) è upregolato nella periferia durante
37
INTRODUZIONE
la stimolazione nociva o l’infiammazione neurogenica. La SP è rilasciata dallo stesso
precursore mediante l’azione di proteasi chiamate convertasi che agiscono sul gene
PPT a livello di residui cationici. La sintesi della SP si verifica nei ribosomi (Harmar
et al., 1980; Harmar et al., 1982) ed è confinata nel citoplasma. La SP è poi messa in
vescicole di immagazzinamento (Merighi et al., 1988; Plenderleith et al., 1990) e
trasportata lungo l’assone ai terminali. Studi biochimici (Takahashi et al., 1975) e
immunoistochimici (Harmar e Keen 1982) hanno dimostrato che la SP è trasportata
lungo i rami centrale e periferico dei neuroni sensitivi primari. La maggior parte
della SP è prodotta nelle cellule gangliari sensitive e trasportata verso le regioni
terminali dei nervi periferici del sistema periferico ad una velocità media di 5-6
mm/H mediante un meccanismo di trasporto assonale.
3.3 Distribuzione della SP
Le prime descrizioni sulla distribuzione della SP nel cervello dei mammiferi
risalgono agli anni 70 (Hökfelt et al., 1975; Ljungdahl et al., 1978). Questi risultati
iniziali hanno utilizzato anticorpi diretti contro la sequenza carbossiterminale del
peptide, condivisa da tutte le neurochinine, e perciò ci si doveva aspettare una cross
reazione con le altre neruochinine. Studi successivi eseguiti usando anticorpi che
riconoscevano solo la SP, hanno fornito una descrizione più precisa della
localizzazione dei corpi cellulari, fibre e terminali nel SNC dei mammiferi (Shults et
al., 1984; Ribeiro-da-Silva e Hökfelt, 2000). Alti livelli di immunoreattività della SP
sono state identificate in aree conosciute essere implicate nella modulazione delle
reazioni di stress e ansia come la corteccia cingolata, il caudato putamen, il nucleo
accumbens, il setto, l’ippocampo, l’amigdala, varie aree ipotalamiche come la PAG,
il nucleo dorsale del rafe, il lucus ceruleus, i nuclei parabrachaiali e nel nucleo del
38
INTRODUZIONE
tratto solitario. In queste regioni, la SP frequentemente coesiste nello stesso neurone
con altre neurochinine e con “classici” neurotrasmettitori
come la dopamina,
l’acetilcolina, la serotonina, la noradrenalina, il GABA e il glutammato o
neuropeptidi come l’ormone rilasciante la tireotropina e l’encefalina (Pickel et al.,
1979; Hökfelt et al., 1982; Kachidian et al., 1991; Nicholas et al., 1992; Dean et al.,
1993).
39
INTRODUZIONE
Capitolo IV
L’ NK1
4.1 Struttura del recettore
Analisi comparative delle proprietà farmacologiche della SP, dell’NKA e dell’NKB
ha portato all’identificazione di tre distinti recettori NK, ognuno con un ligando
preferito: la SP lega preferenzialmente il recettore NK1, mentre l’NKA e l’NKB
mostrano preferenze rispettivamente per l’NK2 e l’NK3 (Hökfelt et al., 2001, Saria,
1999). Comunque, ogni NK possiede proprietà opposte a tutti e tre, ma l’attività
biologica di questi sistemi appare essere governata dalla co-localizzazione e
dall’affinità delle varie NKs a differenti recettori NK (Saria, 1999).
Il recettore NK1, originariamente definito sulla base dei criteri farmacologici, è stato
strutturalmente identificato come il prodotto di un singolo gene che codifica una
proteina di lunghezza variabile in varie specie di mammiferi; il prodotto del gene
maturo del recettore NK1 può essere considerato un membro della superfamiglia dei
recettori accoppiati a proteine G (Yokota et al., 1989; Hershey e Krause., 1990). In
accordo con la nomenclatura di Montreal, il recettore NK1 è il mediatore di attività
biologiche codificato dalla sequenza C-terminale delle tachichinine per il quale la SP
è l’agonista più potente rispetto alla neurochinina A (NKA) o neurochinina B (NKB).
Sebbene la SP è il ligando preferito dei recettori NK1 (affinità 0,05-0,5 nM) (Regoli
et al., 1994), tutte le tachichinine che condividono la stessa sequenza aminoacidica
all’estremità carbossiterminale che essenzialmente dètta la loro attività biologica,
mostra molti gradi di cross-reattività verso i recettori delle tachichinine (Hardwick
40
INTRODUZIONE
et al., 1997) (Fig. 9).
La sequenza dei recettori NK1 clonata mostra un
alto grado di omologia con quella di diverse specie
tra cui l’uomo, il topo, il ratto e il porcellino
d’India (Gerard et al., 1993). Il sequenziamento del
recettore NK1 umano e del ratto mostra un grado di
Figura 9
Rappresentazione schematica del recettore NK1
umano (adottato da Regoli et al.(1994).
similarità tra le due specie del 92% (Gerard et al.,
1991). Comunque, quando si utilizzano antagonisti
selettivi dell’NK1 ci sono discrete variazioni tra le specie. Queste variazioni
riguardano la posizione 116 e la posizione 290 che contengono Val e Ile nel recettore
umano e Leu e Ser in quello del ratto e del topo (Fong et al., 1992; Sachais et al.,
1993). L’analisi del grado di restrizione del DNA genomico da cellule ibride topo e
uomo indica che il recettore NK1 è localizzato in singola copia sul cromosoma
umano 2 (Gerard et al., 1991). Il recettore NK1 ha una regione non trascritta 5’
relativamente lunga rispetto a quella degli altri recettori delle tachichinine, che è
preceduta da una singola sequenza TATAAA (Hershey e Krause, 1990). L’analisi
della regione 5’ non trascritta rivela un elemento responsivo all’AMP ciclico (CREB)
legante il calcio a 625 paia di basi, che è adiacente alla sequenza TATAAA. La
stimolazione del recettore NK1 conduce al turnover dell’inositolo 1,4,5- trifosfato
intracellulare con conseguente aumento del calcio intracellulare. Così, l’elemento
CREB/calcio potrebbe portare i geni a rispondere agli elevati livelli di calcio o AMP
ciclico con aumento della trascrizione genica (Regoli et al., 1994). Questa sequenza
potrebbe giocare un ruolo importante nell’intensa o prolungata stimolazione
dell’NK1, mentre le risposte dell’NK1 sono rapidamente desensibilizzanti e perciò
potrebbe esistere un elemento risensibilizzatore. Studi di radiolabelling e mutagenesi
41
INTRODUZIONE
suggeriscono che l’estremità carbossiterminale contiene una sequenza idrofobica,
GLM-NH2, in base a cui la SP si inserisce nella tasca di legame del ligando
idrofobico (transmembrana II e VII) tra il dominio transmembrana e la superficie
extracellulare e il centro del doppio strato fosfolipidico (Huang et al., 1994). Il resto
della molecola della SP interagisce con gli aminoacidi sulla superficie extracellulare
del recettore. Cellule CHO trasfettate con i recettori NK1 dimostrano che questo
recettore si accoppia a proteine Gq/11, Gαs e Gα0 (Roush e Kwatra, 1998).
Approssimativamente
il
30%
dei
residui
dell’estremità
carbossi-terminale
citoplasmatica del recettore NK1 sono serine e treonine. Questi sono potenziali siti
per la fosforilazione dei recettori accoppiati alla proteina G (Nakanishi, 1991). La
stimolazione del recettore NK1 attiva la fosfolipasi Cβ che porta ad un incremento
transiente dell’ IP3 e della concentrazione citosolica del calcio, la fosfolipasi A2
induce un incremento nella mobilizzazione dell’acido arachidonico (Garcia et al.,
1994) e l’adenilato ciclasi evoca l’accumulo della adenosina ciclica monofosfato
(Takeda et al., 1992). Comunque non appare esserci un cross-talk tra accumulo di
cAMP e formazione di IP3 (Sagan et al., 1996). Nel sistema nervoso centrale
l’espressione dei recettori NK1 è più alta nel putamen-caudato e nel collicolo
superiore con moderati e bassi livelli di recettori NK1 trovati nel collicolo inferiore,
bulbo olfattivo, ipotalamo, ippocampo, sostanza nigra e corteccia cerebrale, setto
striato, ipotalamo, mesencefalo e corna dorsale del midollo spinale (Dam e Quirion,
1986; Shults et al., 1984). Recentemente è stata utilizzata una nuova tecnica che
combina l’immunoistochimica con la fluorescenza e il microscopio confocale per
identificare la localizzazione del recettore NK1. In questi studi la SP può indurre
l’internalizzazione nei neuroni dei recettori NK1 nelle lamine I, II, X e un numero di
neuroni nelle lamine III-V del midollo spinale dorsale. Nel sistema nervoso
42
INTRODUZIONE
periferico l’espressione dei recettori NK1 è stata dimostrata nel ratto (Dray e
Pinnock, 1982; Li e Zhao, 1998) e topo DRGs (Andoh et al., 1996), nei neuroni
intrinseci dell’intestino (Sternini et al., 1995) e in assoni non mielinizzati nella pelle
glabra (Carlton et al., 1996). La discrepanza tra l’espressione della SP e i suoi siti di
legame potrebbe indicare la coesistenza di altre tachichinine e dei loro rispettivi
recettori nello stesso tessuto.
4.2 Distribuzione e funzioni dell’NK1
Il recettore NK1 delle tachichinine è ampiamente distribuito sia nel sistema nervoso
centrale che in quello periferico. Nel SNC questi recettori sono coinvolti in molte
risposte comportamentali (Sivam et al., 1989; Humpel et al., 1990; Shibata et al.,
1990; Shirayama et al., 1996) e nella regolazione della sopravvivenza e della
degenerazione neuronale (Narumi e Fujita, 1978; Narumi e Maki, 1978; Iwasaki et
al., 1989; Calvo et al., 1996; Jonsson e Hallman, 1982; Heath et al., 1995; De Felipe
et al., 1995; Taoka et al., 1996); inoltre regolano la funzione cardiovascolare (Unger
et al., 1988; Itoi et al., 1992; Saigo et al.,1993; Culman et al., 1995; Culman et al.,
1997; Kalia et al., 1984; Lindefors et al., 1986; Feldman, 1995) e respiratoria (Chen
et al., 1990; Rampin et al., 1993; Srinivasan et al., 1991; Yamamoto et al., 1992) e
sono implicati nell’attivazione del riflesso emetico (Ladic e Bunchan, 1996;
Boissonade e Davison, 1997; Gardner et al., 1994; Watson et al., 1995; Andrews et
al., 1996; Tattersall et al., 1996; Rupniak et al., 1997).
A livello del midollo spinale sono attivati durante la trasmissione sinaptica,
specialmente in risposta a stimoli nocivi applicati al campo recettivo di neuroni
afferenti primari (Kuwahara et al., 1987; Stucky et al., 1994; Hanesch et al., 1995;
Schafer et al., 1993; McCarson e Krause, 1994; Abbadie et al., 1996; Yashpal et al.,
43
INTRODUZIONE
1994; Manthy et al., 1995; McCarson e Krause, 1996). Prove neurofisiologiche e
comportamentali supportano un ruolo di questi recettori spinali nella trasmissione del
dolore (Lembeck, 1953). I recettori NK1 spinali modulano anche i riflessi autonomi
(Charlton e Helke, 1985a, b; Buck et al., 1986; Yashpal et al., 1990), incluso il
riflesso della minzione (Maggi, 1991b; Kawatani et al., 1993; Lecci et al., 1993). Nel
sistema nervoso periferico sono ampiamente espressi nel tratto respiratorio (Maggi et
al., 1995; Bowden et al., 1996), genitourinario (Maggi, 1993; Maggi et al., 1992;
Alm et al., 1978; Hua et al., 1987; Maggi et al., 1992) e gastrointestinale (Bartho’ e
Holzer, 1985; Holzer e Holzer-Petsche, 1997a, b; Burcher et al., 1984; Burcher et al.,
1986; Rothstein et al., 1991; Mussap e Burcher 1993; Mantyh et al., 1989; Sternini et
al., 1995) e anche da parecchi tipi di cellule infiammatorie e immunitarie (Maggi,
1997; Baluk et al., 1995; Matsuda et al., 1989; Yano et al., 1989; Lotz et al., 1988;
Laurenzi et al., 1990). Nel sistema cardiovascolare mediano la vasodilatazione
endotelio-dipendente (Pacicca et al., 1992; Zhang et al., 1994; Kuroiwa et al., 1995)
e l’extravasazione delle proteine plasmatiche (Jancsò et al., 1967; Jancsò et al.,
1968). A livello del respiratorio mediano l’infiammazione neurogenica che è
specialmente evidente dopo esposizione delle vie aeree a sostanze irritanti (Maggi et
al., 1995). Nel glomo carotideo mediano la risposta ventilatoria all’ipossia
(Prabhakar et al., 1993; De Sanctis et al., 1994). Nel sistema gastrointestinale,
mediano la contrazione della muscolatura liscia (Bartho’ e Holzer, 1985; Holzer e
Holzer-Petsche, 1997a, b), regolano la secrezione di acqua e ioni (Parsons et al.,
1992; Brown et al., 1992; Reddix e Cooke, 1992; Cox et al., 1993) e mediano la
comunicazione neuro-neuronale (Bartho’ e Holzer, 1985). Nel tratto genitourinario,
sono ampiamente distribuiti nella pelvi renale, uretere, vescica urinaria e uretra e
mediano la contrazione della muscolatura liscia e l’infiammazione in risposta a
44
INTRODUZIONE
stimoli nocivi (Maggi, 1993). Basandosi sulle conoscenze riguardo la loro
distribuzione e i loro ruoli patofisiologici è stato anticipato che gli antagonisti del
recettore NK1 potrebbero essere utilizzati per produrre analgesia (Nagahisa et al.,
1992), come antiemetici (Kris et al., 1996) e per il trattamento di certe forme di
incontinenza urinaria a causa di iperreflessia del detrusore (Lecci
et al., 1993;
Ishizuka et al., 1995). Nel sistema nervoso periferico, gli antagonisti dei recettori
NK1 potrebbero essere utilizzati in parecchie infiammazioni incluse l’artrite,
disordini infiammatori intestinali e cistiti.
La distribuzione dei recettori NK1 che preferiscono la SP, nel sistema nervoso
centrale dei mammiferi, è stata studiata tramite autoradiografia (Shults et al., 1982;
Manthy et al., 1984, 1989; Saffroy et al., 1988, 2003), studi di ibridazione in situ per
valutare l’espressione dell’mRNA che codifica per il recettore (Maeno et al., 1993;
Caberlotto et al., 2003) e tramite immunoistochimica (Nakaya et al., 1994, Barbaresi,
1998) portando prove per un’ ampia ma distinta distribuzione dei recettori NK1 nel
cervello dei mammiferi.
I recettori NK1 sono stati identificati in aree coinvolte nel controllo dell’ansia e delle
risposte a stress, come la corteccia prefrontale, l’ippocampo, il caudato putamen, il
setto laterale, il nucleo accumbens, l’amigdala e vari nuclei ipotalamici, così come la
PAG (Barbaresi, 1998), l’abenula, il rafe dorsale e il locus ceruleus. Sebbene in
molte di queste aree c’è buon accordo tra distribuzione delle fibre contenenti la SP e i
recettori NK1, un aspetto interessante è un apparente disaccordo tra SP e recettori
NK1 in molte aree (Shults et al., 1984; Nakaya et al., 1994). Più particolarmente,
nella sostanza nigra la concentrazione della SP è estremamente elevata, mentre
l’espressione dei recettori NK1 è veramente bassa. Le ragioni per questi mismatches
potrebbero essere fattori tecnici o l’esistenza di sottotipi ancora sconosciuti dei
45
INTRODUZIONE
recettori delle neurochinine (Herkenham, 1987). Un’altra spiegazione per questa
discontinuità anatomica tra i siti di rilascio e i potenziali bersagli dovrebbe essere
l’esteso rilascio e la capacità neuromodulatoria dei neuropeptidi. In confronto ai
classici trasmettitori, i neuropeptidi possono essere rilasciati non sinapticamente da
multipli siti della membrana neuronale (inclusi i dendriti) e sembra persistere nel
fluido extracellulare relativamente per lunghi periodi di tempo. Perciò, dovrebbero
essere capaci di diffondere a distanze considerevoli e agire su bersagli relativamente
distanti (Landgrafe Neumann, 2004).
46
SCOPO DEL LAVORO
Capitolo V
SCOPO DEL LAVORO
Come si è visto, la SP è un neuropeptide che esercita i suoi effetti attraverso il
legame con il recettore Neurokinina 1 (NK1). Dati gli effetti neuromodulatori e
l’ampia distribuzione della SP nel cervello di molte specie, il sistema SP/NK1 è uno
tra i più studiati. Nell’ultimo decennio, numerosi studi hanno dimostrato il
coinvolgimento del sistema SP/NK1 nella regolazione dello stress e dell’ansia.
Fino a poco tempo fa la SP era considerata il principale neurotrasmettitore/
neuromodulatore nella trasmissione del dolore. Ultimamente si è osservato come la
diffusa e divergente distribuzione del sistema SP/NK1 nel cervello possa servire a
modulare le risposte fisiologiche e comportamentali a stimoli nocivi e che generano
stress. Prove evidenti suggeriscono che stimoli stressori portano ad un’intensa
espressione della SP in aree cerebrali fondamentali nel modulare le risposte a tali
stimoli e nel regolare comportamenti affettivi come l’amigdala, il setto, l’ipotalamo,
l’ippocampo, lo striato, il nucleo accumbens, la PAG e il nucleo del rafe. La
distribuzione della SP nel SNC, generalmente corrisponde a quella del suo recettore,
anche se con delle eccezioni (Saria, 1999; Quartara e Maggi, 1998; Nakaya et al.,
1994), come per esempio nella corteccia cerebrale.
Numerosi sono gli studi di autoradiografia e di immunoistochimica che hanno
evidenziato la presenza del recettore NK1 nella corteccia cerebrale di diverse specie:
ratti, gerbilli, porcellini d’India e scimmie (Rigby et al., 2005; Saffroy et al., 2003;
Kaneko et al., 1994), ma non è stato ancora visto come questo recettore varia durante
lo sviluppo post-natale.
47
SCOPO DEL LAVORO
Per questo motivo nel
mio studio, ho indagato la presenza, la distribuzione e
l’espressione del recettore NK1 mediante reazioni di immunocitochimica e
biochimico-molecolari, nella corteccia somatosensoriale di ratto a diverse età.
48
MATERIALI E METODI
Capitolo VI
MATERIALI E METODI
6.1 Animali
In tutti gli esperimenti sono stati utilizzati ratti albini (Sprague-Dawley; Charles
River, Milano, Italia) di diversa età: di meno di 24 ore (P0), di 5 giorni (P5), 10
(P10), 15 (P15), 20 (P20) e 30 giorni (P30). In totale sono stati utilizzati sei ratti per
ogni età: tre per reazioni di immunocitochimica e tre per analisi biochimicomolecolari (Western Blotting).
La gestione e la cura degli animali sono state approvate dalla Commissione Etica per
la Ricerca Animale dell’Università Politecnica delle Marche. Gli esperimenti sono
stati condotti in accordo con la Direttiva 86/609 del Consiglio della Comunità
Europea (24 Novembre, 1986) e approvati dal servizio veterinario locale. Tutte le
procedure sperimentali seguite nel trattamento e sacrificio degli animali sono state
condotte in accordo con le linee guida del National Institute of Medical Reserch
statunitense e approvate dal comitato etico dell’Università Politecnica delle Marche.
Gli animali sono stati alloggiati in gabbie con illuminazione regolata in modo
automatico in cicli di 12 ore di luce e 12 ore di buio; l’accesso all’acqua era libero.
6.2 Immuocitochimica
Gli animali sono stati anestetizzati con un’iniezione intraperitoneale di cloralio idrato
al 12% in tampone fosfato (PB) (0,1M, pH 7.4) e perfusi per via transcardiaca con
una soluzione fisiologica seguita da una soluzione fresca di paraformaldeide al 4% e
acido picrico al 50% in PB.
49
MATERIALI E METODI
Successivamente, i cervelli sono stati rimossi, post-fissati per 12 ore a 4°C nella
stessa soluzione usata per la perfusione, posti in soluzioni crescenti di crioprotettore
(soluzioni di saccarosio in PB al 10, 20, 30%) e quindi tagliati al microtomo
congelatore in sezioni adiacenti di 60 e 90 μm di spessore. Le sezioni di 60 μm di
spessore sono state colorate con la tecnica di Nissl (blu di toluidina all’1% in
soluzione acquosa) (vedi paragrafo 6.3) mentre quelle da 90 μm sono state usate per
la visualizzazione immunocitochimica dell’NK1.
6.2.1 Anticorpi utilizzati
Per l’immunocitochimica si è utilizzato l’anticorpo contro il recettore NK1 che ci è
stato gentilmente fornito dal Professor R. Shigemoto (Nationl Institute for
Physicological Sciences, Okazaki, Japan). La produzione, la purificazione e la
caratterizzazione di questo siero diretto ai residui aminoacidici , 349–407 della
porzione intracellulare all’estremità C-terminale dell’NK1 clonato sono state riportate
precedentemente (Shigemoto et al.,1993).
Per il Western Blotting invece, si è utilizzato l’anticorpo Anti-substance P receptor,
pain della Millipore (Billerica, MA).
6.2.2 Procedura
Le sezioni da 90 μm utilizzate per l’immunocitochimica sono state dapprima
sottoposte ad un trattamento con acqua ossigenata (0,3% in tampone fosfato salino;
PBS, 0,1M, pH 7,6; 30 minuti) per rimuovere l’attività della perossidasi endogena e
quindi lavate in PBS (5 minuti x 3). Per eliminare legami aspecifici, le sezioni sono
state successivamente incubate in Normal Goat Serum (NGS al 2% in PBS) con
0,3% Triton X-100 (1 ora; temperatura ambiente) e quindi poste in anticorpo
50
MATERIALI E METODI
primario disciolto in NGS all’1%, per 2 ore a temperatura ambiente e poi per 12 ore a
4°C. Il giorno successivo le sezioni sono state più volte lavate in PBS (5 min x 3),
poste in NGS al 10% (30 minuti; temperatura ambiente) e poi incubate per 1 ora in
anticorpo secondario biotinilato anti-coniglio preparato in capra, diluito 1:100 in PBS
(bGAR, Vector, Burlingame, CA, BA-1000). Dopo altri lavaggi in PBS, le sezioni
sono state incubate in una soluzione contenente il complesso Avidina-BiotinaPerossidasi (ABC, Vector Laboratories) per un’ora a temperatura ambiente e dopo
molti e prolungati lavaggi (10 min x5 ) sono state fatte reagire con una soluzione di
DAB (3’3’diaminobenzidinatetraidrocloruro; Sigma, St Louis, MO, USA) 0,05% in
Tris 0,05M con 0,03% di acqua ossigenata. Le sezioni sono state montate su vetrini
cromallumati, lasciate asciugare all’aria, e disidratate. I vetrini sono stati poi coperti
con coprioggetto utilizzando la soluzione di
Eukitt
(Kindler GmbH e
Co.,Freiburg,Germany). Le sezioni sono state infine esaminate al microscopio ottico
Leitz Orthoplan (Wetzlar, Germany).
6.3 Colorazione di Nissl
Le sezioni di 60 μm adiacenti a quelle utilizzate per l’immunocitochimica sono state
colorate con la tecnica di Nissl che consiste nell’utilizzo di un colorante basico, la
tionina all’1% in soluzione acquosa che colora di blu gli acidi nucleici, in particolare
l’RNA citoplasmatico contenuto nei ribosomi liberi e nel RER. Questa tecnica
permette così di studiare la citoarchittetonica neuronale, permettendo di discriminare
i sei strati della corteccia cerebrale (Fig. 1a).
6.4 Analisi dei dati
La distribuzione dei neuroni NK1 positivi e lo studio della loro morfologia sono state
51
MATERIALI E METODI
effettuate mediante l’ausilio di una camera lucida posta su un microscopio Leitz
Dialux che montava obiettivi 4x,10x,40x e 100x. i primi 3 obiettivi sono stati utilizati
per la distribuzione mentre il 100x per la morfologia. I disegni sono stati
scannerizzati (risoluzione. 300 DPI) con uno scanner Epson perfection 3170 (Epson,
Nagano), collegato ad un computer HP (Microsoft).
6.5 Raccolta dei campioni di corteccia cerebrale per analisi biochimichemolecolari
Sono stati prelevati chirurgicamente 3 campioni di corteccia cerebrale per ogni età
(P0, P5, P10, P15, P20, P30), posti poi in un tampone di lisi formato da saccarosio
0,32M, EDTA 1mM e inibitori delle proteasi (Protease Inhibitor Cocktail, SIGMAALDRICH,Milano,Italia), prima di essere trattati come segue (Paragrafo 6.6).
6.6 Preparazione degli estratti proteici da tessuto
Essendo la nostra proteina di interesse (NK1) un recettore, i
campioni sono stati trattati secondo il seguente protocollo
(modificato da Danbolt et al., 1990). I tessuti, una volta
prelevati,
sono
stati
pesati
e
omogenati,
con
omogeneizzatori tipo Potter (Fig. 10) in sei volumi di
Figura 10
Potter
utilizzato
per
l’omogenizzazione dei tessuti.
tampone di lisi e centrifugati a 1000g per 10 minuti a 4°C. Il
sopranatante ottenuto da ogni campione è stato centrifugato a 27000g per 20 minuti a
4°C. Il pellet neoformato è stato risospeso in 10 volumi di buffer ipotonico (EDTA
1mM, Tris-HCl 1mM, pH 7,4) e poi centrifugato di nuovo a 27000g per 20 minuti a
4°C. I pellet neoformati sono stati risospesi in 6 volumi di tampone di
omogeneizzazione e centrifugati a 27000g per 20 minuti a 4°C. I pellet formati
52
MATERIALI E METODI
(Frazioni Crude di Membrane Plasmatiche Sinaptiche) sono stati risospesi in
tampone di omogeneizzazione e conservati a -80°C fino all’uso.
6.7 Determinazione della concentrazione proteica
La concentrazione delle proteine è stata misurata con il metodo di Bradford
(Bradford,1976). Il reattivo è costituito da Blu Brillante di Coomassie G-250 allo
0,01%, in etanolo al 4,7% ed acido fosforico all’8,5%. Tale colorante, in seguito al
legame con il materiale proteico, sposta il suo massimo di assorbimento da 465nm a
595nm. La D.O. a 595nm del complesso proteina-reattivo è direttamente
proporzionale alla quantità della proteina nell’intervallo 2-10mg.
Costruendo una retta di taratura (nel range 2-10mg) tramite l’utilizzo di una proteina
standard, la siero albumina bovina, è possibile risalire, dalla D.O. a 595nm, alla sua
concentrazione proteica.
Tale procedura è stata ripetuta per 3-4 volte con quantità diverse di ciascun estratto,
per poi fare la media dei valori ottenuti.
6.8 Western Blotting sui tessuti di corteccia
6.8.1 Elettroforesi in condizioni denaturanti (SDS-PAGE)
Per ciò che riguarda la preparazione dei campioni, aliquote da 50μg (una per ogni
campione di corteccia) sono state unite a Sample Buffer 1X (Tris-HCl 1M, pH6,8
con β-mercaptoetanolo 1%, glicerolo 10%, SDS 2%, e blu di bromofenolo 0,03%) e
poi fatte bollire per 5 minuti.
Tutti i campioni, una volta raffreddati, sono stati quindi caricati, assieme allo
standard (Kaleidoscope Prestained Standards, Bio-Rad Laboratories, Hescules, CA),
in un gel di poliacrilamide al 10% montato in una cella elettrolitica (Mini-
53
MATERIALI E METODI
PROTEAN II Electrophoresis Cell, Bio-Rad) posta in ghiaccio. I campioni sono stati
quindi sottoposti ad una corsa elettroforetica a 110mV per circa 3 ore (in tampone
Tris 0,1M, pH 8,3 con glicina 0,9M e SDS 0,017M).
6.8.2 Trasferimento su membrana di nitrocellulosa
Terminata la corsa elettroforetica è stato effettuato il trasferimento delle proteine dal
gel ad una membrana di nitrocellulosa (Trans-Blot, Bio-Rad Laboratories, 0,2 μm). Il
gel è stato immerso nel tampone di trasferimento (Tris-base 20mM, glicina 150mM,
metanolo 20%) con le spugne e i pezzi di carta da filtro precedentemente tagliati
della loro stessa dimensione. La membrana di nitrocellulosa, tagliata anch’essa della
stessa dimensione del gel, è stata prima immersa in acqua e poi mantenuta nel buffer
di trasferimento. Si è quindi proceduto con l’assemblaggio del sistema di
trasferimento. Il trasferimento è stato protratto per 3 ore a voltaggio costante (36V)
(Mini Trans-Blot Electrophoretic Transfer Cell, Bio-Rad Laboratories). Per
verificare la presenza delle proteine sulla membrana di nitrocellulosa, quest’ultima è
stata immersa in un colorante per proteine (Rosso Ponceau 0,2%, acido
tricloroacetico 3%) per 1 minuto e
lavata in acqua distillata. La membrana
decolorata è stata posta poi in PBS-T (PBS + Tween 0,1%) e successivamente
incubata, sotto agitazione, prima con un tampone di bloccaggio (PBS-T + DFM 5%)
per 2 ore e poi con l’anticorpo primario (Anti-substance P receptor, pain; Millipore,
Billerica, MA) diluito 1:1000 per tutta la notte a 4°C.
Per la visualizzazione della banda della β-actina, proteina utilizzata quale
housekeeping per la normalizzazione dei dati, le membrane sono state incubate con
l’anticorpo primario monoclonale anti-β-actina (SIGMA) per tutta la notte a 4°C. il
giorno successivo, dopo 8 lavaggi di 8 minuti ciascuno con il PBS-T la membrana è
54
MATERIALI E METODI
stata incubata con l’ anticorpo secondario anti IgG coniugato con la perossidasi di
rafano (PI-1000, Vector) diluito 1:1000 in PBS-T + BSA 5% per 2 ore.
La membrana dopo l’incubazione con l’anticorpo secondario è stata ancora lavata 8
volte in un’ora con PBS-T e poi con H2O deionizzata.
6.9 Preparazione e sviluppo delle lastre
La membrana è stata incubata per 5 minuti con il substrato chemiluminescente
(SuperSignal West Pico RPN 21089, Rockford, IL).
Si è proceduto poi allo sviluppo tramite il programma Quantity One (BIORAD).
6.10 Densitometria
Con il programma Quantity One inizialmente si sono definite le bande sulle
immagini, in modo che esse avessero una larghezza corretta ed una esatta altezza. Il
programma trasforma ogni banda in una gaussiana in cui nell’asse delle x viene
riportata l’altezza della banda in millimetri calcolata lungo la linea verticale di corsa
del campione e in quello delle y il valore medio di intensità (in scala di grigio) di tutti
i pixels compresi in ciascun millimetro di altezza in cui la banda può essere
scomposta. Dall’opportuno aggiustamento della linea di base, l’area sottesa dalla
curva è la misura della densità della banda e quindi della quantità corrispondente di
proteina, espressa in intensità per millimetro.
6.10.1 Analisi statistica
I risultati ottenuti sono stati presentati come media + deviazione standard (SD).
L’analisi statistica dei livelli proteici dell’NK1 è stata effettuata utilizzando il
programma ANOVA (PRISM version 4 for windows: GraphPad Software Inc, San
55
MATERIALI E METODI
Diego, CA); p ≤ 0.05 significatività bassa (*), p ≤ 0,01 significatività media (**) e p
≤ 0,001 (***) significatività alta.
56
RISULTATI
Capitolo VII
RISULTATI
7.1 Distribuzione corticale dei neuroni positivi per il recettore NK1
Le reazioni di immunocitochimica nella corteccia parietale di ratto hanno evidenziato
una diversa distribuzione dei neuroni positivi per l’NK1 in funzione dell’età. In figura
11 si possono osservare sezioni rappresentative di corteccia parietale di ratto, da P0 a
P30, trattate per la reazione di immunocitochimica per l’NK1 (Fig. 11 A- F) e quelle
adiacenti controcolorate con tionina (Fig. 11 A’- F’).
L’analisi delle lamine corticali eseguita nelle sezioni controcolorate, ha rivelato che
la corteccia cerebrale dei ratti a P0 è composta da tre strati orizzontali. Il primo,
immediatamente al di sotto della pia è privo di cellule e viene definito zona
marginale (MZ). Sotto la zona marginale c’è un’ampia banda di cellule che si
estende fino alla sostanza bianca e appare divisa in due strati; lo strato superiore è
altamente ricco di cellule strettamente ammassate e viene definito cortical plate (CP)
per la somiglianza con la cortical plate visibile nel cervello dei ratti nel periodo
fetale. Lo strato sottostante la cortical plate, in cui i somi sono più radi e grandi,
corrisponde alla porzione esterna della zona intermedia nella terminologia della
Boulder Committee e viene denominato sub-cortical plate (SCP) (Kristt D.A. 1978).
A P5 le osservazioni al microscopio ottico delle sezioni controcolorate hanno rivelato
che gli strati corticali sono qualitativamente simili a quelli osservati in P0. A partire
da P5 la corteccia cerebrale va incontro a profonde trasformazioni tanto che a P10 si
inizia a distinguere la tipica laminazione corticale (I, II/III, IV, V e VI strato).
57
RISULTATI
Figura 11
La figura mostra sezioni di corteccia cerebrale a P0-P5-P10-P15-P20-P30 reagite con l’NK1 (A, B, C, D, E, F) e sezioni adiacenti controcolorate
con tionina (A’, B’, C’, D’, E’, F’). Gli asterischi indicano gli stessi vasi sanguigni. Taratura: 250 µm.
58
RISULTATI
Figura 11
59
RISULTATI
Figura 12
Distribuzione laminare (A) e relative percentuali (B) dei neuroni NK1 positivi a diverse età di sviluppo post-natale. Taratura: 250µm.
60
RISULTATI
Comparando le sezioni reagite con l’immunocitochimica con quelle controcolorate si
nota che tra P0 e P5 il 93 - 94% dei neuroni NK1 positivi sono localizzati nella subcortical plate (Fig. 12). Da P10 in poi la distribuzione laminare dei neuroni NK1
positivi cambia; sebbene in percentuali diverse, detti neuroni, sono presenti in tutti
gli strati corticali. Nell’intervallo P10 - P30 la laminazione dei neuroni NK1 positivi
rimane abbastanza simile. I neuroni sono più numerosi negli strati infragranulari
dove raggiungono percentuali che oscillano tra il 57% ed il 60% (in media il 35% nel
VI strato e il 24% nel V strato; Fig. 12). Un discreto numero di neuroni è stato
riscontrato nel II/III strato con percentuali che oscillano tra il 23 e il 26% e
percentuali che variano tra il 13 - 14% sono state trovate nel IV strato (Fig. 12).
Pertanto negli strati sovra granulari (II - IV strato), la percentuale dei neuroni NK1
positivi oscilla tra il 36 e il 39% (Fig. 12). Un esiguo numero di neuroni è presente
nel primo strato con percentuali che variano tra il 2 e il 4% (Fig. 12).
Il numero dei neuroni presenti in ogni strato nelle diverse età e le relative percentuali
sono espresse nella Tabella 2.
61
RISULTATI
MZ
N(%)
P0
P5
0
0
CP
N(%)
19
(6,69%)
31
(5,12%)
SCP
N(%)
265
(93,31%)
574
(94,55%)
P10
P15
P20
P30
I
N(%)
II/III
N(%)
IV
N(%)
V
N(%)
VI
N(%)
TOTALE
284
605
50
(2,21%)
188
(4,01%)
63
(3,43%)
131
(3,57%)
523
(23,11%)
1095
(23,41%)
449
(24,46%)
953
(25,99%)
331
(14,63%)
617
(13,19%)
243
(13,24%)
480
(13,09%)
563
(24,88%)
1092
(23,35%)
415
(22,60%)
914
(24,93%)
796
(35,17%)
1685
(36,03%)
666
(36,27%)
1189
(32,42%)
2263
4677
1836
3667
Tabella 2
Numero (N) e relativa percentuale (%) dei neuroni presenti in ogni strato della corteccia alle diverse età.
7.2 Morfologia dei neuroni
Nelle figure 13a e 13b viene mostrata la morfologia di alcuni dei neuroni positivi per
l’NK1 rappresentativi di ogni età.
Dalle osservazioni eseguite è stato possibile notare che nei ratti a P0 e P5 (Fig. 13a:
A, B, C, D, E) i neuroni hanno un soma circolare o ovale molto piccolo (con un
diametro di circa 10 µm) e talvolta di forma irregolare. Dal soma di questi neuroni si
dipartono uno o più dendriti molto spessi (dendriti principali) che si assottigliano a
mano a mano che si allontanano dal corpo cellulare (Fig. 13a: A, B, C, D, E) e da cui
si diramano dendriti molto più sottili (dendriti secondari) alla cui estremità, in molti
casi, sono state osservate formazioni digitiformi denominate coni di accrescimento
(in figura 14a sono evidenziati con una freccia). Lungo i dendriti secondari sono
state inoltre osservate delle varicosità e in alcuni casi piccole estroflessioni tubulari
interpretate come protospine (Fig. 14a: A-P0, neuroni 1, 2, 3). A partire da P5 il
diametro dei somi delle cellule NK1 positive va progressivamente aumentando e da
P10 in poi le dimensioni di questi neuroni non sembrano subire ulteriori incrementi.
Le morfologie dei somi dei neuroni NK1 positivi cambiano con l’età, le forme
irregolari da P10 in poi vanno scomparendo e i dendriti principali diminuiscono di
62
RISULTATI
spessore; solo in rare occasioni e in età comprese tra P10 e P20, sono stati osservati
neuroni dal cui soma si staccava un dendrite molto spesso (Fig. 13b: B, E e Fig. 14b:
A-P15 neuroni 1 e 2 e B-P20 neurone 1). All’aumentare delle dimensioni dei somi
corrisponde anche un aumento delle dimensioni dell’area occupata dall’albero
dendritico (Fig. 13a: G - H – I - L - M e Fig. 13b), da P10 a P30 i dendriti si
assottigliano, aumentano di numero ed è possibile notare un incremento nel numero
delle spine dendritiche (Figura 15: A’’, B, D, E e G’’) e la comparsa di spine
somatiche (Figura 15: C, F e G’)
63
RISULTATI
Figura 13a
Esempi di neuroni a P0, localizzati nella SCP (A, B, C); esempi di neuroni a P5 (C, D, E), tutti presenti nella CP; esempi di neuroni a P10,
presenti nel V strato (L) e VI strato corticale (G, H, I, M). Taratura: 25µm.
64
RISULTATI
Figura 13b
A: striscia di corteccia parietale a P15 con la divisione in strati. Taratura 50 µm. Esempi di neuroni a P15, tutti nel II/III strato (A’, B); esempi di
neuroni a P20, presenti nel II/III strato (C, D, E, F) e nel VI (G); esempi di neuroni a P30, presenti nel II/III strato (H), nel VI (I) e nel IV (L).
Taratura: 25µm.
65
RISULTATI
Figura 14a
Camera lucida di alcuni neuroni corticali positivi per l’NK1: P0 (A), P5 (B) e P10 (C). Le frecce indicano i coni di accrescimento.
Taratura 100 µn.
66
RISULTATI
Figura 14b
Camera lucida di neuroni corticali positivi per l’NK1: P15 (A), P20 (B) e P30 (C). Taratura 100 µm.
67
RISULTATI
Figura 15
Spine e coni di accrescimento. Neuroni a P10 che mostrano coni di accrescimento (A’), varicosità (A’’, B), spine dendritiche (A’’, B) e somatiche
(C); spine dendritiche a P15 (D, E); spine dendritiche (G’) e somatiche (G’’) a P30. Taratura 25 µm.
68
RISULTATI
7.3 Western Blotting dei tessuti di corteccia cerebrale
La figura 16a mostra un’immagine rappresentativa dell’espressione proteica del
recettore dell’NK1 (sequenza troncata che corrisponde a 23 aminoacidi dall’estremità
COOH) sui campioni di tessuto di corteccia cerebrale (da P0 a P30) ottenuta
mediante Western Blotting. Il peso molecolare di tale forma troncata è di circa 35
KDa (Fig. 16a).
Come si può osservare la banda dell’NK1 mostra differenze quantitative tra i
campioni; a P0 è flebile e poco rilevabile, poi diventa sempre più nitida e scura.
Quindi si nota un aumento di espressione dell’NK1 che è direttamente proporzionale
all’aumentare dell’età.
Nella figura 16b è invece riportata l’espressione proteica in Western Blotting della βactina negli stessi lisati di tessuto cerebrale.
La β-actina è stata utilizzata come controllo di caricamento ed i suoi valori di
espressione, ottenuti dall’analisi densitometrica, sono stati usati per normalizzare i
dati densitometrici relativi all’espressione dell’NK1.
Figura 16a
Figura 16b
Figura 16
Espressione proteica dell’NK1 (a) e della β-actina (b) nei tessuti di corteccia cerebrale nello sviluppo post-natale del ratto.
69
RISULTATI
7.4 Analisi semiquantitativa dell’NK1
Con la densitometria (vedi paragrafo 6.10) sono stati calcolati i valori di intensità (in
scala di grigio) dell’NK1 in tutti i campioni cerebrali.
I valori ottenuti rapportati ai corrispondenti valori della β-actina, sono stati riportati
in grafico come media + deviazione standard (Fig. 17):
Intensità NK1
Intensità β-actina
Figura 17
Analisi semiquantitativa dell’NK1 nello sviluppo post-natale della corteccia di ratto.
*: bassa significatività; **: media significatività; ***: alta significatività.
Dall’analisi semiquantitativa dell’NK1, sono risultate differenze di espressione nelle
diverse età. Le più significative riguardano P15 - P20 - P30 in confronto sia a P0 che
a P5 e P20 - P30 con P10.
70
DISCUSSIONE
Capitolo VIII
DISCUSSIONE
Da questi esperimenti è risultato che il recettore NK1 è presente nella corteccia
parietale di ratto sin dalla nascita e che la sua distribuzione varia durante lo sviluppo
post-natale.
A P0 e P5 i neuroni NK1 positivi sono di piccole dimensioni e tutti localizzati negli
strati più profondi; da P10 a P30 invece si distribuiscono in tutti i sei strati della
corteccia. Tale risultato, ottenuto in immunocitochimica, è in accordo con quanto
ottenuto con il Western Blotting in cui si è osservato un aumento dell’espressione
proteica dell’NK1 in funzione dell’età; infatti a P0 e P5 la quantità di NK1 espressa è
poca, probabilmente dovuta alle piccole dimensioni dei somi dei neuroni; da P10,
invece, l’espressione del recettore aumenta fino a P20 e P30, quando l’espressione
proteica rimane pressocchè costante.
A P0 e P5 si è detto che i neuroni sono tutti localizzati nella sub-cortical plate;
questo perché i neuroni corticali nel ratto sono generati prima della nascita ma non
raggiungono la loro posizione finale se non parecchi giorni dopo la nascita (Berry e
Rogers, 1965; Lund e Mustari, 1977).
Studi recenti suggeriscono che i neuroni della SCP inclusi quelli che si trovano nella
sostanza bianca giocano un ruolo chiave durante le prime fasi dello sviluppo della
corteccia cerebrale coordinando la formazione delle connessioni talamocorticali e
corticocorticali (Friedlander e Torres-Reveron, 2009).
Le cellule della SCP
provengono dalla zona ventricolare sotto la corteccia cerebrale, migrando verso la
cortical pre-plate (Stewart e Pearlman, 1987) che poi viene divisa nella MZ e nella
71
DISCUSSIONE
SCP. Mentre i neuroni della CP danno origine alla maggior parte degli strati corticali
(dal II al VI strato), i neuroni della MZ formano il primo strato; i neuroni della SCP
diventano cellule interstiziali della sostanza bianca ed inoltre formano un compatto
strato lungo il fondo del VI strato. Comunque, sebbene molte di queste cellule
muoiono presto dopo l’innervazione della CP da parte degli assoni talamici, il 1020% sopravvive (Chun e Shatz, 1989; Torres-Reveron e Friedlander, 2007). Queste
cellule rimangono per tutto lo sviluppo fino all’adulto, come una compressa banda
sotto il VI strato (Valverde et al., 1989; Vandevelde et al., 1996; Reep e Goodwin,
1988; Clancy e Cullier, 1999). Queste cellule generano potenziali di azione e
ricevono segnali sinaptici sia inibitori che eccitatori (Torres-Reveron e Friedlander,
2005); inoltre, conservano un fenotipo neuronale, ricevono segnali sinaptici da altri
neuroni e innervano gli strati corticali. Torres-Reveron e Friedlander hanno anche
dimostrato che queste cellule forniscono segnali sinaptici eccitatori glutamatergici ai
neuroni del VI strato. Quindi, nonostante non si conosca ancora il ruolo di questi
neuroni della SCP all’interno della corteccia matura, è dimostrato che questi
svolgono importanti funzioni durante lo sviluppo della corteccia cerebrale e che una
parte di queste cellule organizza una rete funzionale che potrebbe contribuire alle
funzioni corticali (Friedlander e Torres-Reveron, 2009).
La SP è uno dei neuropeptidi più conosciuti ed è ampiamente distribuito nel SNC dei
mammiferi (Ohtsuka e Yoshioka, 1993). È implicata in diversi processi fisiologici e
patofisiologici; studi recenti hanno dimostrato il suo ruolo nei meccanismi della
nocicezione, in particolare nel midollo spinale (Hill, 2000), altri hanno stabilito un
suo ruolo nelle funzioni del sistema nervoso, come nello stress (Ebner e Singewald,
2006; Commons 2010). Sono ancora scarse le prove per un coinvolgimento della SP
nella regolazione del ciclo sonno-veglia (Nishino e Fujiki, 2007). Le prime
72
DISCUSSIONE
discussioni riguardo la distribuzione della SP nel cervello dei mammiferi risalgono
agli anni 70 (Hökfelt et al., 1975; Ljungdahl et al., 1978). In questi studi iniziali si
utilizzavano anticorpi contro la sequenza carbossi-terminale del peptide, comune a
tutte le neurochinine. Studi seguenti, invece, hanno utilizzato anticorpi che
riconoscevano solo la SP ed hanno quindi permesso di determinare la localizzazione
delle cellule, delle fibre e dei terminali positivi alla SP nel SNC dei mammiferi
(Shults et al., 1984; Ribeiro-Da-Silva e Hökfelt, 2000). Un’intensa marcatura per la
SP è stata osservata in aree che sono conosciute essere implicate nella modulazione
dello stress e nella risposta a stimoli stressori come l’amigdala, il locus ceruleus,
l’ipotalamo e la sostanza nigra, mentre una moderata marcatura è stata rilevata nel
caudato putamen, nel nucleo accumbens e nel rafe, così come nella I lamina del
midollo spinale. D’altra parte, bassi livelli di SP sono stati identificati nella corteccia
cerebrale, cervelletto e ippocampo (Brownstein et al., 1976; Ljungdahl et al., 1978;
Nakaja et al., 1994).
La distribuzione dei recettori NK1 nel SNC dei mammiferi è stata studiata mediante
autoradiografia (Rigby et al., 2005; Shults et al., 1982; Manthy et al., 1984, 1989;
Saffroy et al., 1988, 2003), da studi di ibridazione in situ che analizzano
l’espressione dell’mRNA codificante per il recettore (Maeno et al., 1993; Caberlotto
et al., 2003) e da immuistochimica (Nakaya et al., 1994) che portano prove evidenti
per un’ampia ma distinta distribuzione dei recettori NK1 nel cervello dei mammiferi.
Una corrispondenza tra la distribuzione dei recettori NK1 e quella della SP è
dimostrata da studi di elettrofisiologia, autoradiografia, immunoistochimica e di
espressione dell’mRNA (Manthy et al., 1984; Nakaya et al., 1994; Maeno et al.,
1993) nell’amigdala, nell’ipotalamo, nell’ippocampo, nel nucleo del rafe, nel tronco
encefalico, nel locus ceruleus e nella PAG. In altre regioni come la sostanza nigra e il
73
DISCUSSIONE
nucleo laterale interpeduncolare, invece, un’intensa marcatura della SP non appare
essere accompagnata dalla co-espressione dei recettori NK1 (Saria, 1999; Quartara e
Maggi, 1998; Nakaya et al., 1994). Questa discrepanza appare anche nella corteccia
cerebrale.
Zhang e Harlan (1994), infatti, utilizzando tecniche di immunocitochimica e
ibridizzazione in situ hanno dimostrato che l’mRNA della SP e le cellule SP sono
presenti in corteccia sin dalla nascita e sono molto abbondanti nel VI strato e
nell’adiacente sostanza bianca; da P5 a P15 il loro numero decresce gradualmente, i
neuroni si espandono lateralmente verso il V strato della corteccia parietale e
temporale. Inoltre questi studi hanno dimostrato la presenza di un esiguo numero di
cellule positive nel II strato. Al contrario, dai nostri esperimenti e da quelli di altri
(Rigby et al., 2005; Dittrich et al., 2012) il recettore NK1 in corteccia è ampiamente
espresso. Una ragione di queste discrepanze potrebbe essere l’esistenza di sottotipi di
recettori delle neurochinine non ancora scoperte (Herkenham, 1987). Un’altra
spiegazione per questa anatomica discontinuità tra i siti di rilascio e i potenziali
bersagli potrebbero essere il diffuso rilascio e la capacità neuromodulatoria dei
neuropeptidi comparata con i classici trasmettitori. I neuropeptidi possono essere
rilasciati sinapticamente da siti mulipli della membrana neuronale (inclusi i dendriti)
e sembrano persistere nel fluido extracellulare per lunghi periodi di tempo; inoltre
sono in grado di diffondere a considerevoli distanze ed agire su bersagli lontani dalle
zone di rilascio (secrezione paracrina) (Landgraf e Newmann, 2004; Shults et al.,
1984; Liu et al., 1994). Inoltre come è stato detto da Herkenham è probabile che i
neuroni che esprimono il recettore NK1 in regioni povere di SP potrebbero ricevere la
SP rilasciata da terminali assonici di vari sistemi afferenti.
74
BIBLIOGRAFIA
Abbadie, C., Brown, J. L., Mantyh, P. W., Basbaum, A. I. (1996). Spinal cord
substance P receptor immunoreactivity increases in both inflammatory and nerve
injury models of persistent pain. Neuroscience 70: 201-209.
Akers, R. M., and Killackey, H. P. (1978). Organization of corticocortical
connections in the parietal cortex of the rat. J. Comp. Neurol. 181: 513-538.
Aliakbari, J., Sreedharan, S. P., Turck, C. W., Goetzl, E. J. (1987). Selective
localization of vasoactive intestinal peptide and substance P in human eosinophils.
Biochemical and Biophysical Research Communications 148: 1440-1445.
Alm, P., Alumets, J., Brodin, E., Hakanson, R., Nilsson, G., Sjöberg, N. O., Sundler,
F. (1978). Peptidergic (Substance P) nerves in the genitourinary tract. Neuroscience
3: 419-425.
Anastasi, A., Erspamer, V. (1962). Occurrence and some properties of eledoisin in
extracts of posterior salivary glands of Eledone. Br. J. Pharmacol. Chemother. 19:
326-336.
Anastasi, A., Erspamer, V., Cei, J. M. (1964). Isolation and amino acid sequence of
physalaemin, the main active polipeptide of the skin of physalaemus fuscumaculatus.
Arch. Biochem. Biophys. 108: 341-348.
75
Andoh, T., Nagasawa, T., Kuraishi, Y. (1996). Expression of tachykinin NK1
receptor mRNA in dorsal root ganglia of the mouse. Brain Res. Mol. Brain Res. 35:
329-332.
Andrews, P., Torii, Y., Saito, H., Matsuki, N. (1996). The pharmacology of the
emetic response to upper gastrointestinal tract stimulation in Suncus murinus. Eur J
Pharmacol 307: 305-313.
Bae, S. J., Matsunaga, Y., Takenaka, M., Tanaka, Y., Hamazaki, Y., Shimizu, K.,
Katayama, I. (2002). Substance P induced preprotachykinin-a mRNA, neutral
endopeptidase mRNA and substance P in cultured normal fibroblast. International
Archives of Allergy and Immunology 127: 316-321.
Baluk,, P., Bertrand, C., Geppetti, P., McDonald, D., Nadel, J. A. (1995). NK1
receptors mediate leukocyte adhesion in neurogenic inflammation in the rat trachea.
Am. J. Physiology 268: L263-L269.
Bandari, P. S., Qian, J., Oh, H. S., Potian, J. A., Yehia, G., Harrison, J. S.,
Rameshwar, P. (2003a). Crosstalk between neurokinin receptors is relevant to
hematopoietic regulation: cloning and characterization of neurokinin-2 promoter.
Journal of Neuroimmunology 138: 65-75.
Bandari, P. S., Qian, J., Yehia, G., Joshi, D. D., Maloof, P. B., Potian, J., Oh, H. S.,
Gascon, P., Harrison, J. S., Rameshwar, P. (2003b). Hematopoietic growth factor
76
inducible neurokinin-1 type: a transmembrane protein that is similar to neurokinin 1
interacts with substance P. Regulatory Peptides 111: 169-178.
Barbaresi, P. (1998). Immunocytochemical localization of substance P receptor in rat
periaqueductal gray matter: a light and electron microscopic study. J. Comp. Neurol.
398: 473-90.
Bartho', L., Holzer, P. (1985). Search for a physiological role of substance P in
gastrointestinal motility. Neuroscience 16: 1-32.
Beaudoin, A. R. (1980). Embryology and teratology. In H. J. Baker, J. R. Lindsey,
and S. H. Weisbroth (eds.), The Laboratory Rat. Vol. II. Research Applications. New
York: Academic Press, pp. 75-101.
Berry, M., and Rogers, A. W. (1965). The migration of neuroblasts in the developing
cerebral cortex. J. Anat. 99: 691-709.
Bertaccini, G, Cei, J. M., and Erspamer, V. (1965). Occurrence of physalaemin in
extracts of the skin of Physalaemus fuscomaculatus and its pharmacological actions
on extravascular smooth muscle. Br. J. Pharmacol. 25: 363-379.
Bertaccini, G., and De Caro, G. (1965). The effect of physalaemin and related
peptides on salivary secretion. J. Physiol. 181: 68-81.
77
Bertaccini, G., De Caro, G., and Impicciatore, M. (1967). Effects of physalaemin on
some exocrine secretions of dogs and rats. J. Physiol. 193: 497-511.
Bhatt, D. H., Zhang, S., Gan, W. B. (2009). Dendritic spine dynamics. Ann. Rev.
Physiol. 71: 261-82. doi: 10.1146/annurev.physiol.010908.163140.
Bianchi Porro, G., Della Porta, P., and Maiolo, A. T. (1965). Portata distrettuale e
metabolismo dell’encefalo sotto infusione continua di eledoisina. Atti Accad. Med.
Lombarda 20: 313-316.
Bjorklund, H., Dalsgaard, C. J., Johnsson, C. E., and Hermansson, A. (1986).
Sensory and autonomic innervation of non-hairy and hairy human skin. An
immunohistochemical study. Cell Tissue Res. 243: 51-57.
Bodian, D. (1966). Development of fine structure of spinal cord in monkey fetuses. I.
The motoneuron neuropil at the time of onset of reflex activity. Bull. Johns Hosp.
119: 129-149.
Bodian, D., Melby, E. C. Jr., Taylor, N. (1968). Development of fine structure of
spinal cord in monkey fetuses. II. Pre-reflex period to period of long intersegmental
reflexes. J. Comp. Neurol. 133: 113-166.
Boissonade, F. M., Davison, J. S. (1997). Fos induced by emetic stimuli correlates
with substance P immunoreactivity in the ferret brainstem. J. Physiology 499: 106P.
78
Bonner, T. I., Affolter, H. U., Young, A. C., and Young, W. S. (1987). A cDNA
encoding the precursor of the rat neuropeptide, neurokinin B. Brain Res. 388: 243249.
Boulder Committee. (1970). Embryonic vertebrate central nervous system: revised
terminology. Anat. Rec. 166: 257-262.
Bowden, J. J., Baluk, P., Lefevre, P. M., Vigna, S., R., McDonald, D. (1996).
Substance P (NK1) recepytor immunoreactivity on endothelial cells of the rat tracheal
mucosa. Am. J. Physiology 270: L404-L413.
Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of
microgram quantities of protein utilizing the principle of protein-dye binding. Anal.
Biochem. 72: 248-54.
Brodmann, K. (1909). "Vergleichende lokalisationslehre der Groβhirnrinde in ihren
Prinzipien dargestellt auf Grund des Zellbaues". Barth, Leipzig.
Brown, D. R., Parsons, A. M., O'Grady, S. M. (1992). Substance P produces sodium
and bicarbonate secretion in porcine jejunal mucosa through an action on enteric
neurons. J. Pharmacol. Exp. Ther. 261: 1206-1212.
Brownstein, M. J, Mroz, E. A, Kizer, J. S, Palkovits, M., Leeman, S. E. (1976).
Regional distribution of substance P in the brain of the rat. Brain Res. 116: 299-305.
79
Brücker, G., Mareš, V., and Biesold, D. (1978). Programmed cell formation in the
rat’s developing visual cortex. Autoradiographic studies. In G. Dörner and M.
Kawakami (eds.), Hormones and Brain Development. Amsterdam: North HollandElsevier, pp. 285-292.
Brunsson, I., Fahrenkrug, J., Jodal, M., Sioqvist, A., and Lundgren, O. (1995).
Substance P effects on blood flow, fluid transport and vasoactive intestinal
polypeptide release in the feline small intestine. J. Physiol. 483: 727-734.
Buck, S. H., Eelke, C. J, Burcher, E., Shults, C. A., O'Donahue, T. L. (1986).
Pharmacologic characterization and autoradiographic distribution of binding sites for
iodinated tachykinins in the rat central nervous system. Peptides 7: 1109-1120.
Bunge, M. B. (1973). Fine structure of nerve fibers and growth cones of isolated
sympathetic neurons in culture. J. Cell Biol. 56: 713-735.
Burcher, E., Bornstein, J. C. (1988). Localization of substance P binding sites
isubmucous plexus of guinea-pig ileum using whole mount autoradiography.
Synapse 2: 232-239.
Burcher, E., Buck, S. H., Lovenberg, W., O'Donahue, T. L. (1986). Characterization
and autoradiographic localization of multiple tachykinin binding sites in
gastrointestinal tract and bladder. J. Pharmacology Exp. Ther. 236: 819-831.
80
Burcher, E., Shults, C. W., Buck, S. H., Chase, T. N., O' Donahue, T. L. (1984).
Autoradiographic distribution of substance K binding sites in rat gastrointestinal
tract: a comparison with substance P. Eur. J. Pharmacol. 102: 561-562.
Burwell, R. D. (2001). Borders and cytoarchitecture of the perirhinal and postrhinal
cortices in the rat. J. Comp. Neurol. 398: 179-205.
Caberlotto, L., Hurd, Y. L., Murdock, P., Wahlin, J. P., Melotto, S., Corsi, M.,
Carletti, R. (2003). Neurokinin 1 receptor and relative abundance of the short and
long isoforms in the human brain. Eur. J. Neurosci. 17: 1736-1746.
Calvo, N., Reiriz, J., Pérez-Navarro, E., Alberch, J. (1996). Tachykinins protect
chlinergic neurons from quinolinic acid excitotoxicity in striatal cultures. Brain Res.
740: 323-328.
Cao, Y. Q., Mantyh, P. W., Carlson, E., Gillespie, A. M., Epstein, C. J., Basbaum, A.
I. (1998). Primary afferent tachykinins are required to experience moderate to intense
pain. Nature 392: 390-394.
Carlton, S. M., Zhou, S., Coggeshall, R. E. (1996). Localization and activation of
substance P receptors in unmyelinated axons of rat glabrous skin. Brain Res. 734:
103- 108.
81
Carter, M. S., and Krause, J. E. (1990). Structure, expression, and some regulatory
mechanisms of the rat preprotachykinin gene encoding substance P, neurokinin A,
neuropeptide K, and neuropeptide gamma, J. Neurosci. 10: 2203-2214.
Cascieri, M. A., Huang, R. R. C., Fong, T. M., Cheung, A. H., Sadowsky, S., Beer,
E., and Strader, C. D. (1992). Determination of the amino acid residues in substance
P conferring selectivity and specificity for the rat neurokinin receptors. Mol.
Pharmacol 41: 1096-1099.
Cavanagh, M. E., and Parnavelas, J. G. (1988). Development of somatostatin
immunoreactive
neurons
in
the
rat
occipital
cortex:
a
combined
immunocytochemical-autoradiographic study. J. Comp. Neurol. 268: 1-12.
Chang, M. M., and Leeman, S. E. (1970). Isolation of a sialagogic peptide from
bovine hypothalamic tissue and its characterization as substance P. J. Biol. Chem.
245: 4784-4790.
Chang, M. M., Leeman, S. E., Niall, H. D. (1971). Aminoacid sequence of substance
P. Nature 232: 86-87.
Charlton, C.
G.,
Helke, C.
J.
(1985a).
Autoradiographic
localization
and
characterization of spinal cord substance P binding sites: high densities in sensory,
autonomic, phrenic, and Onuf's motor nuclei. J. Neurosci. 5: 1653-1661.
82
Charlton, C. G., Helke, C. J. (1985b). Characterization and segmental distribution of
125
I-Bolton-Hunter labeled substance P binding sites in rat spinal cord. J. Neurosci. 5:
1293-1299.
Chavolla-Calderon, M., Bayer, M. K., Perez Fontan, J. J. (2003). Bone marrow
transplantation reveals an essential synergy between neuronal and hemopoietic cell
neurokinin production in pulmonary inflammation. Journal of Clinical Investigations
111: 973-980.
Chen, Z., Hedner, J., Hedner, T. (1990). Local effects of Substance P on respiratory
regulation in the rat medulla oblongata. J. Appl. Physiology 68: 693-697.
Chretien, M., Sikstrom, R., Lazure, C., Mbikay, M., Nasiannet, S., Marcinkiewicz,
M., and Seida, N. G. (1989). Expression of the diversity of neuronal and hormonal
peptides in the cleavage of precursor molecules, in Peptide Hormones as
Prohormones (Martinex J. ed.) pp. 1-24, Ellis Horwood, London.
Chronwall, B. M., and Wolff, J. R. (1981). Nonpyramidal neurons in early
developmental stages of the rat neocortex. Biblthca Anat. 19: 147-151.
Chu, H. V., Kraft, M., Krause, J. E., Rex, M. D., Martin, R. J. (2000). Substance P
and its receptor neurokinin 1 expression in asthmatic airways. Journal of Allergy and
Clinical Immunology 106: 713-722.
83
Chun, J. J., and Shatz, C. J. (1989). Interstitial cells of the adult neocortical white
matter are the remnant of the early generated subplate neuronal population. J. Comp.
Neurol. 282: 555-569.
Clancy, B., and Caullier, I. J. (1999). Widespread projections from subgriseal
neurons (layer VII) to layer I in adult rat cortex. J. Comp. Neurol. 400:275-286.
Clancy, B., Silva-Filho, M., and Friedlander, M. J. (2001). Structure and projections
of white matter neurons in the postnatal rat visual cortex. J. Comp. Neurol. 434: 233252.
Commons, K. G. (2010). Neuronal pathways linking substance P to drug addiction
and stress. Brain Res. 1314: 175-82.
Cooke, H. J., Sidhu, M., Fox, P., Wang, Y. Z., Zimmermann, E. M. (1997).
Substance P as a mediator of colonic secretory reflexes. Am. J. Physiology 272:
G238-G245.
Cooper, P. E., Fernstrom M. H., Rorstad, O. P., Leeman, S. E., and Martin, J. B.
(1981). The regional distribution of somatostatin, substance P and neurotensin in
human brain. Brain Res. 218: 219-232.
Cox, H. M., Tough, I. R., Grayson, K., Yarrow, S. (1993). Pharmacological
characterisation of neurokinin receptors mediating anion secretion in rat descending
colonic mucosa. Naunyn-Schmiedeberg's Arch. Pharmacol. 348: 172-177.
84
Crandall, J. E., and Caviness, W. S. (1984). Thalamocortical connections in newborn
mice. J. Comp. Neurolo. 228: 542-556.
Culman, J., Klee, S., Ohlendorf, C., Unger, T. (1997). Effect of tachykinin receptor
inhibition in the brain on cardiovascular and behavioral responses to stress. J.
Pharmacol. Exp. Ther. 280: 238-246.
Culman, J., Wiegand, B., Spitznagel, H., Klee, S., Unger, T. (1995). Effects of the
tachykinin NK1 receptor antagonist RP67580 on central cardiovascular and
behavioral effects of substance P, neurokinin A and neurokinin B. Br. J. Pharmacol.
114: 1310-1316.
Dalsgaard, C. J., Haegerstrand, A., Theodorsson-Norheim, E., Brodin, E., and
Hokfelt, T. (1985). Neurokinin A-like immunoreactivity in rat primary sensory
neurons: coexistence with substance P. Histochemistry 83: 37-39.
Dam,
T.
V.,
Quirion,
R.
(1986).
Pharmacological
characterization
and
autoradiographic localization of substance P receptors in guinea pig brain. Peptides 7
855-864.
De Felipe, C., Pinnock, R. D., Hunt, S. P. (1995). Modulation of chemotropism in the
developing spinal cord by substance P. Science 267: 899-902.
De Felipe, C., Herrero, J. F., O’Brien, J. A., Palmer, J. A., Doyle, C. A., Smith, A. J.
H., Laird, J. M. A., Belmonte, C., Cervero, F., Hunt, S. P. (1998). Altered
85
nociception, analgesia and aggression in mice lacking the receptor for substance P.
Nature 392: 394-397.
De Sanctis, G. T., Green, F. H. Y., Jiang, X., King, M., Remmers, J. E. (1994).
Ventilatory responses to hypoxia in rats pretreated with nonpeptide NK1 receptor
antagonist, CP 96345. J. Appl. Physiology 76: 1528-1532.
Dean, C., Marson, L., Kampine, J. P. (1993). Distribution and co-localization of 5hydroxytryptamine, thyrotropin-releasing hormone and substance P in the cat
medulla. Neuroscience 57: 811-822.
Del Cerro, M. P., Snider, R. S. (1968). Studies on the developing cerebellum.
Ultrastructure of the growth cones. J. Comp. Neurol. 133: 341-362.
Derer, P. (1979). Evidence for the occurrence of early modifications in the “Glia
limitans” layer of the neocortex of the reeler mutant mouse. Neurosci. Lett. 13:195202.
Diamond, M. C. (1987). Sex differences in the rat forebrain. Brain Res. Rev. 12:
235-240.
Dittrich, L., Heiss, J. E., Warrier, D. R., Perez, X. A., Quik, M., Kilduff, T. S. (2012).
Cortical nNOS neurons co-express the NK1 receptor and are depolarized by
Substance P in multiple mammalian species. Front. Neural Circuits. 6:31.
86
Douglas, F. L., Palkovits, M., and Brownstein, M. J. (1982). Regional distribution of
substance P-like immunoreactivity in the lower brainstem of the rat. Brain Res. 245:
376-378.
Dray, A., and Pinnock, R. D. (1982). Effects of substance P on adult rat sensory
ganglion neurones in vitro, Neurosci. Lett. 33: 61-66.
Droogleever Fortuyn, A. B. (1914). Cortical cell lamination of the hemisphere of
some rodents. Arch. Neurol. Psychol. 6: 221-254.
Ebner, K., Singewald, N. (2006). The role of substance P in stress and anxiety
responses. Amino Acids. 31: 251-72.
Eglezos, A., Andrews, P. V., Boyd, R. L, and Helme, R. D. (1991). Modulation of
the immune response by tachykinins. Immunol. Cell. Biol. 69 :285-294.
Eklund, B., Jogestrand, T., and Pernow, B. (1977). Effect of substance P on
resistance and capacitance vessels in the human forearm, in Substance P (von Euler,
U. S., and Pernow, B., eds.), pp. 275-285, Raven Press, New York.
Emmelin, N., and Lenninger, S. (1967). The “direct” effect of physalaemin on
salivary gland cells. Br. J. Pharmacol. 30: 676-680.
Emson, P. C., Arregul, A., Clement Jones, V., Sandberg, B. E., and Rossor, M.
(1980). Regional distribution of methionine-enkephalin and substance P-like
87
immunoreactivity in normal human brain and in Huntington’s disease. Brain Res.
199: 147-160.
Erspamer, V. (1981). The tachykinin peptides family. Trends Neurosci. 4: 267-269.
Erspamer, V. (1983). Amphibian skin peptides in mammals-looking ahead. Trends
Neurosci. 6: 200-201.
Erspamer, V. (1994). Bioactive secretions of the integument, in Amphibian Biology.
I. The Integuments (Heatwole, H., and Barthalmus, G. T., eds.) pp. 178–350, Surrey
Beatty & Sons, Chipping Norton, NSW, Australia.
Erspamer, V., Bertaccini, G., Urakawa, N. (1964). Biogenic amines and active
polypeptides in the skin of ten Japanese amphibian species. Jpn. J. Pharmacol. 14:
467-473.
Erspamer, V., e Falconieri Erspamer, G. (1962). Pharmacological actions of
eledoisin on extravascular smooth muscle. Br. J. Pharmacol. Chemother. 19(2): 337354.
Evans, T. W., Dixon, C. M., Clarke, B., Conradson, T. B., and Barnes, P. J. (1988).
Comparison of neurokinin A and substance P on cardiovascular and airway function
in man. Br. J. Clin. Pharmacol. 25: 273-275.
88
Feldman, P. D. (1995). NK1 receptor mediation of the vasodepressor effects of
substance P in the nucleus of the tractus solitarius. J. Pharmacol. Exp. Ther. 273:
617-623.
Fleming, D. E., Anderson, R. H., Rhees, R. W., Kinghorn, E., and Bakaitis, J. (1986).
Effects of prenatal stress on sexually dimorphic asymmetries in the cerebral cortex of
the male rat. Brain Res. Bull. 16:395-398.
Floeter, M. K., and Jones, E. G. (1985). Demorphology and phased outgrowth of
callosal axons in the fetal rat. Dev. Brain. Res. 22: 7-18.
Fong, T. M., Yu, H., Strader, C. D. (1992). The extracellular domain of substance P
(NK1) receptor comprises part of the ligand binding site. Biophys. J. 62: 59-60.
Friedlander, M. J., Torres-Reveron, J. (2009). The changing roles of neurons in the
cortical subplate. Front. Neuroanat. 3:15. doi: 10.3389/neuro.05.015.2009.
Friess, H., Zhu, Z., Liard, V., Shi, X., Shrikhande, S. V., Wang, L., Lieb, K., Korc,
M., Palma, C., Zimmermann, A., Reubi, J. C., Buchler, M. W. (2003). Neurokinin-1
receptor expression and its potential effects on tumor growth in human pancreatic
cancer. Laboratory Investigations 83: 731-742.
Frossard, N., and Advenier, C. (1991). Tachykinin receptors and the airways. Life
Sci. 49: 1941-1953.
89
Gaddum, J. H., and Schild, H. O. (1934).
Depressor substances in extracts of
intestine. J. Physiol. (Lond) 83: 1-14.
Gadisseux, J. F., and Evrard, P. (1985). Glial-neuronal relationship in the developing
central nervous system. Dev. Neurosci. 7: 12-32.
Gale, J. S., Bird, E. D., Spoke, E. G., Ivejsen, L. L., and Jessel, T. (1978). Human
brain substance P: distribution in controls and Huntington’s chorea. J. Neurochem.
30: 633-634.
Garcia, M., Sakamoto, K., Shigekawa, M., Nakanishi, S., Ito, S. (1994). Multiple
mechanisms of arachidonic acid release in Chinese hamster ovary cells transfected
with cDNA of substance P receptor. Biochem. Pharmacol. 48: 1735-1741.
Gardette, R., Courtois, M., and Bisconte, J-C. (1982). Prenatal development of
mouse central nervous structures: time of neuron origin and grandients of neuronal
production. Autoradiography study. J. Hirnforsch. 23: 415-431.
Gardner, C. J, Bountra, C., Bunce, K. T., Dale, T. J., Jordan, C. C., Twissell, D.
J.and Ward, P. (1994). Antiemetic activity of NK1 receptor antagonists is mediated
centrally in the ferret. Br. J. Pharmacol. 112: 516P.
Gates, T. S., Zimmerman, R. P., Mantyh, C. R., Vigna, S. R., Maggio, J. E., Welton,
M. L., Passaro, E. P., and Mantyh, P. W. (1989). Substance P and substance K
90
receptor binding sites in the human gastrointestinal tract: localization by
autoradiography. Peptides 9: 1207-1219.
Gerard, N. P., Bao, L., Xiao-Ping, H., Gerard, C. (1993). Molecular aspects of the
tachykinin receptors. Regulatory Peptides 43: 21-35.
Gerard, N. P., Garraway, L. A., Eddy Jr., R. L., Shows, T. B., Iijima, H., Paquet, J.
L., Gerard, C. (1991). Human substance P receptor (NK-1): organization of the gene,
chromosome localization, and functional expression of cDNA clones. Biochemistry
30: 10640-10646.
Gibbins, I. L., Furness, J. B., Costa, M., MacIntyre, I., Hillyard, C. J., and Girgis, S.
(1985). Co-localization of calcitonin gene-related peptide-like immunoreactivity with
substance P in cutaneous, vascular and visceral sensory neurons of guinea pigs.
Neurosci. Lett. 57: 125-130.
Goubillon, M. L., Forsdike, R. A., Robinson, J. E., Ciofi, P., Caraty, A., Herbison, A.
E. (2000). Identification of Neurokinin B expressing neurons as a highly estrogenreceptive, sexually dimorphic cell group in the ovine arcuate nucleus. Endocrinology
141: 4218-4225.
Guard, S., and Watson, S. P. (1991). Tachykinin receptor types: classification and
membrane signaling mechanism. Neurochem Int 18: 149-165.
91
Haefeli, A., and Hurlimann, A. (1962). Substance P, a highly active naturally
occurring polypeptide. Experientia 18: 297-303.
Hanesch, U.,
Blecher, F.,
Stiller, R.
U.,
Emson, P.
C.,
Schaible, H.
G.,
Heppelmann, B. (1995). The effect of unilateral inflammation at the rat's ankle joint
on the expression of preprotachykinin A mRNA and preprosomatostatin mRNA in
dorsal root ganglion cells - a study using non radioactive in situ hybridization. Brain
Res. 700: 279-284.
Hardwick, J. C.,. Mawe, G. M,. Parsons, R. L. (1997).
Tachykinin induced
activation of non-specific cation conductance via NK3 neurokinin receptors in
guinea-pig intracardiac neurones, J. Physiol. (Lond) 504: 65-74.
Harmar, A., Keen, P. (1982). Synthesis, and central and peripheral axonal transport
of substance P in a dorsal root ganglion-nerve preparation in vitro, Brain Res. 231:
379-385.
Harmar, A., Schofield, J. G., Keen, P. (1980). Cycloheximide-sensitive synthesis of
substance P by isolated dorsal root ganglia, Nature 284: 267-269.
Hartung, H. P., and Toyka, H. V. (1989). Substance P, the immune system and
inflammation. Int. Rev. Immunol. 4: 229-249.
92
Heath, M. S., Lints, T. J., Lee, C. J., Dodd, J. (1995). Functional expression of the
tachykinin NK1 receptor by floor plate cells in the embryonic rat spinal cord and
brainstem. J. Physiology 486: 139-148.
Henrikson, C. K., and Vaughn, J. E. (1974). Fine structural relationship between
neuritis and radial glial processes in developing mouse spinal cord. J. Neurocytol. 3:
659-675.
Herkenham, M. (1987). Mismatches between neurotransmitter and receptor
localizations in brain: observations and implications. Neuroscience 23: 1-38.
Hershey, A. D., and Krause, J. E. (1990). Molecular characterization of a functional
cDNA encoding the rat substance P receptor. Science 247: 958-962.
Hicks, S. P., and D’Amato, C. J. (1968). Cell migrations to the isocortex in the rat.
Anat. Rec. 160: 619-634.
Hill, R. (2000). NK1 (substance P) receptor antagonists – why are they not analgesic
in humans? Trends Pharmacol. Sci. 21: 244-6.
Ho, W. Z., Lai, J. P., Li, Y., Douglas, S. D. (2002). HIV enhances substance P
expression in human immune cells. FASEB Journal 16: 616-618.
93
Ho, W. Z., Lai, J. P., Zhu, X. H., Uvaydova, M., Douglas, S. D. (1997). Human
monocytes and macrophages express substance P and neurokinin-1 receptor. Journal
of Immunolology 159: 5654-5660.
Hökfelt, T., Holets, V. R., Staines, W., Meister, B., Melander, T., Schalling, M.,
Schultzberg, M., Freedman, J., Bjorklund, H., and Olson, L. (1986). Coexistence of
neuronal messengers: an overview. Prog. Brain Res. 68: 33-70.
Hökfelt, T., Johansson, O., Kellerth, J. O., Ljungdahl, A., Nilsson, G., Nygards, A.,
and Pernow, B. (1977). Immunohistochemical distribution of substance P, in
Substance P (von Euler, U. S., and Pernow, B., eds.), pp. 117-145, Raven Press, New
York.
Hökfelt, T., Kellerth, J. O., Nilsson, G., Pernow, B. (1975). Substance P: localization
in the central nervous system and in some primary sensory neurons. Science 190:
889-890.
Hökfelt, T., Pernow, B., Wahren, J. (2001). Substance P: a pioneer amongst
neuropeptides. J. Intern. Med. 249: 27-40.
Hökfelt, T., Vincent, S., Dalsgaard, C. J., Skirboll, L., Johansson, O., Schultzberg,
M., Lundberg, J. M., Rosell, S., Pernow, B., Jancso, G. (1982). Distribution of
substance P in brain and periphery and its possible role as a cotransmitter. Ciba
Found. Symp. 91: 84-106.
94
Holzer, P. (1988). Local effector functions of capsaicin-sensitive sensory nerve
endings: involvement of tachykinins, calcitonin gene-related peptide and other
neuropeptides. Neuroscience 24: 739-768.
Holzer, P. (1991). Capsaicin: cellular targets, mechanisms of action and selectivity
for tin sensory neurons. Pharmacol. Rev. 43: 143-201.
Holzer, P. and Holzer-Petsche, U. (1997a). Tachykinins in the gut. Part I.
Expression, release and motor function. Pharmacol. Ther. 73: 173-217.
Holzer, P. and Holzer-Petsche, U. (1997b). Tachykinins in the gut. Part II. Roles in
neural excitation, secretion and inflammation. Pharmacol. Ther. 73: 219-263.
Holzer-Petsche, U. (1995). Tachykinin receptors in gastrointestinal motility. Regul.
Pept. 57: 19-42.
Holzer-Petsche, U., Schimek, E., Amann, R., and Lembeck, F. (1985). In vivo and in
vitro actions of mammalian tachykinins. Naunyn-Schmiedeberg’s Arch. Pharmacol.
330: 130-135.
Hua, X. Y., Theodorsson-Norheim, E., Lundberg, J. M., Kinn, A. C., Hökfelt, T.,
Cuello, A. C. (1987). Co-localization of tachykinins and CGRP in capsaicin-sensitive
afferents in relation to motility effects in the human ureter in vitro. Neuroscience 23:
693-703.
95
Huang, R. R., Yu, H., Strader, C. D., Fong, T. M. (1994). Interaction of substance P
with the second and seventh transmembrane domains of the neurokinin-1 receptor,
Biochemistry 33: 3007-3013.
Humpel, C., Knaus, G. A., Auer, B., Knaus, H. G., Haring, C., Theodorsson, E.,
Saria, A. (1990). Effects of haloperidol and clozapine on preprotachykinin A mRNA,
tachykinin tissue level release and NK1 receptors in the striatonigral system. Synapse
6: 1-9.
Hunter, J. C., Hannah, P. A., and Maggio, J. E. (1985). The regional distribution of
kassininlike immunoreactivity in central and peripheral tissues of the cat. Brain Res.
341: 228-232.
Inagaki, S., Sakanaka, M., Shiosaka, S., Senba, E., Takatsuki, K., Takagi, H., Kawai,
Y., Minagawa, H., and Tohyama, M. (1982). Ontogeny of substance P-containing
neuron system of the rat: immunohistochemical analysis: I. Forebrain and upper
brainstem. Neuroscience 7: 251-277.
Ishizuka, O., Mattiasson, A., Andersson, K. E. (1995). Tachykinin effects on bladder
activity in conscious normal rats. J. Urology 154: 257-261.
Itoi, K., Tschöpe, C., Jost, N., Culman, J., Lebrun, C., Stauss, B., Unger, T. (1992).
Identification of the central tachykinin receptor subclass involved in substance Pinduced cardiovascular and behavioral responses in conscious rats. Eur. J.
Pharmacol. 219: 435-444.
96
Ivy, G. O., and Killackey, H. P. (1981). The ontogeny of the distribution of callosal
projection neurons in the rat parietal cortex. J. Comp. Neurol. 195: 367-389.
Iwasaki, Y., Kinoshita, M., Ikeda, K., Takamiya, K., Shiojima, T. (1989). Trophic
effects of various neuropeptides on the cultured ventral spinal cord of rat embryo.
Neurosci. Letters 101: 316-320.
Jacobson, M. (1978). Developmental Neurobiology. 2nd Ed. New York: Plenum
Press, 562 pp.
Jacobson, S. (1970). Distribution of commissural axon terminals in the rat neocortex.
Exp. Neurol. 28: 193-205.
Jancsò, N., Jancso-Gabor, A., Szolcsanyi, J. (1967). Direct evidence for neurogenic
inflammation and its prevention by denervation and by pretreatment with capsaicin.
Br. J. Pharmacol. 31: 138-151.
Jancsò, N., Jancso-Gabor, A., Szolcsanyi, J. (1968). The role of sensory nerve
endings in neurogenic inflammation induced in human skin and in the eye and paw
of the rat. Br. J. Pharmacol. 32: 32-41.
Jonsson, G., Hallman, H. (1982). Substance P counteracts neurotoxin damage on
norepinephrine neurons in rat brain during ontogeny. Science 215: 75-77.
97
Joosten, E. A. J., and Van Eden, C. G. (1989). Anterograde tracy study on the
development of corticospinal projections from the medial prefrontal cortex in the rat.
Dev. Brain Res. 45: 313-319.
Kachidian, P., Poulat, P., Marlier, L., Privat, A. (1991). Immunohistochemical
evidence for the coexistence of substance P, thyrotropin-releasing hormone, GABA,
methionine-enkephalin, and leucin-enkephalin in the serotonergic neurons of the
caudal raphe nuclei: a dual labeling in the rat. J. Neurosci. Res. 30: 521-530.
Kage, R., McGregor, G. P., Thim, L., and Conlon, M. (1988). Neuropeptide gamma:
a peptide isolated from rabbit intestine that is derived from gamma-preprotachykinin.
J. Neurochem. 50: 1412-1417.
Kalia, M., Fuxe, K., Hökfelt, T., Harfstrand, A., Lang, R. E., Ganten, D. (1984).
Distribution of neuropeptide immunoreactive nerve terminals within the subnuclei of
the tractus solitarius of the rat. J. Comp. Neurology 222: 409-420.
Kalsbeek, A., Voorn, P., Buijs, R. M., Pool, C. W., and Ujlings, H. B. M. (1988).
Development of the dopaminergic innervations in the prefrontal cortex of the rat. J.
Comp. Neurol. 269: 58-72.
Kanazawa, I., and Jessell, T. (1976). Post mortem changes and regional distribution
of substance P in the rat and mouse nervous system. Brain Res. 117: 362-367.
98
Kanazawa, I., Ogawa, T., Kimura, S., and Munekata, E. (1984). Regional distribution
of substance P, neurokinin α and neurokinin β in rat central nervous system.
Neurosci. Res. 2: 111-120.
Kaneko, T., Shigemoto, R., Nakanishi, S., Mizuno, N. (1994). Morphological and
chemical characteristics of substance P receptor-immunoreactive neurons in the rat
neocortex. Neuroscience. 60: 199-211.
Kangawa, K., Minamino, N., Fukada, A., and Matsuo, H. (1983). Neuromedin K: a
novel mammalian tachykinin identified in porcine spinal cord. Biochem. Biophys.
Res. Commun. 114: 533-540.
Kaplan, M. S. (1981). Neurogenesis in the 3-month-old rat visual cortex. J. Comp.
Neurol. 195: 323-338.
Kawana, E., Sandri, C., Akert, K. (1971). Ultrastructure of growth cones in the
cerebellar cortex of the neonatal rat and cat. Z. Zellforsch 115: 284-298.
Kawatani, M., Matsumoto, G., Birder, L. A., Fukuoka, H., Yoshiyama, M., Misaki,
A., Suzuki, S. (1993). Intrathecal administration of NK1 receptor antagonist, CP
96345, inhibits the micturition reflex in the rat. Regul. Peptides 46: 392-395.
Khan, I., Collins, S. M. (1994). Fourth isoform of preprotachykinin messenger RNA
encoding for substance P in the rat intestine. Biochemical and Biophysical Research
Communications 202: 796-802.
99
Kimura, S., Okada, M., Sugita, Y., Kanazawa, I., and Munekata, E. (1983). Novel
neuropeptides, neurokinin a and b, isolated from porcine spinal cord. Proc. Jpn.
Acad. B 59: 101-104.
Kolb, B., Sutherland, R. J., Nonneman, A. J., and Whishaw, I. Q. (1982). Asymmetry
in the cerebral hemispheres of the rat, mouse, rabbit and cat: the right hemisphere is
larger. Exp. Neurol. 78: 348-359.
König, N., Roch, G., and Marty, R. (1975). The onset of synaptogenesis in the rat
temporal cortex. Anat. Embryol. 148:73-87.
König, N.,and Marty, R. (1981). Early neurogenesis and synaptogenesis in cerebral
cortex. Biblthca Anat. 19:152-160.
Konturek, S. J., Jaworek, J., Tasler, J., Cieszkowski, M., and Pawlik, W. (1981).
Effect of substance P and its C-terminal hexapeptide on gastric and pancreatic
secretion in the dog. Am. J. Physiol. 241: G74-G81.
Kostović, I., and Molliver, M. E. (1974). A new interpretation of the laminar
development of cerebral cortex: synaptogenesis in different layers of the neopallium
in the human fetus. Anat. Rec. 178: 395.
Kotani, H., Hoshimaru, M., Nawa, H., and Nakanishi, S. (1986). Structure and gene
organization of bovine neuromedin K precursor. Proc. Natl. Acad. Sci. USA, 83:
7074-7078.
100
Krause, J. E., Chirgwin, J. M., Carter, M.S., Xu, Z. S., and Hershey, A. D. (1987).
Three rat preprotachykinin mRNAs encode the neuropeptides substance P and
neurokinin A. Proc. Natl. Acad. Sci. USA, 84: 881-885.
Krieg, W. J. S. (1946a). Connections of the cerebral cortex. I. The albino rat. A.
Topography of the cortical areas. J. Comp. Neurol. 84: 221-275.
Krieg, W. J. S. (1946b). Accurate placement of minute lesions in the brain of the
albino rat. Q. Bull. Northwestern Univ. Med. Sch. 20: 199-208.
Krieg, W. J. S. (1947). Connections of the cerebral cortex. I. The albino rat. C.
Extrinsic connections. J. Comp. Neurol. 86: 267-394.
Kris, M. G., Radford, J., Pizzo, B. (1996). Dose-ranging antiemetic trial of the NK1
receptor antagonist CP 122721: a new approach for acute and delayed emesis
following cisplatin. In: 2nd Edition. Proc. Am. Soc. Clin. Oncol. 15: p. A1780.
Kristt, D. A. (1978). Neuronal differentiation in somatosensory cortex of the rat. I.
Relationship to synaptogenesis in the first postnatal week. Brain Res. 150: 467-86.
Kristt, D. A., and Molliver, M. E. (1976). Synapses in newborn rat cerebral cortx: a
quantitative ultrastructural study. Brain Res. 108: 180-186.
101
Kuroiwa, M.,
Aoki, H.,
Kobayashi, S.,
Nishimura, J.,
Kanaide, H.
(1995).
Mechanism of endothelium-dependent relaxation induced by substance P in the
coronary artery of the pig. Br. J. Pharmacol. 116: 2040-2047.
Kurtz, M. M., Wang, R., Clements, M., Cascieri, M., Austin, C., Cunningham, B.,
Chicchi, G., Liu, Q. (2002). Identification, localization and receptor characterization
of novel mammalian substance P-like peptides. Gene 296: 205-212.
Kuwahara, H., Sakurada, T., Sakurada, S., Yonezawa, A., Ando, R., Kisara, K.,
Osakada, F., Munekata, E. (1987). Behavioural effects of intrathecally injected
tachykinins in rats with peripheral nerve transection. Naunyn Schmiedeberg's Arch
Pharmacology 336: 656-660.
Ladic, L. A., Buchan, A. M. J. (1996). Association of substance P and its receptor
with efferent neurons projecting to the greater curvature of the rat stomach. J.
Autonom. Nervous System 58: 25-34.
Lai, J. P., Douglas, S. D., Ho, W.-Z. (1998). Human lymphocytes express substance
P and its receptor. Journal of Neuroimmunology 86: 80-86.
Landgraf, R., Neumann, I. D. (2004). Vasopressin and oxytocin release within the
brain: a dynamic concept of multiple and variable modes of neuropeptide
communication. Front. Neuroendocrinol. 25: 150-176.
102
Laurenzi, M. A., Persson, M. A. A., Dalsgaard, C. J., Haegerstrand, A. (1990). The
neuropeptide substance P stimulates production of interleukin-1 in human blood
monocytes: activated cells are preferentially influenced by the neuropeptide. Scand.
J. Immunology 31: 529-534.
Lavielle, S., Chassaing, G., Ploux, O., Loeuillet, D., Besseyre, J., Julien, S., Marquet,
A., Convert, O., Beaujouan, J. C., Torrens, Y., Bergstrom, L., Saffroy, M., Glowinski
J. (1988). Analysis of tachykinin binding site interactions using constrained
analogues of tachykinins, Biochem. Pharmacol. 37: 41-49.
Lazarus, L. H., and Di Augustine, R. P. (1980). Radioimmunoassay for the
tachykinin peptide physalaemin: detection of a physalaemin-like substance in rabbit
stomach. Anal. Biochem. 107: 350-357.
Lecci, A., Giuliani, S., Garret, C., Maggi, C. A. (1993). Evidence for a role of
tachykinins as sensory transmitters in the activation of micturition reflex.
Neuroscience 54: 827-837.
Lecci, A., Maggi, C. A. (2003). Peripheral tachykinin receptors as potential
therapeutic targets in visceral diseases. Expert Opinion in Therapeutic Targets 7:
343-362.
Lee, C. M, Campbell, N. J, Williams, B. J, Iversen, L. L. (1986). Multiple tachykinin
binding sites in peripheral tissues and in brain. Eur. J. Pharmacol. 130: 209-17.
103
Lembeck, F. (1953). Zur Frage der zentralen Ubertragung afferenter Impulse III.
Mitteilung. Das Vorkommen und die Bedeutung der Substanz P in den dorsalen
Wurzeln des Ruckenmarks. Arch. Exp. Pathol. Pharmakol. 219: 197-213.
Lembeck, F., Holzer, P. (1979). Substance P as neurogenic mediator of antidromic
vasodilation and neurogenic plasma extravasation. Naunyn Schmiedebergs Archives
of Pharmacol. 310: 175-183.
Li, H. S., Zhao, Z. Q. (1998). Small sensory neurons in the rat dorsal root ganglia
express functional NK-1 tachykinin receptor. Eur. J. Neurosci. 10: 1292-1299.
Lindefors, N.,
Yamamoto, Y.,
Pantaleo, T.,
Lagercrantz, H.,
Brodin, E.,
Ungerstedt, U. (1986). In vivo release of substance P in nucleus tractus solitarius
increases during hypoxia. Neurosci. Letters 69: 94-97.
Ling, E.A., and Leblond, C. P. (1973). Investigation of glial cells in semithin section.
II. Variation with age in the numbers of the various glial cell types in rat cortex and
corpus callosum. J. Comp. Neurol. 149: 73-82.
Liu, H., Brown, J. L., Jasmin, L., Maggio, J. E., Vigna, S. R., Mantyh, P. W.,
Basbaum, A. I. (1994). Synaptic relationship between substance P and the substance
P receptor: light and electron microscopic characterization of the mismatch between
neuropeptides and their receptors. Proc. Natl. Acad. Sci. USA, 91: 1009-1013.
104
Ljungdahl, A., Hökfelt, T., Nilsson, G. (1978). Distribution of substance P-like
immunoreactivity in the central nervous system of the rat I. Cell bodies and nerve
terminals. Neuroscience 3: 861-943.
Lotz, M., Vaughan, J. H., Carson, D. A. (1988). Effect of neuropeptides on
production of inflammatory cytokines by human monocytes. Science 241: 12181221.
Lund, R. D. (1978). Development and Plasticity of the Brain. New York: Oxford
Press, 370 pp.
Lund, R. D., and Mustari, M. J. (1977). Development of the geniculocortical
pathways in rats. J. Comp. Neurol. 173: 289-306.
Lundberg, J. M. (1996). Pharmacology of cotransmission in the autonomic nervous
system: integrative aspects on amines, neuropeptides, adenosine triphosphate, amino
acids and nitric oxide. Pharmacological Reviews 48: 113-178.
Lundberg, J. M., Brodin, E., and Saria, A. (1983). Effects and distribution of vagal
capsaicin-sensitive substance P neurons with special reference to the trachea and
lungs. Acta Physiol. Scand. 119: 243-252.
Maeno, H., Kiyama, H., Tohyama, M. (1993). Distribution of the substance P
receptor (NK-1 receptor) in the central nervous system. Brain Res. Mol. Brain Res.
18: 43-58.
105
Maggi, C. A. (1991a). The pharmacology of the efferent function of sensory nerves.
Journal of Autonomic Pharmacol. 11: 173-208.
Maggi, C. A. (1991b). The role of peptides in the regulation of the micturition reflex:
an update. Gen. Pharmacol. 22 :1-24.
Maggi, C. A. (1993). The dual, sensory and 'efferent' function of the capsaicinsensitive primary sensory neurons in the urinary bladder and urethra. In: Maggi, C.
A. editors. Nervous Control of the Urogenital System. Harwood Publisher p. 383422.
Maggi, C. A. (1997). The effects of tachykinins on inflammatory and immune cells.
Regul. Pept. 70: 75-90.
Maggi, C. A., Catalioto, R. M., Criscuoli, M., Cucchi, P., Giuliani, S., Lecci, A.,
Lippi, A., Meini, S., Patacchini, R., Renzetti, A. R., Santicioli, P., Tramontana, M.,
Zagorodnyuk, V., Giachetti, A. (1997). Tachykinin receptors and intestinal motility.
Can. J. Physiol. Pharmacol. 75: 696-703.
Maggi, C. A., Geppetti, P., Santicioli, P., Frilli, S., Giuliani, S., Furio, M.,
Theodorsson, E., Fusco, B., and Meli, A. (1988). Tachykinin-like immunoreactivity
in the mammalian urinary bladder: correlation with the functions of the capsaicinsensitive sensory nerves. Neuroscience 26: 233-242.
106
Maggi, C. A., Giachetti, A., Dey, R. D., Said, S. L. (1995). Neuropeptides as
regulators of airway function: with special reference to VIP and the tachykinins.
Physiol. Rev. 75: 277-322.
Maggi, C.
A.,
Giuliani, S.,
Del
Bianco, E.,
Geppetti, P.,
Theodorsson, E.,
Santicioli, P. (1992). CGRP in the regulation of urinary tract motility. Ann. New
York Acad. Sci. 657: 328-343.
Maggi, C. A., Giuliani, S., Santicioli, P., Abelli, L., Regoli, D., and Meli, A. (1987).
Further studies on the mechanisms of the tachykinin-induced activation of
micturition reflex in rats: evidence for the involvement of capsaicin-sensitive bladder
mechanoreceptors. Eur. J. Pharmacol. 136: 189-205.
Maggi, C. A. and Meli, A. (1986). The role of neuropeptides in the regulation of
themicturition reflex. J. Auton. Pharmacol. 6: 133-162.
Maggi, C. A., Meli, A. (1988). The sensory-efferent function of capsaicin-sensitive
sensory neurons. General Pharmacology 19: 1-43.
Maggi, C. A., Patacchini, R., Rovero, P., and Giachetti, A. (1993). Tachykinin
receptors and tachykinin receptor antagonists. J. Auton. Pharmacol. 13: 23-93.
Maggi, C. A., Santicioli, P., Borsini, F., Giuliani, S., and Meli, A. (1986a). The role
of the capsaicin-sensitive innervation of the rat urinary bladder in the activation of
micturition reflex. Naunyn-Schmiedeberg’s Arch. Pharmacol. 332: 276-283.
107
Maggi, C. A., Santicioli, P., Giuliani, S., Regoli, D., and Meli, A. (1986b).
Activation of micturition reflex by substance P and substance K: indirect evidence
for the existence of multiple tachykinin receptors in the rat urinary bladder. J.
Pharmacol. Exp. Ther. 238: 259-266.
Maggio, J. E. (1985). “Kassinin” in mammals: the newest tachykinins. Peptides 6
(Suppl 3): 237-243.
Maghni, K., Michoud, M. C., Alles, M., Rubin, A., Govindaraju, V., Meloche, C.,
Martin, J. G. (2003). Airway smooth muscle cells express functional neurokinin-1
receptors and the nerve-derived preprotachykinin-A gene: regulation by passive
sensitization. American Journal of Respiratory and Cell Molecular Physiology 28:
103-110.
Mantyh, P. W., Demaster, E., Malhotra, A., Ghilardi, J. R. Rogers, S. D., Mantyh, C.
R., Liu, H, Basbaum, A. I., Vigna, S. R., Maggio, J. E., Simone, D. A. (1995).
Receptor endocytosis and dendrite reshaping in spinal neurons after somatosensory
stimulation. Science 268: 1629-1632.
Mantyh, P. W., Gates, T., Mantyh, C. R., Maggio, J. E. (1989). Autoradiographic
localization and characterization of tachykinin receptor binding sites in the rat brain
and peripheral tissues. J. Neurosci. 9: 258-279.
108
Mantyh, P. W., Hunt, S. P., Maggio, J. E. (1984). Substance P receptors: localization
by light microscopic autoradiography in rat brain using SP as the radioligand. Brain
Res. 307: 147-165.
Mantyh, P. W., Mantyh, C. R., Gates, T., Vigna, S. R., Maggio, J. E. (1988).
Receptor binding sites for substance P and substance K in the canine gastrointestinal
tract and their possible role in inflammatory bowel disease. Neuroscience 25: 817837.
Manzini, S., Conti, S., Maggi, C. A., Abelli, L., Somma, V., Del Bianco, E., and
Geppetti, P. (1989). Regional differences in the motor and inflammatory responses to
capsaicin in guinea pig airways. Correlation with content and release of substance Plike immunoreactivity. Am. Rev. Respir. Dis. 140: 936-941.
Marcinkiewicz, N., Seidah, N. G., and Chretien, M. (1993). Les convertases des
prohormones et le système nerveus. Mèdecine/Science (Wash, D. C.). 9: 553-561.
Marin-Padilla, M. (1971). Early prenatal ontogenesis of the cerebral cortex
(neocortex) of the cat (Felis domestica): a Golgi study. I. The primordial neocortical
organization. Z. Anat. Entwckl.-Gesch. 134: 117-145.
Matsuda, H., Kawakita, K., Kiso, Y., Nakano, T., Kitamura, Y. (1989). Substance P
induces granulocyte infiltration through degranulation of mast cells. J. Immunology
142: 927-931.
109
McCarson, K. E., Krause, J. E. (1994). NK1 and NK3 type tachykinin receptor
mRNA expression in the rat spinal cord dorsal horn is increased during adjuvant or
formalin-induced nociception. J. Neurosci. 14: 712-720.
McCarson, K. E., Krause, J. E. (1996). The NK1 receptor antagonist, LY306740
blocks nociception-induced increases in dorsal horn NK1 receptor gene expression.
Mol. Pharmacol. 50: 1189-1199.
McCarson, K. E. (1999). Central and peripheral expression of neurokinin-1 and
neurokinin-3 receptor and substance P-encoding messenger RNAs: peripheral
regulation during formalin-induced inflammation and lack of neurokinin receptor
expression in primary afferent sensory neurons, Neuroscience 93: 361-370.
McFadden, D., Zinner, M. J., and Jaffe, B. M. (1986). Substance P-induced intestinal
secretion of water and electrolytes. Gut. 27: 267-272.
McGillis, J. P., Mitsuhashi, M., and Payan, D. G. (1990). Immunomodulation by
tachykinin neuropeptides. Ann. N. Y. Acad. Sci. 594: 85-94.
Meini, S., Maggi, C. A. (1994). Evidence for a capsaicin-sensitive, tachykininmediated component in the NANC contraction of the rat urinary bladder to nerve
stimulation. British Journal of Pharmacol. 112: 1123-1131.
110
Merchenthaler, I., Maderdrut, J. L., O’Harte, F., and Conlon, J. M. (1992).
Localization of neurokinin B in the central nervous system of the rat. Peptides 13:
815-829.
Merighi, A., Polak, J. M., Gibson. S. J., Gulbenkian, S., Valentino, K. L., Peirone, S.
M. (1988). Ultrastructural studies on calcitonin gene-related peptide-, tachykininsand somatostatin- immunoreactive neurones in rat dorsal root ganglia: evidence for
the colocalization of different peptides in single secretory granules, Cell Tissue Res.
254: 101-109.
Miller, M. W. (1985). Cogeneration of retrogradely labeled cortico-cortical
projection and GABA-immunoreactive local circuit neurons in cerebral cortex. Dev.
Brain res. 23: 187-192.
Miller, M. W. (1987). Effect of prenatal exposure toalcochol on the distribution and
time of origin of corticospinal neurons in the rat. J. Comp. Neurol. 257: 372-382.
Miller, M. W. (1988). Development of projection and local circuit neurons in
neocortex. In A. Peters and E. G. Jones (eds), Development and Maturation of
Cerebral Cortex. Vol. 7, Cerebral Cortex. New York: Plenum Press, pp. 133-175.
Molliver, M. E., Kostović, I., and Van der Loos, H. (1973). The development of
synapses in the human fetus. Brain Res. 50: 403-407.
111
Montero, V. M. (1973). Evoked responses in the rat’s visual cortex to controlateral,
ipsilateral and restricted photic stimulation. Brain Res. 53: 192-196.
Montero, V. M. (1981). Comparative studies on the visual cortex. In “Cortical
Sensory Organization” (Woolsey, C. N., Ed), pp. 33-81. Humana Press, Clifton, NJ.
Montero, V. M., Bravo, H., and Fernández, V. (1973). Striate-peristriate corticocortical connections in the albino and gray rat. Brain Res. 53: 202-207.
Moussaoui, S. M., Le Prado, N., Bonici, B., Faucher, D. C., Cuine´, F., Laduron,
P.M., Garret, C., (1992). Distribution of neurokinin B in rat spinal cord and
peripheral tissues: comparison with neurokinin A and substance P and effects of
neonatal capsaicin treatment. Neuroscience 48: 969-978.
Mussap, C. J., Burcher, E. (1993). Characterization and autoradiographic localization
of tachykinin receptors in rat gastric fundus. J. Pharmacol. Exp. Ther. 266: 10431053.
Nagahisa, A., Kanai, Y., Suga, O., Taniguchi, K., Tsuchiya, M., Lowe, J. A. 3rd,
Hess, H. J. (1992). Antinflammatory and analgesic activity of a nonpeptide substance
P receptor antagonist. Eur. J. Pharmacol. 217: 191-195.
Nakajima, Y., Tsuchida, K., Negishi, M., Ito, S., and Nakanishi, S. (1992). Direct
linkage of three tachykinin receptors to stimulation of both phosphatidylinositol
112
hydrolysis and cyclic AMP cascades in transfected Chinese hamster ovary cells. J.
Biol. Chem. 267: 2437-2442.
Nakanishi, S. (1987). Substance P precursor and kininogen: their structures, gene
organizations, and regulation, Physiol. Rev. 67: 1117-1142.
Nakanishi, S. (1991). Mammalian tachykinin receptors. Annu. Rev. Neurosci. 14:
123-136.
Nakaya, Y., Kaneko, T., Shigemoto, R., Nakanishi, S., Mizuno, N. (1994).
Immunohistochemical localization of substance P receptor in the central nervous
system of the adult rat. J. Comp. Neurol. 347: 249-274.
Narumi, S., Fujita, T. (1978). Stimulatory effects of substance P and NGF on neuritic
outgrowth in embryonic dorsal root ganglia. Neuropharmacology 17: 73-76.
Narumi S, Maki Y. (1978). Stimulatory effects of substance P on neurite extension
and cAMP levels in cultured neuroblastoma cells. Neurochemistry 30: 1321-1326.
Nawa, H., Hirose, T., Takashima, H., Inayaka, S., and Nakanishi, S. (1983).
Nucleotide sequences of cloned cDNA for two types of bovine brain substance P
precursor. Nature (Lond), 306: 32-36.
113
Nicholas, A. P., Pieribone, V. A, Arvidsson, U., Hökfelt, T. (1992). Serotonin-,
substance P- and glutamate=aspartate-like immunoreactivities in medullo-spinal
pathways of rat and primate. Neuroscience 48: 545-559.
Nilsson, G., Dahlberg, K., Brodue, E., Sundler, F., and Strandberg, K. (1977).
Distribution and constrictor effect of substance P in guinea pig tracheobronchial
tissue, in Substance P (von Euler, U. S., and Pernow, B. eds.) pp. 75-82, Raven
Press, New York.
Nishino, S., Fujiki, N. (2007). Neuropeptides as possible targets in sleep disorders.
Expert Opin. Ther. Targets. 11: 37-59.
Noguchi, K., Morita, Y., Kiyama, H., Ono, K., Tohyama, M. (1988). A noxious
stimulus induces the preprotachykinin-A gene expression in the rat dorsal root
ganglion: a quantitative study using in situ hybridization histochemistry, Brain Res.
464: 31-35.
Ogawa, T., Kanazawa, I., and Kimura, S. (1985). Regional distribution of substance
P, neurokinin alpha and neurokinin beta in rat spinal cord, nerve roots and dorsal root
ganglia and the effects of dorsal root section or spinal transection. Brain Res. 359:
152-157.
Otsuka, M., and Yoshioka, K. (1993). Neurotransmitter functions of mammalian
tachykinins. Physiol. Rev. 73: 229-308.
114
Otsuka, M., Konishi S. (1976). Release of substance P-like immunoreactivity from
isolated spinal cord of newborn rat. Nature 264: 83-84.
Pacicca, C., Von der Weid, P. Y., Beny, J. L. (1992). Effects of nitro-Larginine on
endothelium-dependent hyperpolarizations and relaxations of pig coronary arteries. J
Physiol. 457: 247-256.
Page, N. M., Bell, N. J., Gardiner, S. M., Manyonda, I. T., Brayley, K. J., Strange, P.
G., Lowry, P. J. (2003). Characterization of the endokinins: human tachykinins with
cardiovascular activity. Proceeding of the National Academy of Sciences USA 100:
6245–6250.
Page, N. M., Woods, R. J., Gardiner, S. M., Lomthaisong, K., Gladwell, R. T.,
Butlin, D. J., Manyonda, I. T., Lowry, P. J. (2000). Excessive placental secretion of
neurokinin B during the third trimester causes pre-eclampsia. Nature 405: 797-800.
Parnavelas, J. G., Luder, R., Pollard, S. G., Sullivan, K., and Lieberman, A. R.
(1983). A qualitative and quantitative ultrastructural study glial cells in the
developing visual cortex of the rat. Phil. Trans. R. Soc. Lond. B301: 55-84.
Parsons, A. M., Seybold, V. S., Chandan, R., Vogt, J., Larson, A. A., Murray, C. R.,
Soldani, G., Brown, D. R. (1992). Neurokinin receptors and mucosal ion transport in
porcine jejunum. J. Pharmacol. Exp. Ther. 261: 1213-1221.
115
Pascual, D. W., Bost, K. L. (1990). Substance P production by P388D1
macrophages: a possible autocrine function for this neuropeptide. Immunology 71:
52-56.
Patacchini, R., De Giorgio, R., Bartho, L., Barbara, G., Corinaldesi, G., Maggi, C.A.
(1998). Evidence that tachykinins are the main NANC excitatory neurotransmitters
in the guinea-pig common bile duct. British Journal of Pharmacology 124: 17031711.
Patacchini, R., Maggi, C. A., Holzer, P. (2000). Tachykinin autoreceptors in the gut.
Trends in Pharmacological Sciences 21: 166.
Patak, E. N., Pennefather, J. N., Story, M. E. (2000). Effects of tachykinins on
uterine smooth muscle. Clinical and Exp. Pharmacol. and Physiol. 27: 922-927.
Patak, E., Candenas, M. L., Pennefather, J. N., Ziccone, S., Lilley, A., Martín, J. D.,
Flores, C., Mantecόn, A. G., Pinto, F. M. (2003). Tachykinins and tachykinin
receptors in human uterus. British Journal of Pharmacology 139: 523-532.
Paxinos, G., and Watson, C. (1986). “The rat brain in sterotaxic coordinates”. 2nd Ed.
Academic Press, San Diego.
Paxinos,
G.,
Kus,
L.,
Ashwell,
K.
W.
S.,
and
Watson,
C.
(1999).
“Chemoarchitectonic Atlas of the Rat Forebrain”. Academic Press, San Diego.
116
Pearse, A. G., and Polak, J. M. (1975). Immunocytochemical localization of
substance P in mammalian intestine. Histochemistry 41: 373-375.
Pernow, B. (1983). Substance P. Pharmacol. Rev. 35: 85-141.
Pickel, V. M., Joh, T. H., Reis, D. J., Leeman, S. E., Miller, R. J. (1979). Electron
microscopic localization of substance P and enkephalin in axon terminals related to
dendrites of catecholaminergic neurons. Brain Res. 160: 387-400.
Pintado, C. O., Pinto, F. M., Pennefather, J. N., Hidalgo, A., Baamonde, A., Sanchez,
T., Candenas, M. L. (2003). A Role for Tachykinins in Female Mouse and Rat
Reproductive Function. Biology of Reproduction 69: 940-946.
Pinto, F. M., Cintado, C. G., Devillier, P., Candenas, M. L. (2001). Expression of
preprotachykinin-B, the gene that encodes neurokinin B, in the rat uterus. European
Journal of Pharmacology 425: R1-R2.
Plenderleith, M. B., Haller, C. J., Snow P. J. (1990). Peptide coexistence in axon
terminals within the superficial dorsal horn of the rat spinal cord, Synapse 6: 344350.
Pomerat, C. M., Hendelkman., W. J., Raiborn, Ch. W. Jr., Massey, J. F. (1967).
Dynamic activities of nervous tissue in vitro. In: the neuron (H.Hydén ed.) cap 3, p.
119-178. Amsterdam: Elsevier.
117
Prabhakar, N. R., Cao, H., Lowe, J. A., Snider, R. M. (1993). Selective inhibition of
the carotid body sensory response to hypoxia by the substance P receptor antagonist
CP 96345. In: 2nd Edition. Proc. Natl. Acad. Sci. USA 90: 10041-10045.
Quartara, L., and Maggi, C. A. (1997). The tachykinin NK1 receptor. Part I: ligands
and mechanisms of cellular activation. Neuropeptides 31: 537-563.
Quartara, L., and Maggi, C. A. (1998). The tachykinin NK1 receptor. Part II:
distribution and pathophysiological roles. Neuropeptides 32: 1-49.
Raedler, E., and Raedler, A. (1978). Autoradiographic study early neurogenesis in rat
neocortex. Anat. Embryol. 154: 267-284.
Raedler, E., Raedler, A., and Feldhaus, S. (1980). Dynamical aspects of neocortical
histogenesis in the rat. Anat. Embryol. 158: 253-269.
Rakic, P. (1972). Mode of cell migration to the superficial layers of fetal monkey
neocortex. J. Comp. Neurol. 145: 61-84.
Rakic, P. (1982). Early development events: cell lineages, acquisition of neuronal
positions, and areal and laminar development. In Rakic, P., and Goldman-Rakic, P.
S., (eds.), Development and Modifiability of the Cerebral Cortex, Neurosci. Res.
Prog. Bull. 20:439-451.
Rakic, P. (1988). Specification of cerebral cortical areas. Science 241: 170-176.
118
Rameshwar, P. (1997). Substance P: a regulatory neuropeptide for hematopoiesis and
immune functions. Clinical Immunology and Immunopathology 85: 129-133.
Rameshwar, P., Ganea, D., Gascon, P. (1993). In vitro stimulatory effect of
substance P on hematopoiesis. Blood 81: 391-398.
Rampin, O., Pierrefiche, O., Denavit-Saubié, M. (1993). Effects of serotonin and
substance P on bulbar respiratory neurons in vivo. Brain Res. 622: 185-190.
Reddix, R. A., Cooke, H. J. (1992). NK1 receptors mediate substance Pinduced
changes in ion transport in guinea-pig ileum. Regul. Peptides 39: 215-225.
Reep, R. L., and Goodwin, G. S. (1988). Layer 7 of rodent cerebral cortex. Neurosci.
Lett. 90: 15–20.
Regoli, D., Boudon, A., and Fauchère, J. L. (1994). Receptors and antagonists for
substance P and related peptides. Pharmacol. Rev. 46: 551-599.
Regoli, D., Drapeau, G., Dion, S., and D’Orlèans-Juste, P. (1987). Pharmacological
receptors for substance P and neurokinins. Life Sci. 40: 109-117.
Ribeiro-da-Silva, A., Hökfelt, T. (2000). Neuroanatomical localisation of substance P
in the CNS and sensory neurons. Neuropeptides 34: 256-271.
119
Rickmann, M., and Wolff, J. R. (1981). Differentiation of “preplate” neurons in the
pallium of the rat. Biblthca Anat. 19:142-146.
Rickmann, M., and Wolff, J. R. (1985). Prenatal gliogenesis in the neopallium of the
rat. Adv. Anat. Embryol. Cell Biol. 93:1-104.
Rickmann, M., Chronwall, B. M., and Wolff, J. R. (1977). On the development of
non-pyramidal neurons and axons outside the cortical plate: the early marginal zone
as a pallial anlage. Anat. Embryol. 151: 285-307.
Rigby, M., O'Donnell, R., Rupniak, N. M. (2005). Species differences in tachykinin
receptor distribution: further evidence that the substance P (NK1) receptor
predominates in human brain. J. Comp. Neurol. 490: 335-53.
Rockel, A. J., Hiorns, R. W., and Powell, T. P. S. (1980). Basic uniformity in the
structure of the cerebral cortex. Brain 103: 221-243.
Rothstein, R. D., Johnson, E., Ouyang, A. (1991). Distribution of substance P
receptors in the feline gastrointestinal tract using autoradiography. Gastroenterology
100: 1576-1581.
Roush, E. D., Kwatra, M. M. (1998). Human substance P receptor expressed in
Chinese hamster ovary cells directly activates G (alpha q/11), G (alpha s), G (alpha
o). FEBS Lett. 428: 291-294.
120
Rupniak, N. M. J., Tattersall, F. D., Williams, A. R., Rycroft, W., Carlson, E. J.,
Cascieri, M. A., Sadowski, S., Ber, E., Hale, J. J., Mills, S. G., MacCoss, M.,
Seward, E., Huscroft, I., Owen, S., Swain, C. J., Hill, R. G., Hargreaves, R. J. (1997).
In vitro and in vivo predictors of the anti-emetic activity of tachykinin NK1 receptor
antagonists. Eur. J. Pharmacol. 326: 201-209.
Sabatini, B. L., Oertner, T. G., Svoboda, K. (2002). The life cycle of Ca2+ ions in
dendritic spines Neuron 52: 635-648.
Sachais, B. S., Snider, R. M., Lowe, J. A. d., Krause, J. E. (1993). Molecular basis
for the species selectivity of the substance P antagonist CP-96345. J. Biol. Chem.
268: 2319–2323.
Saffroy, M., Beaujouan, J. C., Torrens, Y., Besseyre, J., Bergstrom, L., Glowinski, J.
(1988). Localization of tachykinin binding sites (NK1, NK2, NK3 ligands) in the rat
brain. Peptides 9: 227-241-
Saffroy, M., Torrens, Y., Glowinski, J., Beaujouan, J. C. (2003). Autoradiographic
distribution of tachykinin NK2 binding sites in the rat brain: comparison with NK1
and NK3 binding sites. Neuroscience 116: 761-77.
Sagan, S., Chassaing, G., Pradier, L., Lavielle, S. (1996). Tachykinin peptides affect
differently the second messenger pathways after binding to CHO-expressed human
NK-1 receptors. J. Pharmacol. Exp. Ther. 276: 1039-1048.
121
Saigo, A., Takano, Y., Saito, R., Nakayama, Y., Honda, K., Kamiya, H. (1993). Role
of NK1 receptor in central cardiovascular regulation in rats: studies on a novel
nonpeptide antagonist, CP 96345, of substance P NK1 receptor. Regul Peptides 46:
293-296.
Sakanaka, M., Inagaki, S., Shiosaka, S., Senba, E., Takagi, H., Takatsuki, K., Kawai,
Y., Iida, H., Hara, Y., and Tohyama, M. (1982). Ontogeny of substance P-containing
neuron system of the rat: immunohistochemical analysis: II. Lower brain stem.
Neuroscience 7: 1097-1126.
Sane, J. R. (1989). Analysing cell lineage with a recombinant retrovirus. Trends
Neurosci. 12: 21-28.
Saria, A. (1999). The tachykinin NK1 receptor in the brain: pharmacology and
putative functions. Eur. J. Pharmacol. 375: 51-60.
Saria, A., Martling, C. R., Dalsgaard, C. J., and Lundberg, J. M. (1985). Evidence for
substance P-immunoreactive spinal afferents that mediate bronchoconstriction. Acta
Physiol. Scand. 125: 407-414.
Sauer, F. C. (1935). Mitosis in the neural tube. J. Comp. Neurol. 62: 377-405.
Schafer, M. K. H., Nohr, D., Krause, J. E., Weihe, E. (1993). Inflammation-induced
upregulation of NK1 receptor mRNA in dorsal horn neurones. Neuroreport. 4: 10071010.
122
Schlumpf, M., Shoemaker, W. J., and Bloom, F. E. (1980). Innervation of embryonic
rat cerebral cortex by catecholamine-containing fibers. J. Comp. Neurol. 192: 361376.
Schober, W. (1986). The rat cortex in stereotaxic coordinates. J. Hirnforsch 27: 121143.
Severini, C., Improta, G., Falconieri-Erspamer, G., Salvadori, S., Erspamer, V.
(2002). The tachykinin peptide family. Pharmacol. Rev. 54: 285-322.
Severini, C., Salvadori, S., Guerrini, R., Falconieri-Erspamer, G., Mignogna, G., and
Erspamer, V. (2000). Parallel bioassay of 39 tachykinins on 11 smooth muscle
preparations. Structure and receptor selectivity/affinity relationship. Peptides 21:
1587-1595.
Sharkey, K. A., Williams, R. G., Schultzberg, M., and Dockray, G. J. (1983).
Sensory substance P-innervation of the urinary bladder: possible site of action of
capsaicin in causing urine retention in rats. Neuroscience 10: 861-868.
Sheng, M., and Kim, M. J. (2002). Postsynaptic signaling and plasticity mechanism.
Science 298: 776-780.
Shibata, K., Haverstick, D. M., Bannon, M. J. (1990). Tachykinin gene expression in
rat limbic nuclei: modulation by dopamine antagonists. J. Pharmacol. Exp. Ther.
255: 388-392.
123
Shigemoto, R., Nakaya, Y., Nomura, S., Ogawa-Meguro, R., Ohishi, H., Kaneko, T.,
Nakanishi, S., Mizuno, N. (1993). Immunocytochemical localization of rat substance
P receptor in the striatum. Neurosci. Lett. 153: 157-60.
Shirayama, Y., Mitsushio, H., Takashima, M., Ichikawa, H., Takayashi, K. (1996).
Reduction of substance P after chronic antidepressant treatment in the striatum,
substantia nigra and amygdala of the rat. Brain Res. 739: 70-78.
Shults, C. W, Quirion, R., Chronwall, B., Chase, T. N., O’Donohue, T. L. (1984). A
comparison of the anatomical distribution of substance P and substance P receptors
in the rat central nervous system. Peptides 5: 1097-1128.
Shults, C. W., Quirion, R., Jensen, R. T., Moody, T. W., O’Donohue, T. L., Chase,
T. N. (1982). Autoradiographic localization of substance P receptors using 125I
substance P. Peptides 3: 1073-1075.
Sicuteri, F., Fanciullacci, M., Franchi, G., and Michelacci, S. (1963). The
endecapeptide eledoisin is a powerful vasodilating and hypotensive agent in man.
Experientia 19: 44-47.
Simon, C., Portalier, P., Chamoin, M. C., Ternaux, J. P. (1992). Substance P likeimmunoreactivity release from enterochromaffin cells of rat caecum mucosa.
Inhibition by serotonin and calcium-free medium. Neurochemistry International 20:
529-536.
124
Singh, D., Joshi, D. D., Hameed, M., Qian, J., Gascon, P., Maloof, P. B., Mosenthal,
A., Rameshwar, P. (2000). Increased expression of preprotachykinin-I and
neurokinin receptors in human breast cancer cells: implications for bone marrow
metastasis.. Proceeding of the National Academy of Sciences USA 97: 388-393.
Sivam, S. P., Krause, J. E., Takeuchi, K., Li, S., McGinty, J., Hong, J. S. (1989).
Lithium increases rat striatal β- and γ-preprotachykinin messenger RNAs. J.
Pharmacol. Exp. Ther. 248: 1297-1301.
Smart, I. H. M. (1983). Three dimensional growth of the mouse isocortex. J. Anat.
137: 683-694.
Smart, I. H. M., and McSherry, G. M. (1982). Growth patterns in the lateral wall of
the mouse telencephalon. II. Histological changes during and subsequent to the
period of isocortical neuron production. J. Anat. 134:415-442.
Srinivasan, M., Goiny, M., Pantaleo, T., Lagercrantz, H., Brodin, E., Runold, M.,
Yamamoto, Y. (1991). Enhanced in vivo release of substance P in the nucleus tractus
solitarii during hypoxia in the rabbit: role of peripheral input. Brain Res. 546: 211218.
Stanfield, B. B., and O’Leary, D. D. M. (1985). The transient corticospinal
projections from the occipital cortex during the postnatal development of the rat. J.
Comp. Neurol. 238: 236-248.
125
Steiner, D. F., Smeekens, S. P., Ohagi, S., and Chan, S. J. (1992). The new
enzymology of precursor processing endoproteases. J. Biol. Chem. 267: 2343523438.
Sternini, C., Su, D., Gamp, P. D., Bunnett, N. W. (1995). Cellular sites of expression
of the neurokinin-1 receptor in the rat gastrointestinal tract, J. Comp. Neurol. 358:
531-540.
Stewart, G. R., and Pearlman, A. L. (1987). Fibronectin-like immunoreactivity in the
developing cerebral cortex. J. Neurosci. 7: 3325-33.
Stewart, J., and Kolb, B. (1988). The effects of neonatal gonadectomy and prenatal
stress on cortical thickness and asymmetry in rats. Behav. Neural Biol. 49: 344-360.
Stucky, C. L., Galeazza, M. T., Seybold, V. S. (1994). Time-dependent changes in
Bolton-Hunter-labeled [1251] SP binding in rat spinal cord following unilateral
adjuvant-induced peripheral inflammation. Neuroscience 57: 394-409.
Sturrock, R. R. (1976). Light microscopic identification of immature glial cells in
semithin sections of the developing mouse corpus callosum. J. Anat. 122: 521-537.
Sturrock, R. R. (1986). Postnatal ontogenesis of astrocytes. In S. Fedoroff and A.
Vernadakis (eds.), Development, Morphology and Regional Specialization of
Astrocytes. Vol. 1, Astrocytes. New York: Academic Press, pp. 75-103.
126
Sumner, S. C., Gallagher, K. S., Davis, D. G., Covell, D. G., Jernigan, R. L., Ferretti,
J.A. (1990). Conformational analysis of the tachykinins in solution: substance P and
physalaemin, J. Biomol. Struct. Dyn. 8: 687-707.
Svetukhina, V. M. (1962). Cytoarchitectonics of cerebral neocortex in rodents
(albino rat) Arch. Anat. Gistol. Embryol. 42: 31-45.
Swanson, L. W. (1992). “Brain Maps: structure of the rat brain”. 1st Ed. Elsevier,
Amsterdam.
Swanson, L. W. (1998). “Brain Maps: structure of the rat brain”. 2nd Ed. Elsevier,
Amsterdam.
Takahashi ,T., Otsuka, M. (1975). Regional distribution of substance P in the spinal
cord and nerve roots of the cat and the effect of dorsal root section, Brain Res. 87: 111.
Takeda, Y., Blount, P., Sachais, B. S., Hershey. A. D., Raddatz, R., Krause, J. E.
(1992). Ligand binding kinetics of substance P and neurokinin A receptors stably
expressed in Chinese hamster ovary cells and evidence for differential stimulation of
inositol 1,4,5-trisphosphate and cyclic AMP second messenger responses. J.
Neurochem. 59: 740-745.
127
Taoka, M., Song, S. Y., Kubota, M., Minegishi, A., Yamakuni, T., Konishi, S.
(1996). Increased level of NK1 tachykinin receptor gene expression during early
postnatal development of rat brain. Neuroscience 74: 845-853.
Tatemoto, K., Lundberg, J. M., Jornvall, H., and Mutt, V. (1985). Neuropeptide K:
isolation, structure and biological activities of a novel brain tachykinin. Biochem.
Biophys. Res. Commun. 128: 947-953.
Tattersall, F. D., Wycroft, W., Francis, B., Pearce, D., Merchant, K., MacLeod, A.
M., Ladduwahetty, T., Keown, L., Swain, C., Baker, R., Cascieri, M., Ber, E.,
Metzger, J., MacIntyre, D. E., Hill, R. G., Hargreaves, R. J . (1996). Tachykinin NK1
receptor, antagonists act centrally to inhibit emesis induced by the chemotherapeutic
agent cisplatin in ferrets. Neuropharmacology 8: 1121-1129.
Tennyson, V. M. (1970). The fine structure of the axon and growth cone of the dorsal
root neuroblast of the rabbit embryo. J. Cell Biol. 44: 62-79.
Thulin, L., and Holm, I. (1977). Effect of substance P on the flow of hepatic bile and
pancreatic juice, in Substance P (von Euler, U. S., and Pernow. B., eds.), pp. 247251, Raven Press, New York.
Torres-Reveron, J. E., and Friedlander, M. J. (2005). Quantal Analysis of Synaptic
Connections Between Individual Subplate and Cortical Plate Neurons in Rat Visual
Cortex. Presented at Society for Neuroscience Annual Meeting, Washington, DC,
USA, November 12–16.
128
Torres-Reveron, J. E., and Friedlander, M. J. (2007). Properties of persistent
postnatal cortical subplate neurons. J. Neurosci. 27, 9962-9974.
Unger, T, Carolus WS, Demmert G., Ganten, D., Lang, R. E., Maser-Gluth, C.,
Steinberg, H., Veelken, R. (1988). Substance P induces a cardiovascular defense
reaction in the rat: pharmacological characterization. Circ. Res. 63: 812-818.
Valentino, K. L., and Jones, E. G. (1982). The early formation of the corpus
callosum: a light and electron microscopic study in fetal and neonatal rats. J.
Neurocytol. 11: 583-609.
Valverde, F., Facal-Valverde, M. V., Santacana, M., and Heredia, M. (1989).
Development and differentiation of early generated cells of sublayer Vlb in the
somatosensory cortex of the rat: a correlated Golgi and autoradiographic study. J.
Comp. Neurol. 290, 118–140.
Van Eden C. G., Kross, J. M., and Uylings, H. B. (1990). The development of the rat
prefrontal cortex. Its size and development of connections with thalamus, spinal cord
and other cortical areas. Prog. Brain Res., 85: 169-183.
Van Eden, C. G. (1986). Development of connections between the mediodorsal
nucleus of the thalamus and the preforontal cortex in the rat. J. Comp. Neurol. 244:
349-359.
129
Vandevelde, I. L., Duckworth, E., and Reep, R. L. (1996). Layer 7 and the gray
matter trajectories of cortico-cortical axons in rats. Anat. Embryol. (Berl.) 194, 581–
593.
Vaughn, J. E., Grieshaber, J. A. (1973). A morphological investigation of an early
reflex pathway in the developing rat spinal cord. J. Comp. Neurol. 148: 177-210.
Vaughn, J. E., Henrikson, C. K., Chernow, C. R., Grieshaber, J. A., and Wimer, C.
C. (1975). Genetically-associated variations in the development of reflex movements
and synaptic junctions within an early reflex pathway of mouse spinal cord. J. Comp.
Neurol. 161: 541-554.
Von Euler, U. S., and Gaddum, J. H. (1931). An unidentified depressor substance in
certain tissue extracts. J. Phisiol. 72: 74-87.
Von Volkmann, U. (1926). Vergleichende Untersuchungen an der Rinde der
“motorishen” und “Sehregion” von Nagetieren. Anat. Anz. 61: 234-243.
Waechter, R. V., and Jaensch, B. (1972). Generation times of the matrix cells during
embryonic brain development: an autoradiographic study in rats. Brain Res. 46: 235250.
Watson, J. W., Gonsalves, S. F., Fossa, A. A., McLean, S., Seeger, T., Obach, S.,
Andrews, P. L. (1995). The antiemetic effects of CP 99994 in the ferret and the dog:
role of the NK1 receptor. Br. J. Pharmacol. 115: 84-94.
130
Welker, C. (1971). Microelectrode delineation of fine grain somatotopic organization
of SmI cerebral cortex in albino rat. Brain Res. 26: 259-275.
Welker, C. (1976). Receptive fields of barrels in the somatosensory neocortex of the
rat. J. comp. neurol. 166: 173-190.
Welker, C., and Sinha, M. (1972). Somatotopic organization of SmII cerebral
neocortex in albino rat. Brain Res. 37: 132-136.
Wise, S. P. (1975). The laminar organization of certain afferent and efferent fiber
systems in the rat somatosensory cortex. Brain Res. 90: 139-142.
Wise, S. P., and Jones, E. G. (1978). Developmental studies of thalamocortical and
commissural connections in the rat somatic sensory cortex. J. Comp. Neurol. 178:
187-208.
Witschi, E. (1962). Development: rat. In P. L. Altman and D. S. Dittmer (eds.),
Growth Including Reproduction and Morphological Development. Washington: Fed.
Am. Soc. Exp. Biol., pp. 304-314.
Woolsey, C. N., and LeMessurier, D. H. (1984). The pattern of cutaneous
representation in the rat’s cerebral cortex. Fed. Proc. 7: 137-138.
131
Yamamoto, Y., Onimaru, H., Homma, I. (1992). Effect of substance P on respiratory
rhythm and pre-inspiratory neurons in the ventrolateral structure of rostral medulla
oblongata: an in vivo study. Brain Res. 599: 272-278.
Yano, H., Wershil, B. K., Arizono, N., Galli, S. J. (1989). Substance P-induced
augmentation of cutaneous vascular permeability and granulocyte infiltration in mice
is mast cell dependent. J. Clin. Invest. 84: 1276-1286.
Yashpal, K., Dam, T. V., Quirion, R. (1990). Quantitative autoradiographic
distribution of multiple neurokinin binding sites in rat spinal cord. Brain Res. 506:
259-266.
Yashpal, K., Kar, S., Quirion, S., Hui-Chan, C. W., Henry, J. L. (1994). Noxious
stimulation decreases substance P binding in rat spinal dorsal horn: competition by
endogenous ligand? Neuroreport 5: 2101-2104.
Yokota, Y., Sasai, Y., Tanaka, K., Fujiwara, T., Tsuchida, K., Shigemoto, R.,
Kakizuka, A., Ohkubo, H., Nakanishi, S. (1989). Molecular characterization of a
functional cDNA for rat substance P receptor. J. Biol. Chem. 264: 17649-52.
Zhang, G., Yamamoto, Y., Miwa, K., Suzuki, H. (1994). Vasodilatation induced by
substance P in guinea-pig carotid arteries. Am. J. Physiology 266: H1132-H1137.
132
Zhang, L., Harlan, R. E. (1994). Ontogeny of the distribution of tachykinins in rat
cerebral cortex: immunocytochemistry and in situ hybridization histochemistry. Dev.
Brain Res. 77:23-36.
Zhang, Y., Lu, L., Furlonger, C., Wu, G. E., Paige, C. J. (2000). Hemokinin is a
hematopoietic-specific
tachykinin
that
regulates
B
lymphopoiesis.
Nature
Immunology 1: 392-397.
Zilles, K. (1985). “The cortex of the rat: a stereotaxic atlas”. Springer-Verlag,
Berlin/ Heidelberg/ New York.
Zilles, K. (1990). Anatomy of the neocortex: cytoarchitecture and myeloarchitecture.
In: “The cerebral cortex of the rat” (Kolb, B., and Tees, R. C., Eds), pp. 77-112.
MIT, Cambridge, MA.
Zilles, K., and Wree, A. (1985). Cortex: Areal and laminar structure. In: “Forebrain
and Midbrain” (Paxinos, G., Ed.), Vol. 1, pp. 375-415. Academic Press, San Diego.
Zilles, K., Paolomero-Gallagher, N., Grefkes, C., Scheperjans, F., Boy, C., Amunts,
K., and Schleicher, A. (2002a). Architectonics of the human cerebral cortex and
transmitter receptor fingerprints: Reconciling functional neuroanantomy and
neurochemistry. Eur. Neuropsychopharmacol. 12: 587-599.
Zilles, K., Schleicher, A., Palomero-Gallagher, N., and Amunts, K. (2002b).
Quantitative analysis of cyto- and receptorarchitecture of the human brain. In “Brain
133
Mapping: The Methods” (Toga, A. W., and Mazziotta, J. C., Eds.). 2 nd Ed., pp. 573602.
Zilles, K., Wree, A., Schleicher, A., and Divac, I. (1984). The monocular and
binocular subfileds of the rat’s primary visual cortex: A quantitative morphological
approach. J. Comp. Neurol. 226: 391-402.
Zilles, K., Zilles, B., and Schleicher, A. (1980). A quantitative approach to
cytoarchitectonics. VI. The areal pattern of the cortex of the albino rat. Anat.
Embryol. 159: 335-360.
134