Virus
Corso di
Chemioterapia
I virus: 20-400 nanometri
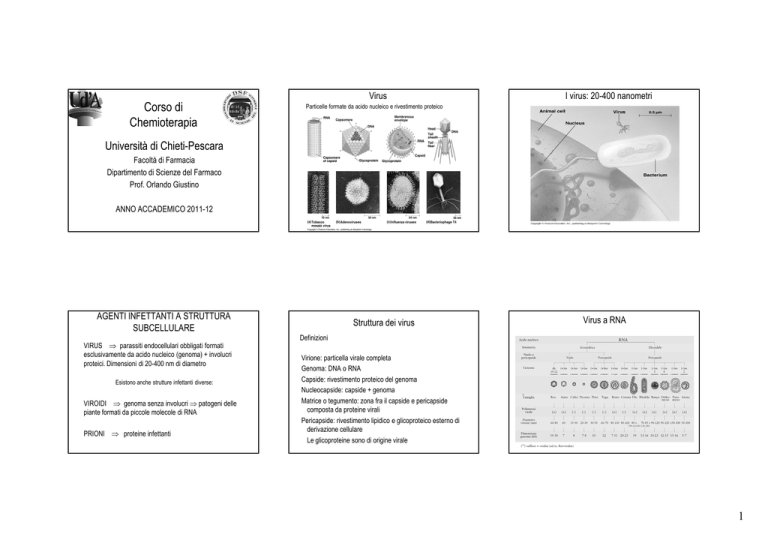
Particelle formate da acido nucleico e rivestimento proteico
Università di Chieti-Pescara
Facoltà di Farmacia
Dipartimento di Scienze del Farmaco
Prof. Orlando Giustino
ANNO ACCADEMICO 2011-12
AGENTI INFETTANTI A STRUTTURA
SUBCELLULARE
Struttura dei virus
Virus a RNA
Definizioni
VIRUS ⇒ parassiti endocellulari obbligati formati
esclusivamente da acido nucleico (genoma) + involucri
proteici. Dimensioni di 20-400 nm di diametro
Esistono anche strutture infettanti diverse:
VIROIDI ⇒ genoma senza involucri ⇒ patogeni delle
piante formati da piccole molecole di RNA
PRIONI ⇒ proteine infettanti
Virione: particella virale completa
Genoma: DNA o RNA
Capside: rivestimento proteico del genoma
Nucleocapside: capside + genoma
Matrice o tegumento: zona fra il capside e pericapside
composta da proteine virali
Pericapside: rivestimento lipidico e glicoproteico esterno di
derivazione cellulare
Le glicoproteine sono di origine virale
1
Virus a DNA
FARMACI ANTIVIRALI
I virus sono parassiti intracellulari che si moltiplicano utilizzando strutture,
organelli e enzimi propri della cellula, di conseguenza
Difficoltà maggiore ⇒ sviluppare farmaci antivirali in grado di inibire
selettivamente la moltiplicazione virale senza danneggiare il
metabolismo cellulare
Farmaco ideale ⇒ interrompe la replicazione virale in un punto specifico
ed essenziale del ciclo replicativo virale senza influenzare il normale
metabolismo cellulare
Virus provvisti di pericapside
Famiglie e generi di virus che infettano i vertebrati
Fasi di ciclo dei replicazione virale
Bersaglio dei farmaci antivirali
I principali farmaci virali si possono classificare in base alle diverse fasi
del ciclo replicativi virale su cui agiscono :
Adsorbimento
Penetrazione e scapsidazione
Replicazione del DNA
Trascrizione
Sintesi proteica
Assemblaggio
1.
Assorbimento o attacco
del virione alla superficie cellulare
2.
Penetrazione del virus nella cellula
3.
Spogliazione o uncoating ed
esposizione dell’acido nucleico virale
4.
Sintesi delle macromolecole virali
5.
Assemblaggio e maturazione
6.
Uscita o rilascio della progenie virale
Bersagli migliori ⇒ funzioni uniche del virus, senza controparte cellulare
2
Tappe del ciclo di replicazione dei virus
Adsorbimento farmaci che “mimano” l’antirecettore o il recettore virale impedendo la
loro interazione (es. l’HIV-1 infetta la cellula utilizzando come antirecettore la
gp120, presente sul virione, e come recettore il CD4, presente sui linfociti T helper).
Questi farmaci si sono rivelati tossici
Penetrazione farmaci che inibiscono il processo di fusione fra pericapside e membrana
cellulare (es. un peptide sintetico T-20 o enfuvirtide) che corrisponde a 36 aa della
regione COOH terminale della gp41 (proteina fusogena) di HIV-1 ne impedisce
l’attività fusogena
Scapsidazione amantadina e rimantadina sono farmaci antinfluenzali che, bloccando il
canale ionico costituito dalla proteina del tegumento M2, ostacolano la migrazione
degli ioni H+ all’interno della particella virale e impediscono l’abbassamento del pH
all’interno delle vescicole che contengono il virus e nell’ambiente “intravirionico” impedendo la liberazione del virus e dell’acido nucleico nel citoplasma
Farmaci che agiscono sulla replicazione degli
acidi nucleici (DNA o RNA)
Analoghi dei nucleosidi: modificazioni
1. Base purinica o pirimidinica
2. Componente saccaridica
3. Legame fra le due componenti
Meccanismi d’azione
1. Inibizione della DNA polimerasi per
competizione con il substrato naturale
2. Interruzione della catena dopo
incorporazione in 3’
3. Previa incorporazione, riduzione del
funzionamento del DNA come stampo
per la replicazione o aumento della sua
sensibilità alla degradazione enzimatica
ANTIHERPESVIRUS
Le infezione da herpes simplex virus di
tipo 1 colpiscono bocca, volto, cute,
esofago e SNC
Quelle di tipo 2 colpiscono i genitali, il
retto, la cute, le mani e le meningi
In entrambi i casi si può trattare di una
infezione primaria o dell’attivazione di
un’infezione latente
Successi dei farmaci antivirali: Acyclovir
Uno dei farmaci antivirali più famosi
utile nelle infezioni da herpesvirus (HSV-1e 2, e VZV)
Acyclovir è un
analogo della
guanina (deossiguanosina aciclica)
non presenta 3’-OH
La vidarabina è stato il primo farmaco di
questa categoria (1977), usato sia per
il trattamento delle infezioni da herpes
simplex che quelle da virus varicellazoster
Blocca la replicazione virale
3
MECCANISMO D’AZIONE DI ACYCLOVIR
La timidina chinasi (TK) è un enzima presente anche nella cellula,
l’affinità dell’aciclovir per la timidina chinasi virale è circa 200
volte superiore a quella per lo stesso enzima nei mammiferi
Acyclovir è un profarmaco
Converito dalla timidina
chinasi (TK) virale, e
successivamente dalle
chinasi cellulari
(concentrazione 40 – 100
volte superiore nelle cellule
infettate)
Questo processo porta alla
produzione della forma
trifosfato di acyclovir che
viene incorporata nella
molecola di DNA nascente e
causa la terminazione della
sintesi di DNA da parte della
polimerasi virale
forme modificate di acyclovir
per facilitare l’assorbimento
orale Valacyclovir (Valtrex)
From DeClercq Nature Reviews Drug Discovery 1, 13 (2002)
Il virus dell’HIV
La sindrome da immunodeficienza acquisita (AIDS) è stata riconosciuta
come nuova entità clinica nel 1981.
Origina dal processo di evoluzione naturale del
virus SIVcpz degli scimpanzé Pan troglodytes
troglodytes dell’Africa Centro Occidentale
HIV-1
HIV-2
limitato all’Africa Occidentale
34 milioni di persone contagiate nel mondo
68%: Africa subsahariana
Tassi elevati:
Causa: HIV (Human Immunodeficiency Virus)
un retrovirus appartenente alla sottofamiglia lentivirinae
scoperto nel 1983 dal medico Luc Montagnier
responsabile della pandemia
Epidemiologia
Origine
•
•
•
•
Analisi molecolari hanno datato la prima zoonosi nel 1920,
probabilmente per il contatto con sangue e carni di animali infetti
America centrale
Caraibi
Europa orientale
Asia (es. India)
Italia: 6,7 nuovi casi di sieropositività ogni 100.000 abitanti e 1.200 casi di AIDS
annui.
4
Tipica infezione da HIV-1
Infezione primaria HIV
symptoms
Sintomi influenzali dopo alcune settimane dall’infezione
symptoms
HIV proviral DNA
lymphadenopathy
fever
rash
headache
Fatigue
diarrhea
sore throat
neurologic manifestations.
no symptoms may be present
HIV antibodies
‘window’
period
HIV viral load
HIV-1 p24 antigen
0 1 2
1° infection
3
weeks
4 5 6 /
2 4
Time following infection
6
years
8
10
Ciclo replicativo HIV
Periodo di latenza
HIV continues to reproduce, CD4 count gradually declines
from its normal value of 500-1200.
Once CD4 count drops below 500, HIV infected person at risk
for opportunistic infections.
The following diseases are predictive of the progression to
AIDS:
persistent herpes-zoster infection (shingles)
oral candidiasis (thrush)
oral hairy leukoplakia
Kaposi’s sarcoma (KS)
AIDS
CD4 count drops below 200 person is considered to have advanced HIV
disease
If preventative medications not started the HIV infected person is now at
risk for:
Infezioni opportuniste
Pneumocystis carinii pneumonia (PCP)
cryptococcal meningitis
toxoplasmosis
If CD4 count drops below 50:
Mycobacterium avium
Cytomegalovirus infections
lymphoma
dementia
Most deaths occur with CD4 counts below 50.
Respiratory system
Pneumocystis Carinii Pneumonia (PCP)
Tuberculosis (TB)
Kaposi's Sarcoma (KS)
Gastro-intestinal system
Cryptosporidiosis
Candida
Cytomegolavirus (CMV)
Isosporiasis
Kaposi's Sarcoma
Central/peripheral Nervous system
Cytomegolavirus
Toxoplasmosis
Cryptococcosis
Non Hodgkin's lymphoma
Varicella Zoster
Herpes simplex
Skin
Herpes simple
Kaposi's sarcoma
Varicella Zoster
5
Azidotimidina (AZT)
La DNA-polimerasi RNA-dipendente (trascriptasi inversa) dei retrovirus è
inibita da diversi analoghi dei nucleosidi dove il gruppo OH
in posizione 3’ dello zucchero è sostituito con altri radicali (ad es. la
Azidotimidina (AZT) dove il gruppo ossidrile é sostituito con un gruppo
azidico). L’azione antivirale dell’AZT si esplica una volta che questa è
fosforilata, in successione, da tre chinasi cellulari
Terapia dell’infezione da
HIV - AZT
il primo farmaco anti-HIV
un analogo nucleosidico
( terminazione di catena)
AZT è convertita nella forma trifosfato
esclusivamente da enzimi cellulari
compete con il pool cellulare di
timidinainibisce la trascrittasi inversa
(RT)
inibitori non-nucleosidici
della RT di HIV
From DeClercq Nature Reviews Drug
Discovery 1, 13 (2002)
Ciclo replicativo HIV e siti d’azione antiretrovirali
Linfocita T infettato da HIV
6
Terapia dell’infezione da HIV - inibitori di Proteasi
la proteasi di HIV è
importante per la
maturazione del virus
(inibizione del
assemblaggio di HIV)
Terapia dell’infezione da HIV - inibitori della
penetrazione
Virione e genoma di HIV (famiglia Retrovirus)
inibitori dell’adsorbimento virale (co-recettori)
bloccano CCR5
SCH-C, si lega stabilmente ad una regione
idrofobica del corecettore CCR5 inibendo
l’adsorbimento del virus (ed il legame delle
chemochine)
in trials clinici
Il primo farmaco derivato
da studi di disegno dei
farmaci (cristallizzazione
della proteasi e studi di
peptidomimica)
inibitori della fusione virale
bloccano gp41
T-20, un piccolo peptide (36mer), si lega al
peptide di fusione inibendo la penetrazione del
virus
From Flint el at Principles of Virology ASM Press
Inibitori della sintesi proteica
farmaci anti-proteasi
Farmaci anti-proteasi
Antiretrovirali in gravidanza
In alcune famiglie di virus (es. retrovirus) le proteine virali vengono
sintetizzate come poliproteine che sono poi tagliate da delle proteasi
virali. Inibendo le proteasi virali non vengono prodotte proteine
funzionali non si formano gli involucri virali
I farmaci inibitori delle proteasi sono dei peptidi che mimano le
sequenze riconosciute dalle proteasi di conseguenza si legano
al sito attivo dell’enzima bloccandolo
Esitono degli inibitori delle proteasi di HIV-1 (Es. saquinavir, indinavir)
che vengono utilizzati nella terapia dell’AIDS, associati ad analoghi
dei nucleosidi
7
Inibitori del rilascio
Amantadina
Analoghi di acido sialico, sostituzione al 4’
OH con un gruppo aminico o
guanidinico
Gli inibitori della neuraminidasi bloccano
questi processi impedendo la diffusione
del virus
Entrambi mimano la struttura dell’acido
sialico agendo come degli inibitori
competitivi
Lo zanamivir viene somministrato per via
inalatoria, mentre lo oseltamivir per via
orale
Emersione di mutanti virali
Emoagglutinina
(antirecettore)
Alcuni virus durante la fase di gemmazione possono rimanere legati alla
cellula per l’interazione di proteine del pericapside con proteine della
membrana cellulare
È questo il caso del virus dell’influenza dove la emoagglutinina virale
(HA) rimane legata con le molecole di acido sialico presenti sul
recettore cellulare
Il virus riesce a superare questo blocco grazie all’azione della
neuraminidasi virale (NA) che scinde le molecole di acido sialico e
permette il rilascio dei virioni
La neuraminidasi sembra inoltre facilitare il passaggio del virus
attraverso il rivestimento mucoso degli epiteli polmonari idrolizzando i
residui di acido sialico presenti nelle glicoproteine del muco
Antiinfluenzali
zanamivir
Acido sialico
(recettore)
(Neuraminidasi)
oseltamivir
Caratteristiche e tipi di interferone (IFN)
Azione degli IFN nel corso dell’infezione
Il primo tipo di interferone prodotto è l’IFN-β indotto principalmente a livello delle
mucose dove iniziano la maggior parte delle infezioni virali. L’IFN-β diffonde
scarsamente e quindi può bloccare l’infezione al sito d’ingresso del virus
Inibisce la spoliazione del virus
dell’Influenza A
meccanismo d’azione: inibitore dei canali
ionici M2
Somministrazione
– entro 24-48 ore dall’infezione
– per 10 giorni ad alte dosi
Problemi terapeutici
1) L’amantadina non ha effetto contro i virus dell’influenza
B (i virus dell’Influenza B presentano canali ionici con
proprietà molto differenti)
2) emersione di mutanti virali
3) tossicità per il sistema nervoso centrale
Se il virus diffonde attraverso il sistema linfatico ed il circolo ematico viene in contatto
con leucociti e cellule dendritiche plasmocitoidi in grado di produrre l’IFN-α. L’IFNα è molto diffusibile e raggiunge organi distanti contribuendo a contrastare
l’estensione dell’infezione, in particolare agendo sugli endoteli delle barriere
naturali (ematoencefalica, polmonare, placentare
Perdurando l’infezione, viene attivata la risposta immune specifica e gli antigeni virali
possono interagire con gli specifici linfociti TH CD4 e T CD8 inducendo la
produzione di IFN-γ che possiede la capacità di potenziare l’azione delle cellule
effettrici della risposta cellulo-mediata
8
Meccanismi antivirali degli
interferoni alfa e beta
Legano recettori eterodimerici (IFNAR1/IFNAR-2) della famiglia
ematopoietina/citochina
L’interazione IFN/recettore attiva la
fosforilazione dei fattori trascrizionali STAT 1
e STAT2 che traslocano al nucleo e attivano
la trascrizione di geni e l’espressione di
proteine/enzimi (proteina chinasi-PKR, 2’,5’
oligoAsintetasi, Mx)
Queste proteine rimangono inattive e
vengono attivate solo in seguito ad un
infezione virale ed alla interazione con
molecole di RNA virale a doppia elica
La PKR riconosce corte molecole di dsRNA,
dimerizza e si attiva fosforilando il fattore di
inizio della traduzione (elongation factor 2),
con conseguente blocco delle sintesi proteiche
La 2’,5’-oligo A sintetasi favorisce la sintesi di
oligoadenilati che attivano una RNAsi cellulare
con degradazione degli mRNA
Le proteine Mx, appartenenti alle GTPasi,
associate in strutture multimeriche bloccano la
trascrizione e l’assemblaggio delle particelle
virali
Applicazioni terapeutiche degli IFN
Infezioni virali rIFN-α
Papillomavirus
Infezioni croniche da HBV e HCV
Neoplasie rIFN-α
Leucemia mieloide cronica
Leucemia a cellule capellute
Linfoma di Hodgkin
Sarcoma di Kaposi
Melanoma
Malattie neurodegenerative rIFN-β
Sclerosi multipla
9












