DIAGNOSI SIEROLOGICA DI INFEZIONE DA EBV
CONFRONTO TRA CHEMIOLUMINESCENZA
(LIAISON) E IMMUNOENZIMATICA (CHORUS)
Savino O., Mauro M.V., Tenuta R., Greco F. Giandomenico A.M., Giraldi C.
U.O.C. di Microbiologia e Virologia Clinica e Molecolare Ospedale Annunziata AO Cosenza
Introduzione. Epstein Barr virus (EBV) appartiene alla famiglia degli Herpesvirus, sottofamiglia gamma-herpesvirus,
con genoma a DNA lineare a doppio filamento. EBV infetta il 90%, circa, della popolazione mondiale causando
un’infezione generalmente asintomatica. È l’agente eziologico della mononucleosi infettiva (IM) ed è associato a
due neoplasie geograficamente ben definite: linfoma di Burkitt
e carcinoma indifferenziato naso-faringeo. La diagnosi dell’IM
si basa su tests sierologici che valutano la presenza di anticorpi
diretti contro i diversi componenti di EBV: IgM/IgG VCA (Viral
Capsid Antigen), IgG EBNA (Epstein Barr Nuclear Antigen), IgG
EA (Early Antigen). VCA-Ag ed EA-Ag stimolano gli anticorpi
della fase acuta dell’infezione, mentre EBNA-Ag quelli della
fase di convalescenza. I livelli individuali degli anticorpi specifici
non sono necessariamente indicativi di malattia quindi la
determinazione parallela dei 4 gruppi anticorpali permette una
migliore discriminazione tra le diverse fasi dellíinfezione da
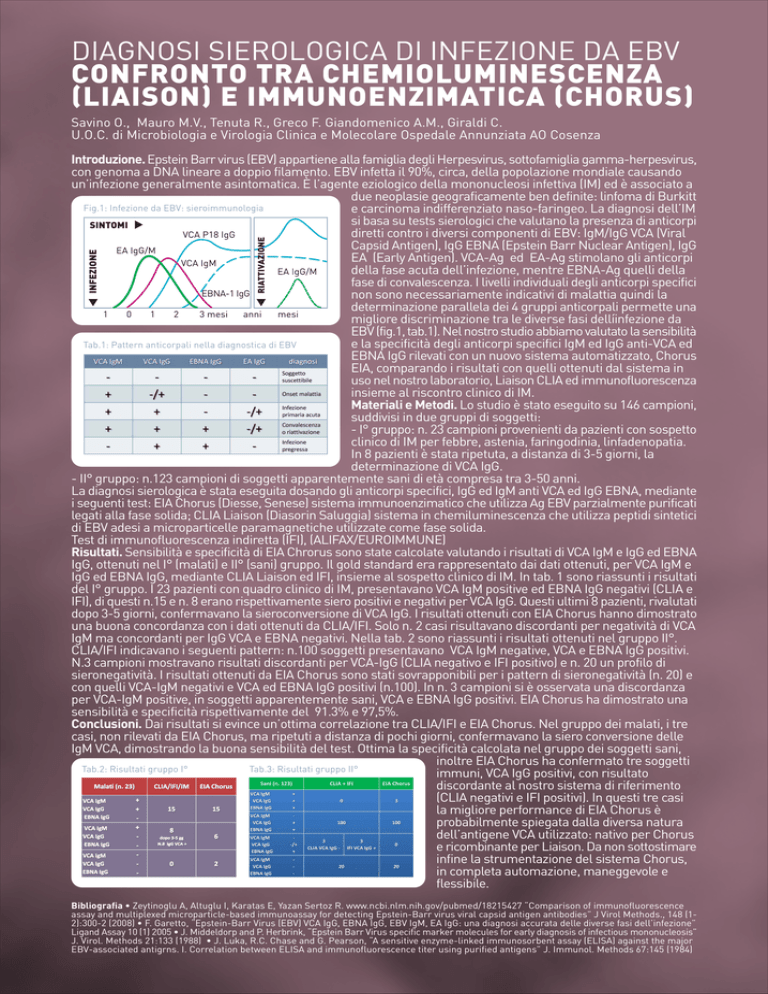
EBV (fig.1, tab.1). Nel nostro studio abbiamo valutato la sensibilità
e la specificità degli anticorpi specifici IgM ed IgG anti-VCA ed
Tab.1: Pattern anticorpali nella diagnostica di EBV
EBNA IgG rilevati con un nuovo sistema automatizzato, Chorus
EIA, comparando i risultati con quelli ottenuti dal sistema in
uso nel nostro laboratorio, Liaison CLIA ed immunofluorescenza
insieme al riscontro clinico di IM.
Materiali e Metodi. Lo studio è stato eseguito su 146 campioni,
suddivisi in due gruppi di soggetti:
- I° gruppo: n. 23 campioni provenienti da pazienti con sospetto
clinico di IM per febbre, astenia, faringodinia, linfadenopatia.
In 8 pazienti è stata ripetuta, a distanza di 3-5 giorni, la
determinazione di VCA IgG.
- II° gruppo: n.123 campioni di soggetti apparentemente sani di età compresa tra 3-50 anni.
La diagnosi sierologica è stata eseguita dosando gli anticorpi specifici, IgG ed IgM anti VCA ed IgG EBNA, mediante
i seguenti test: EIA Chorus (Diesse, Senese) sistema immunoenzimatico che utilizza Ag EBV parzialmente purificati
legati alla fase solida; CLIA Liaison (Diasorin Saluggia) sistema in chemiluminescenza che utilizza peptidi sintetici
di EBV adesi a microparticelle paramagnetiche utilizzate come fase solida.
Test di immunofluorescenza indiretta (IFI), (ALIFAX/EUROIMMUNE)
Risultati. Sensibilità e specificità di EIA Chrorus sono state calcolate valutando i risultati di VCA IgM e IgG ed EBNA
IgG, ottenuti nel I° (malati) e II° (sani) gruppo. Il gold standard era rappresentato dai dati ottenuti, per VCA IgM e
IgG ed EBNA IgG, mediante CLIA Liaison ed IFI, insieme al sospetto clinico di IM. In tab. 1 sono riassunti i risultati
del I° gruppo. I 23 pazienti con quadro clinico di IM, presentavano VCA IgM positive ed EBNA IgG negativi (CLIA e
IFI), di questi n.15 e n. 8 erano rispettivamente siero positivi e negativi per VCA IgG. Questi ultimi 8 pazienti, rivalutati
dopo 3-5 giorni, confermavano la sieroconversione di VCA IgG. I risultati ottenuti con EIA Chorus hanno dimostrato
una buona concordanza con i dati ottenuti da CLIA/IFI. Solo n. 2 casi risultavano discordanti per negatività di VCA
IgM ma concordanti per IgG VCA e EBNA negativi. Nella tab. 2 sono riassunti i risultati ottenuti nel gruppo II°.
CLIA/IFI indicavano i seguenti pattern: n.100 soggetti presentavano VCA IgM negative, VCA e EBNA IgG positivi.
N.3 campioni mostravano risultati discordanti per VCA-IgG (CLIA negativo e IFI positivo) e n. 20 un profilo di
sieronegatività. I risultati ottenuti da EIA Chorus sono stati sovrapponibili per i pattern di sieronegatività (n. 20) e
con quelli VCA-IgM negativi e VCA ed EBNA IgG positivi (n.100). In n. 3 campioni si è osservata una discordanza
per VCA-IgM positive, in soggetti apparentemente sani, VCA e EBNA IgG positivi. EIA Chorus ha dimostrato una
sensibilità e specificità rispettivamente del 91.3% e 97,5%.
Conclusioni. Dai risultati si evince un’ottima correlazione tra CLIA/IFI e EIA Chorus. Nel gruppo dei malati, i tre
casi, non rilevati da EIA Chorus, ma ripetuti a distanza di pochi giorni, confermavano la siero conversione delle
IgM VCA, dimostrando la buona sensibilità del test. Ottima la specificità calcolata nel gruppo dei soggetti sani,
inoltre EIA Chorus ha confermato tre soggetti
immuni, VCA IgG positivi, con risultato
discordante al nostro sistema di riferimento
(CLIA negativi e IFI positivi). In questi tre casi
la migliore performance di EIA Chorus è
probabilmente spiegata dalla diversa natura
dell’antigene VCA utilizzato: nativo per Chorus
e ricombinante per Liaison. Da non sottostimare
infine la strumentazione del sistema Chorus,
in completa automazione, maneggevole e
flessibile.
Bibliografia • Zeytinoglu A, Altuglu I, Karatas E, Yazan Sertoz R. www.ncbi.nlm.nih.gov/pubmed/18215427 “Comparison of immunofluorescence
assay and multiplexed microparticle-based immunoassay for detecting Epstein-Barr virus viral capsid antigen antibodies” J Virol Methods., 148 (12):300-2 (2008) • F. Garetto, “Epstein-Barr Virus (EBV) VCA IgG, EBNA IgG, EBV IgM, EA IgG: una diagnosi accurata delle diverse fasi dell’infezione”
Ligand Assay 10 (1) 2005 • J. Middeldorp and P. Herbrink, “Epstein Barr Virus specific marker molecules for early diagnosis of infectious mononucleosis”
J. Virol. Methods 21:133 (1988) • J. Luka, R.C. Chase and G. Pearson, “A sensitive enzyme-linked immunosorbent assay (ELISA) against the major
EBV-associated antigrns. I. Correlation between ELISA and immunofluorescence titer using purified antigens” J. Immunol. Methods 67:145 (1984)