1
INDICE: Ipotensione ortostatica neurogenica pag. 2­7; Effetti emodinamici acuti del Tolvaptan pag. 8­13;Progressi nel trattamento dell'arresto cardiaco pag 14­23; ECG di WPW pag 23; L'umanitarismo contro l'umano. Ai nostri malati non stacchiamo la spina pag 24­26. Ipotensione ortostatica neurogenica La neuro-scintigrafia cardiaca permette di evidenziare direttamente in vivo la denervazione simpatica noradrenergica in pazienti con ipotensione ortostatica
neurogenica (fig.1).
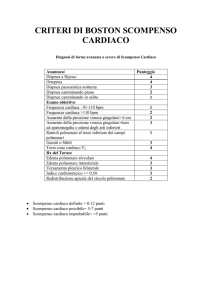
Figura 1: Neuro imaging cardiaco .
La dopamina marcata (6-[18F]Fluorodopamina) evidenzia mediante la scansione
tomografica della emissione di positroni (PET) la presenza o meno dell’attività
noradrenergica nelle cellule miocardiche. L’ammoniaca marcata ([13N]NH3) è un
agente rivelatore dello stato di perfusione miocardica in un paziente con atrofia
multi-sistemica (MSA) e un paziente con morbo di Parkinson in cui è presente
ipotensione ortostatica neurogenica (PD+NOH). Nell’immagine centrale, il paziente
con PD+NOH mostra assenza di radioattività rintracciabile della dopamina marcata
(6-[18F]FDA) nel miocardio del ventricolo sinistro, nonostante la normale perfusione
evidenziata (a destra) dalla radioattività dell’ammoniaca marcata [13N]NH3. A
sinistra, il paziente con MSA evidenzia normale innervazione noradrenergica del
miocardio.1
2
LA NUOVA INFORMAZIONE CARDIOLOGICA (NIC)
è inviata gratuitamente secondo una mailing list predisposta; si può essere
cancellati o essere iscritti per riceverla, inviando la richiesta a:
[email protected]
L’archivio dei numeri precedenti si trova nel sito:
http://www.foliacardiologica.it
Direttore Responsabile: Prof. Paolo Rossi - [email protected]
Direttore Scientifico: Dott. Eraldo Occhetta – [email protected]
Segretario Scientifico: Dott. Gabriele Dell’Era - [email protected]
Ipotensiome Ortostatica Neurogenica I pazienti con ipotensione ortostatica neurogenica (NOH) possono essere classificati in
termini fisio-patologici in base alla presenza o assenza di denervazione simpatica
noradrenergica, con o senza neuro-degenerazione centrale e indipendentemente dal
fatto che la diagnosi clinica neurologica sia definita o incerta.1
Complessivamente, il profilo neuro-chimico permette di identificare 2 gruppi di
pazienti: quelli con denervazione noradrenergica post-gangliare, come si verifica in
quei casi di morbo di Parkinson (PD) in cui è presente anche ipotensione ortostatica
neurogenica (PD+NOH) e nel puro fallimento autonomico (PAF), e quelli invece con
innervazione post-gangliare intatta, come nell’atrofia multi- sistemica (MSA).
L’assunzione della posizione ortostatica determina una riduzione della pressione
venosa centrale per effetto del sequestro di sangue negli arti inferiori. Nel soggetto
3
normale la conseguente riduzione della gittata cardiaca determina un ridotto
stiramento dei barorecettori dell’arco aortico e del seno carotideo, che induce una
inibizione del vago e una conseguente disinibizione dell’ortosimpatico. La presenza di
disautonomia o di anomalia funzionale riflessa può compromettere l’arco riflesso baro
recettoriale e determinare ipotensione in conseguenza di stimoli, quali l’ortostatismo,
che riducono il ritorno venoso al cuore, e sono normalmente inadeguati a generare
ipotensione.
L’ipotensione ortostatica è definita come una riduzione della pressione arteriosa
sistolica di almeno 20 mmHg o della pressione diastolica di almeno 10 mmHg, dopo
l’assunzione attiva della posizione ortostatica oppure dopo ortostatismo passivo fino
ad almeno 60° (head up tilt) 2. Nel 1996 un comitato di consenso ha indicato che
l’ipotensione ortostatica deve essere rilevata entro 3 minuti dall’assunzione
dell’ortostatismo 3.
In circa un terzo dei pazienti con persistente e consistente ipotensione ortostatica, si
usa il termine ipotensione ortostatica idiopatica in quanto non ne viene identificata la
causa, anche dopo un’ampia valutazione di laboratorio.4 In tutti questi casi, si
associano anormalità della regolazione riflessa della circolazione mediata dal sistema
simpatico noradrenergico, cioè, è una ipotensione ortostatica idiopatica neurogenica.
Il fallimento del sistema nervoso simpatico provoca sempre l’intolleranza della postura
diritta. Per contro, l’ipotensione ortostatica è una prova palese del fallimento
simpatico. Tale fallimento produce le caratteristiche anormalità da battito a battito
della pressione arteriosa associate con la manovra di Valsalva, illustrate nella figura 2.
Figura 2: Risposte della frequenza cardiaca e della pressione arteriosa nelle 4 fasi della manovra di Valsalva Rispetto al soggetto di controllo (sinistra), la manovra di Valsalva nel paziente con ipotensione ortostatica idiopatica neurogenica
(destra) è caratterizzata da una progressiva diminuzione della pressione arteriosa durante lo sforzo della compressione toracica a
glottide chiusa in fase II (freccia); dopo il rilascio della manovra, la pressione sistolica aumenta lentamente verso il valore basale,
nelle fasi III e IV (poligono grigio) e non si verifica l’iper-innalzamento pressorio 5,6, sopra la linea base in fase IV (linea nera
spessa). Pazienti con ipotensione ortostatica neurogenica presentano anche un fallimento tipico del baro riflesso cardio-vagale. Ciò
spiega perché le risposte della frequenza cardiaca alla manovra di Valsalva o alla respirazione profonda siano subnormali. Tali
risposte, tuttavia, sono mediate principalmente dal sistema parasimpatico colinergico, e non dal sistema simpatico noradrenergico.
L’algoritmo clinico per l’approccio clinico al paziente con ipotensione ortostatica è descritto
nella tabella I.
4
Tabella I.
Algoritmo per una valutazione clinica della ipotensione ortostatica. Ipotensione ortostatica: persistente, consistente?
No: se episodica & inaspettata = considerare sincope neurogenica
Si
Causa identificabile? (vedi tabelle in appendice)
Farmaci: (vasodilatatori, chemioterapici, fenotiazine)
Ipovolemia: (disidratazione, perdite ematiche, insufficienza surrenale)
Scompenso cardiaco: (blocco cardiaco, stenosi aortica)
Ristagno venoso: (prolungata degenza a letto, varicosità accentuate)
Neuropatia periferica: (diabete, amiloidosi, alcol)
Lesione del sistema nervoso centrale: (lesioni del midollo spinale, siringomielia)
Si = trattare la causa sottogiacente
No = Neurogenica? :
Risposta battito per battito alla manovra di Valsalva
Noradrenalina plasmatica in ortostatismo
Resistenze vascolari in ortostatismo
No = escludere ipovolemia altre cause non neurogeniche
Si = denervazione periferica noradrenalinica? :
Scintigrafia simpatica cardiaca
Catecolamine plasmatiche in supino
Sonde neurofarmacologiche
No = diagnosi principali:
se evidente neuro-degenerazione centrale,
MSA (atrofia multi sitemica)
se non evidente neuro-degenerazione
centrale, AAG (gangliopatia autonomica
autoimmune)
Si = diagnosi principali:
se evidente neuro-degenerazione centrale:
PD+NOH (morbo di Parkinson+ipotensione
ortostatica neurogenica), LBD (demenza)
se non evidente neuro-degenerazione centrale:
PAF (fallimento autonomico puro)
Cause L’ipotensione ortostatica può essere determinata da numerose cause
(tab. II): da farmaci, da cause non-neurogeniche, da cause neurogeniche,
o essere primaria neurogenica.
Tabella II: Cause dell’ipotensione ortostatica Primarie Disautonomia acuta o subacuta Pandisautonomia pura Pandisautonomia associata a segni neurologici Disautonomie croniche Disautonomia cronica pura 5
Atrofia multisistemica Malattia di Parkinson con disautonomia Secondarie Congenite (deficit fattore di crescita nervoso) Ereditarie (ad esempio, amiloidosi familiare, sindrome Riley‐Day) Malattie metaboliche Diabete mellito Malattie croniche epatiche e renali Deficit di vitamina B12 Secondarie ad abuso di alcool Malattie infiammatorie Sindrome di Guillain‐Barré Mielite trasversa Infezioni (batteriche, virali) Intossicazioni (ad esempio, botulismo) Tumori cerebrali e sindromi paraneoplastiche Connettivopatie (ad esempio, LES) Lesioni midollari Farmaci (ad esempio, alfa‐litici) Sincope neuro mediata Innanzitutto, dovrebbero essere escluse le cause frequenti e reversibili di diminuzioni
ortostatiche della pressione arteriosa, quali l’emorragia gastrointestinale e
l’assunzione di nitroglicerina. Secondo, si dovrebbero ricercare le cause identificabili di
ipotensione ortostatica. Probabilmente le più frequenti sono medicazioni, ipovolemia,
disidrazione, scompenso cardiaco, e malattie—in gran parte irreversibili—che sono
associate con neuropatie autonomiche (quali, diabete mellito, insufficienza renale
cronica, e amiloidosi).
Sintomatologia L’ipotensione ortostatica può essere un segno asintomatico o manifestarsi con sintomi
che variano da lieve obnubilamento del sensorio a perdita della coscienza (Tab.III).
Frequentemente accade che i pazienti, pur soffrendo d’ipotensione ortostatica, non
accusino in modo tipico sincopi ricorrenti perché imparano a riconoscere i sintomi
premonitori, quali debolezza generale, vertigini, visione evanescente, o lieve cefalea, e
a trattarli assumendo subito la posizione supina. Invece, nei pazienti che presentano
l’intolleranza ortostatica con cadute ricorrenti, si aggiunge un importante fattore di
rischio da fratture dell’anca e da traumi cranici.
6
Tabella III: Sintomatologie presincopali dell’ipotensione ortostatica, che precedono la perdita di coscienza Ipoperfusione cerebrale Capogiro/sensazione di mancamento Disturbi visivi
Visione offuscata Visione a cannocchiale Amaurosi Scotomi Disturbi della visione dei colori Confusione o disturbi cognitivi Ipoperfusione muscolare Cervicalgia o dolore occipitale Lombalgia Ipoperfusione cardiaca Angina pectoris (raramente) Ipoperfusione renale Oliguria Altri Debolezza, affaticamento Cadute Ẻ inoltre possibile che, compresente all’ipotensione ortostatica, si manifesti
ipertensione arteriosa in posizione supina, anche in forma grave.7 La combinazione di
ipotensione ortostatica e ipertensione supina pone uno stimolante dilemma clinico
poiché il medico deve bilanciare il rischio di ipertensione arteriosa cronica verso il
rischio immediato di cadute e conseguenti eventi morbosi.
Indice neurochimico Un indice neurochimico per rilevare l’ipotensione ortostatica neurogenica è la risposta
della noradrenalina plasmatica all’ortostasi. Normalmente, i livelli della noradrenalina
plasmatica si raddoppiano in 5 minuti di posizione eretta. Nella ipotensione ortostatica
neurogenica, la noradrenalina plasmatica di solito aumenta di <60% o di < 1 nmol/L
( 150 pg/mL).8
La denervazione simpatica noradrenergica si associa non solo con diminuito ricambio
di noradrenalina, (bassi livelli plasmatici di DHPG), ma anche con ridotta assunzione
neuronale di noradrenalina dallo spazio extracellulare. Complessivamente, con il
profilo neurochimico s’identificano 2 gruppi di pazienti: quelli con denervazione
noradrenergica post-gangliare, come nel PD+NOH and PAF, e quelli con integra
innervazione post-gangliare, come in MSA.1
Cenni di terapia 7
In relazione alla gravità dell’insufficenza della funzione baro-riflessa, i pazienti con
denervazione noradrenergica periferica presentano risposte più ampie ai farmaci che
incrementano l’occupazione di adrenorecettori e risposte minori ai farmaci che
promuovono il rilasciamento di noradrenalina. Nell’ipotensione ortostatica neurogenica
con denervazione noradrenergica periferica, una volta accertata la iper-regolazione di
adrenorecettori, sembrerebbe appropriato un agonista che agisce direttamente sugli
adreno-recettori. La midrodrina (prodotto dalla © GUTRON (Nycomed)), è l’unico
agonista degli α-adrenorecettori attivo per via orale.
Pazienti con denervazione noradrenergica potrebbero rispondere bene alla ioimbina o
ad una amina simpatico-mimetica indiretta.
Se i pazienti con ipotensione ortostatica rimangono sintomatici nonostante il trattamento con
questi farmaci possono anche essere trattati con fluidrocortisone, steroide che trattiene il sodio
(in dieta con molto sale), octreotide, o desmopressina in quanto tali sostanze svolgono
meccanismi di azione separati da quelli dei farmaci che agiscono direttamente o indirettamente
su gli adrenorecettori.
A causa di una ipertensione supina, farmaci che aumentano la pressione arteriosa
dovrebbero essere somministrati soltanto durante le ore di attività. Di notte, i pazienti
dovrebbero essere istruiti a dormire con la testa del letto elevata. Stando a letto, i
pazienti con ipertensione supina potrebbero assumere medicamenti che includono
nitrati o calcio antagonisti come la nifedipina. Questi farmaci dovrebbero essere usati
con grande cautela durante le ore di attività perché l’insufficienza del baro riflesso
simpatico provoca ampie risposte ipotensive in tutti i pazienti con ipotensione
ortostatica, indipendentemente dalla diagnosi clinica.
Bibliografia 1. Goldstein D S., Sharabi Y. Neurogenic Orthostatic HypotensionA Pathophysiological
Approach. Circulation. 2009;119:139-146.
2. Mathias CJ, Kimber JR (1999) Postural hypotension: causes,clinical features, investigation, and
management. Annu Rev Med 50:317–336.
3.
The Consensus Committee of the American Autonomic Society and the American Academy of
Neurology (1996) Consensus statement on the definition of orthostatic hypotension, pure
autonomic failure, and multiple system atrophy. Neurology 46(5):1470.
4. Robertson D, Robertson RM. Causes of chronic orthostatic hypotension. Arch Intern
Med. 1994; 154: 1620–1624.
5. Goldstein DS, Tack C. Non-invasive detection of sympathetic neurocirculatory failure.
Clin Auton Res. 2000; 10: 285–291.
6. Vogel ER, Sandroni P, Low PA. Blood pressure recovery from Valsalva maneuver in
patients with autonomic failure. Neurology. 2005; 65: 1533–1537.
7. Goldstein DS, Pechnik S, Holmes C, Eldadah B, Sharabi Y. Association between supine
hypertension and orthostatic hypotension in autonomic failure. Hypertension. 2003; 42:
136–142.
8. Ziegler MG, Lake CR, Kopin IJ. The sympathetic-nervous-system defect in
primary orthostatic hypotension. N Engl J Med. 1977; 296: 293–297.
Prof. Paolo Rossi primario cardiologo Novara.
[email protected]
8
Effetti emodinamici acuti del Tolvaptan (bloccante dei recettori V2 della Vasopressina ), nei pazienti con scompenso cardiaco sintomatico e disfunzione sistolica. Acute hemodynamic effects of Tolvaptan, a Vasopressin V2 receptor blocker, in patients with symptomatic heart failure and systolic disfunction. Udelson JE., Orlandi C., Ouyang J. et al. JACC 2008; 52: 1540‐5 Background. E’ stato riscontrato che i livelli plasmatici di vasopressina sono aumentati nei pazienti
con scompenso cardiaco e disfunzione sistolica del ventricolo sinistro 1. Ciò può
favorire la ritenzione idrica con conseguenti alterazioni della emodinamica. Il
Tolvaptan è un antagonista selettivo della vasopressina ed agisce bloccando i recettori
V2 a livello renale 2. E’ stato inoltre dimostrato che l’uso di Tolvaptan aumenta la
diuresi e provoca riduzione del peso corporeo e, di conseguenza, un rapido
miglioramento della sintomatologia, nei pazienti ricoverati per una riacutizzazione di
scompenso cardiaco 3.
Relativamente poco si sa sugli effetti emodinamici degli antagonisti della
Vasopressina. L’obiettivo di questo studio è stato quindi di valutare l’impatto dell’uso
del Tolvaptan sui parametri emodinamici, in pazienti con scompenso cardiaco
avanzato.
Metodi. Lo studio è stato multicentrico, prospettico, randomizzato, in doppio cieco.
Sono stati arruolati pazienti con scompenso cardiaco (riscontrato da almeno 3 mesi) in
classe NYHA III o IV e con frazione di eiezione inferiore a 40%. I pazienti dovevano
assumere una terapia ottimizzata per lo scompenso cardiaco da almeno 1 mese. La
presenza di valori di pressione arteriosa sistolica inferiore a 90 mmHg o di
creatininemia superiori a 3 mg/dL, era considerata criterio di esclusione.
I pazienti venivano sottoposti a cateterismo destro e, dopo un periodo di
stabilizzazione, venivano arruolati allo studio in presenza di una pressione capillare
polmonare (PCWP) maggiore di 18 mmHg in 2 determinazioni. Successivamente sono
stati randomizzati alla somministrazione orale, in doppio cieco, di placebo o di una di
tre dosi di Tolvaptan (15, 30 o 60 mg). I parametri vitali, emodinamici e renali sono
stati raccolti nelle successive 8 ore, mantenendo la terapia (anche diuretica) in atto e
somministrando 250 cc di liquidi ogni 2 ore.
9
End point primario è stata la variazione del picco di pressione capillare polmonare a 38 ore dalla somministrazione, mentre tra gli end points secondari vi erano le variazioni
di altri parametri emodinamici e renali e degli elettroliti serici.
Risultati.
Nello studio sono stati arruolati 181 pazienti (caratteristiche cliniche in Tabella I).
Tabella I: caratteristiche cliniche della popolazione
Tutte le dosi di Tolvaptan in studio hanno provocato una significativa riduzione della
pressione capillare polmonare e della pressione arteriosa polmonare rispetto al
placebo (Tabella II).
Tabella II: effetti del Tolvaptan sui parametri emodinamici Inoltre le tre dosi di Tovaptan hanno provocato rispetto al placebo, un incremento
significativo e dose dipendente della diuresi nelle 12 ore successive alla
10
somministrazione. L’osmolalità delle urine è risultata più bassa nei pazienti
stato somministrato il farmaco in studio (Figura 1).
cui era
Figura 1: variazione medie del volume urinario (alto) e dell’osmolalità delle urine (basso) rispetto al placebo, delle varie dosi di Tolvaptan (p<0.0001 per tutti i confronti) .
Infine l’uso di Tolvaptan ha provocato un incremento modesto dei valori di sodiemia.
Non si sono evidenziate invece sostanziali differenze per quanto riguarda la
funzionalità renale e la potassiemia.
Discussione. I risultati dello studio evidenziano che l’uso di Tolvaptan in pazienti con scompenso
cardiaco avanzato, provoca in acuto un modesto miglioramento dei valori emodinamici
associato ad incremento della diuresi. L’incremento della diuresi è risultato dose
dipendente, mentre gli effetti emodinamici non sembrano legati all’incremento della
dose di farmaco.
Secondo gli Autori, questi risultati spiegano il meccanismo fisiologico alla base dei
risultati ottenuti nello studio Everest. In tale studio i pazienti con scompenso cardiaco
acuto sono stati sottoposti a terapia con Tolvaptan alla dose di 30 mg o placebo (oltre
11
alla terapia standard dello scompenso cardiaco). In acuto si è osservato un
significativo miglioramento della dispnea e degli edemi con riduzione del peso
corporeo 3 .
L’aumento della diuresi provoca una riduzione del volume circolante con conseguente
miglioramento dei dati emodinamici e dei sintomi. Inoltre la ridotta escrezione di sodio
causa l’aumento della sodiemia. Entrambi i meccanismi sono favoriti dalla inibizione
della vasopressina causata dal blocco del recettore V2 a livello renale.
Gli effetti emodinamici riscontrati nello studio sono modesti e sicuramente minori di
quelli ottenuti con sostanze quali il levosimendan o la nesiritide: gli Autori comunque
sottolineano come la maggior riduzione della pressione capillare polmonare riportata
con l’uso di tali farmaci sottopone i pazienti a maggior rischio di fenomeni ipotensivi
che non sono invece segnalati con l’uso di Tolvaptan 4.
Commento.
La vasopressina è un nonapeptide prodotto nell’ipotalamo ed immagazzinata
nell’ipofisi da dove viene secreta in condizioni di disidratazione ed aumentata
osmolarità del sangue (soprattutto in presenza di aumentata concentrazione di sodio).
L’azione dell’ormone a livello renale (recettori V2), provoca restrizione della diuresi ed
aumentata secrezione di sodio. L’ormone, tramite i recettori V1a invece, provoca
vasocostrizione a livello arterioso. Inoltre a livello miocardio (sempre tramite i
recettori V1a) la vasopressina sarebbe in grado di provocare ipertrofia ventricolare
sinistra 2 (Figura 2).
Figura 2:Azioni della vasopressina a livello vascolare, cardiaco e renale (da Goldsmith et al.2 ) Per ragioni ancora poco chiare, nei pazienti con scompenso cardiaco acuto o cronico la
vasopressina risulta aumentata1. Analogo aumento della vasopressina è presente
anche nei pazienti con ridotta funzione ventricolare sinistra non ancora clinicamente
scompensati. La combinazione di ritenzione idrica (con aumento del precarico) e di
vasocostrizione (con aumento del postcarico) contribuirebbe (insieme all’azione diretta
dell’ormone sulle cellule miocardiche) al rimodellamento negativo evidente nello
scompenso cardiaco 2. Inoltre la contemporanea presenza di iponatriemia che è facile
osservare in questi pazienti, ha un riconosciuto valore prognostico negativo 5.
L’attuale terapia dello scompenso cardiaco è basata sull’uso di ACE inibitori, sartanici,
betabloccanti e diuretici. Nella fase acuta dello scompenso cardiaco, la terapia chiave
è tuttora rappresentata dall’uso di diuretici ad alte dosi per ridurre il volume di liquidi
circolanti tramite la stimolazione della diuresi. Ben conosciuti sono gli effetti collaterali
12
di tale terapia: peggioramento della funzionalità renale, ipotensione, disturbi
elettrolitici (ipopotassiemia o iposodiemia).
Il razionale dell’uso di antagonisti del recettore V2 , si baserebbe sulla necessità di
aumentare la secrezione di acqua favorendo al contrario il mantenimento dei valori di
sodiemia.
Gli studi condotti sull’uomo con tali farmaci (p.e. Tolvaptan o Lixivaptan) hanno
dimostrato una capacità di aumentare la diuresi senza incrementare la secrezione di
sodio (effetto “acquaretico” ma non “saliuretico”) . Tali farmaci sono inoltre risultati
ben tollerati dimostrando come effetto collaterale più evidente la sete 4 .
Lo studio Everest 4 (multicentrico, prospettico, randomizzato ed in doppio cieco)
prevedeva la randomizzazione di pazienti con frazione di eiezione inferiore a 40% e
con riacutizzazione di una scompenso cardiaco cronico, alla somministrazione di
placebo o Tolvaptan 30 mg (oltre alla classica terapia dello scompenso cardiaco).
Sono stati randomizzati 4133 pazienti.
Durante il follow up, non si sono registrate differenze statisticamente significative né
per la mortalità totale né per l’endpoint combinato di mortalità cardiovascolare +
ospedalizzazione per scompenso cardiaco (Figura 3).
Figura 3: Curve di Kaplan‐Meier della mortalità globale ( a sinistra) e di mortalità cardiovascolare + ospedalizzazioni per scompenso cardiaco ( a destra) 4 Due sottostudi sono stati condotti collateralmente per testare gli effetti clinici a breve
termine del Tolvaptan 3 . Gli Autori hanno dimostrato come l’aggiunta di un
antagonista dei recettori V2 alla terapia classica dello scompenso cardiaco, provochi
nel breve periodo (1 o 7 giorni dall’inizio della terapia) miglioramento di alcuni dei
segni o sintomi dello scompenso con maggior riduzione di edemi e dispnea e maggior
aumento della diuresi e della riduzione del peso corporeo, rispetto ai pazienti a cui era
stato somministrato placebo. Inoltre ai pazienti randomizzati al Tolvaptan, è stato
possibile utilizzare una dose minore di diuretici dell’ansa.
Lo studio di Udelson e coll. si prefigge di svelare gli effetti emodinamici che sono alla
base di questi miglioramenti acuti conseguiti dalla terapia con Tolvaptan. Lo studio
considera 181 pazienti con disfunzione sistolica (frazione di eiezione inferiore a 40%)
in classe NYHA III o IV e con elevata wedge pressure (maggiore di 18 mmHg). Le tre
dosi considerate di Tolvaptan (15, 30 e 60 mg) hanno provocato una riduzione
analoga della wedge pressure e della pressione arteriosa polmonare ed un aumento
dose dipendente della diuresi. Inoltre il Tolvaptan ha provocato, rispetto al placebo,
un modesto e dose dipendente aumento della sodiemia.
13
In definitiva, gli antagonisti della vasopressina sono in grado, mediante l’aumento
della diuresi (senza contemporaneo aumento della secrezione di sodio), di migliorare
l’emodinamica del paziente scompensato portando ad un miglioramento acuto di
alcuni dei segni o sintomi di scompenso cardiaco. Questo avviene senza manifestare
gli effetti collaterali dei farmaci abitualmente utilizzati in queste condizioni (soprattutto
i diuretici) ma anzi si sono dimostrati in grado di aumentare i valori di sodiemia nei
pazienti iposodiemici 7.
Non è stato tuttavia possibile ad oggi, dimostrare che tali farmaci migliorano la
sopravvivenza del paziente con scompenso cardiaco acuto o cronico 4 .
L’uso in cronico del Tolvaptan è stato inoltre associato ad effetti collaterali non
pericolosi ma fastidiosi come la sete o la secchezza delle fauci (a volte con necessità di
sospensione della terapia).
L’uso dei bloccanti dei recettori V2 quindi, può essere considerato utile, per ora, nelle
fasi di riacutizzazione di uno scompenso cardiaco cronico, in associazione alla terapia
standard (e non in sostituzione ai diuretici) soprattutto in presenza di iposodiemia.
Ulteriori studi, anche con l’uso di bloccanti di entrambi i recettori (V2 e V1a), sono
attesi nei prossimi anni per verificare le potenzialità di tali molecole anche nel
migliorare la prognosi del paziente con scompenso cardiaco cronico. Risulta inoltre
necessario valutare l’efficace dei bloccanti dei recettori della vasopressina anche in
pazienti con scompenso cardiaco acuto di nuova insorgenza, con scompenso cardiaco
avanzato o in presenza di scompenso con funzione sistolica conservata.
Bibliografia 1. Goldsmith SR,Francis GS, Cowley AW et al. Increased plasma arginine Vasopressin in
patients with congestive heart failure.J Am Coll Cardiol 1983; 1: 1385-90.
2. Goldsmith SR, Gheorghiade M. Vasopressin antagonism in heart failure. J Am Coll
Cardiol; 2005; 46: 1785-91
3. Gheorghiade M, Konstam MA, Burnet JC et al. Short term clinical effects of Tolvaptan,
an oral Vasopressin antagonist, in patients hospitalized for heart failure: results of the
EVEREST clinical status trial. JAMA 2007; 297:1332-43.
4. Konstam MA, Gheorghiade M, Burnet JC et al. Effect of oral Tolvaptan in patients
hospitalized for worsening heart failure: results of the EVEREST outcome study. JAMA
2007; 297: 1325-31.
5.
6.
7.
De Luca L, Klein L, Udelson JE et al. Hyponatremia in patients with heart failure. Am J Cardiol
2005; 19L-23L
Gheorghiade M, Gattis WA, O’Connor CM et al. Effects of Tolvaptan, a Vasopressin antagonist, in
patients hospitalized with worsening heart failure: a randomized controlled trial (ACTIV). JAMA
2004; 291: 1963-71.
Schrier RW, Gross P, Gheorghiade M et al. Tolvaptan, a selective oral Vasopressin V2receptor antagonist, for Hyponatremia. N Engl J Med 2006; 355:2099-112
Dott. Paolo Devecchi Divisione Clinicizzata di Cardiologia A.O.U. “Maggiore
della Carità”. Novara Tel. 03213733294
[email protected]
14
Gordon A. Ewy, Karl B. Kern: Recent Advances in Cardiopulmonary Resuscitation
Cardiocerebral Resuscitation. J Am Coll Cardiol 2009;53:149–57
La rianimazione cardio-cerebrale (CCR, cardiocerebral resuscitation) rappresenta un
nuovo approccio alla rianimazione dei pazienti colpiti da arresto cardiaco provocato da
fibrillazione ventricolare (FV); tale approccio si è dimostrato in grado di aumentare
significativamente la sopravvivenza libera da sequele neurologiche1-5. La rianimazione
cardio-cerebrale presenta tre pilastri fondamentali (tabella 1): esecuzione continua di
compressioni toraciche durante la fase di supporto vitale basale (BLS = Basic Life
Support); nuovo algoritmo di supporto vitale cardiaco avanzato (ACLS = Advanced
Cardiac Life Support); terapia aggressiva post-rianimatoria, che può comprendere
l’induzione di ipotermia terapeutica ed uno studio di cateterismo cardiaco precoce
seguito o meno da un intervento coronarico percutaneo.
CCC = compressione toracica continua; CCR = rianimazione cardio-cerebrale; FV non
trattata (es. >5 min.); 200 CCCS = 200 compressioni del torace
15
Durante l’arresto cardiaco in presenza di testimoni, nella rianimazione cardiocerebrale, a differenza della rianimazione cardio-polmonare, le manovre rianimatorie
ad opera di astanti non esperti prevedono compressioni continue del torace non
accompagnate dalla respirazione bocca a bocca. Per quanto riguarda il supporto vitale
cardiaco avanzato, viene raccomandata la defibrillazione immediata oppure ritardata,
sulla base del modello trifasico della fibrillazione ventricolare elaborato da Weisfeldt e
Becker6. La defibrillazione immediata è raccomandata se i soccorritori hanno accesso
ad un defibrillatore automatico esterno oppure nel caso in cui il personale di
emergenza giunga sul luogo durante la fase elettrica della FV, cioè entro 4-5 minuti
dalla sua insorgenza1. Tuttavia, il personale di emergenza spesso giunge sul luogo
dopo la fase elettrica, cioè nella fase circolatoria della FV2. Durante tale fase, il
miocardio fibrillante ha già consumato gran parte delle sue riserve energetiche;
pertanto la compressione toracica, che è necessaria affinché si abbia perfusione
miocardica, deve essere effettuata prima ed immediatamente dopo la
defibrillazione1,7,8. L’intubazione endotracheale viene posticipata e va evitata
un’eccessiva ventilazione, mentre è raccomandata la somministrazione precoce di
adrenalina1,3(figura 1).
Figura 1: Protocollo della rianimazione cardio­cerebrale. Il personale di emergenza, all’arrivo sul luogo, deve eseguire in prima istanza 200 compressioni toraciche, tranne nel caso in cui esse non siano già state eseguite da soccorritori non esperti che si trovavano sul posto. In questo caso, il personale di emergenza potrà direttamente eseguire l’analisi del ritmo cardiaco tramite defibrillatore. Se non sono intervenuti soccorritori prima dell’arrivo del personale di emergenza, l’analisi del ritmo cardiaco dovrà essere preceduta dall’esecuzione di 200 compressioni toraciche. È importante ottenere un completo rilascio della parete toracica dopo ciascuna compressione. Le compressioni devono essere eseguite ad un ritmo di 100/minuto. Se necessario, dopo l’analisi del ritmo sarà erogato uno shock elettrico. Dopo l’erogazione della scarica, il personale di emergenza dovrà riprendere immediatamente le compressioni toraciche; dopo l’esecuzione di 200 compressioni toraciche, verrà eseguita nuovamente l’analisi del ritmo cardiaco ed andrà ricercata la presenza del polso. Tale sequenza andrà ripetuta finché il paziente non mostrerà segni di ripresa o il ritmo cardiaco non sarà ritornato regolare. Se ciò non si verifica dopo 3 sequenze ripetute, si procederà con l’intubazione del paziente. Durante i 3 cicli di rianimazione cardio‐cerebrale, non è infatti prevista l’intubazione del paziente ma solo l’insufflazione passiva di ossigeno ad alto flusso (da 10 a 15 16
l/minuto). Nel paziente che rimane incosciente o non respira in modo adeguato, è raccomandata l’intubazione prima del trasferimento in ospedale. Per evitare una ventilazione eccessiva, è raccomandato, quale approccio iniziale alla
ventilazione, la somministrazione passiva di ossigeno9,10. La rianimazione cardiocerebrale si è dimostrata in grado di aumentare notevolmente la sopravvivenza nei
pazienti con arresto cardiaco in presenza di testimoni e con ritmo defibrillabile3-5. Nella
fase post-rianimazione, nei pazienti in stato comatoso sono raccomandati sia
l’ipotermia sia il cateterismo cardiaco (in assenza di controindicazioni), anche in
assenza dei classici segni elettrocardiografici di infarto o ischemia. La rianimazione
cardio-cerebrale non è raccomandata nei pazienti con arresto respiratorio, in quanto
tali pazienti richiedono una precoce ventilazione; in questo caso, rimangono valide le
raccomandazioni
delle
linee
guida
della
rianimazione
cardiopolmonare
(cardiopulmonary resuscitation, CPR)11. I protocolli di CRP e CCR sono confrontati
nella tabella 2.
Tabella 2. Confronto tra rianimazione cardiocerebrale e Rianimazione cardiopolmonare. ACLS = advanced cardiac life support Commento alla tabella 2. Per anni la rianimazione cardio-polmonare ha rappresentato il
gold standard nell’ambito di un complesso contesto clinico, quale è l’arresto cardiaco.
Tuttavia, nonostante su questo tema l’ultimo aggiornamento delle Linee-guida
ACC/AHA raccomandi un rapporto compressione/ventilazione di 30:2, le evidenze
scientifiche a suffragio di tale schema sono modeste. I modelli sperimentali hanno,
diversamente, messo in luce il ruolo della rianimazione cardio-cerebrale, il cui scopo
fondamentale è quello di garantire un flusso ematico costante, attraverso continue
compressioni. In tal modo, non andrebbero persi i fatidici “16 secondi” per le due
compressioni, tempo durante il quale l’afflusso ematico al distretto encefalico si
azzera, causando frequentemente danni irreversibili, accompagnati da sequele
neurologiche gravemente disabilitanti. In aggiunta, la rianimazione cardio-cerebrale si
è dimostrata, sia nel modello sperimentale che in quello umano, superiore al classico
17
schema rianimatorio, in termini di ridotta mortalità ed aumentata sopravvivenza libera
da complicanze neurologiche. I pazienti che sembrerebbero maggiormente giovare di
questa tecnica sono quelli con fibrillazione ventricolare e ritmo defibrillabile.
Resuscitazione cardio­polmonare (CPR): deludenti tassi di sopravvivenza. La morte cardiaca improvvisa rappresenta una delle principali cause di morte nei paesi
industrializzati12; negli Stati Uniti, ad esempio, essa è, in ordine di frequenza, seconda
soltanto alle morti di natura neoplastica13. I tassi di sopravvivenza nei pazienti con
arresto cardiaco extraospedaliero rimangono tuttora deludenti, dal momento che si
attestano appena sopra l’1%14. I tassi di sopravvivenza aumentano fino a 4 volte nei
pazienti che ricevono tempestivamente (particolarmente entro il primo minuto) la
resuscitazione cardio-polmonare (CPR) da astanti15; tuttavia, è stato calcolato che ciò
si verifica solo in 1 su 4-5 casi. Nello studio di Rea e coll. è stato riportato un aumento
del 40% della sopravvivenza nei pazienti con arresto cardiaco extraospedaliero
testimoniato nei quali la defibrillazione veniva immediatamente seguita dalla
compressione toracica, omettendo la ricerca del polso o la re-analisi del ritmo postdefibrillazione, in contrasto con quanto precedentemente raccomandato16. Una
possibile spiegazione ai deludenti risultati riscontrati nei pazienti trattati con
resuscitazione cardio-polmonare potrebbe provenire dal fatto che tale protocollo di
rianimazione è indifferentemente raccomandato in due condizioni molto diverse tra
loro: l’arresto cardiaco primario, in cui il sangue arterioso è per lo più totalmente
ossigenato al momento dell’arresto, e l’arresto cardiaco secondario ad insufficienza
respiratoria, in cui la gittata cardiaca è inizialmente normale in contrasto con la
perdita della funzione ventilatoria, che porta ad ipossiemia, ipotensione e,
secondariamente, ad arresto cardiaco1. Data la diversa base fisiopatologica di tali
condizioni, sono dunque senza dubbio necessari approcci diversificati.
La ventilazione nella fase di supporto vitale basale (BLS), tuttora raccomandata dalle
correnti linee guida, rappresenta in realtà una metodica impropria nella rianimazione
cardiopolmonare in caso di arresto cardiaco primario, riducendo notevolmente la
sopravvivenza proprio nei pazienti che hanno, in teoria, le più alte possibilità di
sopravvivenza, cioè coloro colpiti da arresto cardiaco in presenza di testimoni in cui
vengano effettuate manovre di primo soccorso da parte degli astanti e con ritmo
defibrillabile. Le ragioni di tale fenomeno sono molteplici:
•
la maggior parte degli astanti è restia ad effettuare la ventilazione bocca-abocca per ragioni igieniche e sociali; questo fenomeno non risparmia coloro che
hanno ricevuto un training di primo soccorso; ciò spesso determina la rinuncia,
da parte dell’astante, all’effettuazione del primo soccorso;
•
l’effettuazione della ventilazione bocca-a-bocca risulta in interruzioni lunghe e
scoordinate delle compressioni toraciche17, determinando così un aumento
dell’incidenza di danni neurologici permanenti18; le compressioni toraciche sono
infatti in grado di fornire un flusso ematico anterogrado appena sufficiente a
mantenere la perfusione cerebrale e, di conseguenza, qualsiasi loro interruzione
può risultare critica per la funzione neurologica;
•
la ventilazione a pressione positiva, anche se praticata senza interruzione delle
compressioni toraciche, determina un aumento della pressione intratoracica,
causando così una riduzione del ritorno venoso e quindi della perfusione
miocardica e cerebrale19. Questo fenomeno è aggravato nel caso di insufflazioni
vigorose, particolarmente se effettuate a torace compresso10;
•
la ventilazione bocca-a-bocca può determinare insufflazione di aria nello
stomaco piuttosto che nelle vie aeree15, potendo causare la comparsa di
rigurgito;
18
•
l’evidenza della necessità di ventilare immediatamente il paziente non è basata
né su dati clinici, in quanto non esistono studi a questo riguardo, né logici,
poiché al momento di un arresto cardiaco indotto da FV, le vene polmonari, le
sezioni sinistre del cuore e l’intero sistema arterioso sono ricchi di sangue
ossigenato. Pertanto, il problema principale non è ossigenare il sangue, bensì
far circolare il sangue ossigenato. Inoltre, le ventilazioni raccomandate non
determinano un aumento della saturazione arteriosa di ossigeno, ma provocano
soltanto un ritardo nell’effettuazione delle compressioni toraciche20;
•
la ventilazione bocca-a-bocca non è necessaria in un numero significativo di
pazienti, poiché in molti di essi, se le compressioni toraciche iniziano
precocemente e non vengono interrotte, la respirazione riprende; la
ventilazione fisiologica è caratterizzata dalla diminuzione della pressione
intratoracica e, quindi, dall’aumento del ritorno venoso, in contrasto con quanto
si verifica durante le insufflazioni artificiali.
Educazione dei cittadini al primo soccorso. Un motivo plausibile a causa del quale le linee guida continuano ancora oggi a
raccomandare l’esecuzione sia delle compressioni toraciche che delle ventilazioni è la
preoccupazione che i soccorritori “laici” non siano in grado di distinguere un arresto
cardiaco primario, in cui è possibile non eseguire le ventilazioni, da un arresto
cardiaco secondario ad insufficienza respiratoria, nel quale invece le ventilazioni sono
necessarie. È dunque necessario fornire ai cittadini programmi di educazione al primo
soccorso che consentano loro di discernere tra i due tipi di arresto cardiaco ed
effettuare dunque gli interventi adeguati.
In presenza di individuo colpito da collasso improvviso, un astante non esperto deve
innanzitutto valutarne lo stato di coscienza, tramite la tecnica del “shake and shout”:
il soggetto colpito va scosso leggermente per le spalle e chiamato ad alta voce; se non
vi è risposta a tali stimoli, il soggetto va definito incosciente. A questo punto è
necessario valutare la funzione respiratoria: essa va considerata anormale in caso di
assenza del respiro, respiro intermittente o ansimante, gorgoglii. Un soggetto in tali
condizioni deve essere considerato vittima di un arresto cardiaco21.
Ecco alcuni casi in cui vi è una chiara compromissione delle vie aeree, facilmente
riconoscibile anche dal soccorritore laico, in cui va assolutamente eseguita, in
associazione alle compressioni toraciche, la ventilazione:
A) paziente che collassa in un ristorante, durante il pasto. In questo caso, la causa più
probabile di arresto cardiaco è rappresentata dall’ostruzione delle vie aeree ad opera
del bolo alimentare; è dunque appropriato innanzitutto tentare la disostruzione delle
vie aeree tramite la manovra di Heimlich 1 e quindi iniziare la rianimazione con
ventilazione e compressioni toraciche.
1
Una persona esegue la manovra di Heimlich utilizzando le mani per esercitare una pressione
sotto il diaframma. Ciò provoca anche la compressione dei polmoni e a sua volta esercita una
pressione su qualsiasi oggetto si trovi nella trachea, con lo scopo di provocarne l'espulsione. In
sostanza ciò rappresenta un potente e artificiale colpo di tosse. (Dal momento che la vittima
del soffocamento ha un'ostruzione alle vie aeree, non riuscendo a riempire i polmoni, non ha
nemmeno la possibilità di tossire da sola.). La manovra di Heimlich è una manovra invasiva
che può arrecare danni anche se eseguita correttamente. In nessun caso dovrà essere
effettuata su una persona che respira o che è in grado di parlare o tossire. L'esercitazione a
scopo didattico deve essere effettuata esclusivamente sul manichino e sotto la supervisione
di un istruttore esperto.
19
B) paziente in stato di incoscienza recuperato dall’acqua. In questo caso, saranno
necessarie sia le ventilazioni che le compressioni.
C) paziente che collassa in seguito ad overdose di sostanze alcoliche o stupefacenti:
tale paziente presenterà un sensorio obnubilato e un respiro lento a causa della
compromissione dei centri del respiro; sarà dunque necessario, anche in questo caso,
associare la ventilazione alle compressioni toraciche.
Nuovi protocolli per l’emergenza. Parte del razionale della rianimazione cardio-cerebrale è meglio comprensibile
considerando il sopracitato modello trifasico dell’arresto cardiaco dovuto a FV6. La fase
iniziale, detta fase elettrica, caratterizza i primi 4-5 minuti. Durante tale fase,
l’intervento terapeutico fondamentale è rappresentato dalla defibrillazione. La seconda
fase è definita circolatoria e dura i successivi 10 minuti. Durante questa fase, il
mantenimento di un’adeguata perfusione cerebrale e coronarica è cruciale per la
sopravvivenza libera da sequele neurologiche. Paradossalmente, se durante la fase
circolatoria la defibrillazione viene effettuata come primo intervento, le probabilità di
sopravvivenza del paziente risultano ridotte22. Se le compressioni toraciche non
vengono eseguite prima dell’erogazione dello shock, la defibrillazione in questa fase
determina infatti quasi sempre asistolia o attività elettrica senza polso. Per tali ragioni,
il protocollo della rianimazione cardio-cerebrale (CCR) raccomanda, nella fase
circolatoria, l’esecuzione di 200 compressioni toraciche prima dell’erogazione di una
singola scarica e, successivamente ad essa, l’esecuzione immediata di altre 200
compressioni prima dell’analisi del ritmo1,2. Analogamente, durante entrambe le fasi è
sconsigliato procedere all’intubazione endotracheale, dal momento che quest’ultima
non solo comporta la sospensione temporanea delle compressioni toraciche, ma
determina anche effetti avversi conseguenti alla ventilazione a pressione positiva e
alla frequente iperventilazione10,19. Le conseguenze avverse della ventilazione a
pressione positiva sono rappresentate da un aumento della pressione intratoracica,
che comporta riduzione del ritorno venoso, determinando, dunque, la diminuzione
della perfusione cerebrale e coronarica. Ricerche su modelli animali hanno messo in
evidenza che l’iperventilazione, condizione piuttosto comune durante le procedure di
rianimazione, non solo determina l’aumento della pressione intratoracica media e la
diminuzione della pressione di perfusione coronarica, ma è associata anche alla
riduzione della sopravvivenza ad un’ora rispetto ai controlli non iperventilati. Per
evitare tali effetti, il protocollo della rianimazione cardio-cerebrale raccomanda
l’insufflazione passiva di ossigeno, tramite l’apertura delle vie aeree con device
orofaringeo, il posizionamento di una maschera non-rebreather e la somministrazione
di ossigeno ad alto flusso (circa 10 L/min)3.
Primi dati nell’uomo. Finora sono due gli studi che hanno pubblicato i risultati delle prime esperienze di
rianimazione cardio-cerebrale. Nello studio di Kellum e coll. è stata osservata una
maggiore sopravvivenza libera da complicanze neurologiche nei pazienti trattati con
rianimazione cardio-cerebrale, rispetto ad un gruppo storico di controllo, in cui la
rianimazione è stata eseguita secondo le Linee-guida dell’AHA/ACC del 2000 (40%
versus 15% rispettivamente, p =0.002)3. Bobrow e coll. hanno dimostrato un
incremento maggiore del 300% nella sopravvivenza alla dimissione ospedaliera nel
sottogruppo di pazienti trattati con rianimazione cardio-cerebrale, con ritmo
defibrillabile ed arresto cardiaco testimoniato4.
Il terzo pilastro della rianimazione cardio­cerebrale. La mortalità intra-ospedaliera dei pazienti inizialmente rianimati da un arresto
cardiaco è molto elevata, essendo pari a circa il 75%. Circa un terzo dei decessi è
20
causato da una severa compromissione del sistema nervoso centrale; un altro terzo è
provocato da insufficienza cardiaca; i casi rimanenti possono manifestarsi in seguito
all’azione di vari fattori causali, quali, ad esempio, infezioni o insufficienza
multiorgano23. Uno studio clinico norvegese ha per la prima volta evidenziato che il
tasso di sopravvivenza dei pazienti rianimati da un arresto cardiaco era
significativamente aumentato in coloro che ricevevano un’aggressiva terapia postrianimazione. Tale approccio è basato su due trattamenti terapeutici fondamentali:
l’induzione di ipotermia e l’esecuzione di un intervento coronarico percutaneo (PCI).
L’ipotermia terapeutica veniva indotta in tutti i pazienti che rimanevano in stato di
coma dopo la rianimazione, mentre la PCI veniva effettuata in tutti i pazienti in cui si
sospettava ischemia miocardica come fattore causale o concausale dell’arresto
cardiaco). Il tasso di sopravvivenza a lungo termine (follow-up a 1 anno) risultava
significativamente superiore dopo l’entrata in vigore di tale approccio terapeutico
aggressivo rispetto al periodo precedente (26% vs 56%, p=0.001). Inoltre, tra i
sopravvissuti a 1 anno trattati con terapia aggressiva, il tasso di sequele neurologiche
era molto basso (il 9% presentava deficit neurologici lievi e solo l’1% sequele gravi).
Un’analisi multivariata di tali dati ha evidenziato che il fattore maggiormente correlato
alla sopravvivenza è rappresentato dalla terapia di rivascolarizzazione, sia tramite
angioplastica coronarica percutanea (PTCA) che tramite intervento chirurgico di
bypass coronarico24.
Importanza dell’ipotermia terapeutica. L’induzione terapeutica di ipotermia moderata (da 32 a 34°C) nei pazienti che
permangono in stato di coma dopo la rianimazione è sostenuta dalla maggioranza dei
medici rianimatori. Due trials randomizzati e prospettici, effettuati su ampie
popolazioni, hanno dimostrato che tale metodica aumenta il tasso di sopravvivenza
assoluto e migliora il tasso di sopravvivenza libera da sequele neurologiche in tale
tipologia di pazienti25,26.
Ruolo dell'intervento coronarico percutaneo (PCI) post­rianimazione. L’esecuzione precoce di intervento coronarico percutaneo dopo la rianimazione
dovrebbe essere effettuata in tutti i pazienti in cui esista il sospetto di patologia
coronarica, indipendentemente dalla presenza di sintomi e modificazioni
elettrocardiografiche indicative di ischemia miocardica. Spaulding e coll. hanno infatti
dimostrato che né la sintomatologia, come ad esempio il dolore toracico, né le
alterazioni elettrocardiografiche, come l’elevazione del segmento ST, durante il
decorso post-rianimazione, sono predittori sensibili di un’occlusione coronarica
acuta27. L’individuazione, tramite la precoce esecuzione del cateterismo cardiaco, e il
trattamento di un infarto miocardico con sopraslivellamento del segmento ST (STEMI)
mediante intervento coronarico percutaneo hanno determinato un tasso di
sopravvivenza alla dimissione pari al 62%; tra i sopravvissuti, il 79% non dimostrava
complicanze neurologiche28-31.
Pertanto, la strategia terapeutica aggressiva post-rianimazione, rappresentata
dall’induzione di ipotermia terapeutica e da un precoce studio angiografico coronarico
percutaneo, si è dimostrata in grado di aumentare la sopravvivenza nei pazienti
rianimati dopo arresto cardiaco ed è dunque entrata a far parte del protocollo per la
rianimazione cardio-cerebrale.
Conclusioni.
La perfusione continua coronarica e cerebrale durante un arresto cardiaco è
fondamentale per consentire al paziente una sopravvivenza libera da deficit
neurologici. Il protocollo della rianimazione cardio-cerebrale ha dimostrato di essere in
grado di migliorare la sopravvivenza nei pazienti colpiti da arresto cardiaco che
21
ricevono una rianimazione sul posto da parte di testimoni e con ritmo defibrillabile. La
rianimazione cardio-cerebrale prevede l’abolizione della respirazione bocca-a-bocca
durante la fase di supporto vitale basale (BLS), proponendosi in tal modo, da un lato,
di eliminare l’interruzione delle compressioni toraciche, fondamentali per assicurare la
perfusione cardiaca e cerebrale nel paziente colpito da arresto, e, dall’altro, di vincere
la reticenza ad effettuare tale manovra, condizione comune nei soccorritori non
esperti. La rianimazione cardio-cerebrale prevede inoltre modifiche nella fase di
supporto vitale cardiaco avanzato (ACLS), con la posticipazione dell’intubazione
endotracheale, l’esecuzione di 200 compressioni toraciche prima e immediatamente
dopo l’erogazione dello shock elettrico e la somministrazione precoce di adrenalina. La
rianimazione cardio-cerebrale prevede infine l’applicazione di un approccio terapeutico
aggressivo nella fase post-rianimazione: tale strategia prevede l’induzione di
ipotermia terapeutica nei pazienti che permangono in stato di coma dopo la
rianimazione e l’esecuzione di un precoce studio angiografico coronarico percutaneo in
tutti i pazienti che non presentino controindicazioni a tale procedura.
Bibliografia 1.
Ewy GA. Cardiocerebral resuscitation:
Circulation 2005;111(16):2134-42.
the
new
cardiopulmonary
resuscitation.
2.
Kern KB, Valenzuela TD, Clark LL, Berg RA, Hilwig RW, Berg MD, et al. An alternative
approach to advancing resuscitation science. Resuscitation 2005;64(3):261-8.
3.
Kellum MJ, Kennedy KW, Ewy GA. Cardiocerebral resuscitation improves survival of
patients with out-of-hospital cardiac arrest. Am J Med 2006;119(4):335-40.
4.
Bobrow BJ, Clark LL, Ewy GA, Chikani V, Sanders AB, Berg RA, et al. Minimally
interrupted cardiac resuscitation by emergency medical services for out-of-hospital cardiac
arrest. Jama 2008;299(10):1158-65.
5.
Kellum MJ, Kennedy KW, Barney R, Keilhauer FA, Bellino M, Zuercher M, et al.
Cardiocerebral resuscitation improves neurologically intact survival of patients with out-ofhospital cardiac arrest. Ann Emerg Med 2008;52(3):244-52.
6.
Weisfeldt ML, Becker LB. Resuscitation after cardiac arrest: a 3-phase time-sensitive
model. Jama 2002;288(23):3035-8.
7.
Berg MD, Clark LL, Valenzuela TD, Kern KB, Berg RA. Post-shock chest compression
delays with automated external defibrillator use. Resuscitation 2005;64(3):287-91.
8.
Berg RA, Hilwig RW, Kern KB, Ewy GA. Precountershock cardiopulmonary resuscitation
improves ventricular fibrillation median frequency and myocardial readiness for successful
defibrillation from prolonged ventricular fibrillation: a randomized, controlled swine study. Ann
Emerg Med 2002;40(6):563-70.
9.
Milander MM, Hiscok PS, Sanders AB, Kern KB, Berg RA, Ewy GA. Chest compression
and ventilation rates during cardiopulmonary resuscitation: the effects of audible tone
guidance. Acad Emerg Med 1995;2(8):708-13.
10.
Aufderheide TP, Lurie KG. Death by hyperventilation: a common and life-threatening
problem during cardiopulmonary resuscitation. Crit Care Med 2004;32(9 Suppl):S345-51.
11.
2005 American Heart Association Guidelines for Cardiopulmonary Resuscitation and
Emergency Cardiovascular Care. Circulation 2005;112(24 Suppl):IV1-203.
12.
Zheng ZJ, Croft JB, Giles WH, Mensah GA. Sudden cardiac death in the United States,
1989 to 1998. Circulation 2001;104(18):2158-63.
13.
State-specific mortality from sudden cardiac death--United States, 1999. MMWR Morb
Mortal Wkly Rep 2002;51(6):123-6.
14.
Eckstein M, Stratton SJ, Chan LS. Cardiac Arrest Resuscitation Evaluation in Los
Angeles: CARE-LA. Ann Emerg Med 2005;45(5):504-9.
22
15.
Becker LB, Berg RA, Pepe PE, Idris AH, Aufderheide TP, Barnes TA, et al. A reappraisal
of mouth-to-mouth ventilation during bystander-initiated cardiopulmonary resuscitation. A
statement for healthcare professionals from the Ventilation Working Group of the Basic Life
Support and Pediatric Life Support Subcommittees, American Heart Association. Circulation
1997;96(6):2102-12.
16.
Rea TD, Helbock M, Perry S, Garcia M, Cloyd D, Becker L, et al. Increasing use of
cardiopulmonary resuscitation during out-of-hospital ventricular fibrillation arrest: survival
implications of guideline changes. Circulation 2006;114(25):2760-5.
17.
Assar D, Chamberlain D, Colquhoun M, Donnelly P, Handley AJ, Leaves S, et al.
Randomised controlled trials of staged teaching for basic life support. 1. Skill acquisition at
bronze stage. Resuscitation 2000;45(1):7-15.
18.
Kern KB, Hilwig RW, Berg RA, Sanders AB, Ewy GA. Importance of continuous chest
compressions during cardiopulmonary resuscitation: improved outcome during a simulated
single lay-rescuer scenario. Circulation 2002;105(5):645-9.
19.
Aufderheide TP, Sigurdsson G, Pirrallo RG, Yannopoulos D, McKnite S, von Briesen C, et
al. Hyperventilation-induced hypotension during cardiopulmonary resuscitation. Circulation
2004;109(16):1960-5.
20.
Meursing BT, Wulterkens DW, van Kesteren RG. The ABC of resuscitation and the Dutch
(re)treat. Resuscitation 2005;64(3):279-86.
21.
Ewy GA. Continuous-chest-compression cardiopulmonary resuscitation for cardiac
arrest. Circulation 2007;116(25):2894-6.
22.
Cobb LA, Fahrenbruch CE, Walsh TR, Copass MK, Olsufka M, Breskin M, et al. Influence
of cardiopulmonary resuscitation prior to defibrillation in patients with out-of-hospital
ventricular fibrillation. Jama 1999;281(13):1182-8.
23.
Schoenenberger RA, von Planta M, von Planta I. Survival after failed out-of-hospital
resuscitation. Are further therapeutic efforts in the emergency department futile? Arch Intern
Med 1994;154(21):2433-7.
24.
Sunde K, Pytte M, Jacobsen D, Mangschau A, Jensen LP, Smedsrud C, et al.
Implementation of a standardised treatment protocol for post resuscitation care after out-ofhospital cardiac arrest. Resuscitation 2007;73(1):29-39.
25.
Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N
Engl J Med 2002;346(8):549-56.
26.
Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, et al. Treatment
of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N Engl J Med
2002;346(8):557-63.
27.
Spaulding CM, Joly LM, Rosenberg A, Monchi M, Weber SN, Dhainaut JF, et al.
Immediate coronary angiography in survivors of out-of-hospital cardiac arrest. N Engl J Med
1997;336(23):1629-33.
28.
Quintero-Moran B, Moreno R, Villarreal S, Perez-Vizcayno MJ, Hernandez R, Conde C, et
al. Percutaneous coronary intervention for cardiac arrest secondary to ST-elevation acute
myocardial infarction. Influence of immediate paramedical/medical assistance on clinical
outcome. J Invasive Cardiol 2006;18(6):269-72.
29.
Gorjup V, Radsel P, Kocjancic ST, Erzen D, Noc M. Acute ST-elevation myocardial
infarction after successful cardiopulmonary resuscitation. Resuscitation 2007;72(3):379-85.
30.
Garot P, Lefevre T, Eltchaninoff H, Morice MC, Tamion F, Abry B, et al. Six-month
outcome of emergency percutaneous coronary intervention in resuscitated patients after
cardiac arrest complicating ST-elevation myocardial infarction. Circulation 2007;115(11):135462.
23
31.
Knafelj R, Radsel P, Ploj T, Noc M. Primary percutaneous coronary intervention and mild
induced hypothermia in comatose survivors of ventricular fibrillation with ST-elevation acute
myocardial infarction. Resuscitation 2007;74(2):227-34.
Roberta De Rosa, MD, Raffaele Piccolo,MD.
Dipartimento di Medicina clinica, Scienze Cardiovascolari e Immunologiche,
Università degli Studi di Napoli “Federico II” Via S. Pansini 5, 80131 Napoli
[email protected], [email protected]
FLASH
Tipica manifestazione della sindrome di Wolff-Parkinson-White nell'elettrocardiogramma
di Holter 1
Un uomo di 27 anni senza eventi importanti nell'anamnesi remota si è presentato in
ambulatorio cardiologico lamentando crisi di palpitazioni intermittenti. Una
registrazione Holter di 24 ore ha rivelato ritmo sinusale di base con onde delta
(Figura, frecce). Un battito ventricolare prematuro inizia una salva di tachicardia di
complessi stretti (Figura, teste di freccia), con perdita dell'onda delta e comparsa di
onde P invertite (P) indicative di attivazione atriale retrograda. Questa serie di eventi è
diagnostica della sindrome di Wolff-Parkinson-White.
Breve striscia elettrocardiografica che mostra un ritmo sinusale di base con onde delta (frecce), battito prematuro ventricolare (PVB), e l'iniziazione di tachicardia ortodromica con perdita delle onde delta (teste di freccia). 1. Ren X, Blumlein SL. Classic Holter Manifestation of Wolff-Parkinson-White Pattern. Circulation.
2008;118:1767.
24
Dietro l’umanitarismo eutanasico Susanna Tamaro indovina il ghigno della morte e la
stessa indifferenza nazista che ha aperto i lager. “Un padre che ama non vuole una sinistra
agonia ospedaliera per la figlia”
Roma. Strana beffa nella Giornata della Memoria. A notarla è Susanna Tamaro, la
scrittrice italiana più letta nel mondo. Il giorno in cui si ricorda l’apertura dei lager
nazisti e lo sterminio degli ebrei è lo stesso in cui il Tar lombardo autorizza a mettere
fine alla vita di Eluana Englaro. “Mi colpisce la gravità spaventosa che consegniamo
alle generazioni future nella frattura dell’idea dell’umano. Mostriamo la stessa
indifferenza o la complicità superficiale che oggi noi rimproveriamo ai contemporanei
della Shoah. Com’è possibile che in Germania gente che conosceva la musica, la
poesia, la filosofia tedesca, punta di diamante della cultura europea, abbia potuto
convivere con la Shoah e tacere? Tra sessant’anni si faranno la stessa domanda a
proposito della nostra indifferenza verso la vita dei deboli, dei malati, degli esclusi. C’è
un caso singolo, si dice, e per limitare il dolore si può avallare qualsiasi tesi. Si pensa
di agire in chiave umanitaria, mentre è esattamente il contrario: è la distruzione
dell’uomo.” La differenza più tragica, forse, sta nel fatto che sotto il nazismo a
dominare era l’ordine impersonale dello stato, oggi, invece la disumanità, la volontà di
escludere dalla nostra vita il dolore, la malattia, la fragilità, nasce nel cuore del
singolo. “Viene anche instillata dai media, grazie a una sapiente manipolazione. E’
come se il pensiero della coscienza individuale non esistesse più, ma venisse insufflato
dal chiacchiericcio mediatico. Non c’è più un contemplare la vita dalla propria
solitudine, ma l’asserire e il ripetere qualcosa che viene proposto come giusto. Anche
se non è detto che la maggioranza sia la parte giusta. Chi decide che una vita è degna
di essere vissuta? La vita è l’unica cosa sacra che c’è. Non c’è nient’altro da difendere.
Siamo contro la pena di morte e a favore dell’eutanasia? E’ la vita prêt-à-porter:
qualcun altro decide quando nasco, quando me ne vado. L’assenza di senso è
talmente grande che scompare la dimensione del mistero dell’umanità.” Susanna
Tamaro ha una visione tetra del futuro. Crede che il caso Englaro sia “la testa d’ariete”
contro l’ultimo baluardo della sacralità della vita. Con la forza dell’immaginazione,
vede i vecchietti che in ospedale languono nell’attesa di un’operazione al femore, e
per loro teme che un giorno sarà moneta corrente una soluzione radicale. “Una bella
punturina e il problema è risolto. Lo stato ha interesse: pensa che risparmio. Si
aprono così scenari spaventosi di morte, desolazione, orrore assoluto. La maschera
dell’umanitario nasconde, in realtà, il ghigno della morte. Tutti sono contro la pena di
morte: ma vale solo per i sani e in galera. Non c’è più comprensione del senso del
destino; del fatto che il male è una prova, perché la vita è un cammino, non un peso
dal quale liberarsi”. La sentenza sul caso Englaro, però, è anche l’ultima frontiera
dell’autonomia, visto che il padre invoca la volontà della figlia di non vivere in certe
condizioni. “E’ una cosa detta e non scritta: sul piano del diritto vale zero. Lui dice che
lo fa per amore. Ma il suo non è amore. Allora perché non tenerla a casa? Perché non
assisterla di persona nella lunga agonia, affinché raggiunga quello che noi chiamiamo
25
la pace. Stare accanto ai morenti è una grande missione, una fonte di vita
straordinaria. Beppino Englaro, invece, vuole per sua figlia un’agonia sinistra in
ospedale. E i medici, che hanno visto il video dell’agonia di Terri Schiavo, assicurano
che anche nel suo caso, visto che non è malata, ma mangia e beve grazie a un
sondino, sarà una morte atroce per soffocamento. Allora, se fossero onesti, sarebbe
più coerente sopprimerla con un’iniezione letale. La verità è che l’umanitario ha preso
il posto dell’umano. E l’ideologia dell’umanitarismo è diventata l’ultima ideologia
possibile, anche se in sé è qualcosa di malato, di storpiante, oltreché molto
ricattatorio per chi vi si oppone. Come sarebbe? Vuoi metterti contro le ragioni
umanitarie? Non puoi. E’ abominevole”.
Il Foglio – 29 gennaio 2009
Ai nostri malati non stacchiamo la spina Intervista a Monsignor Vinicio Albanesi 04 gennaio 2009
La vigilia di Natale non ce l’aveva proprio più fatta a tenerselo sullo stomaco: «Si
parla tanto del caso di Eluana - aveva detto – e noi di ' Eluane' ne abbiamo molte.
Nonostante non se ne parli, la spina noi non la stacchiamo». Monsignor Vinicio
Albanesi guida la Comunità di Capodarco, che di donne e uomini nello stesso stato
vegetativo di Eluana Englaro ne segue tre ( oltre a decine e decine di disabili gravi e
gravissimi in condizioni forse anche peggiori). Tre persone che vivono nella comunità
e «in mezzo a noi», assistite ventiquattro ore su ventiquattro, seguite da una nutrita
cerchia di medici. E che erano entrate lentamente o improvvisamente in stato
vegetativo.
Perché mai «non staccate la spina», don Vinicio? Perché una persona in stato vegetativo è come un neonato, che non può difendersi,
che non riesce a esprimere desideri e comunicare. Quindi è la persona più fragile che
possa esistere al mondo.
Persona? Come si può definirla tale? Cos’altro è o dovrebbe essere? Non so, un essere sceso dalla luna o una specie di '
corpo estraneo'? Su, come si fa a non parlare di persona?
Forse è che la loro vita non ha più una dignità tale da essere vissuta? Stiamo scherzando o cosa? Eluana non ha creato relazioni? Non sta creando
relazioni? Non è una presenza umana? Chi, poi, può dire fino a giurarlo che lei non
abbia canali comunicativi?
Resta però lo stato vegetativo Lo stato vegetativo è uno stato nel quale esternamente e cerebralmente non si
manifestano reazioni, non si risponde, non si comunica. Però si vive. Si respira. E noi
non conosciamo tutti i livelli di conoscenza e sensazioni che una persona ha seppure
non riesca ad esprimerli all’esterno.
Don Vinicio, basta insomma respirare per essere vivi? Quando il suo cuore batte da solo, la sua carne è calda, i suoi polmoni sono capaci di
respirare e lei di aprire e chiudere gli occhi, una persona è morta? Non scherziamo,
davvero.
Nemmeno quando le probabilità che si risvegli sembrino bassissime? Le dico molto di più, a me non interessa affatto se si risveglierà o meno, o calcolare
quante sono le probabilità che lo faccia: io l’accudisco perché è viva e perché le voglio
bene. Le persone sono abituato ad accompagnarle al cimitero quando sono morte e
non prima.
26
Molti però direbbero che lei, così, si permette di ledere la libertà che ognuno dovrebbe avere di farsi ciò che vuole. Quando uno lotta per la vita, lo fa perché la ritiene ancora bella, utile e degna di
essere vissuta: è quando si sente che la propria lotta è finita, fisicamente, proprio
fisicamente, come in un malato terminale, che allora è un’altra cosa.
Cioè quel che avrebbe voluto Eluana? No. Quel che dice il padre di Eluana.
Se una delle vostre persone in stato vegetativo le avesse detto, qualche anno fa, «se dovessi finire in quelle condizioni, staccami qualsiasi macchina o toglimi nutrimento e idratazione», lei che avrebbe fatto? Non le avrei dato retta. E perché? Non mi si può chiedere questo. Sarebbe come se
uno dei nostri tossici mi dicesse «dammi i soldi per comprarmi la droga» . Io aiuto le
persone.
Poniamo allora che sia un malato terminale a chiederle di essere lasciato morire: lei che farebbe, don Vinicio? Lo accompagnerei alla morte senza infierire su di lui: senza mantenerlo in vita ad
ogni costo con mezzi spropositati. Senza accanimento terapeutico. Anzi, a quel punto,
credo che si abbia ogni diritto ad avere una preghiera per la buona morte.
Ecco, a proposito: nutrizione e idratazione secondo lei sono un accanimento terapeutico? No, affatto: sono semplicemente necessarie alla sopravvivenza. Sa cos’è
l’accanimento terapeutico? Ne vuole un esempio? Quando qualcuno sta morendo a
volte gli iniettano la dopamina, che fa pulsare qualche ora in più, meccanicamente, il
cuore e basta.
Questo non sembra esser troppo rispettoso del diritto alla morte.
È evidente che non lo sia. Il punto è che dobbiamo imparare a rispettare anche il diritto alla vita.
La morte, don Vinicio, non fa parte della nostra storia personale?
Certo, ma quando è esaurita la vita. Ripeto: se un malato è terminale di cancro, cerchi di non
farlo soffrire e lo accompagni fino al momento della morte. E quest’ultima non è uno 'scandalo': fa
parte della naturalità della nostra vita. Alla sua fine.
Pino Ciociola




![Scompenso cardiaco- attività dell`Asl di Nuoro [file]](http://s1.studylibit.com/store/data/005106553_1-2acc9f03391e8aa6792037a95036da21-300x300.png)