Q
U
Per la spiegazione delle schede e le abbreviazioni, cliccare Q
QU
UIII
Q
U
QU
UIII
Per il glossario, cliccare Q
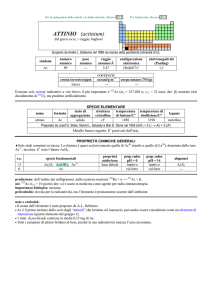
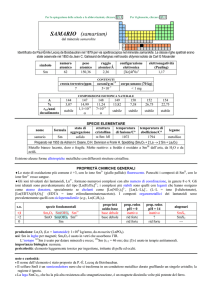
TALLIO (thallium)
dal greco ������ = germoglio verde
*
**
*
**
Identificato spettroscopicamente da William Crookes nel 1861 nei residui dellindustria di H2SO4.
simbolo
Tl
numero
atomico
81
peso
atomico
204,38
raggio
atomico/�
1,96
configurazione
elettronica
[Xe]4f145d106s26p1
COMPOSIZIONE ISOTOPICA
NATURALE
CONTENUTI
0,85
crosta terrestre/ppm
oceani/g m
3
elettronegatività
(Pauling)
1,62 Tl(I), 2,04 Tl(III)
2�10
corpo umano (70 kg)
5
---
A
203
205
%
29,52
70,48
t1/2/anni
stabile
stabile
SPECIE ELEMENTARE
stato di
struttura
temperatura
aggregazione cristallina di fusione/C°
�-Tl: hP
solido
304
temperatura di
legame
ebollizione/C°
tallio
Tl
1473
metallico
Preparato da Claude-Auguste Lamy nel 1862 per elettrolisi di TlCl3
Metallo bianco-grigiastro, tenero e malleabile ma poco tenace. Abbastanza reattivo: si ossida a TlI allaria
umida, in acqua contenente O2, con gli alogeni e in soluzioni di acidi ossidanti.
nome
formula
Esistono alcune forme allotropiche metalliche con differenti strutture cristalline.
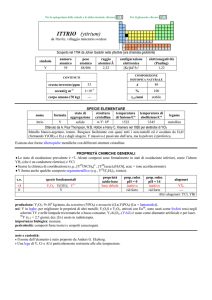
PROPRIETÀ CHIMICHE GENERALI
�Lo stato di ossidazione più importante è +1, con lo ione Tl+ che si comporta come gli ioni alcalini. TlIII è un ossidante e
idrolizza facilmente; TlCl3 con Cl forma complessi fino a [TlCl]63. Oltre agli ossidi Tl2O e Tl2O3 esiste lossido misto
(TlI)3TlIIIO3. TlI3 è in realtà un composto di TlI, formato dagli ioni Tl+ e I3; gli altri trialogenuri sono invece composti di TlIII.
TlCl2 è un composto a valenza mista: Tl+[TlIIICl4]. Colora di verde la fiamma.
�Il tallio forma composti organometallici come TlIII(CH3)2+ e TlI(C5H5).
s.o.
specie fondamentali
+3
+1
0
Tl2O3 Tl2O3· nH 2 O Tl 3 +
Tl2O TlOH Tl+
Tl
proprietà
acido-base
base debole
base forte
prop. redox
pH = 0
oss medio
inattivo
rid debole
prop. redox
pH = 14
inattivo
rid debole
rid debole
alogenuri
TlX3
TlX
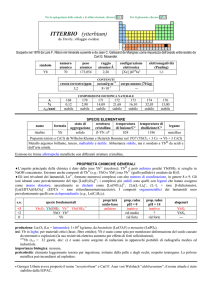
produzione: Tl (anche in composti): 1�105 kg/anno (escluso USA), come prodotto secondario delle metallurgie di Zn e di Pb.
usi: Tl in leghe ad alta resistenza alla corrosione; Tl2O in vetri ad alto indice di rifrazione e trasparenti allIR, usati nellottica
di fotocopiatrici.
201
Tl (t1/2 = 3,0 giorni; dec: �) è usato in diagnostica medica.
importanza biologica: nessuna.
pericolosità: elemento fortemente tossico.
note e curiosità:
� Il nome dellelemento è stato proposto da W. Crookes.