Q
U
Per la spiegazione delle schede e le abbreviazioni, cliccare Q
QU
UIII
Q
U
QU
UIII
Per il glossario, cliccare Q
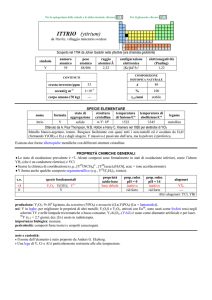
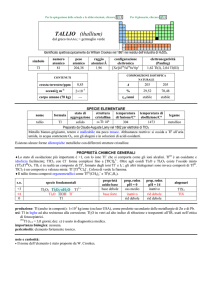
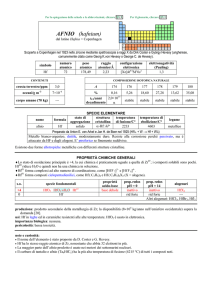
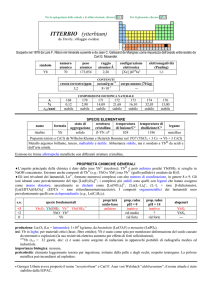
ATTINIO (actinium)
dal greco ����� = raggio, bagliore
*
**
*
**
Scoperto da André L. Debierne nel 1899 nei residui della pecblenda (minerale di U).
simbolo
Ac
numero
atomico
89
peso
atomico
---
raggio
atomico/�
2,47
configurazione
elettronica
[Rn]6d17s2
elettronegatività
(Pauling)
1,1
CONTENUTI
crosta terrestre/ppm
tracce
oceani/g m3
---
Esistono solo isotopi radioattivi a vita breve; il più importante è
decadimento di 235U), ma prodotto artificialmente.
nome
formula
attinio
Ac
corpo umano (70 kg)
---
227
Ac (ma = 227,028 u; t1/2 = 22 anni; dec: �) naturale (dal
SPECIE ELEMENTARE
stato di
struttura
temperatura
aggregazione cristallina di fusione/C°
solido
cF
1050
temperatura di
ebollizione/C°
3198
legame
metallico
Preparato da Josef G. Stites, Murrel L. Salutsky e Bob D. Stone nel 1955 (AcF3 + 3 Li � Ac + 3 LiF)
Metallo bianco-argento. E passivato dallaria.
PROPRIETÀ CHIMICHE GENERALI
�Solo studi compiuti su tracce. La chimica è quasi esclusivamente quella di AcIII (simile a quello di LaIII), dominata dallo ione
Ac3+, incolore. E noto lidruro AcH2.
s.o.
specie fondamentali
+3
0
Ac2O3 Ac(OH)3 Ac3+
Ac
proprietà
acido-base
base debole
prop. redox
pH = 0
inattivo
rid forte
prop. redox
pH = 14
inattivo
rid forte
alogenuri
AcX3
---
produzione: dellordine dei milligrammi, dalla reazione nucleare 226Ra + n � 227Ac + �.
usi: 225Ac (t1/2 = 10 giorni; dec: �) è usato in medicina come agente per radio-immunoterapia.
importanza biologica: nessuna.
pericolosità: elevata per la radioattività, ma lelemento è praticamente assente dallambiente.
note e curiosità:
� Il nome dellelemento è stato proposto da A.L. Debierne.
� Ac è il primo termine della serie degli attinidi che termina col laurenzio; può anche essere considerato come un elemento di
transizione (quarto elemento del gruppo 3).
� 1 tonn di pecblenda contiene in media 0,15 mg di Ac.
� Tutti i campioni di attinio brillano al buio, perché la sua radioattività ionizza laria circostante.