I segnali Notch
Numerosi segnali extracellulari sono proteine
diffusibili, in grado di coprire anche notevoli
distanze prima di giungere alla cellula
bersaglio dotata del recettore (es: ormoni,
ligandi TGF-beta, BMP)
Esistono anche segnali che rimangono sulla
superficie della cellula “sorgente”, perciò
solo le cellule a diretto contatto con questa
potranno ricevere il segnale (juxtacrine
signaling)
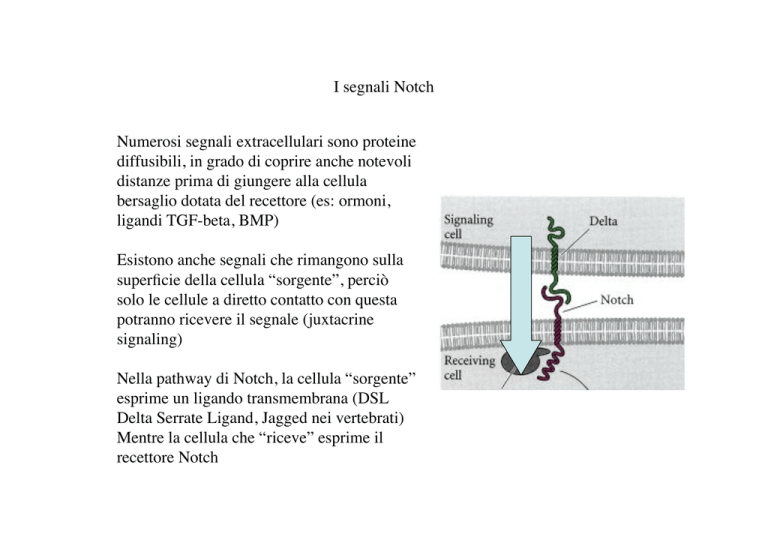
Nella pathway di Notch, la cellula “sorgente”
esprime un ligando transmembrana (DSL
Delta Serrate Ligand, Jagged nei vertebrati)
Mentre la cellula che “riceve” esprime il
recettore Notch
Notch mutant
In una cellula non stimolata,
il fattore di trascrizione
“dormiente” CSL non è in
grado di attivare in maniera
efficiente i promotori bersaglio
In presenza di un ligando DSL,
Notch viene processato
proteoliticamente
La porzione intracellulare del
recettore Notch (NICD)
trasloca al nucleo, riconosce
CSL e promuove la
trascrizione di geni target
Il taglio proteolitico di Notch richiede due (TRE!) diverse
proteasi che lavorano in serie
L’azione delle proteasi è attivata dal cambio conformazionale
di Notch indotto dall’interazione con i ligandi di tipo Delta
L’interazione ligando-recettore coinvolge anche la cellula
sorgente, in cui l’endocitosi di Delta è parte integrante
dell’attivazione di Notch (l’endocitosi “tira” su Notch
cambiandone la conformazione?)
Trasduzione del segnale: cosa succede al promotore
1) CSL lega HDAC; istoni deacetilati; promotore spento
2) Delta signaling: CSL lega Notch ICD; HDAC
vengono scalzate (derepressione); promotore può
essere acceso debolmente
3) Legame di MAM (mastermind): reclutamento
efficiente delle HAT; promotore acceso
Gli effettori di Notch: HES repressors / trancription factors
DESTINO DI DEFAULT
NICD
DESTINO INDOTTO
Il signaling di Notch è importante nei
processi di differenziamento in cui le
cellule devono fare una scelta di tipo
binario (es: nella neurogenesi primaria,
dove inibisce la formazione di
neuroblasti - vs. glia -, o nel
differenziamento dell’intestino, dove
promuove la formazione di cellule
mucipare - vs. enterociti)
In questi casi, le cellule del tessuto in
formazione hanno un destino “di
default” (cioè in assenza di segnali
esterni istruttivi) e un destino che viene
indotto attivamente da Notch
Il differenziamento in risposta a Notch
avviene in maniera controllata ma
“casuale” (non è possibile prevedere
quale cellula seguirà un dato destino)
perché prevede una competizione tra
cellule vicine (inibizione laterale)
Neurogenesi primaria: come mai solo alcune cellule
del neuroectoderma diventano neuroni?
Alto
Delta
Destino
primario di
default
(neuroblasto)
Alto
Notch
Destino
secondario
indotto
(glia)
A cosa serve l’inibizione laterale?? ==> Minime asimmetrie tra cellule
inizialmente uguali vengono amplificate e stabilizzate portando al
differenziamento (casuale ma ordinato) di due popolazioni diverse
Neuroblasti
e Glia
Neuroectoderma
Cellule equivalenti
Campo di equivalenza
tempo
Alto
Delta
Destino
primario di
default
(neuroblasto)
Alto
Notch
Destino
secondario
indotto
(glia)
All’inizio tutte le cellule esprimono
SIA il ligando Delta
SIA il recettore Notch
Attivazione di Notch si oppone al
programma di differenziamento di
default (verso neuroblasti) e
promuove invece il destino gliare
Attivazione di Notch inibisce
l’espressione di Delta
La cellula A risponde meglio/prima a Notch, e
quindi esprime meno ligando Delta
La cellula B avrà meno stimolazione di Notch, e
quindi esprime più ligando Delta
La cellula A riceve sempre più stimolazione di
Notch e non si differenzia (diventa Glia)
La cellula B invece non riceve stimolazione e si
differenzia in Neuroblasto
Glia
A
A
B
B
Neuroblasto
Notch
Notch
Delta
Neurogenin
Delta
Geni del differenziamento neuronale
Nella cellula che NON
risponde a Notch
Neurogenin
Delta (induce le altre cellule a Glia)
Geni del differenziamento neuronale
I segnali Hedgehog
denticles
Wild-type
Hedgehog mutant
I segnali Hedgehog (HH) controllano lo sviluppo embrionale sia negli invertebrati
(Drosophila), dove sono stati scoperti, sia nei vertebrati
Come molti altri segnali (Wnt, TGF-beta, BMP etc.) la pathway di HH viene
“riutilizzata” durante la vita degli organismi per regolare numerosi processi, sia
durante le diverse fasi dello sviluppo embrionale, sia durante la vita adulta
Nei vertebrati, i segnali Hh sono stati studiati principalmente per il loro ruolo:
- come morfogeni nel controllo del differenziamento cellulare (identità D-V dei
neuroni nel SNC, polarità dell’arto e numero/identità delle dita negli arti)
- come regolatori della proliferazione/sopravvivenza cellulare
In assenza del ligando
Il recettore Ptc (12TM)
mantiene Smo inattivo
GSK3
CK1
(b-TRCP)
Ci (cubitus interruptus) è
mantenuto sui microtubuli
(Hedgehog Signaling
Complex) e processato
proteoliticamente nella
forma Ci-R (repressoria)
Solo Ci-R può traslocare al
nucleo, e qui inibisce
attivamente la trascrizione
dei promotori bersaglio
In presenza del ligando
Ptc non è più in grado di
inibire Smo (il ligando
INATTIVA il recettore)
Smo blocca il
complesso che
“taglia” Ci
Ci (cubitus interruptus) non viene
tagliato ed è libero di traslocare al
nucleo nella forma full-lenght
(fosforilazione del HSC?)
Ci associa con CBP e
promuove la trascrizione
dei promotori bersaglio
In assenza di ligando
In presenza di ligando
Smoothened è una proteina trasmembrana (7TM) e si pensa che in assenza del
ligando venga mantenuta in vescicole intracellulari dove è inattivo
solo quando HH lega il recettore, Smo può localizzare sulla membrana
citoplasmica e da qui attivare Ci
Nei vertebrati esistono tre diversi omologhi di Ci, i fattori di trascrizione Gli1-3
La relativa importanza della funzione repressoria/attivatoria cambia nei differenti Gli
(Gli3 principalmente repressorio, Gli2 principalmente attivatorio)
Spesso i fattori Gli funzionano in maniera combinatoriale + feedback (Gli1)
GRADIENTI…
Un modello semplificato per il funzionamento di HH come morfogeno
Smo inattivo
HH
HH
Smo parzialmente attivo
Smo attivo
Ci+CBP
Ci-R
promotore
represso
A
promotore
inattivo
(tx basale)
promotore
attivo
B
C
Sorgente
di HH
Mutazioni inattivanti di Patched
HH
HH
Smo è sempre attivo
Ci+CBP
promotore
attivo
promotore
attivo
C
C
Sorgente
di HH
Mutazioni inattivanti di Smoothened
HH
HH
Ci-R
promotore
represso
promotore
represso
A
A
Sorgente
di HH
Mutazioni che aboliscono solo la funzione attivatoria di Ci
(Ci lega il DNA ma funziona solo come repressore)
HH
promotore
represso
A
HH
Sorgente
di HH
promotore
inattivo
(tx basale)
B
Mutazioni che aboliscono solo la funzione repressoria di Ci
(Ci lega il DNA ma funziona solo come attivatore)
HH
HH
Ci+CBP
promotore
inattivo
(tx basale)
promotore
attivo
B
C
Sorgente
di HH
ESEMPI DI GRADIENTI MORFOGENETICI CHE COINVOLGONO UN
GRADIENTE DI SHH:
- Neural tube D/V (Generazione di motoneuroni, interneuroni etc)
- Divisione del campo dell’occhio (anlage) in due!
- Sviluppo arto (ZPA)
- Somite (induce Sclerotomo e patterning miotomo e dermatomo)
… e molti altri…
Shh controlla il differenziamento D/V dei neuroni nel SNC
Il gradiente di Shh si traduce nell’espressione localizzata
di combinazioni di fattori di trascrizione
Differenti fattori Gli contribuiscono a formare il gradiente di risposta a Shh
Gli
repressori
Gli
attivatori
Manca il contributo ATTIVATORIO di Gli2;
Le cellule non sono in grado di percepire la
dose massima di SHH (V3, rosso)
Manca il contributo REPRESSORIO di Gli3;
Le cellule non sono in grado di distinguere
correttamente tra dosi intermedie di SHH
I segnali HH nei vertebrati hanno un ruolo fondamentale anche nella
morfogenesi cranio-facciale
SHH (secreto dal mesoderma assiale) è importante per stabilire la polarità D/V
del SNC e, di conseguenza, la suddivisione del prosencefalo in telencefalo e
diencefalo, per la formazione dei due emisferi del telencefalo, per la formazione
dei bulbi nasali e delle vescicole ottiche
Mutazione di SHH nel topo, o sindromi umane dovute a mutazione di
componenti della pathway di SHH, causano perciò anomalie dello sviluppo
come la oloprosencefalia (nei casi estremi: una unica vescicola prosencefalica,
occhio ciclopico, proboscide)
human SHH mutant
Famiglie con mutazione ereditaria del gene Shh
Solitary median maxillary Central Incisor (SCI)
Holoprosencephaly (HPE)
I segnali HH hanno un ruolo anche nello sviluppo dell’arto
Shh è il fattore responsabile della polarizzazione AnteroPosteriore dell’arto (identità e numero delle dita, radio/ulna)
Mutazioni di Shh o di componenti della pathway provocano
malformazioni dell’arto (polidattilia-sindattilia)
Greig
Cephalo-polysyndactyly
Pallister-Hall
(allele nullo Gli3)
(Gli3 solo repressorio) Topi Gli3-/-
Il ligando Hedgehog viene
sintetizzato come un
precursore in grado di
autocatalisi (proteolisi)
HH-N viene modificato per
aggiunta di un colesterolo e di
un palmitato
Disturbi nel metabolismo del
colesterolo hanno effetto sul
signaling di HH (sia a livello
del ligando che del recettore
Patched)
Il ruolo del colesterolo nel signaling da Hedgehog
Mutazione in enzimi della via biosintetica
del colesterolo nell’uomo (sindrome
SLOS, gene della 7-dehydrocholesterolreduttasi) causano oloprosencefalia e
malformazioni degli arti
Sostanze che interferiscono con la
biosintesi del colesterolo (alcaloidi
come jervine e cyclopamine) hanno
effetti teratogeni dovuti alla perdita di
SHH signaling
Veratrum
Californicum
Shh dall’embriologia ai tumori
Nelle cellule adulte, i segnali HH promuovono la
proliferazione cellulare
Patched funziona quindi come tumor-suppressor
(loss di Ptc = attivazione costitutiva di Smo =
proliferazione incontrollata)
Mutazioni inattivanti di Patched (o altre mutazioni
attivanti della pathway) sono all’origine dei
carcinomi delle cellule basali della pelle (tra i più
frequenti tumori alla pelle) e si trovano in molti
altri tumori (medulloblastoma, glioma, tumori
gastrici, carcinomi squamosi della pelle etc.)
Mutazioni ereditarie di Patched causano la “basal
cell nevus syndrome”, che predispone
all’insorgenza di carcinomi basali, oltre a
presentare numerose anomalie dello sviluppo
(fusione delle dita, anomalie facciali)
Inattivazione PTC
attivazione
costitutiva
GLI
iperproliferazione