Cap. 6 Dentro la materia
6.1 Le caratteristiche della materia
La materia ha due caratteristiche fondamentali:
a) Ha una massa espressa in chilogrammi
b) Possiede un volume misurato in metri cubi
Perciò possiamo concludere che: definiamo materia tutto ciò che ha una massa
ed occupa un volume.
6.2 La teoria atomica della materia
La diversità della varie sostanze è dovuta alla diversità della composizione
chimica della materia spiegata dalla teoria atomica. Comunque spezziamo del
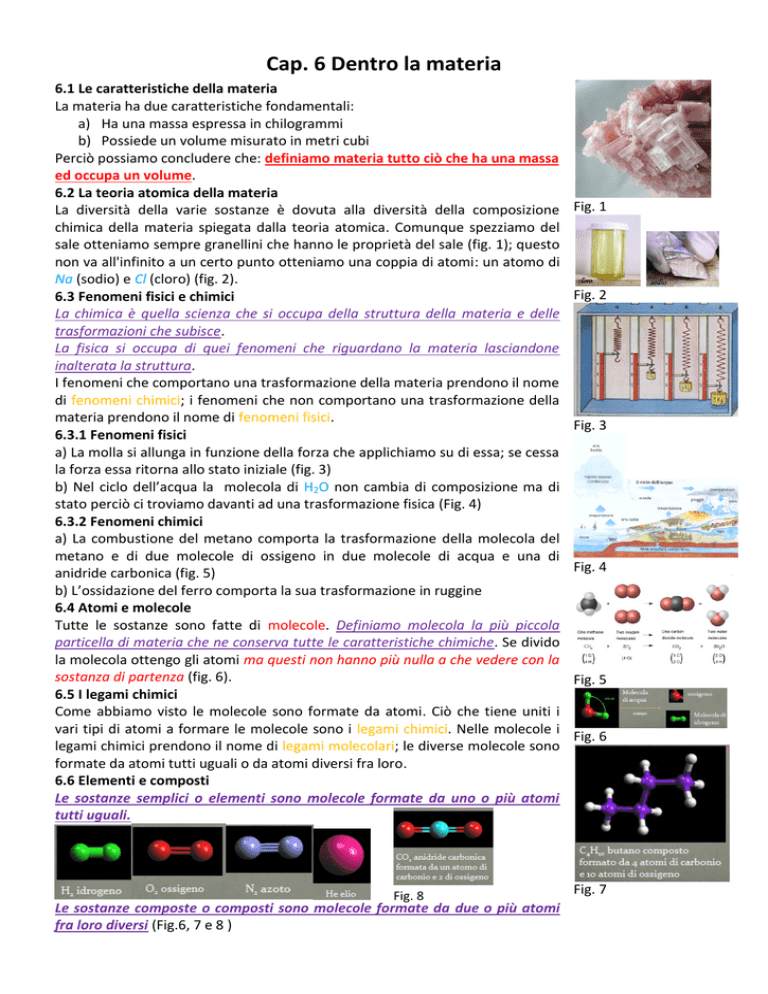
sale otteniamo sempre granellini che hanno le proprietà del sale (fig. 1); questo
non va all'infinito a un certo punto otteniamo una coppia di atomi: un atomo di
Na (sodio) e Cl (cloro)(fig. 2).
6.3 Fenomeni fisici e chimici
La chimica è quella scienza che si occupa della struttura della materia e delle
trasformazioni che subisce.
La fisica si occupa di quei fenomeni che riguardano la materia lasciandone
inalterata la struttura.
I fenomeni che comportano una trasformazione della materia prendono il nome
di fenomeni chimici; i fenomeni che non comportano una trasformazione della
materia prendono il nome di fenomeni fisici.
6.3.1 Fenomeni fisici
a) La molla si allunga in funzione della forza che applichiamo su di essa; se cessa
la forza essa ritorna allo stato iniziale (fig. 3)
b) Nel ciclo dell’acqua la molecola di H2O non cambia di composizione ma di
stato perciò ci troviamo davanti ad una trasformazione fisica (Fig. 4)
6.3.2 Fenomeni chimici
a) La combustione del metano comporta la trasformazione della molecola del
metano e di due molecole di ossigeno in due molecole di acqua e una di
anidride carbonica (fig. 5)
b) L’ossidazionedelferrocomportalasuatrasformazioneinruggine
6.4 Atomi e molecole
Tutte le sostanze sono fatte di molecole. Definiamo molecola la più piccola
particella di materia che ne conserva tutte le caratteristiche chimiche. Se divido
la molecola ottengo gli atomi ma questi non hanno più nulla a che vedere con la
sostanza di partenza (fig. 6).
6.5 I legami chimici
Come abbiamo visto le molecole sono formate da atomi. Ciò che tiene uniti i
vari tipi di atomi a formare le molecole sono i legami chimici. Nelle molecole i
legami chimici prendono il nome di legami molecolari; le diverse molecole sono
formate da atomi tutti uguali o da atomi diversi fra loro.
6.6 Elementi e composti
Le sostanze semplici o elementi sono molecole formate da uno o più atomi
tutti uguali.
Fig. 8
Le sostanze composte o composti sono molecole formate da due o più atomi
fra loro diversi (Fig.6, 7 e 8 )
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
6.7 L’atomo
Dal greco ἄτομος «indivisibile» e tale è considerato dalla chimica mentre per la
fisica esso risulta suddiviso in particelle più piccole; infatti, esso risulta suddiviso
in tre tipi di particelle: protoni, neutroni ed elettroni.
I protoni e neutroni occupano la parte centrale dell’atomo detta nucleo e per
questo essi sono anche detti nucleoni.
Neutroni
I protoni sono particelle cariche ed hanno una carica positiva mentre i neutroni, Fig. 9
come dice lo stesso nome, sono privi di carica (fig. 9).
I nucleoni non sono particelle elementari ma anch'essi costituiti da particelle più
piccole dette quark (si definiscono particelle elementari quei costituenti della
materia che non presentano una struttura interna)
Di queste ne esistono diversi tipi ma per fortuna a noi ne interessano solo due: i
quark up (su) aventi una carica pari a +2/3 e i quark down (giù) aventi carica
pari a -1/3.
I neutroni sono formati da due quark down e un quark up pertanto la loro carica
sarà: -1/3 -1/3 +2/3 = 0; i protoni sono formati da due quark up e un quark
Fig. 10
down perciò la sua carica sarà: +2/3 +2/3 -1/3 = + 1. I quark cono tenuti insieme
dalla forza nucleare forte (fig. 10).
Intorno al nucleo ruotano delle altre particelle che prendono il nome di
elettroni. L’elettrone è una particella di carica negativa e( -1) a differenza dei
nucleoni non è composta da particelle più piccole ed è una“ vera” particella
elementare. Nell’atomo il numero dei protoni è uguale a quello degli elettroni
perciò l’atomo è neutro (Fig. 11).
6.7.1 Perché gli atomi sono differenti
I costituenti degli atomi sono sempre gli stessi ma non il loro numero perciò
saràproprioquestoadistinguereunatomodall’altro; in particolare due atomi Fig. 11
diversi avranno un diverso numero di protoni (e perciò anche di elettroni)
Il numero dei protoni presenti in un atomo prende il nome di numero atomico Z
Fig. 13
H Z =1
Fig. 12
6.8 Numero di massa atomica
Se andiamo a vedere le masse dei costituenti del nucleo ci accorgeremo che
protonieneutronihannomasseall’incircaugualimentreglielettronisonocirca
Fig. 14
1800 volte più leggeri; perciò la massa degli atomi è data dalla somma dei
protoni e degli elettroni in essi presenti. Si definisce numero di massa atomica
(A) il numero dei nucleoni presenti in un atomo (fig. 12)
6.9 I gusci elettronici
Gli elettroni che ruotano intorno al nucleo non sono distribuiti a caso a si
trovano in particolari zone dette gusci elettronici. Teoricamente non c’è un
limite al numero dei gusci elettronici ma normalmente si dice che i gusci
elettronici sono 7 perché con questa quantità è possibile sistemare tutti gli
atomi fino a Z=119 ma tale atomo non è stato ancora scoperto. Ad ogni guscio
compete una particolare energia che ne determina il livello energetico. Ogni
guscio può contenere un determinato numero di elettroni in base a
determinate regole su cui non è il caso addentrarsi; basterà ricordare che il
protoni
primo guscio contiene 2 elettroni, l’ultimo guscio al massimo 8 elettroni (fig. 13
e 14)
6.10 Gli isotopi
Sappiamo già dallo scorso anno che atomi di uno stesso elemento hanno lo
stesso numero di protoni ma non è assolutamente detto che abbiano lo stesso
numero di neutroni anzi non è assolutamente così. Se il numero di neutroni può
variare significa che nell’atomo di un elemento è fisso il numero Z ma può
variare il numero A. Si definiscono isotopi tutti gli atomi di uno stesso
elemento che differiscono per il numero di massa A e che quindi sono
fisicamente (non chimicamente) diversi fra loro.
6.11La tavola periodica
Nel XIX sec. erano conosciuti molti elementi chimici ma non si riusciva a trovare
il modo di ordinarli in una maniera coerente. Dopo vari tentativi due chimici
imboccarono la strada giusta
Nel 1870 il chimico tedesco Julius Mever pubblicò un modello di tavola degli
elementi. In maniera indipendente, il professore di chimica russo Dmitrii
Mendeleev pubblicò nel 1869 la sua prima versione di tavola periodica. In tutte
e due le tavole gli elementi erano ordinati in righe e colonne, in ordine di peso
atomico crescente in modo tale che elementi che appartenevano alla stessa
colonna presentassero caratteristiche simili.
La tavola periodica di Mendeleev presentava diversi spazi vuoti. Il chimico
sosteneva che questi spazi contenessero degli elementi che ancora dovevano
essere scoperti; in questo modo la sua tabella non era un semplice modo di
ordinare gli atomi ma era a tutti gli effetti una teoria scientifica in quanto essa
prevedeva:
1 L’esistenza di elementi che ancora dovevano essere scoperti
2 Prediceva le caratteristiche che dovevano avere questi elementi e perciò
dava delle indicazioni ben precise su come andarli a cercare.
Il successo di entrambe le previsioni fece di Mendeleev uno dei maggiori
scienziati di fama mondiale.
Dalla struttura della tavola periodica e dalla comprensione del modo in cui i vari
atomi si combinavano gli scienziati ebbero l’intuizione sul modo con cui gli
elettronisipotavanodistribuireall’internodegliatomi.
L’attuale tavola periodica conta 118 atomi di cui 92 maturali e 26 artificiali
(transuranici) ottenuti in laboratorio, il più pesante è il Ununoctium
In essa si contano:
7 righe orizzontali dette periodi
8 colonne verticali dette gruppi
Un gruppo di elementi detti di elementi detti di transizione
Due sottogruppi dei lantanidi e degli attinidi
Fig. 15
6.11.1 I metalli
Nella tavola di Mendeleev gli elementi sono raggruppati in metalli non metalli
semimetalli e gas nobili ma cosa li contraddistingue?
I metalli (Fig. 15)
1. Salvo il Hg a temperatura ambiente sono tutti solidi
2. Sono lucidi e splendenti
3. Hanno alto punto di ebollizione e fusione (ecc. alcalini)
4. Sono duttili (ridotti in fili)
5. Sono malleabili (ridotti in fogli)
Fig. 16
6. Conduttori di elettricità e calore
6.11.2 Non metalli (fig. 16)
1. A temperatura ambiente la maggior parte si trova allo stato gassoso, il
Br è liquido mentre C, S, e Si sono solidi
2. Sono opachi
3. Hanno bassi punti di fusione e di ebollizione
4. Non sono ne duttili ne malleabili
5. Sono cattivi conduttori di elettricità e calore (ecc. C)
6.12 Nomi e simboli
Ogni atomo ha un suo simbolo che deriva dal suo nome latino. Eccone alcuni
esempi Elemento
Nome Latino
Simbolo
Lettura
Idrogeno
hydrogenum
H
acca
Ossigeno
oxygenum
O
o
Calcio
calcium
Ca
ci-a
Ferro
ferrum
Fe
effe-e
Mercurio
hydrardyrum
Hg
acca-gi
Carbonio
carbonium
C
ci
6.13 Formule chimiche
Si definisce formula chimica la notazione che utilizza simboli e indici per dare
informazioni relative alla composizione atomica e alla struttura di una
molecola. Eccone alcuni esempi:
Fig. 17
Carbonato di calcio (fig. 17)
Si legge
Cia-ci-o-tre
Fig. 18
Metano (fig. 18) acqua ossigenata (fig. 19)
Fig. 19
si legge ci-acca-quattro
si legge acca-due-o-due
6.14 Legami chimici
Un numero relativamente piccolo di atomi può originare un numero
elevatissimo di composti chimici; come abbiamo già visto questo si origina
mettendo insieme diversi tipi di atomi. Tutto questo può grazie alla capacità
Fig. 20
degli atomi di formare legami chimici.
Ma come si formano questi legami?
6.14.1 Regola dell’ottetto
Glielementideigasnobilihanno8elettronisull’orbitaleesterno. Sappiamo che
tali elementi erano tutti sconosciuti a Mendeleev perché non formano composti
con gli altri atomi; questo si verifica perché tali atomi hanno l’orbitale esterno
completo che non li rende reattivi dal punto di vista chimico.
Perché non pensare che anche gli atomi possano cercare di legarsi per
raggiungere questa configurazione elettronica esterna particolarmente stabile?
L’elio (fig. 20) e il neon (fig. 21) sono due gas nobili e hannol’orbitaleesterno Fig. 21
completo (2e e 8 e). Gli atomi che non hanno l’orbitale esterno completo sono
elementi chimicamente instabili (non fisicamente instabili come ad esempio il
tritio che è radioattivo) e sono fortemente reattivi cioè tendono a formare
legami con gli altri atomi.
Idrogeno (fig. 23) e ossigeno (fig. 22) nonhannol’orbitaleesternocompletoe
perciò sono fortemente reattivi e pronti a formare legami chimici. Si ha legame
chimico quando una forza di natura elettrostatica tiene uniti due o più atomi
in modo da formare una nuova specie chimica.
Vediamo adesso alcune applicazioni di questa regola con alcuni esempi.
Consideriamo una molecola di acqua, se noi contiamo gli elettroni abbiamo che Fig. 22
nella molecola di acqua l’idrogeno ha due elettroni sull’orbitale esterno e
l’ossigeno8elettronisull’orbitaleesternoperciòlaformazionedella molecola di
acqua ha portato al completamento dell'orbitale esterno (fig. 24). La stessa cosa
la possiamo vedere nel metano, se noi contiamo gli elettroni abbiamo che
l’idrogeno ha due elettroni sull’orbitale esterno e il carbonio 8 elettroni
sull’orbitaleesternoperciòla formazione della molecola di metano ha portato
al completamento dell'orbitale esterno (fig. 25)
Fig. 23
Fig. 26
Fig. 24
fig. 25
Se noi prendiamo in considerazione la molecola di cloro e contiamo gli elettroni
abbiamo che i due atomi di cloro hanno entrambi otto elettroni sull’orbitale
esterno (fig. 26).
6.15 La valenza
Fig. 31
Gli atomi quando si incontrano entrano i contatto tramite gli elettroni
dell’orbitale esterno perciò sono questi che formano legami. Questi elettroni
sono anche detti elettroni di valenza e il loro numero stabilisce quanti legami
può formare l’atomo. Si definisce valenza il numero di legami chimici che un
atomo può fare.
Gli elementi del gruppo I hanno valenza 1 (Fig. 27); quelli del gruppo II hanno
valenza 2 (fig. 28); gli elementi del gruppo III hanno valenza 3 (fig. 29); quelli del
Fig. 32
gruppo IV hanno valenza 4 (Fig. 30); quelli del gruppo V hanno valenza 3 (fig. 31)
Fig. 33
Fig. 27
Fig. 28
Fig. 29
Fig. 30
quelli del gruppo VI hanno valenza 2 (fig. 32); quelli del gruppo VII hanno
valenza 1 (fig. 33) e infine quelli del gruppo VIII hanno valenza 0 (fig. 34).
Facciamo l’esempio dell’ossigeno, esso ha valenza 2 perciò può formare 2
legami: o fa un doppio legame con un altro atomo di ossigeno (fig. 8) oppure
lega due atomi di valenza 1 (es.l’HFig.24).
Il carbonio ha valenza 4 può formare legami con 4 atomi a valenza 1 con due Fig. 34
atomi a valenza 2, con 2 atomi a valenza 1 e 1 a valenza 2 o con un atomo a
valenza 1 e uno a valenza 3 come nelle figure seguenti:
Fig. 36
Fig. 35
6.16 Gli ioni
Il termine deriva dal greco ἰόν che significa andare …unostranonomeperun
atomo ma vediamo cosa indusse Faraday nel 1834 ad introdurre questo
termine. Gli ioni hanno la capacità di muoversi all’interno di un campo elettrico
(da qui il nome). L’acqua che per sua natura è un ottimo isolante diventa
conduttore se facciamo una soluzione con un composto ionico (cioè un
composto che si scioglie liberando ioni). Tutto questo strano discorso ci porta a
concludere che gli ioni sono atomi o gruppi di atomi dotati di carica elettrica.
Questa carica può essere positiva o negativa a seconda che abbiano perduto o
acquistato uno o più elettroni rispetto alla loro normale configurazione di
sistema elettronicamente neutro.
Gli ioni vengono indicati, con il simbolo dell’atomo o del gruppo atomico,
portante in alto a destra tanti segni + o − quanti sono gli elettroni perduti o
acquistati.
Facciamo alcuni esempi; se prendiamoinconsiderazionel’atomo di sodio (Fig.
36);essohaunsoloelettronenell’orbitale3,questaconfigurazioneèinstabile
ma può raggiungerne una stabile perdendo l’unico elettrone che si trova
sull’orbitale3ottenendo così la stessa configurazione elettronica esterna del Ne
diventando però Na+ (fig. 37). Si è formato uno ione a carica positiva che prende
il nome di catione.
Prendiamoorainconsiderazioneilcloro(fig.38);essoha7elettronisull’ultimo
orbitale (n=3); questa configurazione elettronica è instabile perché il livello
esterno non è completo ma se il cloro acquista un elettrone assume la stessa
configurazione elettronica esterna dell’argo diventando però Cl-. Si è formato
uno ione a carica negativa che prende il nome di anione.
6.16.1 Quando si formano gli ioni?
Normalmente gli atomi del primo e secondo gruppo formano cationi quando
formano legami; quelli del sesto e settimo gruppo tendono a formare anioni
specie quando si legano con quelli del primo e secondo gruppo.
Negli altri casi gli atomi tendono a condividere gli elettroni nei legami chimici
piuttosto che formare ioni; questocomportamentoètipicoanchedell’idrogeno
pur appartenendo al primo gruppo.
6.17 Il legame ionico
Consideriamo un atono di sodio e uno di cloro (Fig. 40). Il sodio acquista la sua
configurazione elettronica stabile cedendo l’elettrone dell’orbitale n=3
diventando Na+ (Fig. 41) cedendoilsuoelettroneall’atomodiclorochediventa
Cl- (Fig. 42), in questo nodo anche il cloro raggiunge la configurazione di gas
nobile. A questo punto abbiamo un catione sodio con carica positiva e un
anione cloruro con carica negativa. Gli ioni con carica opposta si attraggono per
forza elettrostatica e si origina così un nuovo composto: il cloruro di sodio(fig.
43) con la formazione di un legame ionico.
Il legame ionico è la conseguenza dell'attrazione elettrostatica che si
manifesta tra i due ioni di carica opposta.
Fig. 37
Fig. 38
Fig. 39
Fig.40
Fig. 41
Fig. 42
6.18 Legame covalente
Si dice che fra due atomi si è formato un legame covalente quando due atomi
mettono in comune uno o più elettroni forniti da ciascun atomo.
6.18.1 Legame covalente fra atomi uguali
L’atomodicloroha7esull’orbitale esterno perciò manca un solo elettrone per
raggiungerelastrutturaelettronicadell’argo (fig. 44). Vediamo in che modo due
atomi di cloro possono risolvere il problema. Se i due atomi di cloro mettono in
comune un elettrone entrambi ricevono un elettrone extra hanno raggiunto la
configurazione elettronica esterna dell’argo. Questa messa a comune ha
originato un legame fra i due detto legame covalente (fig. 45).
6.18.2 Il legame covalente fra atomi diversi
Prendiamo in considerazione un atomo di cloro e uno di idrogeno. Un atomo di
cloro può raggiungere la configurazione elettronica di un gas nobile se
acquisisce un elettrone; la stessa cosa succede per l’atomo di idrogeno che in
questo modo acquisisce la configurazione elettronica esterna dell’elio (Fig. 46).
A ciascuno dei due perciò serve un elettrone, se condividono due elettroni
risolvono il problema raggiungendo entrambi 8 elettroni. La coppia condivisa
formaunlegamecovalentefral’atomodicloroel’atomodiidrogeno (Fig. 47). I
due elettroni condivisi si muovono intorno ad entrambi gli atomi.
6.19 Il legame metallico
Nei metalli gli atomi perdono facilmente gli elettroni più esterni trasformandosi
in ioni positivi. Questi ioni vanno ad occupare il minor spazio possibile
sistemandosi all'interno di un reticolo cristallino. Gli elettroni persi non
appartengono ad un singolo atomo ma a tutto il reticolo del solido e sono liberi
di muoversi fra gli ioni positivi garantendo la neutralità del sistema e fungendo
da collante per gli ioni.
6.20 Storia dell’atomo
La teoria della materia ha da sempre rappresentato un’idea portante della
scienza anzi essa è nata insieme alla scienza. Vediamo schematicamente quali
sono stati i frutti delle riflessioni sulla natura della materia:
Taletesostennecheilprincipiodituttelecosefossel’acqua
Anassimeneloricondusseall’aria
Anassimandro ad una sostanza primigenia detta apeiron
Eraclito al fuoco
Empedocle introdusse i 4 elementi che dominarono la scena fino al
rinascimento (terra, acqua, aria fuoco)
Democrito formulò per primo l’ipotesi della teoria atomica della materia
La visione di Democrito fu minoritaria fino alla seconde metà del settecento ma
si mantenne sempre viva.
La teoria atomica formulata da Democrito deduce l'esistenza di atomi da un
processo logico e puramente teorico attraverso il quale comprende che
scomponendo la materia in parti sempre più piccole non si può che arrivare a
dei costituenti fondamentali e indivisibili.
Studiando quando si andava scoprendo sulle reazioni chimiche (legge della
conservazione della massa di Lavoisier, delle proporzione definite di Proust e
quella delle proporzioni multiple da lui stesso formulata) Dalton pose le basi per
la moderna teoria atomica sviluppando 5 punti fondamentali (fig. 49)
1. la materia è costituita da particelle elementari, dette atomi;
2. gli atomi sono indivisibili e inalterabili;
3. gli atomi di uno stesso elemento sono identici tra loro, possedendo la
stessa massa e le stesse proprietà;
Fig. 43
Fig. 44
Fig. 45
Fig. 46
Fig. 47
Fig. 48
4. gli atomi di elementi diversi sono differenti;
5. gli atomi di elementi diversi si combinano tra di loro formando particelle
composte (atomi composti, come allora si diceva), o composti; in ogni
determinato composto, il rapporto numerico con cui sono combinati gli
atomi costituenti è definito e costante.
Nel 1897 Thomson studiando il passaggio della corrente elettrica nei gas
rarefatti, dimostra che i raggi emessi dal catodo (raggi catodici) sono
particelle di carica negativa.
Siccome l’atomo è neutro debbono esistere particelle di carica positiva; sulla
base di questi dati Thomson propose il suo modelloatomico“apanettone” (Fig.
Fig. 49
50). L’atomo è rappresentato come particella neutra costituita a sua volta da
particelle negative sparse (come le uvette e i canditi nel panettone) in una
pasta positiva. Le cariche negative e positive si neutralizzano tra loro.
Rutherford bombardando una sottile lamina di oro con particelle alfa (costituite
da due protoni e due neutroni e dotate perciò di carica positiva 2+) si accorse
che molte di queste venivano deviate mentre se fosse stato vero il modello di
Thomson dovevano passare senza deviazioni. Da questo esperimento si accorse
Fig. 50
che le cariche negative dovevano trovarsi all’esterno dell’atomo e quelle positive
al suo interno e che l’atomo era sostanzialmente vuoto. Sulla base di queste
evidenze Rutherford propone il suo modello atomico planetario (Fig. 51), simile
al sistema solare: un nucleo denso, dotato di carica elettrica positiva, attorno
al quale ruotano, come i pianeti intorno al Sole, gli elettroni, particelle dotate
di carica elettrica negativa in orbite circolari.
Tuttavia questo modello era chiaramente instabile, secondo le leggi
sull’elettromagnetismo gli elettroni in movimento dovrebbero emettere energia
elettromagnetica e cadere sopra il nucleo.
Per superare questo inconveniente Bohr propose un nuovo modello basata sulla Fig. 51
moderna fisica quantistica sviluppata da lui stesso, Plank ed Einstein. Nel
modello di Bohr (fig. 52) l’elettrone non cade sul nucleo, ma ruota senza
emettere energia lungo orbite circolari prefissate: gli stati stazionari. La
spiegazione del modello di Bohr richiede competenze che vanno al di là delle
competenze richieste nel corso di scuola media perciò ci fermiamo qui.
Fig. 52