Lez. 6-10
Da Faraday a Rutherford
(la scoperta delle particelle subatomiche)
Lez 6-10
1
Alessandro
Volta
• Nell'anno 1799 Volta costruì un
dispositivo a cui diede nome di "
apparato elettromotore ", che in
seguito venne denominato come Pila di
Volta. La pila di Volta era costituita da
una serie di dischi in zinco e rame
impilati uno all'altro, interposti ad essi
vi erano dischi di feltro imbevuti di
sostanza acida; era nato così il primo
generatore statico di energia elettrica.
Lez 6-10
2
Michael Faraday
(Newington Butts 1791 - Hampton Court 1867),
Circa 30 anni dopo l'inglese Michael Faraday proseguendo gli
studi e le ricerche iniziate dal danese Hans Cristians Oersted e
dal francese André Marié Ampérè scoprì che la corrente
elettrica poteva essere generata da variazioni di un campo
magnetico, studiò e scoprì il fenomeno dell'elettromagnetismo,
gettò le basi per gli studi sugli elettroliti, inventò la "gabbia di
Faraday" efficace parafulmine.
Lez 6-10
3
• Studiò l’elettricità e il magnetismo.
• 1821: produce un campo magnetico
impiegando un conduttore attraversato
da corrente elettrica.
• 1831: scopre il fenomeno dell’induzione
elettromagnetica e, nello stesso anno,
dimostra l’interazione tra correnti
elettriche.
Studia
i
fenomeni
dell’elettrolisi.
Lez 6-10
4
W. Crookes (1879)
1)
Viaggiano in linea retta e proiettano su uno schermo
fluorescente l’ombra degli oggetti posti sul loro cammino
Lez 6-10
5
Raggi catodici
2) Possiedono energia cinetica e possono far
girare una ruota a pale
3) Danno fluorescenza in alcune sostanze (tubi televisivi)
4) Vengono deviati da un campo magnetico
5) Sono carichi negativamente
6) Possono attraversare sottili fogli di metallo
Nel 1894 G. J. Stoney propone il nome di elettrone per indicare la
Lez 6-10
6
carica elementare di elettricità negativa.
Raggi catodici
• Secondo la teoria elettromagnetica, una carica che si
muove si comporta come un magnete e può interagire
con i campi elettrici e magnetici attraverso cui passa
Lez 6-10
7
(Manchester
1856
Cambridge 1940), fisico
britannico,
studiò
all'Owens College (oggi
parte dell'università di
Manchester) e al Trinity
College
dell'univ.
di
Cambridge. Professore di
fisica sperimentale al
Cavendish Laboratory e
poi direttore del Trinity
Nel 1906 ricevette il premio Nobel per la fisica come College (1918-1940). Fu
riconoscimento
del
suo
lavoro
sulla
conduzione presidente della Royal
dell'elettricità attraverso i gas. Nel corso di uno studio dei Society dal 1915 al 1920.
raggi catodici scoprì l'elettrone, il principale costituente della
materia e ne misurò la carica e la massa.
Lez 6-10
8
J. J. Thomson
•Teorico e sperimentatore, nel 1898 formulò
un modello di atomo, poi abbandonato,
secondo cui le particelle di carica negativa
erano immerse in una massa gelatinosa di
carica positiva.
Lez 6-10
9
“…il valore di questa carica negativa è
identico a quello della carica positiva che
porta l’atomo di idrogeno nell’elettrolisi
delle soluzioni….”
J. J. Thomson dimostrò che la parte carica negativamente dei raggi
catodici è indipendente dalle caratteristiche chimiche di un gas
ionizzato, mentre la parte positiva ne dipende se è soggetta a una
differenza di potenziale; la parte negativa è identificabile negli
elettroni (la parte positiva corrisponde a cationi metallici, perciò
Lez 6-10
10
dipende dalla natura di ogni singolo
metallo).
L’elettrone
• Usando tubi a raggi catodici J. J. Thomson dimostrò che
quando una alta differenza di potenziale veniva
applicata tra due elettrodi la stessa particella veniva
emessa dall’elettrodo negativo indipendentemente dalla
natura del metallo usato come elettrodo.
• La deflessione che i raggi subivano quando venivano
applicati campi elettrici e magnetici lo portarono a
concludere che erano particelle cariche negativamente
che egli definì elettroni.
• Aggiustando il campo elettrico e quello magnetico egli
riuscì a calcolare il rapporto carica/massa per
l’elettrone.
Lez 6-10
11
•Robert Andrews Millikan (Morrison 1868 - San Marino, Pasadena 1953), fisico statunitense, ottenne
risultati fondamentali nell'ambito della fisica atomica. Studiò alla Columbia University e alle università di
Berlino e di Gottinga. Nel 1896 si trasferì all'università di Chicago dove nel 1910 gli venne assegnata la
cattedra di fisica. Lasciò l'università nel 1921 per assumere la direzione del laboratorio di fisica Norman
Bridge al California Institute of Technology.
Lez 6-10
12
Una volta determinato il rapporto
carica/massa dell’elettrone, la
determinazione della massa o della carica
consentirà il calcolo dell’altra. Millikan
determinò la carica dell’elettrone attraverso
l’esperimento delle goccioline d’olio. Le
cariche delle goccie d’olio erano differenti,
ma ciascuna era un multiplo della più
piccola carica che egli definì carica
dell’elettrone.
• Il valore attualmente accettato per la
massa dell’elettrone è
9.109389 × 10-28g.
• Il valore attualmente accettato per la
carica dell’elettrone è
1.602 × 10-19C.
Lez 6-10
La massa
dell’elettrone
13
•Nel 1886 Goldstein scoprì l’esistenza di una specie di
radiazioni che egli chiamò raggi canale” e suppose portassero
una carica positiva. Questo fu confermato da W. Wien il quale
dimostrò che il loro rapporto m/e era notevolmente più elevato
che nei raggi catodici.
Lez 6-10
14
Il protone
• Nell’esperimento dei raggi canale (1896) la
collisione di raggi catodici (elettroni) con
molecole gassose strappava elettroni dalle
molecole. Le particelle positive formavano un
“canale” attraverso i buchi nel catodi.
• Il rapporto carica/massa dipende dal gas
utilizzato. Ciascuna particella positiva ha un
rapporto carica/massa che è multiplo di quello
della particella positiva derivata dall’idrogeno.
Perciò la particella fondamentale fu definita
quella derivata dall’idrogeno. A questa
particella RutherfordLezdiede
il nome di protone.
6-10
15
Il protone
• I protoni sono 1800 volte più
pesanti dell’elettrone ed hanno
una carica eguale ma di segno
opposto a quella dell’elettrone.
• Convenzione: è stato deciso di
utilizzare +1 per la carica del
protone e –1 per quella
dell’elettrone.
Lez 6-10
16
Nel 1895 W. C. Roentgen scoprì i raggi X
•Henry Becquerel (1852-1908; premio Nobel nel 1903),
fisico francese, scoprì che una lastra fotografica anneriva
a contatto con sali di uranio U; questo avvenne durante
le sue ricerche sulla fluorescenza (24-2-1896).
Lez 6-10
17
•Marya Sklodowska (18671934; premio Nobel nel
1903 e nel 1911), chimica
polacca, durante ricerche
sulla
piezoelettricità
dell'uranio, ne individuò la
capacità
di
emettere
radiazioni;
scoprì
la
radioattività (termine da lei
inventato) del torio Th.
Lez 6-10
Decadimento spontaneo del
nucleo sotto forma di
particelle alfa (nuclei di He),
18
particelle beta (elettroni),
e
raggi gamma (fotoni)
Marie Curie e la radioattività
Lavorando su tonnellate di
pechblenda, riuscì a isolare e
caratterizzare il polonio Po
(Z=84) e il radio Ra (Z=88); la
radioattività comporta anche la
trasformazione di un
elemento in un altro.
Particella
•onde
elettromagnetiche
•nessuna carica
•nessuna attrazione
•molto penetranti
Particella
• cariche
•
•
positivamente
attratte lamina
negativa
(He++) basso
potereLez
penetrante
6-10
Particella
• cariche
negativamente
• attratte lamina
positiva
• potere penetrante
19
100 volte
•(1871-1937; premio Nobel nel 1909) studiò la diffrazione di
particelle a emesse per radioattività e le individuò come He2+,
cioè come nuclei di elio; riuscì a calcolare il diametro dei
nuclei: 10-12-10-13 cm, contro 10-8 cm circa per il diametro
degli atomi (da ciò si può dedurre l'enorme densità del
nucleo, circa 1011 Kg/cm3 cioè 100.000 Ton/mm3!).
Lez 6-10
20
• La carica del nucleo, uguale al numero
degli elettroni, è una costante
fondamentale che determina le
proprietà dell’atomo.
• La massa dell’atomo e le sue proprietà
radioattive sono determinate
esclusivamente dal nucleo.
Lez 6-10
21
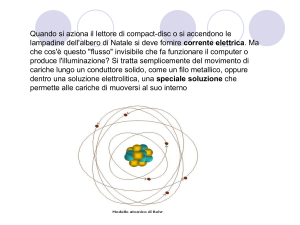
L’esperimento
di Rutherford
L’atomo è costituito da
una parte centrale,
chiamata nucleo, in cui
è<concentrata quasi tutta
la massa, e da una parte
periferica, molto più
grande e quasi vuota, dove
si trovano gli elettroni.
l raggio di un atomo è circa 10.000 volte più
grande del raggio del suo
Lez 6-10
22
nucleo. L’atomo
è praticamente quasi vuoto.
IL MODELLO
PLANETARIO
• L’atomo è soprattutto vuoto poiché la maggior
parte delle particelle
passa attraverso gli atomi
senza venir deflessa
• Il nucleo è molto denso e carico positivamente
poiché le particelle vengono respinte e deflesse.
• Gli elettroni occupano lo spazio intorno al nucleo
• L’atomo è elettricamente
neutro.
Lez 6-10
23
q q
r
1
mv
r
2
2
Attrazione
2
Forza
elettrostatica centrifuga
E
maggiore
E
minore
= r
= r
maggiore
minore
Spettri continui!!!!!!
• L’elettrone è attratto dal nucleo da una forza
elettrostatica. Questa forza, secondo l’ipotesi di
Rutherford, è uguale e contraria alla forza centrifuga,
che agisce sull’elettrone in conseguenza del suo moto
circolare. Questo equilibrio di forze è analogo a quello
esistente nel sistema solare fra Sole e pianeti.
Lez 6-10
24
Lez 6-10
25
James Chadwick (1891-1974; premio Nobel nel 1935) scoprì nel 1932 che si
potevano ottenere ioni H+ (protoni) p per bombardamento a di certi materiali:
riscontrò che la carica positiva del protone ha lo stesso valore di quella negativa
dell'elettrone. Scoprì anche che, per bombardamento
di elementi leggeri (B, Be)
si ottenevano particelle senza carica e di massa circa eguale a 1 u.m.a., che
furono chiamate
neutroni n.
Dedusse perciò che protoni e neutroni fossero
costituenti del nucleo.
Lez 6-10
26
ISOTOPI
“L’identità della somma
algebrica
delle
cariche
positive e negative dei
nuclei, quando la loro
somma
aritmetica
è
diversa, dà quelli che io
chiamo ISOTOPI”.
•ISOTOPI: Atomi
chimicamente identici
(hanno eguale Z) ma
con diverso numero N
di neutroni (A è perciò
diverso).
Lez 6-10
27
• Molti elementi hanno massa atomica non
sempre vicina all'unità (per esempio Cl
35.45; H 1.008; Ni 58.71...). Ciò è dovuto
alla possibilità di esistenza di nuclei con
eguale Z (perciò chimicamente eguali) e
diverso A (perciò con diverso numero di
neutroni nel nucleo). Questi nuclidi di uno
stesso elemento si chiamano isotopi.
(esempio 11H, 21H; oppure 126C, 136C)
Lez 6-10
28
Nucleoni
• Le particelle costituenti il nucleo, in
particolare neutroni e protoni, sono
chiamate in generale nucleoni; i
nucleoni possono essere soggetti a
mutue relazioni:
A>Z
Ogni atomo è caratterizzato dal numero atomico Z
= numero di protoni nel nucleo (e uguale al
numero degli elettroni dell'atomo neutro) e dal
numero di massa A = numero
di nucleoni (protoni
Lez 6-10
29
e neutroni) del nucleo.
Numero atomico e
numero di massa
• Il numero degli elettroni presenti
in un atomo è uguale al numero
dei protoni. Il numero dei protoni
si chiama numero atomico.
•
Il numero dei neutroni presenti in un
atomo è uguale o un po’ superiore al
numero dei protoni. Il numero totale
dei protoni e dei neutroni si chiama
numero di massa.
Lez 6-10
(A), la forza di repulsione
elettrostatica
che
si
stabilisce tra corpi carichi
dello
stesso
segno
renderebbe impossibile la
formazione di un nucleo
costituito
soltanto
di
protoni.
(B),
le
forze
nucleari che interessano
protoni e neutroni rendono
stabile il nucleo.
30
Numero atomico e
numero di massa
Lez 6-10
31
Unità di massa atomica
• Secondo un accordo internazionale, la
massa atomica è la massa di un atomo in
unità di massa atomiche. Un’unità di
massa atomica (uma) è definita come una
massa esattamente uguale ad un
dodicesimo della massa di un atomo di
carbonio-12. Il carbonio-12 è l’isotopo di
carbonio che ha sei protoni e sei neutroni.
Ponendo la massa atomica del carbonio-12
uguale a 12 uma abbiamo lo standard per
misurare la massa atomica di tutti gli altri
elementi.
Lez 6-10
32
uma
uma
Lez 6-10
uma
33
Le dimensioni
dell’atomo
• Il picometro (simbolo pm) è una unità di
misura della lunghezza e vale 10–12 m,
cioè
0,000.000.000.001
m
(un
miliardesimo di millimetro).
• L’unità di massa atomica (abbreviata in
u.m.a.; simbolo u) è una unità di misura
della massa utilizzata in chimica e in
fisica atomica e vale 1,66 × 10–24 g; ciò
significa che un grammo corrisponde a
circa 600.000 miliardi di miliardi di
Lez 6-10
34
u.m.a.
Lez 6-10
35
Riassumendo:
Lez 6-10
36
Il metodo più diretto e accurato
per determinare le masse
atomiche e le masse molecolari è
la spettrometria di massa. In uno
spettrometro di massa, un
campione gassoso è bombardato
da un flusso di elettroni ad alta
•Questi ioni positivi (di massa m e
energia. Le collisioni tra gli
carica e) vengono accelerati
elettroni e gli atomi gassosi (o le
passando attraverso due lastre di
molecole) producono specie
carica opposta. Gli ioni che
cariche positivamente, chiamate
emergono sono deviati da un
magnete in una traiettoria circolare.
ioni, per allontanamento di un
Il raggio della traiettoria dipende
elettrone dagli atomi o dalle
Lez 6-10dal rapporto carica/massa (e/m
37 ).
molecole.
•Moderna tavola periodica. Gli elementi sono sistemati secondo il numero atomico che è
mostrato sopra il simbolo di ogni elemento. Con l’eccezione dell’idrogeno (H), i non metalli
appaiono sulla parte destra superiore della tavola. Le due file di metalli sotto il corpo
principale della tavola sono poste separatamente per evitare di avere una tavola periodica
troppo larga. Il lantanio (57) dovrebbe seguire il bario (56) mentre l’attinio (89) dovrebbe
seguire il radio (88). La notazione 1-18 dei gruppi è stata raccomandata dall’Unione
Lez 6-10
38
Internazionale della Chimica Pura e Applicata
(IUPAC) ma non è ancora di utilizzo generale.
In questo testo, utilizziamo generalmente la notazione dei gruppi (1A-8A e 1B-8B).
Nella moderna Tavola periodica gli elementi sono
sistemati in funzione del loro numero atomico (presente
come apice sul simbolo dell’elemento) in file orizzontali,
chiamati periodi, e in colonne verticali, chiamate gruppi
o famiglie. Elementi nello stesso gruppo tendono ad
avere proprietà fisiche e chimiche simili.
• Gli elementi possono essere catalogati come metalli, non
metalli o metalloidi. Un metallo è un buon conduttore di calore
e di elettricità, mentre un non metallo è di solito un cattivo
conduttore di calore e di elettricità. Un metalloide ha proprietà
intermedie tra quelle dei metalli e dei non metalli.
Alcalini
Alcalino-Ter
Transizione
Lez 6-10
Calcogeni
Alogeni
Gas Nobili
39
Numero atomico e
simbolo degli elementi
Due atomi che hanno diverso numero atomico sono
diversi: questi atomi hanno proprietà chimiche e fisiche
diverse. Noi viviamo respirando ossigeno (Z = 8), ma
moriremmo immediatamente respirando fluoro (Z = 9).
La nostra pelle può stare per decenni a contatto con
l’oro (Z = 79), ma il contatto con il mercurio (Z = 80) è
pericolosissimo. L’oro è solido, il mercurio è liquido. La
variazione, anche di una sola unità, del valore del
numero atomico causa profonde modificazioni nelle
proprietà chimiche, fisiche e biologiche.
H = idrogeno
Na = sodio
Fe = ferro
C = carbonio
O = ossigeno
Nel 1814 il chimico svedese Jöns
Berzelius propose di far corrispondere a
ogni elemento un simbolo chimico,
costituito dalle lettere iniziali del nome
latino dell’elemento.
Lez 6-10
40
Alluminio
Argento
Argo
Arsenico
Azoto
Bario
Bromo
Calcio
Carbonio
Cloro
Cromo
Elio
Ferro
Fluoro
Fosforo
Idrogeno
Iodio
Litio
Magnesio
Manganese
Mercurio
Neon
Nichel
Al
Ag
Ar
As
N
Ba
Br
Ca
C
Cl
Cr
He
Fe
F
P
H
I
Li
Mg
Mn
Hg
Ne
Ni
13
47
18
33
7
56
35
20
6
17
24
2
26
9
15
1
53
3
12
25
80
10
28
Nomi, simboli
e numeri atomici
Oro
Ossigeno
Piombo
Platino
Potassio
Rame
Silicio
Sodio
Stagno
Titanio
Uranio
Xeno
Zinco
Zolfo
Lez 6-10
Au
O
Pb
Pt
K
Cu
Si
Na
Sn
Ti
U
Xe
Zn
S
79
8
82
78
19
29
14
11
50
22
92
54
30
16
41
Formula
empirica e
molecolare
• La formula molecolare è uguale o
multipla rispetto alla formula empirica,
Lez 6-10
42
che è la formula minima
Lez 6-10
43