MODULO 3 - LA MATERIA:
COMPOSIZIONE E TRASFORMAZIONI
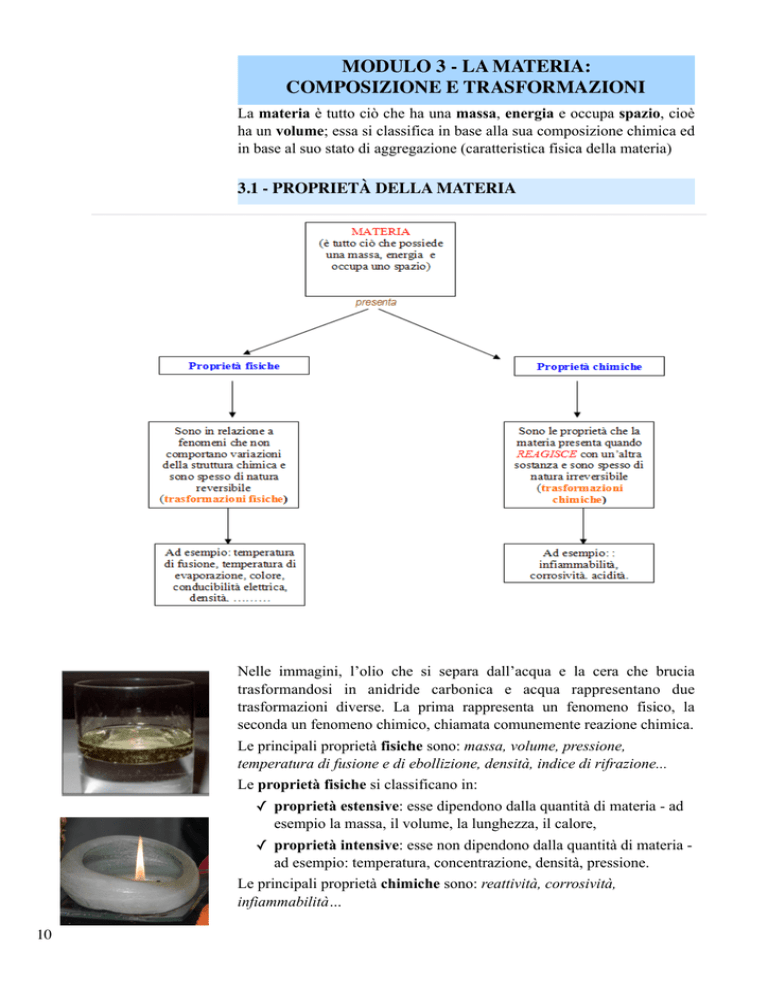
La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè
ha un volume; essa si classifica in base alla sua composizione chimica ed
in base al suo stato di aggregazione (caratteristica fisica della materia)
3.1 - PROPRIETÀ DELLA MATERIA
!
Nelle immagini, l’olio che si separa dall’acqua e la cera che brucia
trasformandosi in anidride carbonica e acqua rappresentano due
trasformazioni diverse. La prima rappresenta un fenomeno fisico, la
seconda un fenomeno chimico, chiamata comunemente reazione chimica.
Le principali proprietà fisiche sono: massa, volume, pressione,
temperatura di fusione e di ebollizione, densità, indice di rifrazione...
Le proprietà fisiche si classificano in:
✓ proprietà estensive: esse dipendono dalla quantità di materia - ad
esempio la massa, il volume, la lunghezza, il calore,
✓ proprietà intensive: esse non dipendono dalla quantità di materia ad esempio: temperatura, concentrazione, densità, pressione.
Le principali proprietà chimiche sono: reattività, corrosività,
infiammabilità…
10
3.2 - LA COMPOSIZIONE DELLA MATERIA
MATERIA
SOSTANZE PURE
MISCUGLI
Sono i singoli componenti
della materia hanno
proprietà proprie ed hanno
una composizione chimica
definita.
Esempi: acqua distillata,
ferro, ossigeno, metano,
glucosio
TRASFORMAZIONI
FISICHE
Sono costituiti da due o
più sostanze.
si classificano in
si classificano in
SOSTANZE
ELEMENTARI
SOSTANZE
COMPOSTE
Costituite da atomi
di un solo
elemento.
Non possono
essere trasformate
in sostanze più
semplici.
Esempi: ferro Fe,
Sodio Na, Zolfo S,
Idrogeno H2,
Ossigeno O2, ...
Costituite da
atomi di due o più
elementi uniti fra
loro. Possono
essere scomposte
in sostanze più
semplici.
Esempi: Cloruro
di sodio NaCl,
acqua distillata
H2O, glucosio
C6H12O6...
TRASFORMAZIONI
CHIMICHE
!
!
MISCUGLI
OMOGENEI
MISCUGLI
ETEROGENEI
(soluzioni)
Sono formati da
una sola fase, le
sostanza non sono
distinguibili.
La trasparenza e la
limpidezza
indicano
l’omogeneità.
Presentano
caratteristiche
uguali in tutti i
punti.
Esempi: acqua del
rubinetto, aria,
benzina, bronzo,
acciaio, vino.
Sono formati da
due o più fasi, le
sostanze sono
distinguibili a
occhio nudo o con
il microscopio.
L’opacità di un
miscuglio è indice
di eterogeneità.
Presentano
caratteristiche
diverse in punti
diversi.
Esempi: acqua e
olio, latte,
maionese, nebbia,
fumo, sabbia.
!
!
11
ESERCIZI
1. Classifica le sostanze qui elencate nelle categorie prima viste. Nella colonna “Osservazioni” indica il motivo
della classificazione.
Sostanza
Elemento Composto
Miscuglio Miscuglio
Omogeneo Eterogeneo
Aria
Rame
Vino
Sabbia
Latte
Azoto
Fumo
Nebbia
Maionese
Olio
Vetro
Acciaio
Bronzo
Argento
Oro
Succo di pera
Birra
Acqua distillata
Ossigeno
Aranciata
Acqua e olio
Plastica
Profumo
Grappa
Acqua di mare
Acqua e sciroppo
Crema cosmetica
Granito
Coca cola chiusa
Sale da cucina
2. Trova nel vocabolario le definizioni appropriate per i seguenti vocaboli:
a. dispersione: ______________________________________________
b. sospensione: ______________________________________________
c. emulsione: _______________________________________________
3. Trova nella tabella i miscugli che possano coincidere con queste descrizioni.
12
Osservazioni
La materia si presenta quasi sempre sotto forma di miscele complesse
di sostanze diverse chiamate miscugli: solo in rari casi si ritrovano
sostanze pure.
3.2.1 - I miscugli
Vi sono due tipi di miscugli:
✓ i miscugli omogenei sono miscele in cui le proprietà chimicofisiche non dipendono dal punto in cui vengono misurate e sono
costituite da una sola fase (N.B. una fase è una porzione di materia
omogenea in ogni sua parte, cioè le cui proprietà chimiche e fisiche
non dipendono dal punto in cui vengono misurate),
✓ i miscugli eterogenei sono miscele in cui è possibile identificare
porzioni aventi proprietà chimico-fisiche diverse.
Il petrolio è un miscuglio
omogeneo di idrocarburi
diversi.
L'acqua e l'olio assieme formano
un miscuglio eterogeneo.
I miscugli possono essere separati nei loro attraverso procedure basate
sulle diverse proprietà fisiche dei costituenti stessi.
3.2.2 - Le sostanze pure
Le sostanze pure, i singoli componenti dei miscugli, vengono a loro volta
classificate in due categorie:
✓ le sostanze elementari sono costituite da atomi dello stesso tipo
cioè dello stesso elemento chimico,
✓ le sostanze composte sono costituite da atomi di tipi diversi, cioè
di almeno due elementi chimici diversi.
Le sostanze composte possono essere ulteriormente separate in sostanze
elementari costituenti attraverso procedimenti chimici.
L’immagine sotto descritta illustra in modo schematico i vari stadi del
processo di separazione dei materiali nei loro componenti. Nella prima
fase, un miscuglio viene suddiviso in sostanze pure mediante metodi
fisici; nella seconda fase le sostanze composte che si ottengono vengono
scomposte in sostanze elementari mediante metodi chimici.
metodi
fisici
Miscugli
omogenei o
eterogenei
metodi
chimici
Sostanze
composte
Sostanze
elementari
13
3.2.3 - Metodi fisici di separazione dei miscugli
Decantazione o sedimentazione
Metodo meccanico di separazione di particelle solide dal liquido in cui
sono sospese, sfruttando la sola forza di gravità. Esso risulta tanto più
efficace quanto maggiore è la densità delle particelle in sospensione
rispetto al liquido che fa da solvente. Un altro parametro che influisce
sulla decantazione è la dimensione delle particelle sospese: più sono
grandi, più rapida ed efficace risulta la decantazione.
Filtrazione
Con l’uso di opportuni filtri è possibile separare particelle solide, più o
meno grandi, da miscugli liquidi e gassosi. Nel caso di miscugli liquidi,
la parte solida resta sopra il filtro, mentre la parte liquida lo attraversa,
per gravità, scendendo verso il basso. I miscugli aeriformi vengono
forzati ad attraversare il filtro: l’aria lo attraversa mentre le polveri
vengono trattenute dal filtro.
Centrifugazione
Tecnica usata quando si è in presenza di particelle solide molto piccole
con densità molto vicina a quella del liquido, oppure quando si ha a che
fare con quantità così piccole di miscuglio da non rendere praticabile la
decantazione o la filtrazione. Si utilizza un apposito strumento che si
chiama centrifuga in cui vengono inserite provette contenenti il miscuglio
da separare. Le provette sono successivamente sottoposte a rotazione
molto rapida: per effetto della forza centrifuga il materiale solido si
deposita sul fondo della provetta.
Estrazione
Se un componente di un miscuglio è solubile in un dato liquido
(solvente), può essere allontanato dal miscuglio. Naturalmente il
successo dell’operazione dipende dalla capacità del solvente di sciogliere
di preferenza il componente del miscuglio che si desidera. Tale capacità è
chiamata selettività o affinità.
14
Cromatografia
La cromatografia è la più versatile fra le tecniche di separazione e
consente di risolvere anche i casi più difficili. Il solvente, che in questo
caso si chiama fase mobile, trasporta i componenti del miscuglio
attraverso una fase fissa. Nella cromatografia su strato sottile, la fase
fissa, costituita da un sottile strato di materiale inerte, come silice o
allumina, è fissato su una lamina di alluminio. La lamina si può ritagliare
nelle dimensioni volute, con le forbici. Una tecnica più antica, ma ancora
utilizzata in campo biochimico, è la cromatografia su carta. La
separazione dei componenti di un miscuglio, deposto sulla lastrina o sulla
carta in forma di macchia, è provocata dalla fase mobile. Il solvente si
muove attraverso la fase fissa per azione capillare. Le diverse sostanze
del miscuglio si muovono a velocità diversa e perciò si separano.
Distillazione
La distillazione è il metodo privilegiato di purificazione dei liquidi e si
basa sulla diversa volatilità dei componenti dei miscugli liquidi. La
volatilità rappresenta la tendenza di un liquido a evaporare ed è più alta
per i liquidi a basso punto di ebollizione. La distillazione riunisce in sé
due passaggi di stato, l’evaporazione e la condensazione. Il primo inizia
nel recipiente in cui la miscela bolle. Il secondo interessa i vapori, che
vengono condensati all’interno dell’apparecchiatura, mediante l’utilizzo
di acqua fredda. Il dispositivo in cui avviene la condensazione si chiama
refrigerante. I vapori di una miscela all’ebollizione sono più ricchi nel
componente che possiede la maggior volatilità. La condensazione di tali
vapori comporta un grado più o meno elevato di purificazione. Nel caso
della distillazione di una soluzione contenente sali disciolti, che in genere
non sono volatili, la separazione dei soluti dal solvente è completa.
15











