1.5
\
TRASFORMAZIONE ISOCORA
Detta anche isovolumica, avviene a volume costante; poco significativa per sistemi aperti, si
può pensare che si verifichi in un sistema chiuso a pareti rigide e indeformabili, quindi la
potremo indicare brevemente con:
dv=O
ovvero con:
v =costante
EQUAZIONE DI TRASFORMAZIONE
Per ricavarla basta separare nella p v = R T i fattori costanti (v, R) da quelli variabili (p, T):
da
pv=RT
p = costante
cioè
si ottiene
o anche
T
dunque la pressione è direttamente proporzionale alla temperatura assoluta, come avevano già
scoperto a fine '700 il fisico Alessandro Volta e il chimico francese Joseph-Louis Gay-Lussac.
La stessa legge si può anche ricavare applicando l’equazione caratteristica dei gas perfetti per
gli stati 1 (iniziale) e 2 (finale):
p1·v1 = R·T1
p2·v2 = R·T2
facendo il rapporto tra le due equazioni sopra scritte e tenendo presente che il volume specifico è
costante si ottiene:
p1
p2
T1
T2
che si può anche scrivere:
p1
T1
p2
T2
RAPPRESENTAZIONE GRAFICA NEI PIANI T E R M O D I DINAMICO p-v ED ENTROPICO T-S
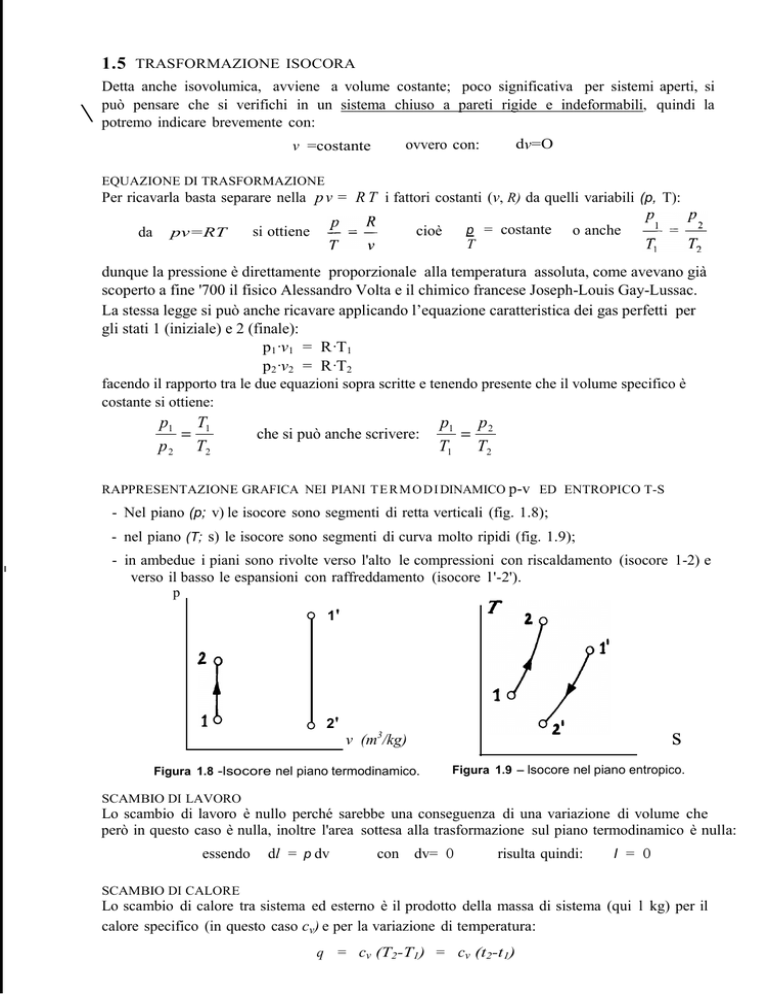
- Nel piano (p; v) le isocore sono segmenti di retta verticali (fig. 1.8);
- nel piano (T; s) le isocore sono segmenti di curva molto ripidi (fig. 1.9);
l
- in ambedue i piani sono rivolte verso l'alto le compressioni con riscaldamento (isocore 1-2) e
verso il basso le espansioni con raffreddamento (isocore l '-2').
p
1'
2'
s
v (m3/kg)
Figura 1.8 -lsocore nel piano termodinamico.
Figura 1.9 - lsocore nel piano entropico.
SCAMBIO DI LAVORO
Lo scambio di lavoro è nullo perché sarebbe una conseguenza di una variazione di volume che
però in questo caso è nulla, inoltre l'area sottesa alla trasformazione sul piano termodinamico è nulla:
essendo
dl = p dv
con
dv= O
risulta quindi:
l = O
SCAMBIO DI CALORE
Lo scambio di calore tra sistema ed esterno è il prodotto della massa di sistema (qui l kg) per il
calore specifico (in questo caso cv) e per la variazione di temperatura:
q = cv (T2-T1) = cv (t2-t1)