BIOPHYSICS RESEARCH srl
ECCITOTOSSICITA’
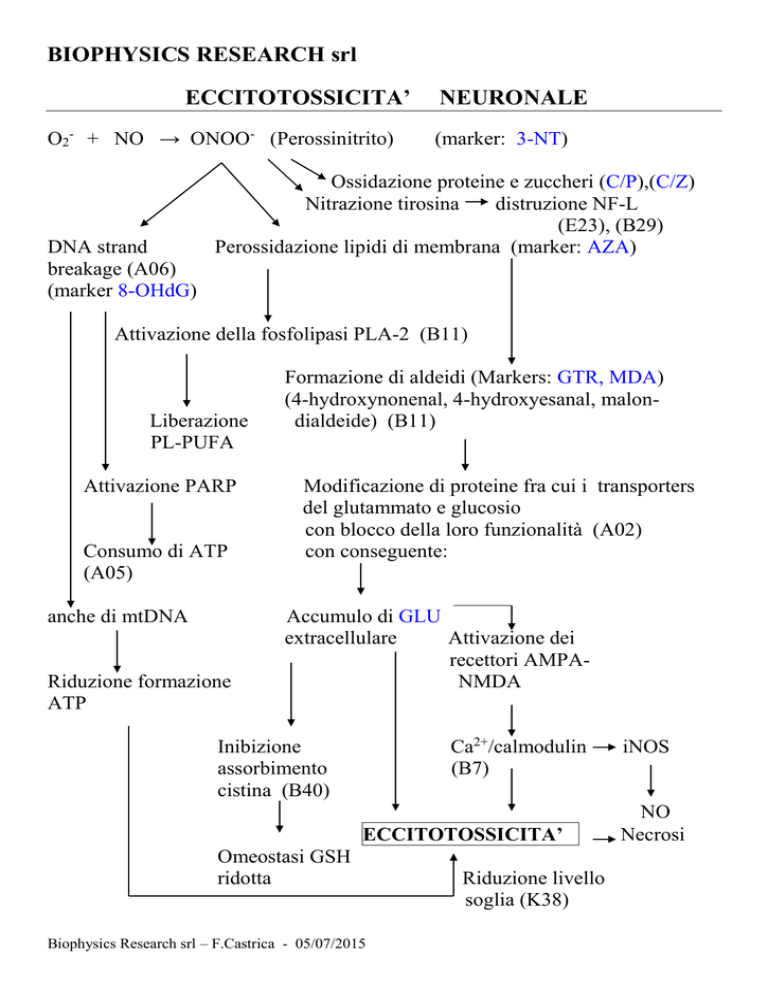
O2- + NO → ONOO- (Perossinitrito)
DNA strand
breakage (A06)
(marker 8-OHdG)
NEURONALE
(marker: 3-NT)
Ossidazione proteine e zuccheri (C/P),(C/Z)
Nitrazione tirosina
distruzione NF-L
(E23), (B29)
Perossidazione lipidi di membrana (marker: AZA)
Attivazione della fosfolipasi PLA-2 (B11)
Liberazione
PL-PUFA
Attivazione PARP
Consumo di ATP
(A05)
anche di mtDNA
Riduzione formazione
ATP
Formazione di aldeidi (Markers: GTR, MDA)
(4-hydroxynonenal, 4-hydroxyesanal, malondialdeide) (B11)
Modificazione di proteine fra cui i transporters
del glutammato e glucosio
con blocco della loro funzionalità (A02)
con conseguente:
Accumulo di GLU
extracellulare
Attivazione dei
recettori AMPANMDA
Ca2+/calmodulin
(B7)
Inibizione
assorbimento
cistina (B40)
ECCITOTOSSICITA’
Omeostasi GSH
ridotta
Biophysics Research srl – F.Castrica - 05/07/2015
Riduzione livello
soglia (K38)
iNOS
NO
Necrosi
BIOPHYSICS RESEARCH srl
CONTRASTO DEI MECCANISMI ECCITOTOSSICI
La prima via per il contrasto dei meccanismi eccitotossici è l’uso di antiossidanti ad integrazione di quelli
naturale già esistenti a livello cellulare, non più in grado di contrastare i processi ossidativi e nitrosilanti in
atto.
Antiossidanti naturali:
Antiossidanti enzimatici:
superossido dismutasi (SOD1, SOD2), glutatione reduttasi (GRx), glutatione perossidasi (GSH-Px), catalasi
(CAT),..........
Sequestratori di metalli di transizione:
ferritina, transferrina, ceruloplasmina, ..........
Antiossidanti non enzimatici lipofili:
ubichinolo (CoQ10H2), ubichinone (CoQ10), Vit. E, β-carotene e carotenoidi, Vit. A, acido diidrolipoico e
lipoico, flavonoidi,.........
Antiossidanti non enzimatici idrofili:
Vit. C, glutatione ridotto (GSH), tioli, albumina, poliamine,..........
Gli integratori da somministrare devono essere usati con oculatezza, rispettando le esigenze da soddisfare:
passaggio della barriera emato-encefalica con buon rendimento ( la Vit. E non passa, così come il GSH,
etc.); assorbimento accertato (l’ubichinone è assorbito solo in presenza di bile, i flavonoidi sono distrutti da
glicossidasi gastroenteriche con formazione di agliconi, anche mutageni); adeguatezza dell’effetto scavenger; adeguatezza della categoria, vita media, possibilità di sovradosaggio senza danni.
Lo studio dei metaboliti tramite la metodica BIO_EXPLORER consente di ottimizzare la terapia antiossidante: la presenza di perossido di idrogeno indica una scarsa attività del GSH-Px, che può spesso essere restaurata somministrando 30 microgr. di Selenio (Se). La fase attuativa del processo apoptotico può essere
contrastata somministrando piccole quantità di magnesio solfato, inibitore della caspase-3. L’attivazione
della proteina riparatrice del DNA PARP, attivata da danni dovuti a radicali ossidrilici (OH.) con un processo spesso suicida per il grande consumo di ATP, può essere inibito con basse dosi di nicotinammide (e.g.
50-70mgr).
Lo stress ossidativo è spesso affiancato da processi anche originariamente ossidativo-dipendenti (es.: la glicosilazione), divenuti nel tempo autonomi, meccanismi infiammatori ed eccitatori dovuti a neurotrasmettitori e neuropeptidi attivati per tempi lunghi
Biophysics Research srl – F.Castrica - 05/07/2015
BIOPHYSICS RESEARCH srl
DANNEGGIAMENTO DEL DNA ED mtDNA
Il DNA ed mtDNA è danneggiato da processi diversi, fra i quali i più importanti sono:
1. ossidazione 8-OHdG
2. infiammazione 5-Clorouracil
Nel caso di ossidazione, il danno è prodotto in maggior parte da radicali ossidrilici (OH.), ma anche da perossinitrito (ONOO-). Il marker di riferimento dell’ossidazione del DNA/mtDNA è l’8-OHdG
I radicali ossidrilici OH. sono generati da reazioni Fenton (Fe + H2O2) o di Haber Weiss (Cu + H2O2) o da
altre reazioni per lo più legate al perossinitrito.
Per evitare danni al DNA/mtDNA, è dunque necessario evitare la formazione di OH. Si tratta quindi di potenziare l’azione dell’enzima GSH-Px (glutatione per ossidasi) che insieme alla CAT (catalasi) trasforma
l’H2O2 in acqua, somministrando Se (selenio) due volte al giorno dopo colazione e cena 50 microgr galenici.
Il perossinitrito è generato dalla reazione fra NO (ossido nitrico) ed O2- (anione superossido). Per ridurne la
formazione è necessario utilizzare antiossidanti che interagiscano con l’ O 2- eliminandolo, ad es. il Pycnogenolo (EUOX – OTI). Altra via che porta indirettamente alla formazione di perossinitrito è la riduzione di
ipoxantina in xantina, ad opera della Xantina Ossidase nel metabolismo delle purine per la produzione finale di acido urico. La XO si trova di norma nel fegato, ma passa nel sangue se il fegato non funziona correttamente.
Il perossinitrito può essere rivelato dal marker 3-NT .
Il perossinitrito porta alla perossidazione dei lipidi di membrana liberati dall’attivazione delle lipasi, a causa
dei processi ossidativi in corso, con conseguente generazione di aldeidi (4-HNE etc., marker GTR , malondialdeide (marker MDA ), etc. Le aldeidi modificano proteine in genere, fra le quali i trasporti del glutammato (marker GLU ), del glucosio, etc, iniziando sequenze di tipo eccitotossico che portano alla distruzione della cellula interessata.
Biophysics Research srl – F.Castrica - 05/07/2015
BIOPHYSICS RESEARCH srl
I FOLATI E L’ECCITOTOSSICITA’
Il principale donatore di metili è la S-adenosil-L-metionina, il cui metabolismo è strettamente correlato a
quello della Vit. B12 e dell’acido folico.
Il processo apoptotico attivato dall’omocisteina segue il seguente ordine: danno del DNA, attivazione della
proteina riparatrice PARP, attivazione dei caspase e della p53, calo del potenziale di membrana dei mitocondri e disintegrazione del nucleo. Inibendo il PARP , si sopprime l’aumento di livello della p53, il calcio
intracellulare, la formazione dei ROS, l’attivazione dei caspase e la riduzione del declino del potenziale di
membrana mitocondriale.
L’omocisteina aumenta in modo marcato la vulnerabilità dei neuroni dell’ippocampo all’eccitotossicità ed al
danno ossidativo.
Il processo apoptotico sopra descritto dovuto agli alti livelli di omocisteina è presente in una vasta gamma di
malattie neurodegenerative, incluso l’Alzheimer.1
I.I. Kruman – Homocysteine elicits a DNA damage response in neurons that promotes apoptosis and hypersensitivity to excitoxicity – The J Neuroscience 2000 20(18): 6920-26
1
Biophysics Research srl – F.Castrica - 05/07/2015












