Corso%di%Laboratorio%di%Energetica,%Anno%accademico%2012/13
Relazione sulle Fuel Cells
Robin%Dallimore%Mallaby%–%Giuseppina%De%Bona%–%Andrea%De%Nigris%–%Fabio%Fabbris%–Aldo
%Tommaso%Grimaldi
Introduzione
Scopo dell’esperimento è verificare ed analizzare il funzionamento diretto e inverso di una cella a
combustibile funzionante con idrogeno e ossigeno prodotte per elettrolisi dell’acqua distillata
mediante un pannello fotovoltaico.
1. Preparazione dell’esperimento
1.1 Strutture e disponibilità
L’esperienza didattica viene effettuata presso l’edificio “laboratori didattici Marzio Falco”. L’intera
struttura ospita diversi laboratori, nel nostro caso abbiamo usufruito dell’aula dedicata alle
esperienze di fisica tecnica, situata al primo piano.
1.2 Installazione Modello
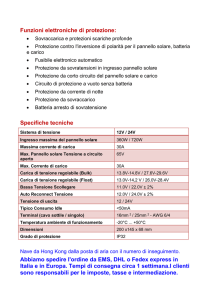
Per effettuare la prova è stato predisposto un circuito composto da:
• un pannello fotovoltaico, che è stato montato su un supporto mobile in grado di ruotare
attorno a un perno, per variare l’incidenza della luce;
• una lampada che simuli i raggi solari;
• due cilindri graduati che contengano l’acqua distillata e successivamente anche l’idrogeno e
l’ossigeno;
• un voltmetro e un amperometro, che ci consentono di rilevare le misure delle grandezze
elettriche in gioco;
• una ventola, azionabile elettricamente, e un LED, che funzionano come carichi fissi;
• un potenziometro, utilizzato come carico regolabile tra 0,3 e 100 Ω;
• tre fuel cell di tipo PEM, di cui una più grande, collegata ai cilindri contenenti l’acqua, atta a
effettuare l’elettrolisi, mentre le altre due, collegate tra loro in parallelo, funzionanti come
generatori;
• un cronometro, utilizzato per scandire i tempi di misurazione.
Le celle che producono energia sono più piccole per cercare di riuscire a mantenere una produzione
dei 2 gas maggiore del loro consumo nel caso di funzionamento contemporaneo della parte di
produzione e di quella di consumo.
Il tutto è montato su un pannello verticale, che contiene i vari elementi e tutti i fori per i
collegamenti elettrici, che vengono effettuati mediante cavi che terminano con le cosiddette
“bananine”. I collegamenti per i fluidi sono invece operati tramite tubicini in plastica.
La rappresentazione di un modello viene riportata in figura alla pagina seguente.
2. Acquisizione dei dati
Preparazione della procedura sperimentale
La prova consiste tre parti, ovvero l’analisi della produzione di corrente elettrica mediante il
pannello fotovoltaico, l’utilizzo della corrente prodotta nel processo di elettrolisi mediante la prima
fuel cell e infine l’utilizzo dei gas prodotti per alimentare le due celle in parallelo per la produzione
di corrente elettrica.
Prima parte: analisi della caratteristica del pannello
Nell’esperimento utilizzeremo il pannello come fonte energetica, quindi vogliamo determinare il
suo funzionamento caratteristico. Per provarlo inizialmente lo colleghiamo alla resistenza più bassa
del potenziometro. Si può notare che il pannello ha bisogno di ricevere un quantitativo minimo di
luce per iniziare a produrre corrente (energia di attivazione). Per vedere quanta potenza ottengo
collego la cella a voltmetro e amperometro, che mi daranno tensione e corrente erogata.
Inoltre a seconda di quanto varia l’intensità luminosa la curva della potenza si sposta. Variando
invece la resistenza del potenziometro riusciamo a disegnare l’andamento della potenza in base al
carico, che per caratteristica intrinseca dei pannelli avrà una forma a campana, presentando quindi
un massimo. È in questo punto che nella pratica comune si cerca di mantenersi poiché la massima
potenza implica anche il massimo rendimento. Generalmente nei pannelli commerciali esiste un
dispositivo che ha il compito di regolare il carico cercando di rimanere attorno alla massima
potenza.
Procediamo quindi alla misura. Utilizziamo una luce che illumina il pannello perpendicolarmente
alla sua superficie, e variamo il carico partendo dal massimo e scendendo fino a 0,3 ohm; ad ogni
passo, una volta arrivati a regime, rileviamo le misure di resistenza, tensione e corrente. Fatto ciò
ruotiamo il pannello, in modo da variare l’incidenza della luce sul pannello, causando una
diminuzione complessiva della potenza prodotta, e ripetiamo le misure.
Seconda parte: produzione di idrogeno e ossigeno
Per poter alimentare le celle destinate alla produzione di energia elettrica abbiamo bisogno di
idrogeno e ossigeno. Dunque ora colleghiamo effettivamente il pannello alla cella elettrolitica, di
modo che possa avvenire la reazione di elettrolisi. L’acqua distillata contenuta nei cilindri è a
contatto con la cella, che quindi risulta impregnata. Innanzitutto, poiché il circuito è collegato
direttamente alle celle utilizzatrici, tappiamo i tubi di collegamento con delle strozzature.
Dopodiché posizioniamo su ciascun cilindro un tappo che è dotato di un condotto che permetta la
risalita dell’acqua in un cilindro secondario grazie alla pressione generata dalla formazione dei gas,
i quali andranno invece ad accumularsi nella parte alta del cilindro principale. Per produrre i gas
utilizziamo una tensione e corrente fissate, che misuriamo mediante voltmetro e amperometro.
Dopo aver atteso la produzione a regime, misuriamo ogni 30 secondi il volume di gas prodotti (in
ml). Questo ci permetterà in seguito di calcolare la portata prodotta di gas. Una volta ottenuta una
quantità sufficiente di prodotti possiamo proseguire con l’ultima fase.
Terza parte: produzione di corrente mediante le fuel cell
A questo punto possiamo andare a valutare separatamente il circuito di produzione di energia
elettrica mediante il consumo degli elementi precedentemente ottenuti. Per prima cosa andiamo a
tappare le uscite della cella per fare in modo che idrogeno e ossigeno vengano consumati quasi
completamente e non escano liberamente in aria; inizialmente però vanno lasciati i tappi aperti per
far sì che i gas possano ripulire i condotti dall’aria e permettere l’avvio del processo. Quindi
far sì che i gas possano ripulire i condotti dall’aria e permettere l’avvio del processo. Quindi
apriamo le due strozzature per consentire ai gas di andare a lambire le pareti delle celle.
Verifichiamo il corretto funzionamento del circuito utilizzando come carico di prova la ventola.
Per rilevare le misure elettriche necessarie colleghiamo, tra la cella e il carico, voltmetro e
amperometro, rispettivamente in parallelo e in serie al carico.
Come prima cosa quindi effettuiamo una serie di misure di tensione e corrente al variare della
resistenza del potenziometro, prestando attenzione al livello di idrogeno e ossigeno: nel caso sia in
esaurimento, è necessario far ripartire il processo di elettrolisi, contemporaneamente alla
generazione di corrente oppure, preferibilmente, scollegando il carico.
Infine passiamo alla rilevazione del consumo dei combustibili; per fare ciò scegliamo una resistenza
costante, di modo che la potenza richiesta sia costante e quindi l’andamento lineare. Nel nostro caso
abbiamo scelto una resistenza di 20 Ω, e abbiamo rilevato nuovamente tensione e corrente, per
avere un riferimento di potenza sviluppata. Quindi l’ultimo passo consiste nel misuriamo ogni 30
secondi il volume di gas consumati (in ml).
3. Riduzione dei dati
3.1 Analisi statistica
In questo caso le rilevazioni sono state effettuate un’unica volta, e non ripetute. Non verrà dunque
utilizzata un’analisi statistica dei dati in quanto priva di significato.
3.2 Equazione di riduzione dei dati
Per l’elaborazione dei dati procederemo passo-passo nelle 3 parti precedentemente descritte; una
formula comune a tutta la trattazione sarà quella della potenza : P = V · I
3.2.1 Caratteristica del pannello
I dati ricavati dalla prova vengono riportati nelle due seguenti tabelle, in cui è già stata calcolata
anche la potenza prodotta; nella prima abbiamo irradiato il pannello con incidenza perpendicolare,
mentre nella seconda il pannello è stato ruotato per ottenere una minore incidenza.
Abbiamo quindi visualizzato su un grafico i due principali parametri elettrici, tensione e corrente.
Come si può notare, diminuendo la quantità di energia luminosa fornita, la curva si sposta verso il
basso. Questo poiché l’area sottesa rappresenta il prodotto V · I, ovvero la potenza sviluppata.
Dal momento che quest’ultima varia a seconda della resistenza collegata, per meglio comprenderne
l’andamento è stato tracciato un secondo grafico in funzione di R.
Risulta più facile ora notare che, come precedentemente detto, la caratteristica del pannello presenta
un massimo che rappresenta anche la massima efficienza del pannello. Nel nostro caso si presenta
per un valore di 3 Ω e 1,065 W.
3.2.2 Produzione di produzione di idrogeno e ossigeno
Per la produzione dei due gas sono stati ricavati i seguenti dati:
Sono state effettuate due prove a diversa potenza erogata dal pannello, ottenuta variando l’incidenza
della luce, per verificare il legame potenza – portata.
Il tempo 0 e il tempo 150 secondi sono usati come riferimenti relativi alla fine del transitorio,
momento in cui abbiamo iniziato a effettuare le misure; riportando tutto in un grafico, otteniamo il
seguente andamento:
L’andamento risulta pressoché lineare, e si verifica anche che il volume di idrogeno prodotto risulta
doppio rispetto a quello di ossigeno; ciò è concorde con il modello teorico della reazione di
elettrolisi:
Poiché possiamo considerare la produzione come lineare, la portata espressa in [ml/s], che può
essere vista come la derivata del volume rispetto al tempo, sarà data semplicemente dal coefficiente
angolare della retta che meglio approssima i nostri dati. Dai calcoli effettuati otteniamo i 2 valori
cercati:
Potenza([W] H2([ml] O2([ml]
1,2264
0,1
0,053333
0,379185 0,05
0,023333
Calcoliamo ora l’efficienza di produzione dei gas; per farlo utilizzeremo la formula dell’efficienza
di Faraday:
Il
lo si calcola mediante l’espressione:
dove:
o I è la corrente utilizzata nella produzione
o I è la corrente utilizzata nella produzione
o t è l’intervallo di tempo considerato
o
è il volume occupato da una mole in condizioni standard (
risulta pari a 22,414 [litri/mole]
o z è il numero di elettroni coinvolti nella reazione, nel nostro caso 2
o F è la carica di una mole di elettroni, che vale 96484 [C/mol]
e
), che
3.2.3 Produzione di corrente mediante le fuel cell
Nella produzione di corrente abbiamo effettuato una prova variando la resistenza del carico
ottenendo i seguenti valori:
Quindi abbiamo tracciato il grafico che rappresenta l’andamento di V in funzione di I
Si può notare
come
l’andamento della curva si possa distinguere in 3 zone distinte: la prima, in cui la tensione crolla
rapidamente dal valore teorico di corto circuito di 1,23 V a causa delle perdite dovute alla necessità
di superare l’energia di attivazione necessaria per far avvenire le reazioni; la seconda in cui la
decrescita è più lenta e quasi lineare, per le perdite generate ralla resistenza interna; l’ultima in cui
si presenta il problema della diffusione che fa crollare verticalmente il valore di tensione.
Valutiamo ora il comportamento della potenza al variare del carico mediante un grafico nel quale le
ascisse, che rappresentano la resistenza, sono in scala logaritmica per meglio rappresentare i passi
tra i valori:
Come si può rilevare, la potenza ha un massimo nella zona intorno ai bassi carichi, in particolare
nel nostro caso per il valore di 1 Ω. È possibile constatare, ricercando questo punto nel grafico
precedente, che esso si trova nella zona centrale, quella con andamento quasi lineare, ma appena
prima del crollo dovuto alla diffusione; questo infatti è il valore di ottimo che generalmente viene
inseguito con varie strategie, per esempio mediante un controllo automatizzato del carico applicato,
proprio perché risulta il miglior compromesso tra la potenza erogata e la stabilità della cella.
Per quanto riguarda i consumi invece, abbiamo ricavato i seguenti dati sperimentali:
Come nella parte precedente, l’andamento quasi lineare della retta ci consente di determinare la
portata, che in questo caso rappresenta il consumo dei due reagenti, come coefficiente angolare
della retta di best-fit; esso risulta negativo, coerentemente col fatto che rappresenta un consumo.
Proviamo dunque a calcolare l’efficienza di utilizzo degli elementi: utilizzeremo il calcolo del
come esposto sopra, utilizzando come valore di tempo il nostro riferimento di t=30 s e la
corrente misurata I=0,336 A. Otteniamo quindi:
Come
considereremo il
medio che risulta di 1,4 ml ogni 30 s.
I valori delle efficienze sono riportati in seguito:
ç(f(= 0,854093
ç(e(= 0,06678
NB: I calcoli vengono riportati nel foglio di calcolo Excel
4. Analisi incertezze
In questo caso non è stato possibile prendere più valori di una stessa misura, di conseguenza non è
stato possibile adoperare un analisi statistica per l’elaborazione dei dati e di conseguenza non
avremo devi valori riguardanti le incertezze delle diverse misure.
5. Considerazioni finali
In seguito alle misure effettuate abbiamo osservato che ad un aumento della corrente dovuto ad una
diminuzione della resistenza del circuito vi è un maggiore consumo di energia e di conseguenza nel
caso della cella a combustibile un maggiore consumo di idrogeno.
Inoltre osserviamo che con l’ossidazione dell’idrogeno si dell’acqua che depositandosi sulla cella
impedisce alla nuova fonte di idrogeno di ossidarsi riducendo il rendimento della cella stessa, man
mano che i reagenti si consumano quando questi vengono a mancare la potenza generata cala
drasticamente fino a raggiungere il valore nullo.
Per quanto riguarda il pannello fotovoltaico invece è stato osservato come l’incidenza della fonte di
energia su di esso influenza l’energia che questo è in grado di fornire.
Il controllo del funzionamento di tutti i componenti tramite il mini-ventilatore è risultato positivo,
pertanto la prova e i dati analizzati sono da considerarsi validi.