LABORATORIO SUGLI OSSIDI BASICI
ESPERIENZA 1: ossido e idrossido di Calcio
Materiale:
Ossido di Calcio in polvere, becher, soluzione di fenolftaleina, cappa. Carta da filtro, imbutino, becher, cannuccia
Procedimento, osservazioni, considerazioni
PRIMA PARTE. Porre una punta di spatola di ossido di calcio (detto anche calce viva) in un becher ed agitare fino
alla formazione di una soluzione lattiginosa. La reazione è fortemente esotermica, per evitare pericolosi schizzi
caustici è meglio lavorare sotto cappa. La reazione che avviene è la seguente:
CaO + 2H2O ----> Ca(OH)2
L'idrossido è riconoscibile aggiungendo alcune gocce di fenolftaleina. CURIOSITA’: la reazione viene usata per
produrre bevande calde in lattina. L’idrossido di calcio viene detto “calce spenta”, componente delle malte e degli
intonaci
2 PARTE. Prendere la soluzione di idrossido di calcio precedentemente formata , di colore fucsia per la presenza di
fenolftalenina in ambiente basico, procedere a filtrazione per togliere torbidità (non sono sicura che questo si possa
fare in tempi brevi!!!!) dovuta all’idrossido di calcio in sospensione, ottenuta una soluzione quasi limpida prendere
una cannuccia e soffiarvi dentro per fare avvenire la seguente reazione (serve a rivelare la presenza di CO2 nell’aria
espirata):
Ca(OH)2 + CO2 CaCO3 + H2O
La soluzione diviene incolore (il fucsia sparisce perché l’idrossido di sodio si trasforma in carbonato di calcio, quindi
diviene progressivamente meno basica) ed anche lattiginosa per la formazione di carbonato di calcio insolubile.
Tuttavia se si continua a soffiare la soluzione torna ad essere trasparente per formazione di bicarbonato di calcio
secondo la seguente reazione
CaCO3 + CO2 + H2OCa(HCO3)2
ESPERIENZA 2: Na in acqua
Materiale:
Sodio metallico, bacinella con acqua, cartina tornasole
Procedimento, osservazioni, considerazioni
Prendere il sodio metallico, fare notare che è conservata sotto petrolio considerata l’elevata reattività del sodio
(ossidazione con ossigeno aria). Fare osservare caratteristiche generali: solido leggero, lucente con riflessi rosa se
appena tagliato, a basso punto di fusione, molle e malleabile. Appartiene al 1 gruppo della tavola periodica, metallo
alcalino con fortissima tendenza all’ossidazione. Mettere una pallina in acqua (mai versare acqua sul sodio, reazione
violenta!) , avviene la seguente reazione:
2 Na + 2 H2O → 2 NaOH + H2
La reazione è fortemente esotermica, è tanto violenta da provocare l'incendio all'aria dell'idrogeno sviluppato,
l’idrogeno che si incendia funzione da “propellente” e la pallina si muove nell’acqua fino a quando tutto il sodio ha
reagito. Infine misurare pH con cartina tornasole. L’idrossido di sodio, soda caustica, è una base forte.
ESPERIENZA 2: ossido e idrossido di Mg
Materiale:
Nastro di magnesio, accendino o bunsen, crogiuolo, cartina tornasole, soluzione di fenolftaleina, acqua
calda e fredda
Procedimento, osservazioni, considerazioni
PRIMA PARTE: Il Mg appartiene al 2° gruppo della tavola periodica (metalli alcalini-terrosi) forte riducente
in quanto si ossida a Mg++, infatti sul nastro può esservi patina d’ossidazione.
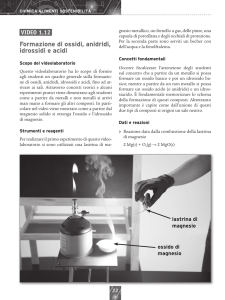
Si prende un pezzo di 20-30 cm di nastro di magnesio e, tenendone un’estremità con la pinza, si avvicina
l’altra estremità alla fiamma. Il Mg si incendia producendo una luce bianca (lampo al magnesio).
La reazione è esotermica perché libera più energia termica di quella consumata per avviarla.
La reazione, una volta avviata, prosegue spontaneamente, perché il calore che essa produce funziona come
energia
di
attivazione
per
il
suo
mantenimento.
Il magnesio, durante la combustione, si combina con l’ossigeno, formando una polvere costituita da ossido
di magnesio MgO, la reazione che avviene è:
2Mg + O2 → 2MgO
Curiosità: il “lampo al magnesio” (l’energia viene liberata in forma di energia luminosa) veniva usato nei
primi flash della macchina fotografica.
Raccogliere l’ossido che si è formato in una provetta, aggiungere acqua e misurare pH con cartina
tornasole. E’ avvenuta la seguente reazione:
MgO+ H20→Mg(OH)2
L’idrossido di magnesio che si è formato è una base, quindi il pH misurato è basico. Curiosità: MgO è noto
anche con il nome di Magnesia ed un antiacido. L’idrossido di magnesio invece ha proprietà lassative.
2 PARTE. Mettere due pezzi di nastro di Mg in due becherini (oppure in due capsule), nel primo aggiungere
100 mL di acqua calda e nel secondo 100 mL di acqua fredda, in entrambe aggiungere 2-3 gocce di
fenolftaleina. Il magnesio è un metallo alcalino terroso e reagisce con l'acqua secondo la reazione
Mg + 4H2O → Mg(OH)2 + H2
Si nota che la reazione avviene in acqua calda perché la maggiore temperatura rende più veloce la reazione,
altrimenti lenta. Dove la reazione avviene si nota lo sviluppo di idrogeno gassoso, contemporaneamente la
soluzione indicatrice vira verso il rosso scarlatto per la progressiva formazione dell’idrossido di magnesio
che è una base.
N.B le esperienze sugli ossidi basici si possono completare facendo vedere il dispositivo di Vera sulle piogge
acide, così si può parlare anche delle anidridi e degli ossoacidi.