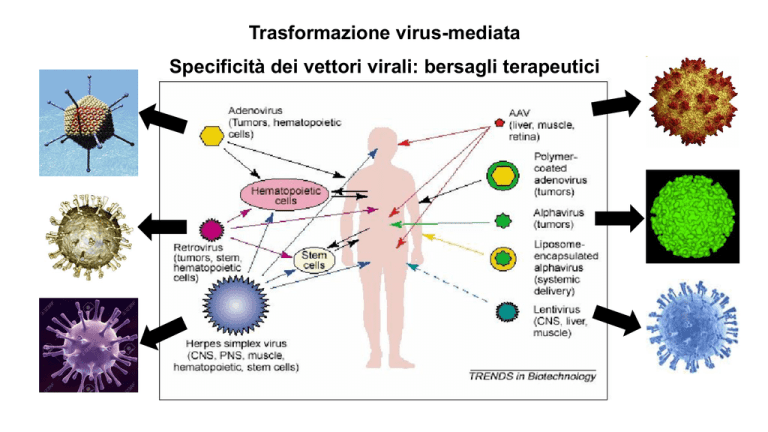
Trasformazione virus-mediata
Specificità dei vettori virali: bersagli terapeutici
Vettori d’espressione in cellule di mammifero: i Retrovirus
2.
3.
4.
5.
Il gene di DNA da clonare viene inserito tra le sequenze LTR 5’ e 3’,
che vengono delete delle sequenze essenziali per la replicazione
virale relative alla TATA box e quelle per il legame dei fattori di
trascrizione cellulari NF-kB e Sp1, creando un vettore autoinattivo
(SIN self-inactivating) per evitare il rischio potenziale di originare una
particella virale infettiva.
Solo le sequenze LTR e Ψ devono essere presenti nel vettore
ricombinante (cis): Ψ, è essenziale per l’impacchettamento delle
proteine dell’involucro virale (envelope), che vengono glicosilate
quando inserite nella membrana della cellula ospite, durante il
processo di gemmazione (senza lisi).
Un promotore virale forte (CMV) o umano (phosphoglycerate kinase,
PGK) deve essere inserito per l’espressione del gene ricombinante.
Il gene ricombinante va a sostituire i geni gag, pol, env.
La maggior parte delle funzioni virali (trans) possono essere fornite da
plasmidi e/o virus helper, difettivi e trasfettati prima nella cellula
ospite.
Plasmide per l’involucro
Plasmide per il packaging
Retrovirus ricombinante
CMV
1.
Vettori d’espressione in cellule di mammifero: i Retrovirus
1.
Ψ
neomicina fosfotransferasi, per
la selezione delle cellule trasfettate
Cellule
bersaglio: non
contenenti i
geni essenziali, 2.
RNA copiato in
DNA e
integrato nel
genoma
Trasfezione
di
cellule
helper
coi
vettori
helper/plasmidici shuttle, contenenti anche i geni
per la trascrittasi inversa e l’integrasi.
Trasfezione di cellule bersaglio per la produzione
delle particelle col retrovirus ricombinante (ad RNA)
Murine Leukemia Viruses
CMV promoter,
per le trascrizione
Gene clonato
Selezione e
purificazione
3.
4.
Trasfezione
coi vettori shuttle
oppure con virus
helper per la
Produzione della
Cellula helper,
trasfettata con un
vettore esprimente i
geni gag, pol, env
Infezione
coi virus helper
Durante l’infezione di cellule bersaglio, il gene
ricombinante si integra nel genoma durante mitosi,
viene espresso dal promotore forte CMV, trascritto e
tradotto nella proteina ricombinante.
Il gene Env, codificante la proteina dell’envelope può
essere
sostituito
per
produrre
glicoproteine
dell’involucro ed originare virus ricombinanti in grado
di infettare altri tipi di cellule bersaglio (la proteina
gp120 è stata sostituita con la glicoproteina G del
virus della vescicolostomatite, aumenta il numero
di linee cellulari che possono essere infettate e facilita
la purificazione dei virioni tramite centrifugazione, in
quanto secreti per gemmazione).
I virus come vettori d’espressione per la terapia genica
Terapia genica: sostituzione del gene alterato (causante la malattia)
con un gene esogeno «sano» per produrre la proteina corretta
La terapia genica ex vivo
1.
2.
3.
Consiste nel prelievo delle cellule della persona interessata,
messe in coltura in laboratorio.
Vengono anche trasfettate con il gene d'interesse, inserito
tramite un apposito vettore (spesso vengono usati vettori
virali).
Successivamente vengono reinfuse o reimpiantate nel corpo
del soggetto.
Tale procedura è sicuramente la più lunga e la più costosa, ma
permette di selezionare ed amplificare le cellule d'interesse ed
inoltre gode d'una maggior efficienza.
È attualmente la modalità più utilizzata ma è riservata solamente
a quei casi in cui sia possibile prelevare, mettere le cellule in
cultura e reinserirle nell'organismo.
Nel 2003, a seguito di una sperimentazione di successo nella quale pazienti
affetti da una rara forma di immunodeficienza severa ereditaria avevano
ricevuto l’infusione autologa di cellule ematopietiche trasdotte con retrovirus
ed erano guariti dalla malattia, 3 pazienti hanno sviluppato però una
leucemia causata dal suo inserimento a monte di un protooncogene
attivandone l’espressione.
i retrovirus
i lentivirus
gli adenovirus
i virus adenoassociati
gli herpesvirus
Vettori d’espressione per la terapia genica: i Lentivirus
I Retrovirus si integrano nel genoma delle cellule bersaglio solo quando la membrana nucleare è
«assente» e di conseguenza solo quando le cellule si replicano (mitosi) possono essere infettate.
È da segnalare, infine, che lo spazio tra le due sequenze LTR consente l'inserzione di un gene di lunghezza
massima di 8 kb
Un problema deriva dalla casualità dell'integrazione del DNA virale (sito d’inserzione), il che può portare alla
disattivazione od attivazione d'alcuni geni con rischio di fenomeni di «mutagenesi inserzionale».
I Lentivirus:
appartengono alla famiglia dei Retrovirus, ma a differenza di questi
possono infettare anche cellule non replicanti, il che li rende dei buoni
candidati per modificare l'espressione delle cellule a differenziazione
terminale, come quelle del cuore o del sistema nervoso centrale, e facilita
anche i processi di trasfezione ex vivo in quanto le cellule in cultura non
hanno bisogno di stimoli per essere indotte a dividersi.
Il DNA (copia dell’RNA virale) ottenuto dalla Trascrittasi Inversa si
complessa con altre proteine virali, formando un complesso che permette il
passaggio attraverso la membrana nucleare. Questo meccanismo,
comunque, non è l'unico esistente, infatti è stata individuata una sequenza
regolatrice polipurinica centrale (cPPT, central polypurinic tract), situata
nel gene della polimerasi, che favorisce la traslocazione nel nucleo della
cellula ospite. Recentemente, inoltre, è stato indicato un residuo di valina
situato in posizione 165 dell'integrasi quale fattore in grado di favorire
l'ingresso nel nucleo in maniera più efficace del cPPT.
Ma anche presentano buon tropismo per linfociti e macrofagi
Vettori d’espressione per la terapia genica: gli adenovirus
Sono virus a DNA lineare a doppio filamento (36 Kb), il genoma
contiene unità essenziali per la replicazione virale (trascrizione precoce).
1. Infettano numerosi tipi differenti di cellule, anche non proliferanti
(neuroni).
2. Non si integrano nel genoma, non c’è rischio di attivazione di
oncogeni o repressione di oncosoppressori
3. Adatti all’inserimento di grandi segmenti di DNA esogeno, stabili. Nei
vettori mancanti dei geni E1a ed E1b, e E3 è possibile inserire 7
Kb, ma non si replicano autonomamente e danno problemi di
ricombinazione quando co-trasfettati con vettori contenenti l’unità
trascrizionale E1. Sviluppati vettori carenti anche delle regioni E2 e
E4, capaci di contenere 10 Kb. Molto conveniente la delezione
E1/E4, perché E4 è responsabile degli effetti immunogeni virali. In
alternativa, il gene E3 può essere tolto e inserito DNA di
riempimento per mantenere le capacità di impaccamento.
4. Adenovirus gutless, possono contenere fono a 37 Kb, ma
necessitano di virus helper per espletare tutte le funzioni, con
conseguente rischio di ricombinazione e infezione.
5. Promettenti per la terapia in vivo, i vaccini così prodotti non danno
effetti collaterali e intolleranza (un decesso per risposta infiammatoria
iperacuta: Marshall 1999).
6. Producono placche di lisi con quantità elevate di virus (1011 unità
formanti placca pfu/ml).
7. Adatti a espressioni transienti
Vettori d’espressione per la terapia genica: i virus adenoassociati (AVV)
1.
Sono virus a DNA lineare a singolo filamento, ne sono stati
descritti 11 sierotipi, in grado di infettare cellule di diversi
tessuti, anche non attivamente proliferanti (fegato e neuroni).
L’80-90% della popolazione risulta essere positiva per i
sierotipi 2 e 3.
2.
L’AAV si integra nel DNA cromosomico in una regione ben
precisa sul cromosoma 19 ed esprime i suoi geni a livelli molto
bassi, infettando la cellula in modo latente.
3.
Solo la successiva co-infezione con un altro virus (adenovirus
o herpesvirus) attiva il loro ciclo litico e produce una gran quantità
di virioni, ciò li rende più controllabili e sicuri in terapia genica,
evitando fenomeni di «mutagenesi inserzionale».
http://cmr.asm.org/content/21/4/583.full.pdf
Vettori d’espressione per la terapia genica: i virus adenoassociati (AVV)
4.
Lo sviluppo di nuovi helper li ha resi idonei alla
produzione di vaccini
5.
Sviluppati vettori senza entrambi i geni cap e rep.
Genoma di piccole dimensioni (5 Kb). Nei primi vettori il
DNA esogeno veniva inserito al posto del gene cap,
mentre la proteina rep interferisce coi promotori
eucarioti ed è responsabile di molti degli effetti tossici.
La delezione di rep, nei vettori rAAV, causa perdita
della specificità di integrazione e aumenta il rischio di
inattivazione inserzionale.
Vettori d’espressione per la terapia genica: i virus adenoassociati (AVV)
6.
Scarsa capienza: le ridotte dimensioni del virione non
permettono l’inserimento di DNA esogeno di lunghezza
superiore alla 4 Kb e questo comporta notevoli limitazioni al
loro utilizzo.
7.
Sviluppo di vettori trans-splicing AAV: co-trasfettando
nella stessa cellula il cDNA clonato in due vettori separati,
contenenti uno la regione 5’ del cDNA e l’altro la regione 3’.
Questo sistema sfrutta la capacità di formare dei
concatenameri AAV testa-coda tramite ricombinazione nei
ITR (inverted terminal repeats). In questo approccio, il
transgene è diviso tra due vettori rAAV contenente
adeguatamente collocato tra i siti di giunzione donatore (SD)
e accettore (SA). La Trascrizione di molecole AAV
ricombinati, seguita al corretto splicing del trascritto mRNA,
produce un prodotto genico funzionale. Questa applicazione
è utile per inserire fino a 9 kb.
Il trans-splicing è stato utilizzato con successo per l'espressione
genica nelle cellule della retina, polmone, e, più recentemente,
muscolo.
Vettori d’espressione per la terapia genica: i virus adenoassociati (AVV)
Gli AAV sono uno strumento promettente per la terapia
genica:
Non scatenano una risposta immunitaria (forse per la
semplicità della struttura del loro capside)
Per la trasduzione di cellule quiescenti del sistema nervoso,
retina, muscolo e fegato ed in studi clinici preliminari
Trattamento di malattie ereditarie: fibrosi cistica, emofilia e
distrofia muscolare
Vettori d’espressione per la terapia genica: gli herpesvirus (HBV e HSV)
1.
2.
3.
4.
Sono virus herpesvirus (EBV) e virus della varicella zoster (HSV),
DNA a doppio filamento, trasmessi asintomaticamente o causano
infezioni lunghe da guarire.
Inserti piuttosto grandi anche di 20 kb.
HSV non è in grado di integrarsi, non è possibile avere
un'espressione a lungo termine dei geni inseriti.
EBV usato come vettore replicativo e HSV usato come vettori di
traduzione, particolarmente adatto alla terapia genica del sistema
nervoso (per la terapia di patologie neurologiche quali il morbo di
Parkinson, di Alzheimer e di Huntington); durante la replicazione litica
HSV viene trasmesso anche attraverso le sinapsi, usato per seguire il
tracciato dei prolungamenti assonali con opportuni geni marcatori.
I virus come vettori d’espressione per la terapia genica
Herpesvirus HSV (61 kb genome)
max 20 kb
I virus come vettori d’espressione per la terapia genica in vivo
La terapia genica in vivo
Viene attuata quando le cellule non possono essere messe in coltura, o prelevate e reimpiantate,
come quelle del cervello o del cuore e della maggior parte degli organi interni; rappresenta un modello
terapeutico con elevate complicanze e di più difficile applicazione. Il gene, viene inserito nell'organismo,
tramite:
1. un opportuno vettore a DNA, plasmidico, repliconi o virale, direttamente per via locale o sistemica.
2. sistemi liposomici: lipoplessi, poliplessi, lipopoliplessi. Questi, si formano attraverso l'interazione
elettrostatica sussistente tra il DNA (carico negativamente) e nanoparticelle (cariche positivamente). Le
nanoparticelle possono essere rispettivamente di tipo lipidiche (liposomi cationici), o polimeriche
(policationi), o un sistema supramolecolare formato da liposomi e policationi. Potenzialmente tutti i tre
tipi di vettori non virali potrebbero sostituire gli attuali vettori a DNA. Possono essere indirizzati su cellule
specifiche.
3. Trasferimento genico di plasmidi ricombinanti liposoma-mediato
Retinoschisi giovanile e dell'amaurosi congenita
Il Prof. David Schaffer dell'Università di Berkley
(Usa), è riuscito a creare virus adenoassociati che
possono essere iniettati nel corpo vitreo tramite
terapia genica in modo non invasivo, che penetrano
nella retina e il loro DNA sarebbe in grado di
integrarsi con quello delle cellule danneggiate,
permettendone il ritorno alla normalità. Dopo i primi
studi effettuati sui topi, dovrebbero iniziare quelli
sugli occhi delle scimmie, prima di avviare la fase di
sperimentazione sull'uomo.
La prima terapia commerciale con virus modificati
On October 16, 2003, Shenzhen SiBiono GenTech (Shenzhen, China), obtained a drug
license from the State Food and Drug Administration of China (SFDA; Beijing, China) for its
recombinant Ad-p53 gene therapy for head and neck squamous cell carcinoma
(HNSCC), a cancer that accounts for about 10% of the 2.5 million annual new cancer
patients in China. Sold under the brand name Gendicine, the world's first commercial gene
therapy uses an adenoviral vector and cost the company more than RMB 80 ($9.6) million
to develop in addition to research grants they received from government.
Principali malattie oggetto di terapia genica
Il primo caso di terapia genica con virus modificati
Una bambina di quattro anni, è diventata il primo paziente per la terapia genica, il 14 settembre 1990 presso il Centro Clinico NIH. Ha un
deficit di adenosina deaminasi (ADA), una malattia genetica, che la lascia indifesa contro le infezioni. I globuli bianchi sono stati presi da
lei, ed nelle sue cellule sono stati inseriti i geni normali per la l’adenosina deaminasi. Le cellule sono state corrette e reiniettate nella
paziente. Dr. W. French Anderson ha contribuito a sviluppare questo studio clinico di riferimento quando lavorava presso il National Heart,
Lung, and Blood Institute.
Clonazione terapeutica e terapia genica ex vivo
Vettori retrovirali e terapia genica
Di recente è stata isolata una nuova fonte di cellule
staminali emopoietiche, rappresentato dalle cellule
CD34+ mobilizzate nel sangue periferico in seguito
alla somministrazione di un antagonista di CXCR4
(AMD3100 o Plerixafor). La caratterizzazione biologica,
molecolare e funzionale di questa nuova fonte di cellule
staminali fornirà dati a supporto del loro potenziale uso
in terapia genica.
In generale, l’insieme di questi studi espanderà le
nostre conoscenze sul programma genetico delle
cellule staminali emopoietiche umane, provenienti da
differenti fonti, fornendo importanti indicazioni su come
modificarle geneticamente, preservandone le innate
caratteristiche.
Trasferimento genico in cellule staminali
Unità SR-Tiget
Giuliana Ferrari, Coordinatrice Attività di Ricerca e Capo
Unità
Vettori retrovirali e terapia genica
Rischio:
• Vettori possono causare
tumorigenicità a lungo
termine (SCID-leucemia)
• mutagenesi inserzionale
Clonazione terapeutica:
trapianto con cellule autologhe












