Relazione di Cosmina Rosu
3^A od IPSIA “E. Fermi” di Verona
AS 2006/2007
Studio dei fattori che influenzano l’equilibrio chimico:
principio di Le Chatelier
Premessa:
In una reazione chimica all’equilibrio la velocità di formazione dei prodotti dai reagenti è
uguale alla velocità di formazione dei reagenti dai prodotti.
Principio di Le Chatelier : è un principio riguardante l’equilibrio chimico secondo il quale
ogni sistema tende a reagire ad una perturbazione impostagli dall‘esterno
minimizzandone gli effetti. Ad esempio, qualsiasi variazione della concentrazione dei
prodotti o dei reagenti viene minimizzata dal sistema, in modo da ripristinare l’equilibrio.
Scopo:
Verificare sperimentalmente la validità del principio di Le Chatelier (aggiunta di prodotti o
reagenti osservando lo spostamento dell‘equilibrio).
Materiale occorrente:
Quattro provette;
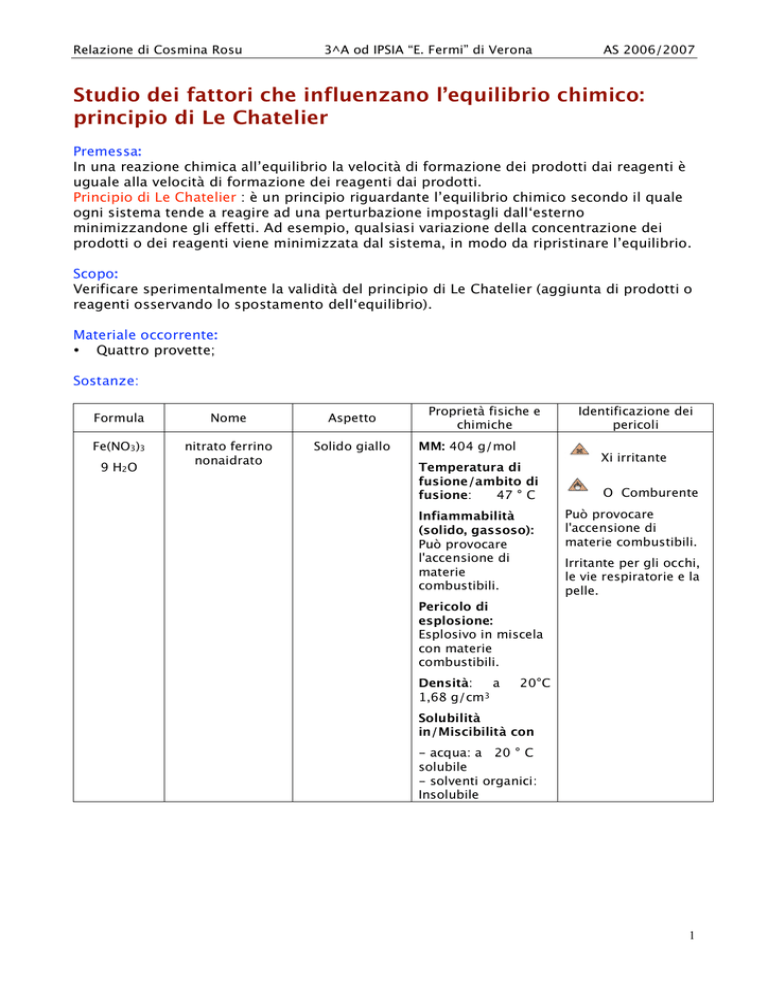
Sostanze:
Formula
Nome
Aspetto
Fe(NO3)3
nitrato ferrino
nonaidrato
Solido giallo
9 H2O
Proprietà fisiche e
chimiche
MM: 404 g/mol
Temperatura di
fusione/ambito di
fusione:
47 ° C
Infiammabilità
(solido, gassoso):
Può provocare
l'accensione di
materie
combustibili.
Identificazione dei
pericoli
Xi irritante
O Comburente
Può provocare
l'accensione di
materie combustibili.
Irritante per gli occhi,
le vie respiratorie e la
pelle.
Pericolo di
esplosione:
Esplosivo in miscela
con materie
combustibili.
Densità:
a
1,68 g/cm3
20°C
Solubilità
in/Miscibilità con
- acqua: a 20 ° C
solubile
- solventi organici:
Insolubile
1
Relazione di Cosmina Rosu
KCNS
Solfocianuro di
potassio
3^A od IPSIA “E. Fermi” di Verona
Cristallino
incolore inodore
MM: 97,18 g/mol
Temperatura di
fusione/ambito di
fusione:
173 ° C
Temperatura di
ebollizione/ambito
di ebollizione: Non
definito.
AS 2006/2007
Xn nocivo
Nocivo per inalazione,
contatto con la pelle e
per ingestione.
A contatto con acidi
libera gas molto
tossico.
Infiammabilità
(solido, gassoso):
Sostanza non
infiammabile.
Pericolo di
esplosione:
Prodotto non
esplosivo.
Densità:
a
1,886 g/cm3
20°C
Solubilità
in/Miscibilità con
- acqua: a 20 ° C
1500 g/l
- solventi organici:
Solubile in alcooli e
in acetone
Na2HPO4
Sodio fosfato
bibasico anidro
Polvere
cristallina
bianca inodore
MM: 141,96 g/mol
Non pericoloso
Temperatura di
fusione/ambito di
fusione:
600 ° C
Infiammabilità
(solido, gassoso):
Sostanza non
infiammabile.
Pericolo di
esplosione:
Prodotto non
esplosivo.
Densità:
20 ° C >1 g/cm3
Solubilità
in/Miscibilità con
- acqua: a 20 ° C
77 g/l
- solventi organici:
Insolubile
2
Relazione di Cosmina Rosu
3^A od IPSIA “E. Fermi” di Verona
AS 2006/2007
Procedimento:
In ognuna delle quattro provette si versa 5 ml della soluzione di Fe(NO3)3 e 5 ml di
KCNS:
3KCNS + Fe(NO3) 3
Come facciamo a stabilire quando e se una reazione è terminata?
- Quando le concentrazioni delle specie presenti sono costanti…….
- Quando i reagenti sono finiti, cioè quando tutti i reagenti si sono
trasformati in prodotti….
3KCNS + Fe(NO3) 3
Fe3+(aq) + 3CNS-(aq) + 3KNO3(aq)
giallo
[FeCNS ]
=
[Fe ] " [CNS ]
2+
K eq
Fe3+(aq) + CNS-(aq) (FeCNS) 2+
rosso sangue
3+
#
Osservazioni:
mL
Fe(NO3)3
mL
KCNS
1
5
5
2
5
5
3
5
5
4
5
5
TE ST
! Altra
aggiunta
Nessuna
aggiunta
Grande
quantità di
Fe(NO3)3
Punta di
spatola di
KCNS solido
Punta di
spatola di
Na2HPO4 solido
Colorazione
Rosso sangue*
Rosso sangue*
(trasparente)
Rosso sangue*
(scurointenso)
Giallo
* La diversa intensità del colore rosso indica la direzione verso cui si è spostato l’equilibrio.
Variare la concentrazione di un composto in una soluzione sposta l’equilibrio laddove si possa
ridurre questo cambiamento di concentrazione.
La prima provetta rimane invariata (riferimento);
Nella seconda provetta si aggiunge una grande quantità di Fe(NO3)3 (REAGENTE)
Nella terza provetta si aggiunge una punta di spatola di KCNS (REAGENTE)
Nella quarta provetta si aggiunge una punta di spatola di Na2HPO4 (questo composto
reagisce con lo ione Fe3+, complessandolo quindi sottraendolo all’equilibrio).
3
Relazione di Cosmina Rosu
3^A od IPSIA “E. Fermi” di Verona
AS 2006/2007
Osservazioni:
1) Nella prima provetta Fe3+ ha reagito con CNS- formando Fe(CNS)2+ che colora di rosso
la soluzione.
2) Nella seconda provetta si era aggiunto Fe(NO3)3: aumentando la quantità del Fe3+
(primo reagente nel sistema), il principio di Le Chatelier prevede la tendenza della
reazione a consumare la sostanza in eccesso, incrementando il prodotto e limitando la
variazione del reagente in eccesso; l’equilibrio si sposta a destra, aumentando il colore
rosso.
3) Nella terza provetta dove si era aggiunto KCNS (il secondo reagente), c’è un
incremento dell’intensità del colore, ma la situazione è analoga a quanto descritto per la
provetta 2: l’equilibrio si sposta a destra, aumentando il colore rosso.
4) Nella quarta provetta il Na2HPO4 agisce da complessante (sostanza che può interagire
con uno ione e può formare un complesso sottraendo il ferro dall’equilibrio). Durante la
reazione la quantità del ferro diminuisce: essendo diminuita la concentrazione di un
reagente (Fe3+) l’equilibrio si sposta a sinistra e il colore giallo della soluzione lo
attesta.
Conclusione:
Il principio di Le Chatelier è stato verificato.
Bibliografia:
F. Tottola, A. Allegrezza, M. Righetti, “Chimica per moduli, guida al laboratorio”, Minerva
Italica
4