POLITECNICO DI MILANO
Scuola di Ingegneria Industriale e dell’Informazione
Corso di Laurea Magistrale in Ingegneria Biomedica
Modellazione ad elementi finiti
del comportamento meccanico passivo
del ventricolo sinistro
Relatore
Prof. Alberto R EDAELLI
Correlatore
Ing. Emiliano VOTTA
Tesi di Laurea di:
Elena B ONINI
matricola 818882
Elisa S TOPPANI
matricola 817229
Anno Accademico
2014 - 2015
Indice
Ringraziamenti
3
Sommario
4
Summary
15
1
Anatomia e fisiopatologia del ventricolo sinistro
27
1.1
Anatomia del cuore . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
27
1.2
Anatomia del ventricolo sinistro . . . . . . . . . . . . . . . . . . . . . . . . .
29
1.3
Struttura del miocardio . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
32
1.4
Ciclo cardiaco
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
37
1.5
Comportamento meccanico del tessuto miocardico . . . . . . . . . . . . . . .
38
2
Stato dell’arte
42
2.1
Modellazione delle proprietà meccaniche passive del miocardio . . . . . . . .
42
2.1.1
Formulazioni . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
45
2.1.2
Modelli . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
48
Modellazione delle proprietà meccaniche attive del miocardio . . . . . . . . .
51
2.2
3
Materiali e Metodi
59
3.1
vumat . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
60
3.1.1
Struttura generale . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
60
3.1.2
Studio preliminare - modello Neo-hookeano . . . . . . . . . . . . . . .
61
1
INDICE
2
3.1.3
4
Modello di Guccione . . . . . . . . . . . . . . . . . . . . . . . . . . .
64
3.2
vuanisohyper_strain . . . . . . . . . . . . . . . . . . . . . . . . . . .
67
3.3
Selezione del tipo di elemento finito . . . . . . . . . . . . . . . . . . . . . . .
70
3.4
Modellazione del comportamento passivo del ventricolo sinistro . . . . . . . .
74
3.4.1
Costruzione della geometria e della mesh . . . . . . . . . . . . . . . .
75
3.4.2
Definizione delle proprietà meccaniche del miocardio . . . . . . . . . .
81
3.4.3
Definizione delle condizioni al contorno . . . . . . . . . . . . . . . . .
81
Risultati e Discussione
82
4.1
Volume intracavitario in funzione della pressione intracavitaria . . . . . . . . .
83
4.2
Deformazioni della parete ventricolare . . . . . . . . . . . . . . . . . . . . . .
88
4.3
Conclusioni e sviluppi futuri . . . . . . . . . . . . . . . . . . . . . . . . . . .
96
Bibliografia
97
Ringraziamenti
Al prof.Emiliano Votta, per i preziosi consigli, l’enorme disponibilità e il suo irrimediabile entusiasmo. Ma soprattutto per averci insegnato a crederci sempre.. “Mai sottovalutare l’uno
percento!”
A Francesco, Matteo, Omar e tutti i dottorandi del “Biomechanics Group”, per averci aiutato a
risolvere i nostri dubbi, rendendo il percorso di questi mesi meno tortuoso.
A tutti i nostri compagni tesisti del CuboLab, per aver condiviso i momenti di gioia e sconforto
di questa avventura
A mamma e papà, perchè senza di loro tutto questo non potrebbe esistere.
3
Sommario
Introduzione
All’interno del corpo umano il cuore è un organo di fondamentale importanza, in quanto si trova
al centro del sistema circolatorio e processa tutto il volume di sangue all’interno di esso. Al
suo interno il cuore è composto da due metà, cuore sinistro e cuore destro, che lavorano come
due pompe in serie e processano il sangue rispettivamente della circolazione sistemico e della
circolazione polmonare. Ogni metà è a propria volta costituita da due camere: un atrio, che
riceve il sangue dalle vene, e un ventricolo, che eietta il sangue nelle arterie. Ogni ventricolo è
separato dall’atrio a monte e dall’arteria a valle rispettivamente da una valvola atrioventricolare
e da una valvola semilunare.
L’azione pompante del cuore, e in particolare dei ventricoli, è consentita dalla struttura del
tessuto muscolare liscio che compone le loro pareti, ovvero il miocardio, il quale è avvolto da
due sottili strati: l’endocardio di natura endoteliale, rivolto verso la cavità interna e l’epicardio,
formato da tessuto connettivo, che si affaccia verso gli organi circostanti.
Il miocardio è organizzato in un sincizio di fibre muscolari, la cui direzione all’interno del tessuto
segue un’organizzazione ben precisa, poste in una matrice extracellulare composta prevalentemente di elastina e collagene e anch’essa organizzata secondo un pattern non casuale (Figura
1).
Sommario
5
Figura 1: Schema della microstruttura del miocardio ventricolare. (a) ventricolo sinistro idealizzato e localizzazione di un volume di controllo a livello dell’equatore del ventricolo; (b) struttura del tessuto in diverse sezioni
lungo lo spessore della parete ventricolare; (c) variazione della direzione delle fibre cardiache in cinque sezioni
di miocardio distribuite a intervalli regolari; (d) organizzazione di fibre muscolari e di collagene della matrice extracellulare che connettono strati adiacenti di tessuto miocardico: è mostrata una terna destrorsa spesso usata per
descrivere il comportamento meccanico del tessuto, in cui f0 indica la direzione delle fibre, s0 la normale alle fibre
nello strato di tessuto e n0 la normale allo strato di tessuto. La stessa terna è ulteriormente schematizzata in (e).
Immagine tratta da Holzapfel, 2009.[20]
Questa microstruttura conferisce al tessuto una risposta meccanica passiva anisotropa, iperelastica e eterogenea alla scala dell’organo (Figura 2), ed una caratteristica contrattile anch’essa
fortemente anisotropa. Tali caratteristiche determinano il complesso modo deformativo cui va
incontro il ventricolo durante la contrazione sistolica, a fronte dell’aumento della pressione del
sangue all’interno della cavità ventricolare.
Sommario
6
Figura 2: Esempio di curve sforzo-deformazione ottenute da diversi protocolli di trazione biassiale su campioni
estratti da singoli strati di tessuto miocardico (piano fs). Le curve si riferiscono alla direzione della fibra miocardica
(ff, pannello a) a alla direzione cross-fibra (direzione ss, pannello b). Eij and Sij sono le component del tensore di
deformazione di Green–Lagrange e del secondo tensore di sforzo di Piola–Kirchhoff. Per ogni direzione considerata
sono mostrati i dati ottenuti da tre protocolli caratterizzati da un rapporto Eff/Ess uguale rispettivamente a 2.05
(triangoli), 1.02 (quadrati) and 0.48 (cerchi). Immagine tratta da Holzapfel, 2009[20]
Le patologie cardiache sono tra le maggiori cause di ospedalizzazione e di morte al mondo;
a titolo di esempio, si stima che solo negli Stati Uniti nel 2011 ci siano state circa 600’000
morti attribuibili a malattie cardiache[31] . Tra queste patologie sono annoverate sia quelle a
carico della parete ventricolare, sia quelle a carico delle valvole cardiache ad esso associate.
L’elevata incidenza a la mortalità di tali patologie motiva una vasta attività di ricerca scientifica a
livello internazionale, che comprende lo sviluppo di modelli biomeccanici al fine di migliorare la
comprensione di scenari patologici e di supportare il miglioramento delle soluzioni terapeutiche.
In questo contesto, presso il Gruppo di Biomeccanica del Dipartimento di Elettronica, Informazione e Bioingeneria è sviluppata da anni un’attività di modellazione agli elementi finiti delle
valvole del ventricolo sinistro, che si vuole estendere alla modellazione congiunta di valvole e
ventricolo per poter analizzare scenari in cui la mutua dipendenza tra le prime e il secondo è un
aspetto cruciale. Il primo passo per raggiungere questo obiettivo è l’implementazione di un modello costitutivo che descriva le proprietà meccaniche del tessuto miocardico, ed in particolare
le sue proprietà passive, avendo cura di implementare un modello che sia agevolmente estendi-
Sommario
7
bile alla descrizione delle proprietà contrattili del miocardio e che sia fruibile tramite il solutore
numerico esplicito usato di norma dal Gruppo di Biomeccanica per la modellazione numerica
di valvole cardiache.
Stato dell’arte
La risposta meccanica passiva di materiali elastici non-lineari ed anisotropi è descrivibile tramite
una funzione energia di deformazione definita positiva U (Strain Energy Function). In termini
molto generici, U dipende dalle deformazioni subite dal materiale e le cui derivate rispetto alle
componenti del tensore di deformazione forniscono le corrispondenti componenti del tensore di
sforzo. Al fine di tener conto in particolare dell’anisotropia, sono disponibili in letteratura due
approcci. Il primo approccio è detto strain based: U dipende dalle componenti del tensore di
Green E = 21 (C − I), dove C è il tensore destro di Cauchy-Green ed è calcolato come C = FT F,
in cui F è la matrice gradiente delle deformazioni, definita come Fi j =
∂ xi
∂ Xj .
In questo caso è
possibile ottenere il tensore di sforzo di Cauchy σ come:
σ =F
∂U T
∂U
− pI = F
F − pI
∂F
∂E
Il secondo approccio è detto invariant based: U dipende degli invarianti e pseudo-invarianti del
tensore C e il tensore σ è ottenibile come:
N
∂ Ii
σ =F ∑
Ui
− pI
∂F
i=1,i6=3
Per ciascuno dei due approcci in letteratura si possono trovare numerosi modelli proposti, tra cui
i due principali sono quello formulato da Guccione e colleghi[15] di tipo strain based, e quello
più recente avanzato da Holzapfel e colleghi[20] , di tipo invariant based.
A partire da Hill già nel 1970[19] , la risposta contrattile del miocardio è stata modellizzata da
Sommario
8
diversi autori riferendosi ai meccanismi che avvengono a livello cellulare nel miocardio, ispirandosi a modelli già esistenti a proposito del muscolo scheletrico. A questi lavori si è ispirato
Guccione nel 1993[16, 14] per completare il modello passivo presentato in precedenza, ricavando
una componente di sforzo da sommare direttamente a quello ottenuto dalla risposta passiva in
direzione delle fibre:
0 0 0
σa = 0 σ 0
0 0 0
σtot = σ p + σa
in cui σ viene calcolata a seconda dei modelli presentati.
Lavori molto più recenti trattano invece la problematica della contrazione attiva del cuore da un
punto di vista più globale, non più focalizzando l’attenzione su fenomeni che avvengono non
più alla scala cellulare, ma alla scala dell’organo. In questo caso, la forza attiva del muscolo
cardiaco non è governata solamente dalle proprietà passive del miocardio, ma dipende anche e
principalmente dall’elestanza attiva del ventricolo che agisce attraverso il ciclo cardiaco. Esempi
di questi lavori sono quelli di Zhong[50] e Hassaballah[18] .
Per lo sviluppo di questo lavoro di tesi si è scelto il modello di Guccione, principalmente per
la possibilità di estendere il modello costitutivo passivo alla risposta attiva. Tale modello è
caratterizzato dalla seguente forma di U:
i
Ch Q
e −1
U=
2
in cui
2
2
2
2
2
2
2
2
2
+ ĒFR
+ ĒFC
+ ĒCF
+ ĒCR
+ ĒRC
+b4 ĒRF
Q = 2b1 (ĒRR + ĒFF + ĒCC )+b2 ĒFF
+b3 ĒCC
+ ĒRR
Dove i pedici F, C, R indicano rispettivamente le direzioni delle fibre, cross-fibre e del piano
perpendicolare al piano contenente le prime due.
Sommario
9
Materiali e Metodi
Le analisi a elementi finiti sono state condotte mediante il solutore esplicito Abaqus/Explicit
(SIMULIA, Dassault Systèms). Il modello costitutivo di Guccione non è presente nella libreria
di materiali del solutore; è stato quindi necessario creare una subroutine esterna in linguaggio
Fortran che gestisse le equazioni che governano il modello. Per questo scopo, esistono due
tipi diversi di subroutine: vumat, di carattere più generale, che consente di definire un qualsiasi tipo di legame e prevede la gestione autonoma del calcolo delle componenti di sforzo, e
vuanisohyper_strain, che come suggerito dal nome, è rivolta nello specifico a materiali
iperelastici che prevedono una formulazione di tipo strain based della funzione energia di deformazione, ed è strutturata in modo tale che l’utente debba preoccuparsi della definizione delle
sole derivate della SEF rispetto alle componenti della matrice Ē (per la quota a parte deviatorica dello sforzo) e rispetto al determinante della matrice F, J = det (F) (per quanto riguarda la
componente volumetrica).
Ciascuna delle sue subroutine presenta punti di forza e criticità, motivo per cui per la scelta
della funzione da utilizzare sono state condotte una serie di prove preliminari in condizioni
estremamente semplificate:
• implementazione della subroutine vumat per un materiale neo-hookeano, già definito
nella libreria Abaqus, e impostazioni di semplici prove di trazione e shear su un cubetto
monoelemento 1x1x1 mm3 a fini puramente comparativi;
• implementazione della subroutine vumat per il modello di Guccione e test preliminari
analoghi al precedente neo-hookeano, e successive prove su geometrie più complesse;
• implementazione della subroutine vuanisohyper_strain per il modello di Guccione, semplici test su monoelemento esaedrico 1x1x1 mm3 e analisi della mesh e della
topologia degli elementi su geometria cilindrica caricata in pressione con andamento a
rampa.
Queste prove hanno messo in luce alcune criticità della vumat implementata nel caso di geometrie complesse e nel caso di grandi rotazioni e hanno indirizzato la scelta verso la subroutine di
Sommario
10
tipo vuanisohyper_strain. Utilizzando quest’ultima è stata condotta una serie di test preliminari simulando la pressurizzazione di cilindri cavi discretizzati con mesh di calcolo diverse
tra loro per risoluzione spaziale e tipo di elementi utilizzati; questi test hanno portato a scegliere
gli esaedri lineari come gli elementi che consentivano il miglior compromesso tra contenimento
dell’onere computazionale e accuratezza dei risultati.
A valle di questa attività preliminare, si è applicato il modello costitutivo implementato alla
simulazione di un esperimento in vitro condotto da McCulloch e colleghi su ventricoli sinistri
canini[30] , in cui i il ventricolo era vincolato alla propria base e pressurizzato passivamente.
A tale scopo, è stato implementato e discretizzato un modello 3D di ventricolo sinistro umano.
La geometria è stata ricostruita a partire da immagini risonanza magnetica cardiaca acquisite
con sequenze CINE in asse corto su un paziente affetto da dilatazione ventricolare, ed è stato
implementato, a partire da codice pre-esistente, uno script in Matlab® (MathWorksTM Inc.,
Natick, MA, United States) che i) importa e filtra i punti ottenuti dal tracciamento di endocario
ed epicardio sulle immagini, ii) chiama esternamente il software CAD Gambit® 2.4.6 (Ansys
Inc., Canonsburg, PA, USA) per generare il modello 3D della parete comprensivo di apice,
suddividendolo automaticamente in 8 regioni, secondo quanto riportato da Hassaballah (Figura
3) e in 8 strati concentrici nello spessore della parete, e iii) discretizza il modello geometrico
con una mesh strutturata di esaedri lineari con una risoluzione spaziale impostata dall’utente.
Al fine di condurre un’analisi di sensitività, sono state realizzate tre mesh, aventi dimensione
caratteristica degli elementi pari rispettivamente a 1.6, 0.8 e 0.4 mm (Figura 4).
Sommario
11
Figura 3: Suddivisione della geometria simil-ventricolare proposta da Hassaballah e colleghi[18] Ciascuna zona
presenta uno specifica variazione delle fibre in direzione transmurale.
L’orientamento delle fibre negli 8 strati di ciascuna regione è stato definito come proposto da
Hassaballah[18] . I parametri costitutivi sono stati definiti come da Guccione nel lavoro del
1993[16, 14] : C = 0.876 kPa, b1 = 0.0, b2 = 18.48, b3 = 3.58, b4 = 1.627. Poiché Abaqus/Explicit
non consente di assumere la perfetta incomprimibilità del materiale quando si usano elementi
finiti solidi, è stato assunto un bulk modulus K = 0.2 MPa.
Figura 4: Progressivo infittimento della mesh. La dimensione caratteristica degli elementi è rispettivamente di
1.6, 0.8, 0.4 mm.
Per simulare le condizioni sperimentali da simulare, i nodi della mesh situati alla base del ventricolo sono stati incastrati ed è stata imposta sulla superficie endocardica una pressione uniforme
crescente linearmente nel tempo, in un intervallo di 0.8 s, da 0 a 5 kPa.
Sommario
12
Risultati e conclusioni
L’andamento del volume intracavitario durante l’inflazione passiva simulata e la corrispondente
curva pressione-volume sono mostrati in Figura 5 per le tre mesh utilizzate; appare evidente che
migliorare la risoluzione spaziale oltre a quella intermedia (0.8 mm) non porta a variazioni di
questi risultati. Ai fini del confronto con i dati sperimentali da letteratura è interessante il fatto
che le curve pressione-volume siano approssimate molto bene (R2 = 0.987) da una polinomiale
di terzo grado, così come nel lavoro di McCulloch[30] . Tuttavia, il volume iniziale del ventricolo modellizzato e dei ventricoli testati in [30] è radicalmente diverso; ai fini di un confronto
in termini non solo di andamento delle curve, ma anche di valori assoluti, è stata ricavata le
curve pressione-variazione percentuale di volume ottenuta dalla simulazione (ΔV%), ed è stata
confrontata con la curva omologa ottenuta normalizzando le variazioni di volume riportate da
McCulloch per un volume iniziale di 40 ml, ovvero il valore medio dei campioni usati negli
esperimenti (Figura 6). Dal confronto di questi dati emerge che complessivamente il ventricolo
modellizzato, se discretizzato con mesh sufficientemente risolute, è più compliante dei ventricoli
canini testati negli esperimenti di McCulloch e colleghi. Ciò potrebbe essere dovuto a differenze
inter-specie nelle proprietà meccaniche del miocardio, al fatto che nel ventricolo dilatato usato
nella simulazione lo spessore di parete è ridotto in proporzione alle dimensioni della cavità ventricolare, o al fatto che nel modello computazionale il ventricolo sinistro è isolato, mentre negli
esperimenti di McCulloch e colleghi tutte le strutture del cuore destro erano preservato e ragionevolmente costituivano un vincolo all’espansione libera di parte della parete del ventricolo
sinistro.
Sommario
13
Figura 5: (a) Volume intracavitario nel tempo; i dati sono approssimati con una curva logaritmica; (b) Grafici
pressione-volume, approssimati con curve polinomiali di terzo grado, ottenute per i tre diversi gradi di infittimento
mesh. In legenda è riportata la lunghezza caratteristica dell’elemento della mesh.
Figura 6: (a) curva pressione-ΔV% ottenuta dalla simulazione per tre diversi gradi di infittimento della mesh a
confronto con la curva pressione-ΔV% ottenuta dalla Figura 5b ottenuta dalla da [30] normalizzando le variazioni
di volume intracavitario per il valor medio dei volumi intracavitari iniziali misurati da McCulloch e colleghi[30] .
Il confronto con i dati sperimentali è stato approfondito analizzando le deformazioni del miocardio misurate in corrispondenza della superficie epicardica al variare di ΔV%. I valori delle
deformazioni sono stati estratti in zona anteriore e posteriore, in tre diverse regioni della parete:
una basale, una media e una verso l’apice. In Figura 7 sono riportati i dati per la zona anteriore
media a titolo di esempio: la dipendenza delle deformazioni da ΔV% ottenuta dalla simulazione
ricalca quella osservata sperimentalmente. Tuttavia, coerentemente con la maggiore compliance
Sommario
14
del ventricolo modellizzato, i valori massimi di deformazione e di ΔV% forniti dal modello
sono nettamente superiori rispetto ai dati corrispondenti ottenuti negli esperimenti.
Figura 7: Confronti tra le deformazioni alla parete epicardica nelle direzioni della fibra ( f f ), cross-fibra (ss)
e attraverso lo spessore della parete (rr), ottenute dall’analisi computazionale simulando con la mesh al maggior
grado di infittimento, e registrate sperimentalmente su ventricoli canini da McCulloch[30] , in funzione di ΔV%.
I risultati ottenuti, pur con i limiti descritti sin qui, sono incoraggianti. Nonostante le possibili
differenze inter-specie in termini di proprietà meccaniche del miocardio e nonostante l’utilizzo
di un modello geometrico di ventricolo ricostruito da immagini di un paziente affetto da dilatazione, la simulazione di un esperimento di pressurizzazione passiva del ventricolo sinistro ha
colto sia in termini qualitativi, sia in termini quantitativi diversi aspetti dell’evidenza sperimentale. Ciò spinge a sviluppare ulteriormente l’attività qui presentata, in particolare nella direzione
di una validazione ancor più robusta del modello di meccanica passiva del miocardio ventricolare, nella direzione dell’estensione del modello costitutivo alla risposta attiva del tessuto e verso
l’integrazione tra modelli di ventricolo e modelli di valvole in continuità con esso.
Summary
Introduction
The heart is the pivotal organ of the cardio circulatory system, and processes the entire blood
volume flowing in it. It is composed by two halves, i.e. the right and left heart, which work
as two pumps in series, and pump blood into the systemic and pulmonary circulation, respectively. Each of the two halves consists of two chambers: an atrium, which receives blood from
veins, and a ventricle, which pumps blood into the arteries. Each ventricle is separated from the
corresponding atrium by an atrioventricular valve and from the corresponding large artery by a
semilunar valve.
The pumping action of the heart, and in particular of the ventricles, is allowed for by the structure
of the myocardium, i.e. the smooth muscle of the cardiac wall, which is surrounded by two thin
layers: the endocardium, which has an endothelial composition and faces the internal cavity, and
the epicardium, made of connective tissue, which faces the surrounding apparatuses.
The myocardium is organized as a syncytium of myofibers; these are oriented within the tissue
following a well-defined pattern, and are immersed in an extracellular matrix mainly composed
of elastin and collagen, again organized into a non-random network (Figure 8).
15
Summary
16
Figura 8: Schematic diagram of: (a) the left ventricle and a cutout from the equator; (b) the structure through
the thickness from the epicardium to the endocardium; (c) five longitudinal–circumferential sections at regular
intervals from 10 to 90 per cent of the wall thickness from the epicardium showing the transmural variation of
layer orientation; (d) the layered organization of myocytes and the collagen fibers between the sheets referred to a
right-handed orthonormal coordinate system with fiber axis f0, sheet axis s0 and sheet-normal axis n0; this same
local reference frame is further schematized in (e). Original figure in Holzapfel and Ogden, 2009[20] .
The microstructure gives to the tissue a passive anisotropic behavior, hyperelastic and heterogeneous at the scale of the organ (Figure 9), and also an anisotropic contractile characteristic. These properties determine the complex deformations of the ventricle during systolic contraction,
when blood pressure in the ventricular cavity increases.
Cardiac diseases are one of the major causes of hospitalization and death all over the world.
For example, just in the US in 2011 600 000 deaths due to cardiac pathologies have been estimated (Mozaffarian D et al. 2015[31] ). These pathologies included the ventricular and valvular
derangements. The high incidence and mortality of these kind of pathologies motivates the
Summary
17
widespread and deep international scientific research on the topic, which involves also the development of biomechanical models to gain insight into pathological scenarios and to support the
improvement of therapeutic solutions.
In this context, the Biomechanics Group of the Electronics, Information and Bioengineering
Department has been exploiting finite element modelling to analyze the two valves connected to
the left ventricle: the mitral and aortic valve. This activity should be extended to the integrated
analysis of these valves and the surrounding ventricle, so to be able to model those scenarios
characterized by a tight functional interaction between the formers and the latter. The first step
towards this goal is the implementation of a constitutive model to describe mechanical properties
of myocardium. In particular, the passive stress-strain behavior of the tissue is the first aspect to
be modeled, possibly accounting for i) the possibility to easily extend the model to include the
contractile properties of the tissue taking care to foresee its implement something which would
be easily combined with the contractile activity, and ii) for the need to use an explicit solver to
handle the numerical simulation of heart valves together with the ventricle.
Summary
18
Figura 9: Representative stress–strain data for three different loading protocols for biaxial loading in the fs plane
of canine left ventricle myocardium: (a) stress Sff against strain Eff in the fiber direction; (b) stress Sss against strain
Ess in the sheet (cross-fiber) direction. Note that Eij and Sij are the components of the Green–Lagrange strain
tensor and the second Piola–Kirchhoff stress tensor, respectively. The three sets of data correspond to constant
strain ratios Eff /Ess equal to 2.05 (triangles), 1.02 (squares) and 0.48 (circles). ). Original figure in Holzapfel and
Ogden, 2009[20] .
State of art
The passive mechanical behavior of nonlinear and anisotropic elastic materials is usually described by a positive defined Strain Energy Function U. In general terms, U depends on deformations of the material, and its derivatives with respect to the components of the deformation
tensor give the corresponding components of the stress tensor. To account for anisotropy in particular, two main formulations are adopted in literature. The first formulation is referred to as
strain-based; W depends on the components of the Green tensor E = 12 (C − I), where C is the
right Cauchy-Green tensor and is computed as C = FT F , where F is the deformation gradient
matrix, defined as Fi j =
∂ xi
∂ Xj .
In this case the Cauchy stress tensor can be calculated with the
Summary
19
following expression
σ =F
∂U
∂U T
− pI = F
F − pI
∂F
∂E
The second approach is called invariant-based; U depends on invariants and pseudo-invariants
of C, and σ can be obtained as
N
∂ Ii
σ =F ∑
Ui
− pI
∂F
i=1,i6=3
For both formulations, many models can be found in literature, proposed by a large number of
authors. The main ones are the Guccione model[15] , which is strain-based, and the more recent
Holzapfel-Ogden model[20] , which is invariant-based.
The contractile response of the myocardium was modeled by many authors, since the seminal
work by Hill in 1970[19] , based on to the mechanisms which take place in cardiomyocites during
the cardiac cycle, usually borrowing pre-existing models about scheletric muscle. Guccione
adopted this approach Guccione in 1993[16, 14] ; he expressed σv directly as the sum of a passive
component σ p and an active component σa
0 0 0
σa = 0 σ 0
0 0 0
σtot = σ p + σa
In which σ is computed in different ways depending on the considered model.
More recent studies adopt a different approach, and focus not on cellular phenomena, but rather
on features at the organ scale. In this case, the active force of the cardiac muscle is not influenced
just by the passive properties of the myocardium, but also by the active elastance of the ventricle
throughout the cardiac cycle. Examples of these studies are Zhong[50] and Hassaballah[18] .
In the work herein reported we exploited the Guccione model, mainly because of the possibility
to extend it to the modeling of the active properties of the myocardium with a reasonable effort.
Summary
20
This model is characterized by the following form of U
i
Ch Q
e −1
U=
2
where
2
2
2
2
2
2
2
2
2
Q = 2b1 (ĒRR + ĒFF + ĒCC )+b2 ĒFF
+b3 ĒCC
+ ĒRR
+ ĒCR
+ ĒRC
+b4 ĒRF
+ ĒFR
+ ĒFC
+ ĒCF
In which the indexes F, C, R indicate the direction of the fiber, the cross-fiber direction in a
myocardial layer, and the normal to the layer, respectively.
Material and Methods
Finite element analyses were run with the explicit solver Abaqus/Explicit (SIMULIA, Dassault
Systèms). The Guccione’s constitutive law is not included in the solver’s material library, hence
an external subroutine implementing the governing equations of the model had to be written in
Fortran language. To this aim, two different kind of subroutine can be used: vumat, which
is the most general method to define any sort of material mechanical properties and requires
the explicit computation of the stress components; and vuanisohyper_strain, which is
specifically conceived for describing the mechanical response of hyperelastic materials through
a strain based approach, and requires only the definition of the derivatives of the Strain Energy
Function with respect to the components of the Green Tensor Ē (for the deviatoric part of the
stress) and with respect to J, which is the determinant of F matrix (for the volumetric part).
Both subroutines have pros and cons; hence, some simple preliminary tests were run to choose
the one most suitable to implementing the Guccione model:
• Implementation of the subroutine vumat for a neo-hookean material, already defined in
Abaqus, and preparation of simple uniaxial tension and shear tests on a single hexahedral
element with dimensions 1x1x1 mm3 , just to have a simple model to identify critical issues
(e.g. syntax) of the subroutines and to test results vs. simple analytical solutions.
Summary
21
• Implementation of the subroutine vumat for the Guccione model, and application in the
same tests performed when using the neo-hookean model, as well as tests involving simple
hollow cylinders and more complex geometries;
• Implementation of the subroutine vuanisohyper_strain for the Guccione model,
same simple tests on hexahedral element of dimensions 1x1x1 mm3 , as well as tests involving simple hollow cylinders and more complex geometries.
These preliminary tests highlighted some critical aspects in the vumat subroutine when running
simulations on idealized geometries and using a non-cartesian reference framework to describe
the tissue mechanical properties. The vuanisohyper_strain subroutine was hence adopted, and applied on a subsequent series of tests aimed at identifying the most suitable element type and size for the present work. The pressurization of a hollow cylinder was simulated with different meshes, characterized by different element types and different spatial resolutions. Results
from this second series of preliminary simulations suggested that linear hexahedral elements
allowed for the best trade-off between computational efficiency and accuracy of the results.
Following these preliminary tests, the constitutive model was finally used in the simulation of
an actual in vitro test, led by McCulloch and colleagues on canine hearts[30] , in which the left
ventricle was inflated passively while being constrained with respect to motions at the ventricular
base.
To this aim, we implemented a 3D model of a human left ventricle. The geometry was reconstructed from cine-magnetic resonance images (MRI) acquired in short axis mode on a patient
affected by ventricular dilation. Starting from a pre-existing code, we implemented a script in
Matlab® (MathWorksTM Inc., Natick, MA, United States), which: i) imports the points obtained from the segmentation of epicardium and endocardium on the images; ii) calls the CAD
software Gambit® 2.4.6 (Ansys Inc., Canonsburg, PA, USA) as a batch process to generate the
3D model of the ventricular wall, dividing it automatically into 4 regions (as in Figure 10, taken
from Hassaballah’s work[18] , wheree the geometry was divided into 8 regions) and 8 concentric layers through the wall thickness; iii) discretizes the ventricular wall into linear hexahedral
Summary
22
elements, with a spatial resolution set by the user. We created three different meshes, with a
characteristic dimension of 1.6, 0.8 and 0.4 mm, respectively (Figure 11).
The orientation of cardiac fibers in each of 8 layers through the wall was defined as proposed by
Hassaballah and co-workers[18] . The constitutive parameters were defined as by Guccione and
colleagues[16, 14] : C = 0.876 kPa, b1 = 0.0, b2 = 18.48, b3 = 3.58, b4 = 1.627. A bulk modulus
of K = 0.2 MPa was defined, since Abaqus Explicit does not handle incompressibility for 3D
finite elements.
Figura 10: Subdivision of similar-ventricular geometry proposed by Hassaballah and colleagues. Each region
has a specific transmural gradient.
To replicate the experimental conditions to be simulated, translations of the nodes belonging to
the ventricular base were prevented from, and a uniform pressure linearly increasing from 0 to
5 kPa over a 0.8 s timeframe was applied on the endocardial surface.
Summary
23
Figura 11: Tightening of the mesh. Characteristic dimension of the element is respectively 1.6, 0.8, and 0.4 mm
Results and conclusion
The overall behavior of the ventricle yielded by the simulation was first quantified in terms of
time-dependent intracavitary volume and pressure-volume response for each of the three different meshes (Figure 12). These results show that improving the mesh spatial resolution beyond
0.8 mm did not change the global response of the ventricle. Also, and interestingly, the pressurevolume response of the modeled ventricle is fitted extremely well by a cubic polynomial function
(R2 = 0.987), as in [30].
Figura 12: a) Internal volume on the cavity versus time, fitted by logarithmic curves; (b) Passive left ventricular
pressure-volume relation, fitted with cubic polynomial curves, for different characteristic dimension of the element,
respectively 1.6, 0.8, and 0.4 mm.
Summary
24
However, the initial volume in the modeled ventricle, which, as already mentioned, is a human
dilated ventricle, is much larger than the initial volume of the canine ventricles used in the in
vitro tests. In order to compare our computational results vs. in vitro data from canine ventricles we hence used the percentage intracavitary volume change (ΔV%) instead of the simple
volume change. To do so, the volume changes reported by McCulloch[30] were normalized by
the mean initial volume therein reported, i.e. 40 ml. Resulting curves are depicted in Figure
13 and show that, if discretized with a sufficient spatial resolution, the ventricle finite element
model is notably more compliant than real canine ventricles tested in [30]. This result could be
due to several results, including i) possible differences in terms of passive mechanical properties between canine and human tissue, ii) the low thickness to inner radius ratio of the dilated
ventricular geometry used in the numerical analysis, and iii) the fact that in our finite element
model the ventricle is isolated, while in the in vitro tests ventricles are part of intact hearts, and
thus the structures of the right heart may limit the expansion of the left ventricular chamber.
The comparison vs. the experimental results by McColluch and co-workers[30] was further detailed by analyzing local strains computed on the anterior and posterior epicardial surface of the
ventricular wall, at three locations for each side: base, equator, and apex. Strain values were
plotted against ΔV% and compared to their experimental counterpart, as exemplified in Figure 14 for the anterior equatorial region. Results clearly show that the experimentally observed
dependency of local strains on ΔV% is closely replicated by the finite element model. Yet, but
consistently with the greater compliance of the human ventricle model as compared to real canine ventricles, the peak strain and ΔV% values computed by the numerical model are much
larger than the corresponding values measured in vitro.
Summary
25
Figura 13: Comparison between the pressure- ΔV% curve computed by finite element simulations with the three
different meshes (colored dots) vs. the experimental curve (black line) obtained by normalizing volume change
data reported in Figure 12 in [30] by 40 ml.
Despite the aforementioned limitations, results yielded by the numerical results are encouraging.
In spite of the possible inter-species differences in terms of tissue mechanical properties, and of
the use of 3D model of the left ventricle derived from clinical images of a patient with ventricular dilation, several experimentally verified key features of ventricular passive mechanics
were correctly captured. This outcome motivates future developments of the work, in particular towards three activities: a more robust validation of the implemented constitutive model of
passive myocardium, the extension of the constitutive model so to account also for the active
contraction of the tissue, and the integration of ventricular models with valvular models.
Summary
26
Figura 14: Comparison between deformation at epicardial wall obtained in fiber direction ( f f ), cross-fiber direction (ss), and through the thickness of the wall (rr) in the experimental analysis on canine ventricles[30] and in the
simulation (results from the thickest mesh), plotted against the normalized volumes.
Capitolo 1
Anatomia e fisiopatologia del ventricolo
sinistro
1.1
Anatomia del cuore
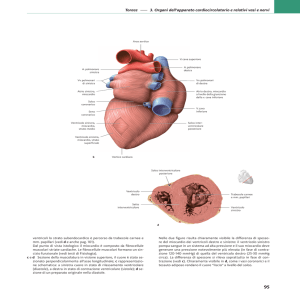
Il cuore è il principale organo del sistema cardiocircolatorio: la sua funzione è pompare sangue
nei distretti corporei. Situato all’interno della cavità toracica tra i due polmoni, è protetto anteriormente dallo sterno e posteriormente dalle cartilagini costali delle vertebre cardiache. E’
avvolto dal pericardio, un sacco fibrosieroso che lo isola dagli organi circostanti e al contempo
lo fissa al diaframma, un muscolo che separa la cavità toracica da quella addominale (Figura
1.1).
27
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
28
Figura 1.1: Posizione del cuore all’interno del torace. Sono evidenziati gli organi e le strutture circostanti.
Il cuore ha una forma di cono appiattito in senso anteroposteriore. L’asse maggiore del cuore,
detto diametro longitudinale, è mediamente lungo 13 cm in un individuo adulto e collega il centro
della base del cuore con l’apice cardiaco; è inclinato di circa 45° rispetto all’asse longitudinale
del corpo, posto su una linea immaginaria tesa tra spalla destra e ipocondrio sinistro. Il diametro
trasversale è perpendicolare al precedente, è calcolato a livello della base e misura mediamente
10 cm (Figura 1.2)
Figura 1.2: Dimensioni caratteristiche del cuore, visto secondo i piani anatomici trasversale e sagittale. In verde
è evidenziata la parete epicardica, in rosso quella endocardica.
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
29
Al proprio interno il cuore è suddiviso quattro cavità: due posterosuperiori, gli atri, e due anteroinferiori, i ventricoli, rispettivamente destri e sinistri. Atri e ventricoli sono separati rispettivamente dai setti interatriale e interventricolare. Gli atri ricevono il sangue di ritorno al cuore
dai vasi venosi, lo trasferiscono alle camere inferiori, i ventricoli, i quali generano la pressione
necessaria a spingere la massa sanguigna verso i vasi arteriosi. Il cuore destro riceve il sangue
deossigenato dalle vene cave e lo pompa ai polmoni attraverso le arterie polmonari; qui avvengono gli scambi gassosi tra vasi e polmoni e il sangue nuovamente ossigenato prosegue il suo
percorso fino al cuore sinistro, immesso attraverso le vene polmonari (le uniche vene del corpo
umano che contengono sangue ossigenato). Passato dall’atrio al ventricolo sinistro, è pompato
da quest’ultimo in aorta (l’arteria principale) e distribuito all’intero circolo sistemico: si crea
così un circuito il cui centro pompante è costituito non da una, bensì da due pompe separate e
poste in serie.
La sequenza di fenomeni appena descritta si ripete in modo ciclico, 60-70 volte al minuto in un
soggetto adulto a riposo. In ogni ciclo cardiaco l’azione pompante delle camere ventricolari è
espletata grazie alla contrazione ritmica ed autonoma del miocardio che costituisce la parete del
cuore, spessa 5 − 6 cm. Come spiegato nei paragrafi a seguire, infatti, il miocardio ha una composizione principalmente muscolare, si contrae e si rilassa rispettivamente nelle fasi di sistole di
diastole, ovvero le due fasi che si alternano nel singolo ciclo cardiaco.
Si noti che il cuore è anch’esso un organo appartenente al circolo sistemico: in prossimità dell’origine dell’aorta si diramano le arterie coronariche, il cui compito è quello di rifornire il muscolo
cardiaco di ossigeno e nutrienti e raccogliere sia le sostanze di rifiuto che l’anidride carbonica
da esso generate. Questi vasi di piccolo calibro irrorano la parete esterna del cuore e sfociano
direttamente in atrio destro.
1.2
[2] I
Anatomia del ventricolo sinistro
ventricoli del cuore, destro e sinistro, sono separati dal setto interventricolare e presentano
delle caratteristiche strutturali comuni. Come già accennato, la loro forma è grossolanamente
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
30
conica, con una geometria della sezione trasversale del cono che è diversa nei due ventricoli.
Nel sinistro, in particolare, tale sezione è approssimativamente circolare (Figura 1.3).
Figura 1.3: Sezione trasversale dei ventricoli, in cui è evidente la diversa forma della sezione dei due ventricoli.
Nel ventricolo sinistro in particolare tale sezione è pressoché circolare.
La base del cono corrisponde al piano valvolare, così che ogni ventricolo ha in corrispondenza
della propria base due orifizi valvolari. L’orifizio posteriore è quello della valvola atrioventricolare che separa il ventricolo dall’atrio corrispondente, ovvero la valvola tricuspide nel ventricolo
destro e la valvola mitrale nel sinistro. In un soggetto adulto in condizioni fisiologiche, la valvola
mitrale ha un orifizio schematizzabile in prima approssimazione come un’ellisse, il cui perimetro è di 7 − 10 cm. L’orifizio anteriore invece separa il ventricolo dalla relativa arteria di efflusso
e corrisponde alla valvola polmonare nel ventricolo destro e alla valvola aortica nel sinistro. Entrambe queste valvole hanno un orifizio quasi circolare e la valvola aortica in particolare ha un
perimetro di circa 7 cm in un soggetto adulto in condizioni fisiologiche.
La zona di ventricolo prospicente l’orifizio atrioventricolare è detta porzione di afflusso, perché
riceve il sangue dall’atrio durante la diastole ventricolare; quella affacciata sull’orifizio arterioso
è invece la porzione di efflusso, deputata a sospingere il sangue verso la rispettiva arteria durante la sistole ventricolare, ed è caratterizzata da una parete liscia, priva delle trabecole carnee che
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
31
caratterizzano gran parte delle altre regioni della parete ventricolare (Figura 1.4). Le trabecole
sono fasci di miocardio, per convenzione classificati in tre categorie o ordini: le trabecole del
3° ordine aderiscono interamente alla parete del ventricolo, quelle di 2° ordine sono fissate solamente alle estremità e libere di muoversi nel tratto centrale, e infine le trabecole del 1° ordine,
dette muscoli papillari, hanno un’unica porzione vincolata, mentre la restante è proiettata all’interno della cavità ventricolare. Dalle estremità libere dei muscoli papillari originano le corde
tendinee, dei sottili tendini costituiti da tessuto fibroso denso che si ancorano all’estremità inferiore dei lembi delle valvole atrioventricolari, fornendo un sistema di ancoraggio per le valvole
e generando, attraverso le valvole atrioventricolari stesse, una continuità anatomica e meccanica
tra miocardio e tessuto fibroso del piano valvolare. Le trabecole carnee hanno massimo sviluppo
nella zona centrale e apicale dei ventricoli, che prende il nome di porzione trabecolata (Figura
1.4).
Figura 1.4: Sezione longitudinale del ventricolo sinistro, in cui sono visibili la valvola mitrale e la valvola aortica,
con i relativi tratti di afflusso (in verde) ed efflusso (in azzurro) all’interno del ventricolo. Sono inoltre visibili le
strutture trabecolari, tra cui i muscoli papillari.
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
1.3
[38] La
32
Struttura del miocardio
parete cardiaca è costituita da tre strati: il più esterno, formato da tessuto connettivo, è
detto epicardio; quello più interno, di natura endoteliale, è detto endocardio; lo strato intermedio
invece, formato da tessuto muscolare cardiaco, è la vera e propria struttura funzionale del cuore
ed è detto miocardio (Figura 1.5).
Figura 1.5: Struttura stratificata della parete ventricolare.
Le cellule miocardiche, dette anche cardiomiociti, sono cellule muscolari striate: così come nel
muscolo scheletrico, la striatura è dovuta alla presenza dei filamenti di actina e miosina, che
vanno a costituire le unità contrattili delle cellule muscolari, dette sarcomeri. Il cuore riesce a
svolgere la sua funzione di pompa grazie ad un processo ritmico di contrazione e distensione del
muscolo cardiaco, che permette rispettivamente di aumentare e diminuire la pressione all’interno della camere, agevolando il movimento del sangue. Il meccanismo di contrazione è simile a
quanto accade per il muscolo scheletrico, ma ci sono delle significative differenze. Innanzitutto i
cardiomiociti sono cellule mononucleate e le fibre muscolari non sono separate, parallele tra loro
e libere di contrarsi selettivamente, bensì collegate tra loro da giunzioni comunicanti, a formare
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
33
una complessa rete tridimensionale supportata da una matrice di tessuto connettivo interstiziale,
che permette alla struttura cardiaca di agire e funzionare come un sincizio. Un’altra sostanziale
differenza risiede nel fatto che nel cuore il meccanismo di eccitazione è intrinseco: esiste una
componente muscolare, il nodo seno-atriale, situato nella parte anteriore della giunzione dell’atrio destro con la vena cava superiore, che funge da “pace-maker naturale”, generando un
segnale di eccitazione che viene trasmesso dagli atri ai ventricoli sino all’apice del cuore, dando
origine alla fase sistolica. Le cellule del miocardio abbondano di mitocondri e sono perfuse da
una fitta rete di capillari; questo è essenziale perché per sostenere le frequenze di contrazione
cardiaca (circa 70 battiti al minuto per un individuo adulto sano) necessitano di un gran quantitativo di ossigeno, che è utilizzato per convertire ATP in ADP e liberare l’energia necessaria alla
contrazione (Figura 1.6).
Figura 1.6: Fibre del muscolo cardiaco. In figura sono evidenziate la continuità tra le cellule del muscolo
cardiaco, a formare un unico sincizio, e la presenza massiccia di mitocondri.
Il muscolo ventricolare è notevolmente più spesso del muscolo atriale e, in particolare, il ventricolo sinistro ha una parete più spessa del destro, con uno spessore medio di 9 − 10 mm (contro i
soli 3 mm di spessore per il ventricolo destro), che tende ad assottigliarsi avvicinandosi all’apice.
Ciò è dovuto al fatto che, mentre il cuore destro pompa sangue diretto ai soli polmoni, il cuore
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
34
sinistro deve sviluppare pressioni maggiori, in modo tale che il sangue possa raggiungere gli
organi più periferici del corpo.
Nello spessore del miocardio si può osservare una continua e ben ordinata distribuzione angolare dell’orientamento delle miofibre, che può essere descritta interamente da due angoli di
proiezione (Figura 1.7):
• Angolo d’elica β : è definito nel piano circonferenziale-longitudinale e aumenta linearmente attraverso lo spessore lungo la coordinata radiale, dal valore più negativo all’epicardio al più positivo all’endocardio. Il range di apertura del ventaglio di fibre non è
costante, ma varia a seconda regione anatomica del ventricolo. Immaginando di suddividere la parete ventricolare come mostrato in Figura 1.8, Rohmer e colleghi nel 2006[39]
hanno condotto uno studio sulla distribuzione dell’angolo β per ogni regione individuata,
ottenendo i risultati riportati in Tabella 1.1.
• Angolo trasverso η: è definito nel piano radiale-circonferenziale e varia linearmente lungo
l’asse longitudinale del ventricolo, da un valore di circa -15 ° alla base a uno di 15 °
all’apice. (Kerckhoffs 2003[25] )
Settale
Anteriore
Laterale
Posteriore
Basale
−60° ÷ 40°
−40° ÷ 60°
−20° ÷ 50°
−20° ÷ 60
Apicale
−50° ÷ 40°
−20° ÷ 60
−20° ÷ 50°
−20° ÷ 60
Tabella 1.1: Variazione dell’angolo d’elica delle fibre β attraverso le 8 regioni individuate da Rohmer nella parete
del miocardio. La variazione è lineare attraverso lo spessore della parete, da un angolo negativo all’epicardio ad
uno positivo all’endocardio.
La contrazione attiva delle fibre, in virtù di questa particolare disposizione, determina l’accorciamento miocardico longitudinale e circonferenziale, l’ispessimento della parete e la torsione
data dalla rotazione contrapposta di apice e base (Figura 1.9).
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
35
Figura 1.7: I tre strati della parete ventricolare: epicardio, endocardio e miocardio. L’architettura del miocardio è
caratterizzata da fibre di collagene organizzate lungo una direzione principale. Quest’ultima è descritta localmente
dall’angolo d’elica β e dall’angolo trasverso η.
Figura 1.8: 8 regioni individuate nella parete del ventricolo sinistro per definire l’apertura del ventaglio di fibre
da endocardio a epicardio secondo diversi range di angolo β .
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
36
Figura 1.9: a) Diagramma di Wiggers del ciclo cardiaco. Mette in evidenza gli eventi del cuore sinistro: sono
mostrati gli andamenti temporali delle pressioni aortica, ventricolare e atriale, la variazione volumetrica della cavità
del ventricolo sinistro, l’elettrocardiogramma e i rumori cardiaci. b) Lunghezza fibre subendocardiche e subepicardiche. c) Deformazioni longitudinali di ciascuna regione del miocardio. d) Rotazione apicale e basale e torsione
del ventricolo. Le curve sono riferite al singolo ciclo cardiaco suddiviso nelle 5 fasi descritte nel Paragrafo 1.4.
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
37
1.4
Ciclo cardiaco
[2, 13] Il
ciclo cardiaco è l’insieme degli eventi legati al flusso del sangue che avvengono nel
cuore nel lasso di tempo di un battito cardiaco; sono comprese entrambe le fasi di contrazione e rilasciamento ventricolare, che prendono il nome rispettivamente di sistole e diastole. La
contrazione cardiaca ha origine in un’area localizzata nell’atrio destro, detta nodo seno-atriale,
costituita dalle cosiddette cellule pacemaker, le quali danno origine a un’onda di depolarizzazione che si propaga da atri a ventricoli, seguendo precise vie di conduzione presenti nel miocardio
fino a raggiungere tutte le fibre miocardiche, che costituiscono un sincizio funzionale.
Anche gli atri possiedono periodi di sistole atriale e diastole atriale, ma date le maggiori pressioni in gioco ed essendo i ventricoli i diretti responsabili dell’eiezione del sangue nelle arterie
polmonare e aorta, con i termini sistole e diastole si fa solitamente riferimento agli avvenimenti
che accadono nei soli ventricoli.
A metà della fase diastolica, atri e ventricoli sono completamente rilasciati; inizia da questa fase
la descrizione del ciclo cardiaco (Figura 1.9):
1. Fase di riempimento ventricolare
Il sangue ritorna al cuore dalle vene sistemiche e polmonari, che seppur abbiano basse
pressioni, sono sufficienti a garantire il ritorno venoso. Entra così nelle cavità atriali e
passa attraverso le valvole AV all’interno dei ventricoli. A fine diastole, corrispondente
alla fine della fase 1, gli atri si contraggono spingendo tutto il sangue residuo all’interno
dei ventricoli. Durante tutta questa fase di riempimento ventricolare, la valvola polmonare
e quella aortica sono chiuse perché la pressione del ventricolo è troppo bassa e inferiore a
quelle vigenti nei rispettivi vasi.
2. Fase della contrazione isovolumetrica
Inizia la sistole e i ventricoli iniziano a contrarre la loro parete, generando un aumento di
pressione al loro interno. Quando questa pressione supera quella atriale le valvole AV si
chiudono, ma anche le semilunari sono ancora chiuse. Il volume di sangue rimane perciò
costante, ma la contrazione ventricolare continua ad aumentare la pressione generata su
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
38
di esso, finché raggiunge valori sufficienti a forzare l’apertura delle valvole polmonare e
aortica.
3. Fase dell’eiezione ventricolare
Con l’apertura delle valvole semilunari, il sangue può lasciare i ventricoli e andare ad
irrorare i circoli polmonare e sistemico. La pressione ventricolare, dopo aver raggiunto il
picco massimo, inizia a diminuire: quando è nuovamente inferiore al valore di pressione
presente nell’arteria uscente dal ventricolo, la valvola semilunare si chiude, dando origine
alla diastole. Non tutto il volume contenuto nel ventricolo è eiettato, ma ne resta una
quantità residua pari a circa il 30-40%.
4. Fase di rilasciamento isovolumetrico
A inizio della diastole successiva, nei ventricoli è presente ancora un po’ di sangue in
pressione, perché la tensione ventricolare richiede tempo per tornare a zero. Tuttavia questa pressione è troppo bassa per aprire le valvole semilunari e troppo alta per permettere
l’apertura delle atrioventricolari. Essendo tutte le valvole chiuse, i rilasciamento avviene
a volume costante. Quando la P nel ventricolo diventa sufficientemente bassa, si aprono
le valvole AV e ricomincia la fase 1.
La frequenza cardiaca a riposo è normalmente 72 battiti al minuto e i tempi di sistole e diastole
non sono uguali: 65% del tempo del ciclo cardiaco, quindi circa 0.5 s, è speso per la fase diastolica, per garantire il riempimento di sangue e la giusta efficienza della pompa, mentre i restanti
0.3 s sono necessari a compiere la fase sistolica.
1.5
Comportamento meccanico del tessuto miocardico
[38] Il tessuto miocardico a riposo ha una risposta sforzo-deformazione passiva di tipo anisotropo,
disomogeneo, incomprimibile e viscoelastico, che presenta cioè un ciclo di isteresi sotto carichi
ripetuti nel tempo.
Il miocardio è un tessuto muscolare e in quanto tale possiede delle unità contrattili, dette sarcomeri. La loro contrazione attiva si traduce in un cambiamento della risposta sforzo-deformazione
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
39
del tessuto rispetto a quella puramente passiva (Figura 1.10). Ovviamente, la componente attiva
della risposta meccanica del tessuto è anch’essa fortemente anisotropa, in virtù dell’organizzazione spaziale delle fibre cardiache illustrata nel Paragrafo 1.3.
Figura 1.10: Studio condotto sui muscoli papillari nel 1965 da Sonnenblick[42] . a) Relazione tensione lunghezza.
E’ mostrata la caratteristica attiva, quella passive e la totale risultante. b) Relazione velocità di accorciamento delle
fibre-forza.
Inoltre, essa dipende dalla lunghezza di precarico della fibra cardiaca, secondo la legge tensionelunghezza che prende il nome di legge di Frank-Starling, per la quale il volume eiettato dal
ventricolo è fortemente dipendente dal volume di fine diastole e questo determina il fenomeno
intrinseco di autoregolazione del cuore (Figura 1.11).
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
40
Figura 1.11: Legge di Frank-Starling del cuore. Esiste una lunghezza ottimale del sarcomero in corrispondenza
della quale la tensione esercitata determina il massimo volume di eiezione. Se il volume di fine diastole è eccessivo,
le fibre son stirate e non consentono più un’eiezione efficiente, scompensando il ventricolo.
Infatti, i sarcomeri che costituiscono le miofibre possiedono una lunghezza ottimale in cui sviluppano il massimo della tensione; con l’aumento del volume ventricolare di fine diastole si
verifica uno stiramento delle fibre che determina una maggior capacità di contrazione all’aumentare dell’entità di stiramento, quindi una maggior efficienza di eiezione del sangue in aorta. Ciò
avviene purché la lunghezza dei sarcomeri non superi una lunghezza critica, perché altrimenti
il cuore si scompensa e si riduce la sua capacità contrattile. In vivo e in condizioni fisiologiche, ciò è garantito dalla caratteristica forza-allungamento delle fibre che garantisce la massima
prestazione del muscolo cardiaco: essendo fortemente non lineare (Figura 1.12), permette il
riempimento a bassi volumi ventricolari senza consistenti aumenti di pressione, svolgendo così
un ruolo cruciale nella risposta meccanica complessiva del tessuto.
Se il muscolo scheletrico presenta un range di overlap ottimale per lo sviluppo di tensione dei
miofilamenti di circa 1.5 − 2.2 µm, nel muscolo cardiaco proprio per evitare lo scompenso la
lunghezza media a cui si mantengono i sarcomeri, anche in virtù di eccessivi stretch, è di circa
2.3 µm.
CAPITOLO 1. ANATOMIA E FISIOPATOLOGIA DEL VENTRICOLO SINISTRO
41
Figura 1.12: Relazione tensione-lunghezza per il muscolo cardiaco. Sono mostrati i valori per un cuore canino.
Capitolo 2
Stato dell’arte
2.1
Modellazione delle proprietà meccaniche passive del miocardio
Il tessuto miocardico ha un comportamento meccanico passivo di tipo iperelastico, come la
maggior parte dei tessuti biologici soggetti a grandi deformazioni, non omogeneo, incomprimibile e anisotropo, perché la risposta alle sollecitazioni meccaniche è fortemente dipendente
dalla direzionalità delle fibre miocardiche. Sebbene sia un materiale caratterizzato anche da
un comportamento viscoelastico, questo aspetto non è rilevante per la modellazione meccanica, in quanto il tempo richiesto per compiere un ciclo cardiaco è molto inferiore rispetto al
tempo di rilassamento della risposta viscoelastica. La viscoelasticità del muscolo cardiaco passivo è stata caratterizzata con prove di creep e relaxation condotte su muscoli papillari di gatti
e conigli[35, 37] . In entrambe le specie si è osservato un rilassamento dello stato di sforzo del
30 − 40% nei primi 10 s. Le curve di rilassamento mostrano che la risposta, a parità di deformazione imposta, non dipende dall’ordine di grandezza della costante di tempo: ciò supporta
l’ipotesi che la viscoelasticità del tessuto miocardico sia quasi lineare. Nella risposta di tipo
creep risulta invece che, imponendo carichi isotonici, dopo circa 100 s la lunghezza originale
varia solamente del 2 − 3%.
La parete del ventricolo sinistro è composta da strati di miociti paralleli, che sono il tipo di
42
CAPITOLO 2. STATO DELL’ARTE
43
cellule predominante e data la forma allungata conferiscono anisotropia al tessuto; questi occupano circa il 70% del volume, mentre il restante 30 è costituito da collagene e componenti
interstiziali[11] . L’orientamento delle fibre miocardiche è eterogeneo nel tessuto non si mantiene costante, ma varia attraverso lo spessore della parete: immaginando di porre il centro di un
sistema di riferimento cilindrico (R, Θ, Z) sull’asse longitudinale del ventricolo, all’aumentare della coordinata radiale aumenta anche l’angolo di rotazione delle fibre attorno all’asse R.
La variazione si attua anche con la coordinata circonferenziale, a seconda dell’area del cuore
considerata.
In questo sistema di riferimento, come è mostrato in Figura 2.1, si possono individuare l’asse
delle fibre f0 , che coincide con la direzione dell’asse principale delle fibre muscolari, l’asse
in direzione del foglietto s0 , che individua la direzione cross-fibra, e l’asse n0 , ortogonale ai
precedenti e che coincide con la normale uscente dal piano in cui giacciono le fibre. È di fondamentale importanza comprendere la variazione della struttura del tessuto miocardico perché
questa specifica architettura è responsabile della caratteristica sforzo-deformazione passiva del
miocardio.
Figura 2.1: Organizzazione stratificata dei miociti all’interno della struttura collagenosa. Individua un sistema di
riferimento ortonormale in cui f0 è orientato secondo l’asse delle fibre s0 è in direzione cross-fibra e n0 ortogonale
ai precedenti.
Inizialmente gli studi sulle proprietà meccaniche del muscolo cardiaco sono stati condotti sperimentalmente su muscoli papillare e su miocardio trabecolare, perché si pensava che il comportamento sotto stress di queste particolari zone potesse essere assimilabile a quello di un materiale
omogeneo e isotropo. Tuttavia già dai primi risultati si è riscontrata una risposta non isotropa
CAPITOLO 2. STATO DELL’ARTE
44
negli stati di deformazione. Di conseguenza l’analisi si è orientata verso un approccio di tipo
locale, analizzando le proprietà del muscolo cardiaco zona per zona per poter costruire successivamente un modello equivalente. Esemplificativo è il lavoro di Dokos e colleghi del 2002[9] ,
in cui sono stati condotti degli studi su cubetti di miocardio ventricolare di maiale, dimostrando
come questo sia meno resistente alle prove di shear nei piani ( f n) e (sn), e nelle direzioni di
shear f e s rispettivamente, come si evince dalla Figura 2.2. Tuttavia per i piani contenenti la
direzione delle fibre la risposta varia significativamente se la direzione di shear diventa s nel
piano ( f s) e n nel piano ( f n).
L’immagine dimostra inoltre la risposta fortemente non lineare del tessuto miocardico e l’effetto
viscoelastico introdotto precedentemente, sottolineato da piccole aree di isteresi che si generano
caricando e scaricando il materiale.
Figura 2.2: Sforzi di taglio ottenuti all’aumentare della deformazione di shear imposta per un cubetto di
miocardio in diversi piani. Lo shear i j si riferisce a una prova di shear in direzione i nel piano i j, con i 6= j.
Come introdotto precedentemente, il miocardio è un tessuto a comportamento iperelastico. Un
materiale è detto iperelastico quando il lavoro compiuto dallo stato di sforzo durante il processo deformativo dipende solamente dalla configurazione iniziale al tempo t0 e da quella finale
CAPITOLO 2. STATO DELL’ARTE
45
al tempo t. Dal punto di vista matematico si postula quindi l’esistenza di una Strain Energy
Function U, che è l’energia di deformazione immagazzinata nel materiale per unità di volume
di riferimento, in funzione dello stato di deformazione. U è definita positiva in quanto riflette la
necessità di compiere lavoro positivo per deformare il solido.
In letteratura sono presenti diversi modelli costitutivi che descrivono il comportamento del miocardio e tutti si basano sulla definizione di U e delle sue derivate, a partire dalle quali è possibile
determinare gli sforzi generati all’interno del tessuto. I più semplici e datati di questi modelli assumono un comportamento isotropo del miocardio (Demiray et al, 1976[8] ), ma sono inadeguati
per la corretta descrizione delle proprietà meccaniche passive del miocardio, perché non tengono
conto dell’orientamento preferenziale delle fibre al suo interno. Modelli più sofisticati tengono
conto non solo della non-linearità, ma anche dell’anisotropia del tessuto miocardico, assumendo
che esso abbia una risposta sforzo-deformazione trasversalmente isotropa (ne sono un esempio
[22]
i lavori di Humphrey & Yin 1987
), Humphrey et al. 1990[21] , Guccione et al. 1991[15] , Co-
sta et al. 1996[7] ) o ortotropa (come ad esempio i modelli di Hunter et al. 1997[23] , Costa et
al. 2001[6] , Schmid et al. 2006[40] ). A tale scopo, in letteratura sono state usati modelli costitutivi iperelastici secondo due tipi di approccio: formulazione invariant-based e formulazione
strain-based.
2.1.1
Formulazioni
Formulazione invariant based
Nei modelli costitutivi cosiddetti invariant-based, W è definita in funzione degli invarianti del
tensore di Cauchy-Green destro, C = FT F, oppure sinistro, B = FFT , in cui F rappresenta la
matrice gradiente di deformazione ∂ x/∂ X, dove x e X indicato le coordinate di un intorno di
materiale rispettivamente in configurazione corrente ed indeformata. Più comune è l’utilizzo
della matrice C e gli invarianti sono così calcolati:
I1 = tr(C)
(2.1)
CAPITOLO 2. STATO DELL’ARTE
46
I2 =
1 2
I1 − tr(C2 )
2
I3 = det(C) = J 2
(2.2)
(2.3)
Definito J = det(F), questo vale 1 nel caso di materiali incomprimibili, oppure è diverso da 1 se
il materiale presenta un certo grado di comprimibilità.
Questi tre invarianti sono isotropi, ma se il materiale descritto presenta una direzione preferenziale nella configurazione di riferimento (è cioè trasversalmente isotropo), tale direzione è individuata dal vettore unitario a0 e si introducono due invarianti addizionali, detti pseudo-invarianti:
I4 = a0 · (Ca0 )
(2.4)
I5 = a0 · C2 a0
(2.5)
Se le direzioni preferenziali sono due, si introduce un secondo vettore unitario b0 , e analogamente gli pseudo-invarianti ad esso riferiti sono:
I6 = b0 · (Cb0 )
(2.6)
I7 = b0 · C2 a0
(2.7)
Inoltre è possibile definire un ulteriore pseudo-invariante misto che dipende da entrambe le
direzioni:
I8 = a0 · (Cb0 ) = b0 · (Ca0 )
(2.8)
Con la definizione della Strain Energy Function è possibile determinare gli sforzo, in termini di
tensore di Cauchy:
N
σ =F
∑
i=1,i6=3
Wi
∂ Ii
− pI
∂F
con p moltiplicatore lagrangiano, da determinarsi sulla base delle condizioni al contorno.
(2.9)
CAPITOLO 2. STATO DELL’ARTE
47
Formulazione strain based
Nei modelli costitutivi cosiddetti strain-based, U è direttamente dipendente dalle componenti
del tensore di Green delle grandi deformazioni E, definito dalla formula E = 21 (C − I), dove I
rappresenta il tensore identità del secondo ordine.
U = U(E)
(2.10)
Per questi modelli l’assunzione è che inizialmente le fibre sono allineate lungo gli assi del sistema ortonormale di riferimento, ovvero del sistema definito in condizioni scariche. La direzione
può perdere l’ortogonalità solamente a deformazione avvenuta. In questo tipo di formulazione
U assume una forma del tipo:
U = a · exp(Q)
(2.11)
Ciò che distingue un modello rispetto all’altro è l’espressione dell’esponente Q, che dipende
dalle componenti di E.
In questo caso il tensore degli sforzi di Cauchy è calcolato come:
σ =F
∂U
∂U T
− pI = F
F − pI
∂F
∂E
(2.12)
Dallo sforzo di Cauchy è possibile passare semplicemente alla formula del Secondo Tensore di
sforzo di Piola-Kirchhoff:
S = JF−1 σ F−T
(2.13)
Indipendentemente dal tipo di definizione, invariant o strain-based, tutti i modelli costitutivi presentano una dipendenza da un set di parametri, il cui valore è stimato a partire da dati
sperimentali ottenuti replicando modi deformativi simili a quanto accade in vivo.
CAPITOLO 2. STATO DELL’ARTE
2.1.2
48
Modelli
Modelli trasversalmente isotropi
Il primo modello anisotropo di tipo invariant-based è stato formulato da Humphrey&Yin nel
1987[22] :
n
h √
o
2 i
U = c {exp [b (I1 − 3)] − 1} + A exp a I4 − 1 − 1
(2.14)
A partire da questo, sono stati studiati e formulati modelli successivi, come quello dello stesso
Humphrey e colleghi del 1990[21] :
U = c1
2
3
√
√
√
I4 − 1 + c2 I4 − 1 + c3 (I1 − 3) I4 − 1 + c5 (I1 − 3)2
(2.15)
Questi modelli, che utilizzano lo pseudo-invariante quarto di C, replicano una riposta trasversalmente isotropa. Inoltre, come più in generale i modelli formulati prima della metà degli anni
’90, si basavano sull’ipotesi di incomprimibilità del materiale. Questa ipotesi è stata rimossa
da Kerckhoffs e colleghi[25] , che nel 2003 hanno introdotto un modello che tenesse conto anche della comprimibilità del materiale, formulando la Strain Energy Function in funzione degli
invarianti Iˆ1 e Iˆ2 di E (dipendenti linearmente dagli invarianti I1 e I2 di C) e in funzione della
componente del tensore di Green-Lagrange in direzione delle fibre, E f f :
U = a0 exp a1 Iˆ12 + a2 Iˆ22 − 1 + a3 exp a4 E 2f f − 1 + a5 (I3 − 1)2
(2.16)
Il vantaggio di questa formulazione è quello di distinguere tre termini: il primo relativo alla
variazione di forma del tessuto, il secondo legato all’aumento di rigidezza in direzione delle
fibre, il terzo dipendente dalle variazioni volumetriche.
I modelli trasversalmente isotropi con formulazione esclusivamente strain-based che si trovano
in letteratura si riconducono all’espressione formulata da Fung nel 1979[12] :
1 Q
U = C e −1
2
(2.17)
CAPITOLO 2. STATO DELL’ARTE
49
E sono ad esempio quello di Guccione e colleghi del 1991[15] , che presenta il termine Q definito
come:
2
2
2
2
Q = 2b1 (Enn + E f f + Ess ) + 2b2 E 2f f + b3 (Enn
+ Ess
+ Ens
+ Esn
) + b4 (E 2f s + Es2f + En2 f + E 2f n )
(2.18)
e quello di Costa e colleghi del 1996[7] :
2
2
Q = 2b1 (Enn + E f f + Ess ) + b2 E 2f f + b3 (Ess
+ Enn
+ 2Esn Ens ) + 2b4 (E f s Es f + E f n En f ) (2.19)
Questi due modelli risulteranno poi essere casi particolari del modello ortotropo proposto da
Costa nel 2001[6] , che sarà illustrato nel paragrafo a seguire ed è costruito proprio a partire da
questi lavori.
Particolarmente interessante è il modello di Guccione, perché è stato ripreso e studiato da diversi
autori, ciascuno dei quali ha ricavato un proprio set di parametri, alcuni dei quali sono riassunti
in Tabella 2.1. La grande variabilità riscontrata tra questi valori è da ritrovare nel fatto che ogni
stima è stata ottenuta con strumenti differenti e sulla base di dati sperimentali di partenza diversi
tra loro.
Anno C [kPa] b1
Autori
Guccione et al.[15] (al variare
1991
b2
b3
b4
0.875
0
1.243
17.50
4.14
0.644
0
2.547
15.09
10.48
0.562
0
3.185
15.38
23.85
dell’orientamento delle fibre)
Guccione et al.[16, 14]
1993
0.876
0
18.48
3.58
1.627
Xi et al.[49]
2011
0.189
0
29.9
13.5
13.3
Hadjicharalambous et al.[17]
2014
0.180
0
27.75
5.37
2.445
Tabella 2.1: Alcuni set di parametri per il modello di Guccione proposti da vari autori.
CAPITOLO 2. STATO DELL’ARTE
50
Modelli ortotropi
A metà anni novanta si è dimostrato che il miocardio non è un materiale trasversalmente isotropo
(LeGrice e colleghi, 1995[27] ). Alla luce di tale evidenza, sono stati formulati modelli costitutivi
ortotropi. Tra questi, uno dei modelli di tipo invariant-based più interessanti e completi è quello
formulato e proposto da Holzapfel nel suo lavoro del 2009[20] , che introduce la seguente Strain
Energy Function:
h
i
o a ai n
a
fs
2
exp [b (I1 − 3)] + ∑
exp bi (I4i − 1) − 1 +
exp b f s I82 f s − 1 (2.20)
U=
2b
2b f s
i= f ,s 2bi
Con questa formulazione, Holzapfel tiene conto del contributo isotropo, attraverso il termine
dipendente da I1 , di quello trasversalmente isotropo con il termine dipendente dagli pseudoinvarianti I4 f e I4s , e di quello ortotropo con la dipendenza dello pseudo-invariante misto I8 f s .
Anche i modelli ortotropi di tipo strain-based in letteratura si rifanno alla stessa formula di Fung
dei modelli trasversalmente isotropi (Formula 2.17) e differiscono solamente per la definizione
dell’esponente Q, che è funzione delle componenti del tensore di Green delle grandi deformazioni E, combinate diversamente e con opportuni parametri a seconda del modello considerato.
Ne sono un esempio il lavoro di Costa e colleghi del 2001[6] , in cui Q è funzione di 7 parametri,
quello di Schmid e colleghi del 2006[3] , che presenta una Q funzione di 12 parametri, e quello
di Hunter e colleghi del 1997[23] , in cui i parametri introdotti sono 18.
Va posta particolare attenzione al lavoro di Costa, il quale, come precedentemente introdotto,
è arrivato alla formulazione ortotropa partendo da suoi precedenti studi, condotti nel 1996[7] , e
dal lavoro di Guccione e colleghi del 1991[15] ; la Q è espressa nel seguente modo:
2
2
2
+ 2b f s E 2f s + 2b f n E 2f n + 2bsn Esn
Q = b f f E 2f f + bss Ess
+ bnn Enn
(2.21)
CAPITOLO 2. STATO DELL’ARTE
2.2
51
Modellazione delle proprietà meccaniche attive del miocardio
Il comportamento delle fibre miocardiche non è solamente passivo. Esse possiedono una capacità contrattile, di cui è necessario tenere conto per replicare in modo fedele il comportamento
del tessuto. Un primo tentativo di descrizione della componente attiva appartiene a Hill che nel
1970[19] ha sviluppato un modello che, a partire dai risultati ottenuti per il muscolo scheletrico,
cercasse di adattarsi a quello cardiaco. L’equazione di Hill è rappresentata nella Figura 2.3 e
definita nel seguente modo:
(v + B)(F + a) = b(F0 + a)
(2.22)
Con a e b costanti, v velocità di accorciamento dei sarcomeri, F forza muscolare e F0 forza
massima tetanica.
Figura 2.3: Relazione tra carico e velocità di accorciamento del sarcomero in una contrazione isotonica ottenuta
con l’equazione di Hill.
Il grosso limite di questa formulazione è che risulta complesso definire in modo rigoroso uno
stato attivo al quale riferirsi, anche perché a differenza del muscolo scheletrico, quello cardiaco
non raggiunge uno stato tetanico e ad ogni contrazione si osserva una tensione variabile, prima
crescente e poi decrescente.
CAPITOLO 2. STATO DELL’ARTE
52
La relazione di tipo iperbolico che lega forza di contrazione e velocità di accorciamento del sarcomero è fortemente influenzata dal comportamento attivo ed è dipendente anche dalla lunghezza dei sarcomeri e dall’istante temporale considerato, perché ogni singola curva forza-velocità
rappresenta un solo istante della contrazione.
È quindi evidente che la contrattilità del cuore gioca un ruolo chiave nella descrizione meccanica
del suo comportamento, per cui risulta piuttosto complesso scindere la componente passiva da
quella attiva, come introdotto nel Capitolo 1 e illustrato in Figura 1.5.
Wong e colleghi all’inizio degli anni ’70[47, 48] per primi hanno utilizzato il modello di Huxley dei filamenti di actina e miosina (il ciclo dei ponti trasversali, 1957[24] ), generalizzandolo in un modello di meccanica del muscolo cardiaco. Successivamente, nel 1980, Panerai[33]
ha ripreso il modello originale di Huxley e legandolo alle leggi che descrivono l’attivazione
lunghezza-dipendente, lo ha incorporato nell’equazione di cinetica di primo ordine che descrive
l’interazione tra ioni calcio Ca++ e troponina C, ottenendo la seguente equazione:
dAC (t)
= c1Ca2f (t) [Ac0 − Ac (t)] − c2 Ac (t)
dt
(2.23)
Dove Ac rappresenta la concentrazione di actina libera di agire con la miosina, Ac0 è una costante
che rappresenta la quantità di actina totale presente nel muscolo, mentre c1 e c2 sono i tassi di
associazione e dissociazione rispettivamente, mostrati in Figura 2.4. Tuttavia questo modello
non tiene conto della deattivazione delle fibre.
CAPITOLO 2. STATO DELL’ARTE
53
Figura 2.4: a) Relazione tra il tasso di associazione tra Ca++ e troponina in funzione della lunghezza del sarcomero. Aumenta esponenzialmente con la lunghezza e trasla verso l’alto all’aumentare della velocità di allungamento.
b) Relazione tra il tasso di dissociazione tra Ca++ e troponinain funzione della lunghezza del sarcomero. Trasla
verso l’alto all’aumentare della velocità di accorciamento.
Nel 1987 Pinto e colleghi[36] hanno proposto una relazione fenomenologica tra la forza attiva sviluppata nel muscolo, la lunghezza del muscolo stesso e il tempo che segue lo stimolo, validando il modello attraverso delle prove sperimentali che monitorassero gli andamenti
lunghezza-tensione o forza-velocità nell’intero muscolo.
Sulla base di quanto era già stato scoperto e definito dagli altri autori, Guccione e colleghi nel
1993[16, 14] , dopo aver modellizzato il comportamento del miocardio passivo, si sono concentrati
sulla modellazione della contrazione miocardica. Le idee introdotte da Guccione scaturiscono
dall’esigenza di giungere ad una formulazione matematica che descriva la meccanica cardiaca
attiva e passiva di un ventricolo sinistro battente, interfacciando in modo piuttosto semplice
e immediato le due componenti. La novità introdotta rispetto ai precedenti lavori è quella di
descrivere il comportamento attivo delle fibre in funzione dell’istante in cui avvengono rapide
variazioni di lunghezza. Poiché la contrazione attiva può essere facilmente descritta assumendo
lo sviluppo di uno sforzo uniassiale in direzione delle fibre, l’idea è quindi quella di sommare al
tensore di Cauchy passivo σp , descritto da Guccione stesso nel precedente lavoro del 1991, un
CAPITOLO 2. STATO DELL’ARTE
54
tensore attivo σa , che ha un’unica componente non nulla in direzione delle fibre f f :
0 0 0
σa = 0 σ 0
0 0 0
(2.24)
σtot = σp + σa
(2.25)
Lo sforzo attivo σ in direzione delle fibre è funzione della tensione isometrica σ0 opportunamente scalata da una funzione Cv , che normalizza la relazione forza-velocità.
σ = σ0Cv
(2.26)
Guccione ha formulato tre modellazioni che descrivono gli sforzi e le deformazioni generati
nella parete cardiaca durante la fase sistolica a seguito dello sviluppo di una tensione attiva:
• Modello di disattivazione
Descrive la disattivazione di muscoli isolati in risposta a rapide variazioni di lunghezza.
La tensione isometrica σ0 è suggerita dai lavori di Lacker e Peskin[26] ], i quali hanno
sviluppato un modello del ciclo dei ponti definendo una relazione tra l’attivazione dell’actina e la tensione sviluppata durante una contrazione isometrica. E’ data dalla seguente
equazione:
σ0 = Ac p(0)
f
f + g(0)
(2.27)
In cui Ac rappresenta la concentrazione di actina libera di interagire con la miosina, p(0)
è la funzione esponenziale che descrive il ciclo dei ponti valutata all’istante iniziale, f e g
sono rispettivamente il tasso di attacco (costante) e distacco (funzione dello spostamento)
dei ponti.
Cv ha invece una formulazione complessa e definita a tratti, a seconda che le fibre si trovino in stato di accorciamento o di allungamento.
CAPITOLO 2. STATO DELL’ARTE
55
• Modello di Hill modificato
Implementato a fini comparativi, non prevede la disattivazione, ma è descritto dalla stessa
relazione forza-velocità in accorciamento e in allungamento ed è proprio per questa caratteristica che è definito come modello “di Hill”. L’equazione di Hill è spesso utilizzata per
descrivere la relazione sigmoidale che sussiste tra tensione attiva nelle fibre cardiache e
concentrazione di ioni calcio, mostrata in Figura 2.5.
Figura 2.5: Relazione tensione-pCa. I dati sperimentali sono fittati con l’equazione di Hill modificata. La forza
isometrica è normalizzata alla tensione di controllo, relativa alla concentrazione di calcio di saturazione pCa=4.5.
Il termine Cv ha la stessa formulazione proposta dal modello di disattivazione, mentre σ0
è descritto da un’equazione fenomenologica suggerita da un precedente lavoro di Tözeren
(1985)[44] espressa nel seguente modo:
σ0 = σmax
Ca20
Ct
Ca20 + ECa250
(2.28)
Nella formula, σmax rappresenta la tensione isometrica raggiunta alla massima lunghezza
del sarcomero e al massimo picco di calcio intracellulare (Ca0 )max .
Ct è una variabile interna, funzione di parametri costanti, dell’istante in cui viene raggiunto
il picco isometrico e della lunghezza del sarcomero.
CAPITOLO 2. STATO DELL’ARTE
56
La sensitività massima lunghezza-dipendente al calcio è funzione di questo picco, di una
costante B che governa la forma del picco isometrico e dalla lunghezza del sarcomero l:
(Ca0 )max
ECa50 = p
exp [B (l − l0 )] − 1
l = lR
p
2E f f + 1
(2.29)
(2.30)
l0 è la lunghezza del sarcomero in condizioni di tensione attiva nulla, lR è invece la
lunghezza del sarcomero in condizioni scariche.
• Modello dell’elastanza
Formulato rimuovendo la dipendenza forza-velocità dal modello di Hill. σ0 è definito
dalla Formula 2.28 come per il modello di Hill modificato, mentre Cv è posto pari a 1.
Sebbene Guccione e colleghi abbiano testato i modelli su una geometria cilindrica, che quindi
oltre ad essere estremamente semplificata restringe il campo d’indagine alla regione equatoriale
del ventricolo, lo studio è stato confrontato con lavori sperimentali (Waldman, 1988[46] ) e ha
condotto a risultati interessanti, mostrati nella Tabella 2.2. Quello principale è che il modello di
disattivazione, nella sua complessità, descrive in modo più appropriato la dinamica all’interno
della parete cardiaca. Ciononostante anche il modello dell’elastanza genera delle deformazioni
nella fase di fine sistole che sono in buon accordo con i dati sperimentali, come è possibile osservare in Figura 2.6. E’ da tenere in considerazione che le distribuzioni ottenute sono fortemente
dipendenti dalla distribuzione delle fibre nello spessore del miocardio e che le torsioni generate determinano uno spostamento delle fibre, per cui la direzione di massimo accorciamento
potrebbe non corrispondere precisamente con la direzione delle fibre.
CAPITOLO 2. STATO DELL’ARTE
Sperimentali
Modello di
disattivazione
Modello di
Hill
Modello
dell’elastanza
E11 out
E11 in
−0.09 ± 0.05
−0.15 ± 0.04
−0.1049
−0.1059
−0.1390
−0.1984
−0.1352
−0.1928
E22 out
E22 in
−0.05 ± 0.04
−0.07 ± 0.07
−0.0497
−0.0506
−0.0875
−0.0896
−0.0855
−0.0873
57
E33 out
E33 in
−0.19 ± 0.15
−0.34 ± 0.16
0.1689
0.2436
0.2678
0.4190
0.2573
0.3994
E12 out
E12 in
−0.04 ± 0.01
−0.04 ± 0.02
0.0339
0.0266
0.0453
0.0331
0.0427
0.0314
E13 out
E13 in
−0.01 ± 0.04
−0.06 ± 0.05
0.000
0.000
0.000
0.000
0.000
0.000
E23 out
E23 in
−0.00 ± 0.04
−0.08 ± 0.06
0.000
0.000
0.000
0.000
0.000
0.000
Tabella 2.2: Confronto tra le misure sperimentali di Waldman del 1988[46] e i modelli computazionali introdotti
e testati di Guccione nel 1993[16, 14]
Figura 2.6: Confronto tra deformazioni determinate sperimentalmente (barre scure) e calcolate a fine sistole con
il modello dell’elastanza. E11 deformazione circonferenziale, E22 deformazione longitudinale E12 deformazione di
taglio nel piano.
Lavori molto più recenti trattano la problematica della contrazione attiva del cuore da un punto
di vista più globale, non più focalizzando l’attenzione sui reali fenomeni che avvengono a livello
intramuscolare, ma studiando il cuore nella sua globalità.
La forza attiva del muscolo cardiaco non è governata solamente dalle proprietà passive del miocardio, ma dipende anche e principalmente dall’elestanza attiva delle miofibre che agisce attraverso il ciclo cardiaco. In un lavoro del 2005, Zhong e colleghi[50] hanno modellato la pom-
CAPITOLO 2. STATO DELL’ARTE
58
pa cardiaca basando la loro descrizione sull’elastanza e la compliance del muscolo cardiaco,
introducendo in particolare il nuovo concetto di elastanza data dal contributo di due termini:
• un’elastanza passiva E p , definita da una relazione volume dipendente, che rappresenta la
resistenza al riempimento ventricolare.
E p = E p0 0 ez pV
(2.31)
• un’elastanza attiva Ea , che può essere utilizzata per caratterizzare lo stato contrattile del
ventricolo ed è definita in funzione del tempo.
Z !
C
− τt
Ea = Ea0 1 − e
C
ZR !
t−d
− τ
e
R
(2.32)
Hassaballah e colleghi, in uno studio pubblicato nel 2013[18] , suggeriscono un metodo per comprendere la proprietà di elastanza attiva, che consiste nel considerare il modulo di Young delle
fibre sempre inferiore o al massimo uguale a Emax = 0.5 MPa e calcolare la variazione delle
proprietà elastiche delle miofibre moltiplicando la pressione che agisce sulla parete del ventricolo per una opportuna costante, definita da
Emax
Pmax .
In Figura 2.7 è riportato l’andamento della
rigidezza calcolata dagli autori.
Figura 2.7: Modulo di Young attivo delle miofibre nel corso di un ciclo cardiaco.
Capitolo 3
Materiali e Metodi
A seguito di una accurata analisi della letteratura, la scelta del modello costitutivo per la modellazione del ventricolo è ricaduta sul modello di tipo strain-based proposto da Guccione nel
1991 [15].
Le ragioni della scelta sono individuabili in:
• Ortogonalità del sistema di riferimento nei sistemi di tipo strain-based, con conseguente
facilità di gestione delle componenti di sforzo e deformazione;
• Modello di Guccione ampiamente studiato e validato;
• Esistenza della modellazione della componente attiva facilmente interfacciabile con quella
passiva (Guccione 1993 [16, 14]);
Per poter utilizzare un materiale con formulazione diversa da quelli presenti nella libreria di
Abaqus è necessario creare una subroutine, ovvero una funzione scritta in linguaggio Fortran
che contiene le equazioni che governano il modello, che è chiamata esternamente dal solutore
numerico. In particolare, per Abaqus/Explicit (SIMULIA, Dassault Systèmes) esistono due
diverse possibili strategie:
• vumat, che è lo strumento più generale per la definizione di un qualunque materiale;
• vuanisohyper_strain, che è specifica per la descrizione di legami anisotropi con
formulazione di tipo strain based.
59
CAPITOLO 3. MATERIALI E METODI
60
Poiché sono due strumenti intrinsecamente diversi l’uno dall’altro, si è ritenuto opportuno analizzare entrambe le possibilità per valutarne criticità e punti di forza.
3.1
vumat
3.1.1
Struttura generale
[1] Una subroutine di tipo vumat è utilizzata per definire il comportamento meccanico costitutivo
di un materiale, e sulla base delle variabili passate in ingresso, calcola il valore di sforzo in ogni
nodo di integrazione della mesh, ad ogni intervallo temporale.
Durante il data-check viene effettuato il controllo sulla relazione costitutiva del materiale e calcolate le proprietà iniziali equivalenti, mentre si noti che sforzi, spostamenti, deformazioni e le
altre variabili di campo, in presenza di un sistema di riferimento locale, sono riferite proprio
rispetto a tali coordinate. Questo aspetto è particolarmente rilevante per i tessuti biologici in generale, che presentano tipicamente aspetti di anisotropia, e per i quali è perciò spesso necessario
introdurre un orientamento locale per caratterizzarli correttamente. Questo vale in modo particolare per il tessuto miocardico, la cui anisotropia non è solo anatomica ma ha anche carattere
funzionale, come precedentemente illustrato nel Paragrafo 1.3.
Definire una vumat significa sostanzialmente definire la relazione tra il tensore gradiente di
deformazione F e il tensore di Cauchy σ , che sarà la variabile in uscita dalla vumat. Si ricorda
che F è data dalla decomposizione polare F = R · U, dove U è il tensore di stretch e R la matrice
di rotazione.
Questo tipo di subroutine consente all’utente di avere notevoli libertà nella definizione del legame costitutivo, servendosi al bisogno anche di ulteriori variabili che vengono prese in ingresso
ad ogni iterazione. In particolare, per i materiali iperelastici, che sono caratterizzati tipicamente da grandi deformazioni, è opportuno definire lo sforzo di Cauchy dipendente dal tensore U
piuttosto che direttamente dalla matrice F, per depurare il calcolo dalla componente di rotazione
della deformazione, e definire così di fatto il modello in un sistema corotazionale.
CAPITOLO 3. MATERIALI E METODI
3.1.2
61
Studio preliminare - modello Neo-hookeano
Prima di cimentarsi con l’implementazione di un modello complesso come quello di Guccione,
è sembrato opportuno iniziare provando a creare una vumat che fosse in grado di replicare un
materiale già presente nella libreria di Abaqus, e per questo scopo è stata scelta la formulazione
neo-hookeana, che rientra nella categoria dei materiali iperelastici isotropi ed è caratterizzata da
una funzione energia di deformazione relativamente semplice:
1
U = C10 (I¯1 − 3) + (Jel − 1)2
D1
(3.1)
Come si può notare, la funzione è formata da una parte deviatorica, governata dal termine C10
e dipendente dall’invariante primo I¯1 (definito come I¯1 = tr(B) ), e da una quota a parte volumetrica, che riguarda la comprimibilità del materiale, coinvolgendo il termine Jel , che è dato
da:
Jel =
1
(1 + εth )3
(3.2)
in cui εth rappresenta le deformazioni dovute a fenomeni termici, trascurate in questo studio
(quindi di fatto per gli scopi di questo lavoro Jel = J). Pur rientrando nella categoria degli iperelastici, il materiale neo-hookeano non presenta anisotropia, e i valori delle variabili restituite
sono perciò riferiti alle coordinate globali del sistema.
Non essendo in alcun modo interessate al comportamento neo-hookeano, l’obiettivo di queste
prove è stato puramente di carattere comparativo, per essere certe di avere il giusto approccio
nella scrittura di subroutine di tipo vumat.
Inizialmente si è pensato di impostare delle prove molto semplici, su un cubetto di dimensioni
1x1x1 mm3 , discretizzato con un unico elemento esaedrico:
• trazione monoassiale lungo la direzione 2;
• prova di pure shear in direzione 1-2, cioè la faccia di normale 1 spostata lungo la direzione
2.
CAPITOLO 3. MATERIALI E METODI
62
Le costanti che compaiono nella Strain Energy Function, C10 e D1 , sono legate alle proprietà
fisiche del materiale, in particolare allo shear modulus µ e al bulk modulus K.
C10 =
µ
[MPa]
2
2
D1 =
K
1
MPa
(3.3)
(3.4)
Questi parametri sono stati scelti in modo tale da riprodurre un comporamento gommoso[4] ,
caratterizzato da un valore elevato per K e molto basso per µ, e sono:
C10 = 0.15 MPa corrispondente a µ = 0.3 MPa
1
D1 = 0.0125 MPa
corrispondente a K = 1600 MPa
Per ogni prova è stata effettuata una coppia di simulazioni, in cui nella prima il materiale è
stato selezionato direttamente dalla libreria di Abaqus, mentre nella seconda definito tramite
vumat. Entrambe sono state confrontate con la soluzione implementata in un foglio Excel, in
cui la matrice F che determina la soluzione è estratta direttamente dalla simulazione mediante un
semplice codice Python, per poter tenere conto della non-perfetta incomprimibilità del materiale,
poiché la comprimibilità perfetta non può essere gestita da Abaqus/Explicit.
I risultati ottenuti, mostrati nelle Figure 3.1 e 3.2, confermano quanto precedentemente introdotto. Infatti, se nel caso di trazione uniassiale in cui le rotazioni non sono sostanzialmente
coinvolte, la corrispondenza tra la soluzione calcolata in Excel, la simulazione con il materiale
neo-hookeano e la simulazione con la vumat è ottima, nel caso della prova di taglio si nota che
lo sforzo è calcolato in modo corretto, ma che è comunque presente una piccola discrepanza, che
diminuisce utilizzando nei conti la matrice U come suggerito nella documentazione . Le differenze residue sono quindi dovute proprio alla gestione delle rotazioni del sistema di riferimento
da parte del solutore.
Inoltre, è interessante notare in Figura 3.1 la curva “Excel Analitico”, che si discosta in maniera
significativa dalle altre curve (che sono invece perfettamente sovrapposte tra loro). Tale curva
è ottenuta assumendo l’ipotesi di perfetta incomprimibilità del materiale e considerando quindi
J = 1; dalla teoria della meccanica dei continui, questo implica che per una prova di trazione
CAPITOLO 3. MATERIALI E METODI
63
uniassiale, per esempio in direzione 22, la matrice F, funzione dello stretch λ , sia così calcolata:
√1
λ
0
0
0
0
λ
0
0
(3.5)
√1
λ
Poiché in Abaqus/Explicit l’incomprimibilità non può essere gestita, si è perciò reso necessario
estrarre la matrice F direttamente dalla simulazione per ottenere una curva confrontabile.
Figura 3.1: Confronto tra le curve sforzo-deformazione della prova di trazione uniassiale. Si noti la discrepanza tra le curve Excel-Abaqus-Subroutine, perfettamente sovrapposte tra loro, e la curva Excel Analitico, che rappresenta la soluzione calcolata secondo l’ipotesi di perfetta incomprimibilità, non ammissibile in
Abaqus/Explicit.
CAPITOLO 3. MATERIALI E METODI
64
Figura 3.2: Confronto tra le curve sforzo della prova di taglio. Da sottolineare come la corrispondenza del risultato della simulazione effettuata con la subroutine rispetto al calcolo in Excel
e alla simulazione con materiale Neo-Hooke di Abaqus sia migliore se viene usata nei calcoli la
matrice U rispetto alla matrice F.
3.1.3
Modello di Guccione
Superato il test preliminare dell’implementazione di un semplice legame costitutivo, si è passati
alla scrittura del modello di Guccione, forti di alcuni accorgimenti e strategie adottate nel più
semplice caso neo-hookeano.
Come precedentemente introdotto, la funzione energia proposta da Guccione ha la tipica forma
di Fung:
U=
i
Ch Q
e −1
2
(3.6)
cui il termine Q è così definito:
2
2
2
2
2
2
2
2
2
+ ĒFC
+ ĒCF
Q = 2b1 (ĒRR + ĒFF + ĒCC )+b2 ĒFF
+b3 ĒCC
+ ĒRR
+ ĒCR
+ ĒRC
+b4 ĒRF
+ ĒFR
(3.7)
con Eii componenti della matrice E opportunamente ruotata per per mezzo della matrice di
rotazione R, che la orienta di un certo angolo θ rispetto alla direzione radiale nel piano della
CAPITOLO 3. MATERIALI E METODI
65
parete, così da portarla nel sistema di riferimento delle fibre.
Ē = R · E · RT
(3.8)
Si noti che la formulazione proposta da Guccione non presenta alcuna suddivisione in quota parte deviatorica e idrostatica, suddivisione che invece è opportuno adottare quando ci si appresta
a scrivere una vumat. Infatti, come molti altri codici numerici, Abaqus calcola lo sforzo suddiviso nelle due componenti, e in particolare per materiali iperelastici anisotropi caratterizzati da
una formulazione delle funzione energia di deformazione di tipo strain-based:
1
∂U T
S = DEV F ·
·F
J
∂E
p=−
∂U
∂J
σ = S − pI
(3.9)
(3.10)
(3.11)
Perciò, la funzione energia può essere riscritta considerando le sole componenti deviatoriche
della matrice E e introducendo un termine aggiuntivo che tenga conto dell’intera deformazione
volumetrica:
i 1 J2 − 1
Ch Q
el
U=
e −1 +
− ln Jel
2
D
2
(3.12)
In questo modo, calcolando opportunamente le derivate della Strain Energy Function è possibile
ricavare agevolmente le componenti si sforzo da inserire nella subroutine.
Anche in questo caso sono stati condotti semplici test (trazione uniassiale e shear) su un unico
elemento esaedrico di dimensione 1x1x1 mm3 .
In questo stadio del lavoro, focalizzato sullo studio del modello più che sui parametri costitutivi
da utilizzare, si è scelto di riferirsi a quelli proposti da Guccione nel suo lavoro del 1993[16, 14] :
C10 = 0.876 kPa
b1 = 0.0
CAPITOLO 3. MATERIALI E METODI
66
b2 = 18.48
b3 = 3.58
b4 = 1.627
Infatti in letteratura si possono trovare stime differenti proposte da diversi autori, alcune delle
quali sono riportate in Tabella 2.1, e si è scelto di rimandare la scelta definitiva a una fase più
avanzata, in cui i valori influenzano realmente la geometria ventricolare e lo specifico tipo di
carico applicato.
Inoltre, lavorando con un codice numerico e dovendo quindi separare quota parte volumetrica
da quota parte deviatorica, si è reso necessario introdurre nel set dei parametri anche il valore
di bulk modulus K (da cui dipende il parametro D presente nella Strain Energy Function). Per
il tessuto miocardico in letteratura si trovano valori piuttosto differenti a seconda che il cuore si
trovi in fase sistolica oppure in fase diastolica (Tabella 3.1).
Fonte
Bulk modulus
Fase del ciclo cardiaco
Shim, 2012[41]
380 kPa
sistole
Dorri, 2006[10]
600 kPa
sistole
Marchesseau, 2013[28]
25 MPa
sistole
Bettendorff-Bakman, 2006[3]
28 kPa
diastole
Veress, 2005[45]
160 kPa
diastole
Tabella 3.1: Principali valori di bulk modulus K riportati in letteratura. Dagli studi emerge che la parete cardiaca
assume un diverso valore di bulk modulus in fase sistolica rispetto alla fase diastolica
Si è scelto in questa analisi un valore di K intermedio, pari a 2 MPa.
Tuttavia, anche in casi di semplici geometrie e condizioni di carico, il solutore restituisce errori,
quasi sempre riconducibili ad eccessiva distorsione degli elementi.
CAPITOLO 3. MATERIALI E METODI
67
Infatti, per quanto l’estrema flessibilità della vumat sia un notevole vantaggio, poiché consente piena libertà nella definizione degli sforzi, rappresenta allo stesso tempo una criticità a cui
prestare molta attenzione. In presenza di un problema caratterizzato da non-linearità sotto molti
punti di vista come quello trattato in questo lavoro (legame costitutivo iperelastico e anisotropo,
geometria ventricolare complessa e orientamenti delle fibre non uniformi attraverso lo spessore della parete), gestire tutti gli aspetti necessari al corretto funzionamento della subroutine è
tutt’altro che banale. In particolare si ritiene che l’origine del problema risieda principalmente
nell’utilizzo di sistemi di riferimento che non coincidono con quello globale.
3.2
vuanisohyper_strain
La subroutine vuanisohyper_strain, analogamente alla vumat, serve per definire il legame costitutivo di un materiale, ma insieme alla corrispondente vuanisohyper_inv (per
formulazioni di tipo invariant-based) è riferita specificatamente a materiali anisotropi.
In particolare, la vuanisohyper_strain si usa per descrivere la funzione energia dipendente dalle componenti del tensore di Green E. La principale differenza rispetto alla vumat
infatti, consiste in ciò che l’utente definisce all’interno della subroutine, che non sono più le
relazioni tra le componenti di sforzo del tensore di Cauchy σ e quelle del tensore U , ma proprio
le derivate della Strain Energy Function rispetto alle componenti di E. Tali derivate sono poi
gestite automaticamente da Abaqus per calcolare lo sforzo secondo le formule precedentemente
introdotte (Formule 3.9-3.11)
Come sempre in Abaqus, è necessario distinguere tra quota parte deviatorica e volumetrica, e
in questo caso il calcolo delle derivate rispetto a E va fatto riferendosi alla sola componente
deviatorica di E. Per quanto riguarda la parte volumetrica, infatti, la subroutine utilizza il determinante della matrice F, J = det (F), che è preso in ingresso per ottenere la p da inserire nella
Formula 3.11.
Come per la vumat inoltre, è possibile inserire dipendenza dalle variabili di campo prese in
ingresso dalla subroutine.
CAPITOLO 3. MATERIALI E METODI
68
Analogamente ai casi precedenti, anche per la vuanisohyper_strain sono state condotte
semplici prove preliminari, al fine di ottenere un confronto con la soluzione implementata in
un foglio Excel ed assicurarsi di avere il controllo sui calcoli operati da Abaqus. I parametri
utilizzati sono gli stessi scelti per le prove con la vumat.
In particolare, i test scelti sono stati, come negli altri esempi presentati, una trazione uniassiale
e una prova di pure shear, e sono stati portati avanti su diversi cubetti, ciascuno con un sistema
di orientamento differente, volto a riprodurre diverse disposizioni delle fibre. Entrambi i tipi di
prova sono stati condotti in controllo di spostamento
• per quanto riguarda la trazione è stato imposto uno spostamento uguale e contrario pari a
0.1 mm alle due facce aventi normale in direzione 2;
• per le prove di shear a una faccia sono state bloccate le traslazioni nelle tre direzioni,
mentre all’altra (di normale 1) è stato imposto uno spostamento in direzione 2 pari a
0.2 mm, con le restanti traslazioni bloccate.
Per quanto riguarda le prove di trazione, in Figura 3.3 si può notare l’evidente effetto dell’anisotropia: lo sforzo nella direzione di trazione è tanto maggiore quanto più le fibre sono allineate
a tale direzione.
Dalla Tabella 3.2 invece, si può apprezzare come gli sforzi nella direzione di interesse, cioè quelli
relativi alla prova in questione (σ22 per la trazione e σ12 per lo shear) trovino buon accordo con
i risultati attesi, ricavati calcolando analiticamente la soluzione in Excel. Nonostante ciò si noti
che la corrispondenza tra i valori diminuisce al crescere dell’angolo di rotazione del sistema.
Infatti, come introdotto nel Paragrafo 3.1.2 a proposito dei test sul materiale neo-hookeano, la
gestione delle rotazioni del sistema di riferimento da parte del solutore non è banale da tenere in
considerazione nei calcoli analitici.
CAPITOLO 3. MATERIALI E METODI
Tipo di prova
Trazione lungo direzione 2
sistema ruotato di 0°
Trazione lungo direzione 2
sistema ruotato di 30°
Trazione lungo direzione 2
sistema ruotato di 45°
Shear direzione 12
sistema ruotato di 0°
Shear direzione 12
sistema ruotato di 30°
Shear direzione 12
sistema ruotato di 45°
69
valore di sforzo Abaqus [MPa]
7.038e − 3
valore di sforzo Excel [MPa]
7.038e − 3
1.472e − 3
1.586e − 3
5.431e − 4
5.866e − 4
2.392e − 4
1.231e − 4
8.166e − 5
9.869e − 5
−1.487e − 5
3.887e − 5
Tabella 3.2: Risultati delle prove di trazione e shear su cubetto monoelemento utilizzando la subroutine
vuanisohyper_strain.
CAPITOLO 3. MATERIALI E METODI
70
Figura 3.3: Prove di trazione uniassiale su elemento esaedrico con diversi orientamenti. Il sistema di riferimento
è ruotato in senso antiorario rispetto all’asse z rispettivamente di 0, 30 e 45 gradi. La componente lungo y delle fibre
risulta perciò essere massima nel primo caso, mentre decresce aumentando il grado di rotazione. Questo comporta
la progressiva diminuzione dello sforzo in direzione 22 nei tre casi.
3.3
Selezione del tipo di elemento finito
Oltre alla scelta dello strumento più adeguato per la definizione delle proprietà meccaniche passive del miocardio, un aspetto rilevante ai fine della modellazione numerica della biomeccanica
ventricolare è la scelta degli elementi finiti da utilizzare nel discretizzare la geometria del model-
CAPITOLO 3. MATERIALI E METODI
71
lo. Per analizzare questo aspetto, sono state effettuate delle prove preliminari su una geometria
semplice, ovvero un cilindro cavo, definendo un sistema di riferimento cilindrico e orientando
le fibre in direzione circonferenziale. Le dimensioni del cilindro sono:
Re = 3 mm
Ri = 2.5 mm
h = 30 mm
Si è imposta sulla superficie interna del cilindro una pressione uniforme di 0.1 kPa, applicata
secondo un andamento a rampa, e i nodi giacenti sulla superficie esterna del cilindro sono stati
vincolati a non traslare in direzione longitudinale né circonferenziale, in modo da consentire
solo l’espansione radiale del cilindro. Il cilindro e le condizioni imposte sono mostrati in Figura
3.4.
Figura 3.4: a) Geometria utilizzata per la prova di sensitività condotta per la scelta degli elementi da utilizzare.
b) Condizioni di carico e di vincolo impostate per la prova.
In questa prova preliminare, la risposta meccanica del materiale costituente la parete del cilindro
è stata descritta tramite il modello di Guccione implementato della subroutine vuanisohyper_strain,
con il set di parametri appena descritto. In questo modo, oltre a consentire il confronto tra diversi tipi di elementi finiti, è stato possibile sfruttare questa prova per valutare ulteriormente
la subroutine implementata, verificando che le simulazioni arrivassero a buon fine e i risultati
fossero ragionevoli.
CAPITOLO 3. MATERIALI E METODI
72
Con queste condizioni sono stati testati tre diversi tipi di elementi, e per ogni tipo di elemento
sono stati presi in considerazione tre diversi gradi di infittimento della mesh, aumentando ad
ogni prova in modo proporzionale il seeding alle basi, ovvero il numero di nodi imposti sulle
circonferenze che delimitano la sezione trasversale della parete del cilindro cavo:
• Esaedri lineari: 3 prove in cui il numero di nodi per ciascun edge è 20, 40 e 80.
• Tetraedri lineari: 3 prove in cui il numero di nodi per ciascun edge è 20, 40 e 80.
• Tetraedri quadratici: 3 prove in cui il numero di nodi per ciascun edge è 12, 32 e 55. Per
quest’ultimo tipo, essendo l’ordine di integrazione quadratico, è stato operato un minor
grado di infittimento, in modo da rendere i risultati paragonabili ai corrispondenti ottenuti
con elementi lineari in termini di distanza caratteristica tra nodi adiacenti.
Gli esaedri quadratici non sono stati presi in considerazione, dal momento che il solutore numerico Abaqus/Explicit non ne consente l’utilizzo.
Per ogni cilindro analizzato, si è selezionato un elemento che espone una faccia sulla cavità interna, circa a metà della distanza assiale, valutando nel suo centroide gli sforzi nelle tre direzioni
principali. I risultati ottenuti sono riportati nei grafici di Figura 3.5, e supportati dai dati presenti
nel lavoro di Tadepalli e colleghi[43] , confermano che il comportamento dei tetraedri lineari è
troppo rigido, e non cattura il reale andamento degli sforzi: per questo motivo sono stati scartati.
Nella seconda colonna della figura è perciò riportata un’analisi più dettagliata dei restanti elementi, da cui si evince che, a patto di infittire opportunamente la mesh, gli esaedri lineari hanno
un comportamento paragonabile a quello dei tetraedri quadratici. In Tabella 3.3 si riportano i
tempi computazionali per ciascuna tipologia di elemento analizzata.
CAPITOLO 3. MATERIALI E METODI
73
Figura 3.5: Valori di sforzo in direzione radiale, circonferenziale e assiale ottenuti nella prova di analisi di
sensitività della mesh su cilindro, per diverse tipologie di elemento e diversi gradi di infittimento.
seeding
Esaedri lineari
Tetraedri lineari
Tetraedri quadratici
20
40
80
20
40
80
12
32
55
numero
elementi
680
540
28800
4532
41477
139234
1554
15159
62453
tempo simulazione
approssimativo
3 min30 s
30 min
2 h20 min
20 min
3 h30 min
8 h50 min
25 min
4 h30 min
17 h30 min
numero cpus
8
8
8
8
4
8
4
4
8
Tabella 3.3: Grado di infittimento della mesh, numero di elementi risultati e costi computazionali per ciascuna
tipologia di elemento studiata.
CAPITOLO 3. MATERIALI E METODI
74
Oltre che sui risultati appena riportati, la scelta finale in merito al tipo di elemento da adottare
è stata basata su un’ulteriore considerazione: l’obiettivo più ampio del lavoro qui proposto è
la simulazione della biomeccanica ventricolare tramite modelli ottenuti da immagini cliniche,
in cui la geometria del dominio di calcolo, ovvero della parete ventricolare, è per forza di cose complessa. In generale, gli elementi tetraedrici rendono più semplice ottenere una mesh di
buona qualità discretizzando geometrie complesse. Tuttavia, allo stesso tempo occorre definire,
in modo possibilmente agevole, diversi strati miocardici attraverso lo spessore della parete, così
da poter definire in ognuno un diverso orientamento delle fibre del tessuto e rendere conto del
gradiente spaziale che esiste attraverso lo spessore della parete. Come sarà meglio spiegato nel
paragrafo 3.4.1, il numero di strati minimo è pari a 8. Stante questa esigenza, la dimensione
caratteristica degli elementi sarebbe limitata dallo spessore del singolo strato di parete; questo
limite, onde evitare di ottenere elementi eccessivamente distorti, si ripercuoterebbe sulla dimensione caratteristica dei tetraedri anche lungo le altre direzioni del dominio di calcolo, portando
ad un aumento massiccio del numero di nodi della mesh e quindi dell’onere computazionale
delle simulazioni. Questa considerazione porta a preferire elementi esaedrici.
Inoltre, ai vantaggi in termini di onere computazionale si aggiunge il fatto che una struttura
ordinata come quella esaedrica consente di applicare più facilmente particolari algoritmi che
siano in grado di lavorare con la connettività della mesh per estrapolare informazioni di interesse
in fase di post-processing.
Sulla base delle considerazioni fin qui esposte, la scelta è ricaduta sugli elementi esaedrici
lineari.
3.4
Modellazione del comportamento passivo del ventricolo
sinistro
Poichè il modello costitutivo implementato rende conto solo delle proprietà meccaniche passive
del miocardio, si è deciso di applicarlo ad una simulazione di espansione passiva del ventricolo
sinistro, replicando quanto fatto sperimentalmente da McCulloch[30] .
CAPITOLO 3. MATERIALI E METODI
3.4.1
75
Costruzione della geometria e della mesh
La geometria del ventricolo è stata ottenuta a partire da dati estratti da immagini di risonanza
magnetica. In un precedente lavoro di tesi (Patelli, 2015[34] ) infatti, sono state segmentate manualmente immagini di risonanza magnetica cardiaca acquisite con sequenza cine su sezioni in
asse corto, ovvero perpendicolari all’asse longitudinale del ventricolo. Da tale segmentazione
sono stati resi disponibili 80 punti sul contorno dell’endocardio e dell’epicardio del ventricolo
sinistro, in 13 diversi piani, per un totale di 1040 punti. Questi punti sono stati inetrpolati tramite
NURBS (Non-Uniform Rational Basis Spline) per ottenere la geometria mostrata in Figura 3.6.
Figura 3.6: Geometria ventricolare ottenuta acquisendo da risonanza magnetica immagini secondo la modalità
asse corto.
Come anticipato nel paragrafo precedente, e come riportato in letteratura, l’orientamento delle
fibre non è uniforme all’interno del ventricolo. Al fine di replicare correttamente questo importante aspetto anatomico, si è reso necessario intervenire nella costruzione della geometria in
modo tale che fosse possibile introdurre adeguate distinzioni nella disposizione delle fibre. In
particolare, si è scelto di fare riferimento al lavoro di Hassaballah[18] , che sulla base dei dati
ricavati da Rohmer[39] , costruisce una semplice geometria ellissoidale e la suddivide in 8 settori,
all’interno di ciascuno dei quali inserisce una variazione lineare attraverso lo spessore dell’orientamento delle fibre, come riassunto in Figura 3.7 e precedentemente introdotto in Tabella
1.1.
CAPITOLO 3. MATERIALI E METODI
76
Figura 3.7: Geometria ellissoidale suddivisa in 8 settori in base all’orientamento delle fibre utilizzata nel lavoro
di Hassaballah[18] .
Per gli scopi di questo lavoro, si è ritenuto sufficiente ridurre a 4 il numero di settori in cui
partizionare la geometria, che per altro non è ellissoidale ma ricostruita da immagini cliniche.
Infatti, la differenza tra una zona basale e la corrispondente zona apicale è piuttosto esigua ed
è perciò stata ritenuta trascurabile. Allo stesso modo, si è scelto di non considerare in questo
modello alcuna variazione dell’angolo trasverso η.
Quindi, dagli 80 punti presenti su ciascun piano sono stati ricavati 4 gruppi di 20 nodi, a formare appunto le 4 regioni anteriore, posteriore, settale e laterale, ciascuna delle quali è stata
poi ulteriormente suddivisa in diversi strati attraverso lo spessore, per replicarne la variazione
transmurale. Il numero minimo di questi layer è stato individuato essere 8, in modo tale che la
differenza di orientamento tra uno strato e il successivo non fosse troppo marcata, e ben tollerata
dal solutore numerico.
Per ottenere strati geometrici diversi equi spaziati nell’intervallo tra epicardio ed endocardio, è
stato implementato un semplice algoritmo in ambiente Matlab® (MathWorksTM Inc., Natick,
MA, United States), che dati due punti (il primo appartenente allo strato dell’epicardio e il corrispondente sull’endocardio) restituisce le coordinate del punto intermedio, ottenute per media
aritmetica tra i valori di x, y, e z di ciascuno dei due nodi considerati. Iterando tre volte l’al-
CAPITOLO 3. MATERIALI E METODI
77
goritmo si è ottenuta la suddivisione della parete in 8 strati nello spessore, tra loro omogenei in
termini di spessore locale ad un dato valore di posizione assiale e circonferenziale nella parete
(Figura 3.8).
Figura 3.8: Creazione dei punti intermedi che individuano gli 8 strati nello spessore.
Il procedimento è ripetuto per i 13 piani, e porta ad ottenere globalmente 9360 punti. In Figura
3.9 si può vedere il ventricolo completo.
Figura 3.9: Ventricolo completo suddiviso in 8 strati su tutti i piani
CAPITOLO 3. MATERIALI E METODI
78
L’intera nuvola di punti ottenuta consente di ricostruire la geometria, che globalmente assume la
forma mostrata in Figura 3.10. Tale geometria deve poi essere discretizzata al fine di condurre
l’analisi ad elementi finiti. Entrambi i passaggi, ovvero costruzione della geometria e creazione
e della mesh, sono stati realizzati in Gambit® 2.4.6 (Ansys Inc., Canonsburg, PA, USA); a tale
scopo, lo script in Matlab® che genera gli strati di paretea partire dai punti ottenuti tramite
segmentazione di immagini cliniche è stato integrato con un secondo script, che genera un file
ASCII di tipo journal, che contiene la sequenza dei comandi da eseguire in Gambit® in modo
automatico. Tali comandi comprendono i) quelli necessari alla ricostruzione del volume della
parete ventricolare, ii) quelli necessari alla generazione della relativa mesh di esaedri lineari e
alla definizione dei gruppi di nodi e elementi necessari per definire l’orientamento locale delle
fibre e per applicare le condizioni al contorno nelle successive simulazioni, iii) quelli relativi
all’esportazione della mesh in un file ASCII con estensione .neu, convertibile tramite un ulteriore
script Matlab® in un file di input per Abaqus.
Figura 3.10: Geometria ventricolare risultante dopo la suddivisione in 8 strati e in 4 regioni anatomiche, secondo
due differenti viste.
Nel generare il modello geometrico e la mesh della parete ventricolare, particolare attenzione è
stata posta sulla regione apicale, che risulta piuttosto critica. Infatti per poter riempire il volume
con una mesh di tipo esaedrico anche a livello apicale, la soluzione più comoda e funzionale è
stata quella di chiudere con delle facce le spline circonferenziali relative al tredicesimo piano e
creare il volume compreso tra queste facce attraverso l’operazione “stitch faces”. A partire dai
CAPITOLO 3. MATERIALI E METODI
79
punti ottenuti sull’immagine di risonanza magnetica acquisita e segmentata nella posizione più
apicale, è stata ottenuta una serie di volumi (Figura 3.11).
Figura 3.11: Costruzione del volume dell’apice come unione dei volumetti in corrispondenza dell’ultimo piano.
La mesh completa è mostrata in Figura 3.12 per tre diversi gradi di infittimento, in cui la dimensione caratteristica degli elementi in zona apicale è stata impostata rispettivamente a 0.4, 0.8 e
1.6 mm. Tutte e tre le mesh sono state usate per le successive simulazioni, così da eseguire una
analisi di sensitività rispetto alle dimensioni degli elementi.
CAPITOLO 3. MATERIALI E METODI
Figura 3.12: Mesh ad esaedri lineari con tre gradi di infittimento progressivo.
80
CAPITOLO 3. MATERIALI E METODI
3.4.2
81
Definizione delle proprietà meccaniche del miocardio
Al fine di definire l’organizzazione delle fibre all’interno della parete ventricolare, e quindi le
proprietà meccaniche del miocardio, si è scelto di introdurre un sistema cilindrico globale centrato nel baricentro dei nodi della base del ventricolo, e si è utilizzato questo riferimento per
definire gli orientamenti delle fibre all’interno di ogni strato e di ogni regione anatomica, ruotando di un opportuno angolo il sistema locale attorno all’asse radiale. Solo l’apice ventricolare
è stato trattato in modo diverso: infatti si è optato per associare a questa regione un sistema
sferico, centrato nel punto corrispondente all’apice dell’epicardio, la cui posizione è nota dalle
acquisizioni di risonanza magnetica.
Forti dei buoni risultati ottenuti dallo studio della mesh condotto su geometrie cilindriche, si
è scelto di mantenere il set di parametri offerti da Guccione nel 1993[16, 14] , a meno del del
bulk modulus, che è stato impostato a un valore diastolico (K = 0.2 MPa), coerentemente con la
simulazione passiva che si intende simulare.
Essendo il miocardio un tessuto biologico, il valore della densità impostato per le prove è dello
stesso ordine di grandezza dell’acqua. In letteratura si trovano infatti valori di circa 1 cmg 3 [29] ,
pertanto è stato utilizzato un valore di densità che, rapportato alle unità di misura di MPa per gli
tonn
sforzi e mm per le lunghezze, è pari a 10−8 mm
3.
3.4.3
Definizione delle condizioni al contorno
Al fine di simulare l’esperimento di di McCulloch e colleghi del 1989[30] , sono state bloccate le
traslazioni dei nodi della mesh appartenenti alla base ventricolare, a mimare il vincolo imposto
dal setup sperimentale. Contestualmente sulla superficie endocardica del ventricolo è stata applicata una pressione uniforme, crescente linearmente nel tempo da 0 a 5 kPa in un intervallo di
0.8 s. La scelta di non superare questo valore pressorio massimo è dettata dal limite massimo di
capacità dei trasduttori di pressione utilizzati applicati alla parete dell’epicardio.
Capitolo 4
Risultati e Discussione
In questo capitolo si riportano i risultati ottenuti a seguito delle prove di inflazione passiva della
geometria ventricolare ottenuta da immagini di risonanza magnetica.
Per valutare la bontà della ricostruzione della struttura ventricolare, tenendo conto di aspetti
non trascurabili quali l’orientamento delle fibre all’interno della cavità e la diversa dispersione
a seconda della regione anatomica, si è reso necessario estrapolare dei dati che potessero essere
confrontabili con alcuni risultati trovati in letteratura. In particolare si è fatto riferimento a
lavori sperimentali di inflazione del ventricolo isolato da cuori canini[30] e a lavori in cui si è
ricostruita una mesh a elementi finiti di ventricolo destro e sinistro da immagini di risonanza
magnetica, simulandone il riempimento diastolico[3] . I principali parametri usati ai fini del
confronto sono la variazione volumetrica della cavità ventricolare e le deformazioni nella parete
cardiaca a fronte di una rampa pressoria da 0 a 5 kPa imposta alla parete endocardica nell’arco
di 0.8 s; durata della rampa e valore massimo di pressione replicano le condizioni usate in [30].
Il confronto è stato effettuato tenendo presente che immagini di risonanza magnetica da cui è
stato ottenuto il modello geometrico sono di un paziente con ventricolo sinistro dilatato, il cui
volume telesistolico è superiore ai valori riscontrabili in letteratura per soggetti sani.
Inoltre, i suddetti dati sono stati analizzati per la stessa simulazione effettuata con tre mesh
con elementi progressivamente più piccoli, con dimensione caratteristica rispettivamente di 1.6,
0.8 e 0.4 mm, così da condurre un’analisi di sensitività rispetto alla risoluzione della griglia di
82
CAPITOLO 4. RISULTATI E DISCUSSIONE
83
calcolo.
4.1
Volume intracavitario in funzione della pressione intracavitaria
Poiché il software Abaqus non consente di estrapolare direttamente i valori di volume della cavità, per ciascuna prova portata a termine sono state estratte le coordinate dei nodi dell’endocardio
per 21 istanti di tempo uniformemente distribuiti durante la durata del fenomeno simulato. Con
lo stesso approccio con cui si è realizzato il file journal importabile da Gambit®, approccio
descritto nel Paragrafo 3.4.1, in ogni istante temporale le coordinate dei nodi sull’endocardio
ventricolare sono state usate per ricostruire la geometria del volume intracavitario e misurarne
l’estensione.
A tale scopo, sono stati implementati due script Matlab®. Il primo di essi processa le coordinate
nodali per riordinare i nodi secondo uno schema regolare. A tale scopo si sfrutta il fatto che
i nodi sono disposti su una geometria ben descrivibile in coordinate cilindriche discretizzata
con una mesh strutturata; dopo aver convertito le coordinate cartesiane dei nodi in coordinate
cilindriche (θ , ρ, z), in cui l’asse z passa per il baricentro del ventricolo ed è allineato all’asse
lungo dello stesso, i nodi sono riordinati in modo che essi siano raggruppati in N livelli lungo
l’asse z e che in ogni livello siano ordinati per ordine crescente di coordinata angolare θ . Il
secondo script prende in ingresso le coordinate cartesiane dei nodi così riordinati e genera un file
journal importabile da Gambit®, in cui per ognuno degli N livelli i nodi sono interpolati da una
non-uniform rational basis spline (NURBS). Le N linee così ottenute sono quindi interpolate per
ottenere la superficie endocardica, usata per definire il volume da essa racchiuso. La procedura
è esemplificata in Figura 4.1.
CAPITOLO 4. RISULTATI E DISCUSSIONE
84
Figura 4.1: Processo di creazione della geometria del volume intracavitario per estrapolarne il valore di volume
ai diversi istanti temporali. (a) estrazione della nuvola di punti appartenenti alla superficie endocardica e ordinati
secondo le convenzioni di Abaqus; (b) riordino dei nodi, raggruppandoli in N livelli lungo l’asse z e disponendoli in
ogni livello per ordine crescente di coordinata angolare θ ; (c) creazione delle NURBS circonferenziali ottenute per
interpolazione dei nodi; (d) creazione delle NURBS verticali; (e) superficie endocardica ottenuta interpolando le
spline circonferenziali e verticali; (f) ottenimento del volume, attraverso la chiusura con altrettante due facce della
base ventricolare e del buco corrispondente all’apice.
CAPITOLO 4. RISULTATI E DISCUSSIONE
85
I valori di volume così ottenuti in funzione del tempo sono mostrati in Figura 4.2, per i diversi
gradi di infittimento della mesh. Confermato dagli studi condotti da Bettendorff-Bakman nel
2006[3] , il cui lavoro è basato sulla modellazione ad elementi finiti della riposta passiva del
miocardio, si può osservare che il volume non aumenta linearmente con la pressione, ma si
assesta a un valore di plateau. I risultati delle simulazioni sono ben approssimati da una curva
logaritmica, con un R2 che, a seconda delle mesh considerate, varia da 0.9504 a 0.9703. Appare
evidente che migliorare la risoluzione spaziale oltre a quella intermedia (0.8 mm) non porta a
variazioni significativa dei risultati.
È inoltre possibile notare, osservando la figura 4.3, che l’andamento delle curve risultanti dalle
simulazioni è in linea con quanto riscontrato in altri lavori sia sperimentali (Nonogi[32] ) che
computazionali (Bettendorff-Bakman[3] ).
Figura 4.2: Variazioni volumetriche della cavità ventricolare nel tempo all’aumentare del grado di infittimento
della mesh. I punti ottenuti sono interpolati con linee di tendenza di tipo logaritmico.
CAPITOLO 4. RISULTATI E DISCUSSIONE
86
Figura 4.3: Evoluzione temporale della pressione interna imposta alla parete endocardica e del relativo volume
estrapolato durante la fase di riempimento. I triangoli rappresentano i valori sperimentali estratti dalle misure di
Nonogi e colleghi[32] , le linee continue le curve pressorie imposte da Bettendorff-Bakman, e colleghi[3] .
Il limite principale di questi risultati consiste nel fatto che il modello di ventricolo si basa sulla
geometria di un paziente affetto da dilatazione ventricolare, con volume telesistolico di circa 240 ml. Tale valore è molto più alto di quello fisiologico, che rientra circa in un range di
62–120 ml per individui maschi, 58–103 ml per le femmine[5] . Questo limite è enfatizzato dal
fatto che i test sperimentali riportati in [30] e mimati dalla simulazione sono stati condotti su
cuori canini, che quindi hanno dei valori assoluti volumetrici molto inferiori a quelli umani,
partendo da un valore di 40 ml a pressione nulla e arrivando ad aumentare il volume della cavità
del 75 ad una pressione di 5 kPa.
Ai fini di un confronto con i valori sperimentali presi da letteratura, non solo in termini di anda-
CAPITOLO 4. RISULTATI E DISCUSSIONE
87
mento delle curve, ma anche di valori assoluti, sono state ricavate le curve pressione-variazione
percentuale di volume ottenuta dalla simulazione (ΔV%) per ciascun grado di infittimento della mesh. Queste curve sono state confrontate con la curva omologa ottenuta normalizzando le
variazioni di volume riportate da McCulloch per un volume iniziale di 40 ml, ovvero il valore
medio dei campioni usati negli esperimenti. In Figura 4.4 sono mostrati gli andamenti ottenuti,
ben approssimati da una curva polinomiale cubica, con un R2 che, a seconda delle mesh considerate, varia da e da 0.9961 a 0.9869. La scelta dell’interpolante è dettata dalla regressione
adottata dagli autori.
Figura 4.4: Curva-pressione-ΔV% ottenuta dalla simulazione per tre diversi gradi di infittimento della mesh,
normalizzando le variazioni di volume intracavitario all’istante iniziale. E’ mostrata in nero la curva sperimentale
ottenuta da McCulloch e colleghi[30] .
Analizzando il confronto tra gli andamenti delle diverse curve relative ai gradi di infittimento
della mesh, si può osservare come le due mesh più fini raggiungano una variazione volumetrica
percentualmente molto più significativa rispetto alla curva sperimentale, che trova buon accordo
con i dati relativi alla mesh più rada. All’origine di questa evidenza potrebbero esserci una serie
di ragioni tra cui:
• il fatto che il ventricolo del paziente adottato sia affetto da cardiomiopatia dilatativa potrebbe incidere sullo spessore della parete, che qualora più sottile comporterebbe una
maggiore variazione di volume a parità di pressione imposta;
CAPITOLO 4. RISULTATI E DISCUSSIONE
88
• i parametri adottati nelle simulazioni numeriche sono stimati su ventricoli umani, mentre gli esperimenti sono condotti su cuore canino: potrebbe entrare quindi in gioco una
variabilità inter-specie;
• una mesh composta da elementi con dimensione caratteristica maggiore è intrinsecamente
più rigida, da cui il comportamento meno cedevole rispetto alle altre due mesh;
• in silico i ventricoli sono trattati come isolati, quindi liberi di espandersi in ogni direzione, mentre stando alla procedura sperimentale descritta da McCulloch e colleghi, i test
sono eseguiti su cuori integri, pertando il ventricolo risente della presenza delle strutture
cardiache circostanti.
4.2
Deformazioni della parete ventricolare
Un ulteriore parametro di confronto con le prove sperimentali condotte da McCulloch e colleghi, che rende più apprezzabile l’analisi, sono le deformazioni registrate all’epicardio nelle tre
direzioni principali, ovvero fibra ( f f ), cross-fibra (ss) e normale uscente al piano contenente
le prime due (nn). I dati sperimentali di deformazione riportati nello studio sono stati ottenuti
tramite l’acquisizione video di marker posti in diverse regioni della superficie epicardica della
parete ventricolare, a formare i vertici di un triangolo equilatero di lato pari a circa 15 − 20 mm,
con il centroide posto rispettivamente a 30%, 50% e 75% della mediana congiungente l’anello
mitralico con l’apice ventricolare.
Ai fini del confronto con quei valori, si sono estrapolati dalle simulazioni i valori di deformazione nominale nelle tre direzioni principali all’epicardio nella regione anteriore e in quella
posteriore, che sono le uniche valutate sperimentalmente per via della tipologia di prova, che
prevede il gonfiaggio di un cuore intero.
Per ciascuna di queste aree anatomiche si è ricavata la media dei valori di deformazione per
elementi appartenenti a una patch quadrata di circa 2 cm di lato, ovvero di dimensioni analoghe
a quelle dei triangoli equilateri definiti dai marker negli esperimenti su cuore canino, selezionate
una nella zona basale, una ad altezza della regione medio-ventricolare e una in zona apicale. Si
CAPITOLO 4. RISULTATI E DISCUSSIONE
89
tenga presente che il modello computazionale sviluppato in questa tesi prevede la distinzione in
quattro settori anatomici, motivo per cui il confronto è potenzialemente più accurato.
Nelle pagine seguenti sono riportati, per ciascuna area di entrambe le regioni anatomiche, i
confronti tra i dati ottenuti sperimentalmente da McCulloch e le deformazioni estrapolate dalla
simulazione numerica per ciascun grado di infittimento della mesh, al variare del ΔV%.
CAPITOLO 4. RISULTATI E DISCUSSIONE
90
Figura 4.5: Valori di deformazione in corrispondenza della superficie epicardica al variare del ΔV% valutati
nella regione anteriore basale. Confronto tra le tre soluzioni numeriche e i valori sperimentali, nelle tre direzioni
principali.
CAPITOLO 4. RISULTATI E DISCUSSIONE
91
Figura 4.6: Valori di deformazione in corrispondenza della superficie epicardica al variare del ΔV% valutati
nella regione anteriore media. Confronto tra le tre soluzioni numeriche e i valori sperimentali, nelle tre direzioni
principali.
CAPITOLO 4. RISULTATI E DISCUSSIONE
92
Figura 4.7: Valori di deformazione in corrispondenza della superficie epicardica al variare del ΔV% valutati
nella regione anteriore apicale. Confronto tra le tre soluzioni numeriche e i valori sperimentali, nelle tre direzioni
principali.
CAPITOLO 4. RISULTATI E DISCUSSIONE
93
Figura 4.8: Valori di deformazione in corrispondenza della superficie epicardica al variare del ΔV% valutati
nella regione posteriore basale. Confronto tra le tre soluzioni numeriche e i valori sperimentali, nelle tre direzioni
principali.
CAPITOLO 4. RISULTATI E DISCUSSIONE
94
Figura 4.9: Valori di deformazione in corrispondenza della superficie epicardica al variare del ΔV% valutati
nella regione posteriore media. Confronto tra le tre soluzioni numeriche e i valori sperimentali, nelle tre direzioni
principali.
CAPITOLO 4. RISULTATI E DISCUSSIONE
95
Figura 4.10: Valori di deformazione in corrispondenza della superficie epicardica al variare del ΔV% valutati
nella regione posteriore apicale. Confronto tra le tre soluzioni numeriche e i valori sperimentali, nelle tre direzioni
principali.
CAPITOLO 4. RISULTATI E DISCUSSIONE
96
I risultati evidenziano che le deformazioni ottenute all’aumentare del volume sono in buon accordo con quanto accade in vivo, e che in effetti la relazione approssima bene l’andamento
lineare, confermato dai valori di R2 riportati in ciascun grafico. In tutto ciò, è comunque importante tenere conto di alcuni aspetti rilevanti, che influiscono sul confronto dei dati numerici
rispetto a quelli sperimentali:
• in corrispondenza della zona apicale, il sistema -pur essendo definito cilindrico- non segue
più la reale distribuzione delle fibre. Pertanto le deformazioni valutate nelle direzioni
principali possono non trovare piena corrispondenza.
• in corrispondenza della base, invece, il vincolo cinematico imposto causa probabili effetti
di bordo nei valori estratti dalla simulazione numerica.
• come introdotto nel paragrafo precedente, si nota che le estensioni volumetriche dei ventricoli simulati vanno ben oltre il dato sperimentale, che troverebbe probabilmente più
accordo avendo a disposizione più dati, soprattutto relativi a ventricoli fisiologici. Ciò
trova riscontro nel fatto che, come per le variazioni volumetriche, la mesh più rada si
comporta in modo meglio assimilabile al ventricolo canino.
4.3
Conclusioni e sviluppi futuri
I risultati ottenuti, pur con i limiti descritti sin qui, sono incoraggianti. Nonostante le possibili
differenze inter-specie in termini di proprietà meccaniche del miocardio, che non hanno potuto
rendere confrontabili in termini assoluti le simulazioni con i test in vitro, e nonostante l’utilizzo
di un modello geometrico di ventricolo ricostruito da immagini di un paziente affetto da dilatazione, la simulazione di un esperimento di pressurizzazione passiva del ventricolo sinistro ha
colto sia in termini qualitativi, sia in termini quantitativi diversi aspetti dell’evidenza sperimentale. Come detto nell’introduzione, la tesi qui presentata si inserisce in un’attività di ricerca più
ampia incentrata sull’analisi biomeccanica di valvole cardiache tramite modellazione numerica,
che si vuole estendere all’analisi congiunta di valvole e camere ventricolari. In questo modo
CAPITOLO 4. RISULTATI E DISCUSSIONE
97
sarebbe possibile modellizzare diversi scenari di interesse clinico caratterizzati dalla forte interdipendenza di valvole e ventricoli. In quest’ottica, lo sviluppo di un modello di miocardio
passivo qui riportato è il punto di partenza per una serie di ulteriori sviluppi volti all’obiettivo
più ampio sopra descritto.
Il primo passo potrebbe essere quello di una validazione ancor più robusta del modello di meccanica passiva del miocardio ventricolare, conducendo un’analisi più accurata dei parametri
costitutivi del modello adottato.
Successivamente si rende necessario acquisire un maggior numero di data-set da immagini di risonanza magnetica, rendendo oltremodo standardizzabile la costruzione della geometria e della
mesh. Verificati questi aspetti preliminari, la direzione è quella di estendere il modello costitutivo alla risposta attiva del tessuto miocardico, legata alla contrazione attiva delle fibre in esso
distribuito.
L’ultimo passo per arrivare alla realizzazione di un modello completo, che sia facilmente interfacciabile con dispositivi valvolari, sarebbe quello di tener conto di appropriate condizioni al
contorno che limitano e influenzano la risposta ventricolare. Si potrebbe ad esempio prevedere
l’influenza dei tessuti circostanti e in particolar modo del ventricolo destro, realizzando un intorno alla geometria ventricolare alla quale vengano attribuite delle proprietà adeguate, col fine
ultimo di ottenere una distribuzione di sforzi e deformazioni che trovino accordo con quanto
registrato in vivo.
Bibliografia
[1] Abaqus documentation 6.10.
[2] Giuseppe Anastasi. Trattato di anatomia umana, volume Volume primo. Edi. Ermes,
quarta edizione edition, 2010.
[3] D-E Bettendorff-Bakman, P Schmid, PP Lunkenheimer, and P Niederer. A finite element
study relating to the rapid filling phase of the human ventricles. Journal of theoretical
biology, 238(2):303–316, 2006.
[4] A K Bhowmick. Mechanical properties of polymers. Material Science and Engineering,
1, 2014.
[5] S Clay, K Alfakih, A Radjenovic, T Jones, and J P Ridgway. Normal range of human left
ventricular volumes and mass using steady state free precession mri in the radial long axis
orientation. Magnetic Resonance Materials in Physics, Biology and Medicine, 19(1):41–
45, 2006.
[6] K D Costa, J W Holmes, and A D McCulloch. Modelling cardiac mechanical properties in three dimensions. Philosophical Transactions of the Royal Society of London A:
Mathematical, Physical and Engineering Sciences, 359(1783):1233–1250, 2001.
[7] KD Costa, PJ Hunter, JM Rogers, J M Guccione, LK Waldman, and A D McCulloch.
A three-dimensional finite element method for large elastic deformations of ventricular
myocardium: I cylindrical and spherical polar coordinates. Journal of biomechanical
engineering, 118(4):452–463, 1996.
[8] H Demiray. Stresses in ventricular wall. Journal of Applied Mechanics, 43(2):194–197,
1976.
[9] S Dokos, B H Smaill, A A Young, and I J LeGrice. Shear properties of passive ventricular myocardium. American Journal of Physiology-Heart and Circulatory Physiology,
283(6):H2650–H2659, 2002.
[10] F Dorri, PF Niederer, and PP Lunkenheimer. A finite element model of the human left
ventricular systole. Computer methods in biomechanics and biomedical engineering,
9(5):319–341, 2006.
98
BIBLIOGRAFIA
99
[11] JS Frank and GA Langer. The myocardial interstitium: its structure and its role in ionic
exchange. The Journal of cell biology, 60(3):586–601, 1974.
[12] YC Fung, K Fronek, and P Patitucci. Pseudoelasticity of arteries and the choice of its mathematical expression. American Journal of Physiology-Heart and Circulatory Physiology,
237(5):H620–H631, 1979.
[13] W J Germann, C L Stanfield, and L Fadiga. Fisiologia umana. Edises, 2009.
[14] J M Guccione and A D McCulloch. Mechanics of active contraction in cardiac muscle: Part
i constitutive relations for fiber stress that describe deactivation. Journal of biomechanical
engineering, 115(1):72–81, 1993.
[15] J M Guccione, A D McCulloch, and L K Waldman. Passive material properties of intact
ventricular myocardium determined from a cylindrical model. Journal of Biomechanical
Engineering, 113(1):42–55, 1991.
[16] J M Guccione, L K Waldman, and A D McCulloch. Mechanics of active contraction
in cardiac muscle: Part ii cylindrical models of the systolic left ventricle. Journal of
biomechanical engineering, 115(1):82–90, 1993.
[17] M Hadjicharalambous, R Chabiniok, L. Asner, E Sammut, J Wong, G Carr-White, J Lee,
R Razavi, N Smith, and D Nordsletten. Analysis of passive cardiac constitutive laws for parameter estimation using 3d tagged mri. Biomechanics and modeling in mechanobiology,
14(4):807–828, 2015.
[18] A I Hassaballah, M A Hassan, A N Mardi, and M Hamdi. An inverse finite element method
for determining the tissue compressibility of human left ventricular wall during the cardiac
cycle. PloS one, 8(12):e82703, 2013.
[19] Archibald Vivian Hill. First and last experiments in muscle mechanics. Cambridge
University Press, 1970.
[20] G A Holzapfel and R W Ogden. Constitutive modelling of passive myocardium: a
structurally based framework for material characterization. Philosophical Transactions
of the Royal Society of London A: Mathematical, Physical and Engineering Sciences,
367(1902):3445–3475, 2009.
[21] JD Humphrey, RK Strumpf, and FCP Yin. Determination of a constitutive relation for
passive myocardium: I. a new functional form. Journal of biomechanical engineering,
112(3):333–339, 1990.
[22] JD Humphrey and FCP Yin. On constitutive relations and finite deformations of passive
cardiac tissue: I. a pseudostrain-energy function. Journal of biomechanical engineering,
109(4):298–304, 1987.
BIBLIOGRAFIA
100
[23] PJ Hunter, MP Nash, and GB Sands. Computational electromechanics of the heart.
Computational biology of the heart, 12:347–407, 1997.
[24] A F Huxley. Muscle structure and theories of contraction. Prog. Biophys. Biophys. Chem,
7:255–318, 1957.
[25] RCP Kerckhoffs, PHM Bovendeerd, JCS Kotte, FW Prinzen, K Smits, and T Arts. Homogeneity of cardiac contraction despite physiological asynchrony of depolarization: a model
study. Annals of biomedical engineering, 31(5):536–547, 2003.
[26] H M Lacker and C S Peskin. A mathematical method for the unique determination of crossbridge properties from steady-state mechanical and energetic experiments on macroscopic
muscle. Lect Math Life Sci, 16:121–153, 1986.
[27] I J LeGrice, BH Smaill, LZ Chai, SG Edgar, JB Gavin, and Peter J Hunter. Laminar structure of the heart: ventricular myocyte arrangement and connective tissue architecture in the dog. American Journal of Physiology-Heart and Circulatory Physiology,
269(2):H571–H582, 1995.
[28] S Marchesseau, H Delingette, M Sermesant, M Sorine, K Rhode, S Duckett, Christopher A
Rinaldi, R Razavi, and N Ayache. Preliminary specificity study of the bestel–clement–
sorine electromechanical model of the heart using parameter calibration from medical
images. Journal of the mechanical behavior of biomedical materials, 20:259–271, 2013.
[29] H Masugata, K Mizushige, S Senda, A Kinoshita, H Sakamoto, S Sakamoto, and H Matsuo. Relationship between myocardial tissue density measured by microgravimetry
and sound speed measured by acoustic microscopy. Ultrasound in medicine & biology,
25(9):1459–1463, 1999.
[30] AD McCulloch, BH Smaill, and PJ Hunter. Regional left ventricular epicardial
deformation in the passive dog heart. Circulation research, 64(4):721–733, 1989.
[31] D Mozaffarian, E J Benjamin, A S Go, D K Arnett, M J Blaha, M Cushman, S De Ferranti,
JP Després, H J Fullerton, V J Howard, et al. Executive summary: Heart disease and stroke
statistics. Circulation, 131(4):434–441, 2015.
[32] H Nonogi, O M Hess, M Ritter, and H P Krayenbuehl. Diastolic properties of the normal
left ventricle during supine exercise. British heart journal, 60(1):30–38, 1988.
[33] Ronney B Panerai. A model of cardiac muscle mechanics and energetics. Journal of
biomechanics, 13(11):929–940, 1980.
[34] M Patelli. Sviluppo e validazione preliminare di uno strumento software per la simulazione
numerica di operazioni di ricostruzione ventricolare a partire da immagini pre-operatorie
di risonanza magnetica. PhD thesis, Politecnico di Milano, 2015.
BIBLIOGRAFIA
101
[35] J G Pinto and P J Patitucci. Creep in cardiac muscle. American Journal of PhysiologyHeart and Circulatory Physiology, 232(6):H553–H563, 1977.
[36] JG Pinto. A constitutive description of contracting papillary muscle and its implications to
the dynamics of the intact heart. Journal of biomechanical engineering, 109(3):181–191,
1987.
[37] JG Pinto and PJ Patitucci. Visco-elasticity of passive cardiac muscle.
biomechanical engineering, 102(1):57–61, 1980.
Journal of
[38] A Redaelli and F Montevecchi. Biomeccanica: Analisi multiscala di tessuti biologici.
Patron Editore, 2008.
[39] D Rohmer, A Sitek, and G T Gullberg. Reconstruction and visualization of fiber and sheet
structure with regularized tensor diffusion mri in the human heart. Lawrence Berkeley
National Laboratory Publication. LBNL-60277, 2006.
[40] H Schmid, MP Nash, AA Young, and PJ Hunter. Myocardial material parameter estimation.a comparative study for simple shear. Journal of biomechanical engineering,
128(5):742–750, 2006.
[41] J Shim, A Grosberg, J C Nawroth, K K Parker, and K Bertoldi. Modeling of cardiac muscle
thin films: pre-stretch, passive and active behavior. Journal of biomechanics, 45(5):832–
841, 2012.
[42] E H Sonnenblick, E Braunwald, and A G Morrow. The contractile properties of human
heart muscle: studies on myocardial mechanics of surgically excised papillary muscles.
Journal of Clinical Investigation, 44(6):966, 1965.
[43] S C Tadepalli, A Erdemir, and P R Cavanagh. Comparison of hexahedral and tetrahedral
elements in finite element analysis of the foot and footwear. Journal of biomechanics,
44(12):2337–2343, 2011.
[44] A Tözeren. Continuum rheology of muscle contraction and its application to cardiac
contractility. Biophysical journal, 47(3):303, 1985.
[45] A I Veress, G T Gullberg, and J A Weiss. Measurement of strain in the left ventricle
during diastole with cine-mri and deformable image registration. Journal of biomechanical
engineering, 127(7):1195–1207, 2005.
[46] L K Waldman, D Nosan, F Villarreal, and J W Covell. Relation between transmural
deformation and local myofiber direction in canine left ventricle. Circulation Research,
63(3):550–562, 1988.
[47] A YK Wong. Mechanics of cardiac muscle, based on huxley’s model: mathematical
simulation of isometric contraction. Journal of biomechanics, 4(6):529–540, 1971.
BIBLIOGRAFIA
102
[48] A YK Wong. Mechanics of cardiac muscle, based on huxley’s model: simulation of active
state and force-velocity relation. Journal of biomechanics, 5(1):107–117, 1972.
[49] J. Xi, P Lamata, S Niederer, S Land, W Shi, X Zhuang, S Ourselin, S G Duckett, A K
Shetty, C A Rinaldi, et al. The estimation of patient specific cardiac diastolic functions
from clinical measurements. Medical image analysis, 17(2):133–146, 2013.
[50] L Zhong, D N Ghista, E YK Ng, and S T Lim. Passive and active ventricular elastances of
the left ventricle. Biomed Eng Online, 4(1):10, 2005.