Parte VI - Vitamine e altri argomenti
Risposte e breve discussione
1)
2)
3)
c. In Estremo Oriente il riso è un alimento di base. Tuttavia, nei casi in cui questo
rappresenti l'unico alimento, si può manifestare il beri-beri poiché il riso è povero di
vitamina B1 (tiamina). Il tiaminpirofosfato è il gruppo prostetico di enzimi che trasferiscono
gruppi aldeidici attivati. Tali enzimi comprendono la transchetolasi, la piruvato deidrogenasi
e la α-chetoglutarato deidrogenasi. Il beri-beri è una malattia carenziale i cui sintomi
principali sono dolori alle estremità provocati da una neuropatia periferica, debolezza
muscolare e ingrossamento cardiaco. I prodotti dei lieviti, il grano intero, le noccioline e la
carne di maiale sono ricchi di tiamina. Colina, etanolammina e serina sono molecole che
costituiscono le teste polari dei fosfolipidi. La glicina è un comune amminoacido.
b. La lipoammide, al pari del CoA, trasferisce gruppi acetile ma, a differenza di questo, non
è un cofattore stechiometrico bensì un cofattore catalitico di un complesso enzimatico. Un
gruppo disolfuro reattivo della lipoammide lega il gruppo acetile che deve essere trasferito.
La lipoammide diventa così acetilipoammide e quindi, dopo aver a sua volta ceduto il
gruppo acilico, diidrolipoammide. Questa reazione e la successiva rigenerazione della
lipoammide sono catalizzate da porzioni differenti dei complessi multienzimatici della
piruvato deidrogenasi e della isocitrato deidrogenasi. L'ATP trasferisce gruppi fosfato
mentre il tiammin pirofosfato trasferisce gruppi aldeidici. NADH e FADH trasferiscono
elettroni.
b. La piruvato carbossilasi catalizza la conversione del piruvato in ossalacetato nella
gluconeogenesi.
Piruvato + HCO3- + ATP → ossalacetato + ADP + Pi
4)
5)
6)
7)
L'attività della piruvato carbossilasi richiede biotina, Mg2+ e Mn2+ e l'enzima è attivato
allostericamente dall'acetil CoA. La biotina non viene carbossilata fino a quando l'acetil
CoA non si lega all'enzima. Per questa ragione, alti livelli di acetil CoA indicano il bisogno
di ossalacetato. Quando i livelli di ATP sono elevati, l'ossalacetato viene consumato nella
gluconeogenesi. Quando invece i livelli di ATP sono bassi l'ossalacetato entra nel ciclo di
Krebs. La gluconeogenesi avviene soltanto nel fegato e nel rene.
b. L'acido pantotenico, detto anche co-acetilasi, è un componente del coenzima A (CoA).
L'acetil Coa è la forma attivata dell'acetato utilizzata nelle reazioni di acetilazione che si
hanno nel ciclo dell'acido citrico e nel metabolismo degli acidi grassi e del colesterolo. Un
deficit di acido pantotenico provocherebbe la diminuzione delle riserve di CoA e avrebbe
conseguenze negative nei mammiferi. Poiché, tuttavia, questa molecola è abbastanza diffusa
negli alimenti, non sono mai stati descritti casi di deficit di acido pantotenico negli uomini.
c. L'anemia perniciosa è provocata dall'impossibilità di assorbire la vitamina B12 nel tratto
gastro-intestinale. Questo fatto potrebbe essere legato ad un deficit di fattore intrinseco, a
gastrectomia totale o a malattie dell'intestino tenue. I segni più precoci di anemia perniciosa
non compaiono prima di 3-5 anni dall'instaurarsi dello stato carenziale.
c. Il pigmento retinico rodopsina è costituito dall'associazione della vitamina A in forma di
11-cis-retinale con l'opsina, una proteina. La rigenerazione della rodopsina passa attraverso
la rigenerazione dell'11-cis-retinale. La reazione al buio coinvolge l'isomerizzazione del
retinale tutto-trans in 11-cis-retinale, che quindi si combina con l'opsina per riformare la
rodopsina. Un deficit di vitamina A è associato a cecità notturna. La vitamina A spesso
deriva dai β-caroteni di origine vegetale.
d. Per essere convertita in trombina, la protrombina deve legare ioni Ca++ che la ancorano
alle membrane piastriniche a seguito di un trauma. L'affinità della protrombina per gli ioni
8)
9)
10)
11)
12)
13)
14)
Ca++ dipende dalla presenza di 10 residui di γ-carbossiglutammato nella sua regione ammino
terminale. La γ-carbossilazione dipende dalla vitamina K ed è una modificazione
postraduzionale, che avviene quando la catena nascente della protrombina è sintetizzata nel
reticolo endoplasmatico rugoso degli epatociti e passa all'interno del lume del reticolo. Gli
anticoagulanti warfarin e dicumarolo sono analoghi strutturali che bloccano la γcarbossilazione della protrombina sostituendosi alla vitamina K. In presenza di tali farmaci,
la protrombina prodotta possiede una scarsa affinità per gli ioni Ca++ e non può legarsi
adeguatamente alle membrane piastriniche per essere convertita in trombina.
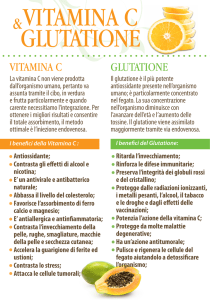
e. L'acido ascorbico, vitamina C, si trova nella frutta e nei vegetali freschi. Il deficit di acido
ascorbico determina l'insorgenza dello scorbuto, noto in passato come "malattia dei
marinai". L'acido ascorbico è necessario per l'idrossilazione della prolina a idrossiprolina nel
collageno, un processo essenziale per la formazione ed il mantenimento strutturale dei
tessuti connettivi. Nello scorbuto si ha una sintesi alterata del collageno da parte delle cellule
mesenchimali con un conseguente danno a carico dei tessuti scheletrici, dentali e connettivi.
Tiamina, niacina, cobalammina e acido pantotenico sono invece presenti nei pesci e nelle
carni.
c. Certi amminoacidi e lipidi sono essenziali da un punto di vista nutrizionale perché
l'organismo umano non può sintetizzarli. L'energia normalmente ottenuta dai carboidrati può
essere ottenuta dai lipidi e dalla conversione di alcuni amminoacidi in intermedi del ciclo
dell'acido citrico.
b. Il ferro ferroso (Fe2+) è la forma assorbita nell'intestino dalla ferritina, trasportata nel
plasma dalla transferrina e immagazzinata nel fegato legata alla ferritina o in forma di
emosiderina. Non esiste una via di escrezione per il ferro. Per questo motivo, un'eccessiva
assunzione di ferro per periodi prolungati può causare l'emocromatosi. Questa è una
condizione in cui si verifica una diffusa deposizione di emosiderina nel fegato, nel pancreas
e nelle ghiandole surrenali. Tra le principali conseguenze di questa condizione vi sono la
cirrosi, il diabete mellito ed alterazioni della pigmentazione cutanea.
b. L'attività antiossidante del glutatione dipende dal mantenimento del suo stato ridotto.
L'enzima glutatione reduttasi trasferisce elettroni dal NADPH al glutatione ossidato
attraverso il FAD. Il glutatione ossidato è composto da due molecole di glutatione unite tra
loro da un ponte disolfuro. Il glutatione ridotto è un tripeptide con un gruppo sulfidrilico
libero. E' la presenza di questo sulfidrile che garantisce l'attività antiossidante del glutatione.
Negli eritrociti, la funzione dei residui di cisteina dell'emoglobina e di altre proteine viene
mantenuta grazie al potere riducente del glutatione.
c. La maltasi, insieme ad altre disaccaridasi, amminopeptidasi e dipeptidasi, è prodotta dalle
cellule della mucosa intestinale. Esistono due tipi di amilasi, una presente nella saliva e
l'altra di origine pancreatica. Chimotripsina ed elastasi sono endoproteasi presenti nel succo
pancreatico mentre la pepsina è un endoproteasi di origine gastrica.
a. La principale funzione della bile è quella emulsionante ovvero la capacità di ridurre la
tensione superficiale delle goccioline lipidiche alimentari durante la digestione. Grazie a
questa azione, svolta in particolare dai sali biliari, gli aggregati lipidici sono ridotti a piccole
particelle, dette micelle, facilmente aggredibili dagli enzimi idrolitici. Questi ultimi sono i
diretti responsabili dell'azione digestiva sui grassi alimentari. Un'altra importante azione
della bile è quella di neutralizzare il chimo acido proveniente dallo stomaco. Questa
funzione è svolta dalla bile assieme al succo pancreatico, particolarmente ricco in
bicarbonati. La presenza di colesterolo, sali biliari, bilirubina, ma anche di altre sostanze
quali farmaci e tossine, giustifica la funzione escretoria della bile.
e. Il morbo celiaco, stato patologico tipico dell'età infantile, è presumibilmente legato
all'assorbimento di frammenti proteici parzialmente digeriti. Questi determinano un
ipersensibilizzazione dell'organismo verso alimenti contenenti certi tipi di proteine, la più
nota delle quali è il glutine. Difetti di assorbimento di zuccheri e lipidi non causano risposte
15)
16)
17)
18)
19)
20)
immunologiche abnormi, mentre la carenza di assorbimento di certe vitamine può condurre
verso stati carenziali.
e. Serina e treonina sono amminoacidi che possiedono un gruppo ossidrilico nella catena
laterale. Questo gruppo può essere impegnato nella formazione di un legame O-glicosidico
con residui zuccherini nelle glicoproteine. L'idrossilisina, residuo presente nel collageno
come conseguenza di una modificazione posttraduzionale, rappresenta un sito di
glicosilazione. Unità saccaridiche possono essere legate anche a residui di asparagina con
legami N-glicosidici. Non sono invece attualmente note proteine con residui di tirosina
glicosilati. I residui di tirosina sono, invece, spesso oggetto di reazioni di fosforilazione
nell'ambito della regolazione covalente dell'attività enzimatica.
d. I legami crociati del collageno hanno la funzione di stabilizzare le fibre della proteina.
Questi si formano in seguito all'azione della lisil ossidasi, un enzima contenente rame che
catalizza la deaminazione ossidativa dei gruppi ε-amminici di certi residui di lisina e
idrossilisina, producendo gruppi aldeidici reattivi (allisine). I gruppi così formati possono
andare incontro a reazioni di condensazione aldolica con altri residui di allisina oppure
formare basi di Schiff con gruppi amminici di lisine e idrossilisine. Tali reazioni, dopo
ulteriori modificazioni, generano legami crociati stabili che hanno grande importanza per la
resistenza alla trazione della fibra del collageno. Le singole catene polipeptidiche del
collageno formano eliche che, tuttavia, non sono stabili. Soltanto l'associazione in una tripla
elica permette la stabilizzazione conformazionale della molecola. Le estremità ricche in
cisteina presenti nella molecola di procollageno sono importanti per la formazione della
tripla elica favorendo la messa in registro delle singole catene ma, una volta svolto questo
compito, tali estremità sono rimosse per idrolisi enzimatica.
a. La sindrome di Marfan, malattia ereditaria che colpisce il tessuto connettivo, è dovuta a
mutazioni che colpiscono il gene della fibrillina, una proteina presente nelle microfibrille. I
soggetti colpiti da sindrome di Marfan hanno tratti caratteristici quali, dita molto lunghe
(aracnodattilia), iperestensibilità delle articolazioni e spiccata tendenza a presentare
alterazioni dell'aorta. Le altre condizioni patologiche indicate dalle risposte sono invece
legate ad anomalie nel processo di sintesi del collageno.
a. L'unità disaccaridica ripetitiva dell'eparina contiene glucosammina e acido iduronico.
Gran parte dei gruppi amminici dei residui di glucosammina sono legati a gruppi solfato. Nacetilglucosammina e acido glicuronico sono le unità ripetitive dell'acido ialuronico. Nacetilgalattosammina, acido glicuronico e solfati sono caratteristici del condroitin solfato. Nacetilglucosammina, galattosio e solfati sono invece caratteristici dei cheratan solfati. Infine,
N-acetilgalattosammina, acido iduronico e solfato sono i costituienti del dermatan solfato.
a. I principali eventi biochimici che si manifestano durante un ciclo di contrazione e
rilasciamento muscolare possono essere riassunti in cinque tappe. i) Nella fase di
rilasciamento ogni testa della miosina idrolizza l'ATP legato senza tuttavia rilasciare i
prodotti di idrolisi. ii) Quando viene stimolata la contrazione, attraverso una serie complessa
di eventi cui partecipano diversi fattori, l'actina diviene accessibile ed è legata alle teste della
miosina. iii) La formazione di tale complesso promuove il rilascio del fosfato e dell'ADP e a
ciò consegue il cambiamento conformazionale della testa della miosina che porta allo
scorrimento dei filamenti. iv) Una molecola di ATP si lega alla miosina. v) Il complesso
formato ha una scarsa affinità per l'actina che viene rilasciata. Quest'ultima tappa
rappresenta un momento cruciale nel processo di rilasciamento che dipende, quindi, dal
legame dell'ATP al complesso actina-miosina.
c. La fosfocreatina costituisce un'importante riserva di energia per il tessuto muscolare.
Questa molecola impedisce la rapida deplezione dell'ATP fornendo un gruppo fosfato di
pronto impiego, che può essere utilizzato per rigenerare rapidamente l'ATP dall'ADP. La
fosfocreatina si forma a partire da ATP e creatina nei momenti in cui il muscolo è rilassato e
le richieste di ATP non sono rilevanti. L'enzima che catalizza la fosforilazione della creatina
21)
22)
23)
24)
25)
26)
è la creatina chinasi (CK), un enzima specifico del muscolo il cui dosaggio è utile in clinica
per la diagnosi di malattie acute o croniche a carico del tessuto muscolare. La presenza di
isoenzimi caratteristici del tessuto miocardico permette di utilizzare la CK anche come
marker diagnostico di malattie cardiache quale, ad esempio, l'infarto miocardico.
b. Il citoscheletro è costituito da un'estesa rete di strutture filamentose intracellulari che
permettono lo svolgimento di importanti funzioni quali esocitosi, endocitosi, trasporto
intracellulare, morfogenesi ed altre. Queste strutture comprendono i filamenti di actina, noti
anche come microfilamenti, i microtubuli, costituiti soprattutto da α- e β-tubulina, e i
filamenti intermedi. Questi ultimi comprendono le cheratine, le proteine simili alla
vimentina, i neurofilamenti e le lamine.
c. La transferrina è una α1-globulina del peso molecolare di circa 76 kDa, sintetizzata nel
fegato. Essa svolge un ruolo fondamentale nel metabolismo del ferro garantendo il trasporto
di questo, in forma ferrica, nel plasma. Il ferro è quindi trasportato dalla transferrina, in un
rapporto di due moli di Fe3+ per mole di proteina, nei siti in cui esso è necessario. La
ceruloplasmina è invece una voluminosa proteina implicata nel trasporto del rame. La
ferritina consente il deposito del ferro e i suoi livelli tendono ad aumentare in quei pazienti
in cui c'è un eccesso di questo elemento. L'aptoglobina è una glicoproteina plasmatica che
lega l'emoglobina extraeritrocitaria formando con questa un complesso molto stabile. Questo
legame impedisce il filtraggio renale dell'emoglobina libera, la quale avrebbe una naturale
tendenza a precipitare nei tubuli renali. La funzione dell'aptoglobina è dunque quella di
impedire la perdita dell'emoglobina e del ferro contenuto in essa. La mioglobina è una
proteina muscolare la cui funzione è quella di immagazzinare ossigeno.
c. Le immunoglobuline (Ig), proteine plasmatiche che migrano con la frazione γ-globulinica,
sono glicoproteine prodotte dalle plasmacellule e possono essere presenti anche nei secreti
delle mucose svolgendo un'azione protettiva nei confronti delle aggressioni da agenti
patogeni. Le Ig presentano una struttura di base data dall'associazione di quattro catene
polipeptidiche, due pesanti e due leggere, mediante ponti disolfuro. Il grado di complessità
strutturale nonché le caratteristiche funzionali delle varie molecole permettono una
classificazione delle Ig. Il peso molecolare delle quattro catene è compreso tra 150 e 190
kDa ma alcune classi di Ig, ad esempio le IgM, sono caratterizzate dall'associazione di più
copie della molecola di base e possono raggiungere pesi molecolari fino a 900 kDa.
c. L'emofilia A è una malattia ereditaria legata al cromosona X, in cui si verifica un deficit
del fattore VIII. Questa condizione patologica è caratterizzata da un difettoso processo
emocoagulativo con conseguenti emorragie.
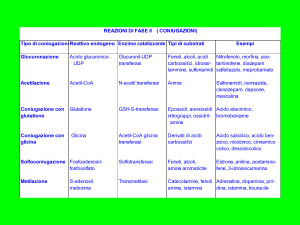
d. La detossificazione degli xenobiotici è un processo che avviene per la massima parte a
livello del fegato. Tra le principali reazioni coinvolte nella trasformazione di xenobiotici vi
sono le idrossilazioni e le reazioni di coniugazione con vari composti. Importanti reazioni di
coniugazione sono la glicuronazione, la solfatazione, l'acetilazione, la metilazione e la
coniugazione con glutatione. La funzione di queste reazioni è quella di rendere la molecola
"estranea" maggiormente solubile e di favorirne così l'eliminazione. La carbammilazione è
una reazione spontanea cui può andare incontro una certa proteina e non ha importanza nella
trasformazione degli xenobiotici. Di un certo rilievo possono essere le reazioni di
dealogenazione di certe molecole tossiche caratterizzate dalla presenza di alogeni.
b. I protoncogeni sono geni presenti in cellule normali i cui prodotti svolgono importanti
ruoli nella differenziazione, crescita e duplicazione cellulare. Questi possono essere attivati a
oncogeni con vari meccanismi tra i quali ricordiamo l'inserzione nel promotore,
l'inserimento di elementi amplificatori, traslocazioni cromosomiche, amplificazione genica e
mutazioni puntiformi.