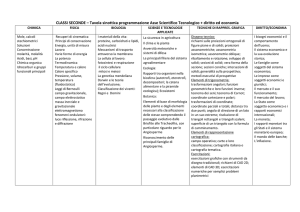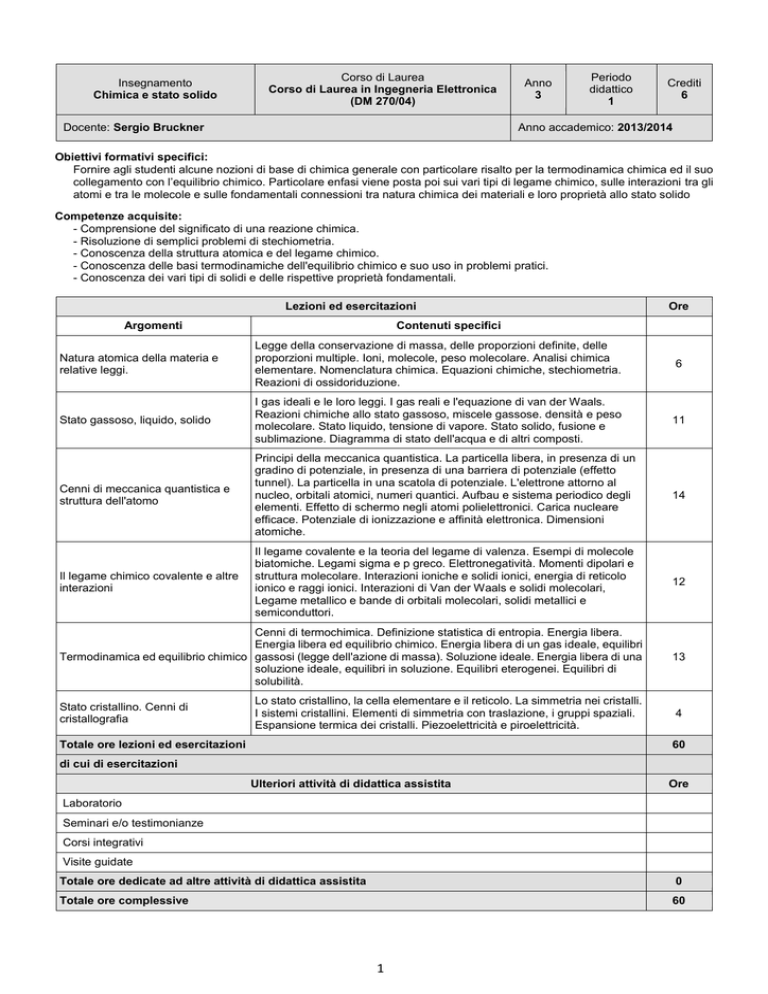
Insegnamento
Chimica e stato solido
Corso di Laurea
Corso di Laurea in Ingegneria Elettronica
(DM 270/04)
Docente: Sergio Bruckner
Anno
3
Periodo
didattico
1
Crediti
6
Anno accademico: 2013/2014
Obiettivi formativi specifici:
Fornire agli studenti alcune nozioni di base di chimica generale con particolare risalto per la termodinamica chimica ed il suo
collegamento con l’equilibrio chimico. Particolare enfasi viene posta poi sui vari tipi di legame chimico, sulle interazioni tra gli
atomi e tra le molecole e sulle fondamentali connessioni tra natura chimica dei materiali e loro proprietà allo stato solido
Competenze acquisite:
- Comprensione del significato di una reazione chimica.
- Risoluzione di semplici problemi di stechiometria.
- Conoscenza della struttura atomica e del legame chimico.
- Conoscenza delle basi termodinamiche dell'equilibrio chimico e suo uso in problemi pratici.
- Conoscenza dei vari tipi di solidi e delle rispettive proprietà fondamentali.
Lezioni ed esercitazioni
Argomenti
Ore
Contenuti specifici
Natura atomica della materia e
relative leggi.
Legge della conservazione di massa, delle proporzioni definite, delle
proporzioni multiple. Ioni, molecole, peso molecolare. Analisi chimica
elementare. Nomenclatura chimica. Equazioni chimiche, stechiometria.
Reazioni di ossidoriduzione.
6
Stato gassoso, liquido, solido
I gas ideali e le loro leggi. I gas reali e l'equazione di van der Waals.
Reazioni chimiche allo stato gassoso, miscele gassose. densità e peso
molecolare. Stato liquido, tensione di vapore. Stato solido, fusione e
sublimazione. Diagramma di stato dell'acqua e di altri composti.
11
Cenni di meccanica quantistica e
struttura dell'atomo
Principi della meccanica quantistica. La particella libera, in presenza di un
gradino di potenziale, in presenza di una barriera di potenziale (effetto
tunnel). La particella in una scatola di potenziale. L'elettrone attorno al
nucleo, orbitali atomici, numeri quantici. Aufbau e sistema periodico degli
elementi. Effetto di schermo negli atomi polielettronici. Carica nucleare
efficace. Potenziale di ionizzazione e affinità elettronica. Dimensioni
atomiche.
14
Il legame chimico covalente e altre
interazioni
Il legame covalente e la teoria del legame di valenza. Esempi di molecole
biatomiche. Legami sigma e p greco. Elettronegatività. Momenti dipolari e
struttura molecolare. Interazioni ioniche e solidi ionici, energia di reticolo
ionico e raggi ionici. Interazioni di Van der Waals e solidi molecolari,
Legame metallico e bande di orbitali molecolari, solidi metallici e
semiconduttori.
12
Cenni di termochimica. Definizione statistica di entropia. Energia libera.
Energia libera ed equilibrio chimico. Energia libera di un gas ideale, equilibri
Termodinamica ed equilibrio chimico gassosi (legge dell'azione di massa). Soluzione ideale. Energia libera di una
soluzione ideale, equilibri in soluzione. Equilibri eterogenei. Equilibri di
solubilità.
13
Lo stato cristallino, la cella elementare e il reticolo. La simmetria nei cristalli.
I sistemi cristallini. Elementi di simmetria con traslazione, i gruppi spaziali.
Espansione termica dei cristalli. Piezoelettricità e piroelettricità.
4
Stato cristallino. Cenni di
cristallografia
Totale ore lezioni ed esercitazioni
60
di cui di esercitazioni
Ulteriori attività di didattica assistita
Ore
Laboratorio
Seminari e/o testimonianze
Corsi integrativi
Visite guidate
Totale ore dedicate ad altre attività di didattica assistita
0
Totale ore complessive
60
1
Modalità d'esame: Prova scritta
Testi consigliati:
- Lezioni ed Esercitazioni di Chimica. Autori: S. Brückner V. Novelli M. Tolazzi. Edizioni LINT Trieste
Ulteriore materiale didattico o informazioni reperibili al sito http://www.webalice.it/sergio.bruckner
2