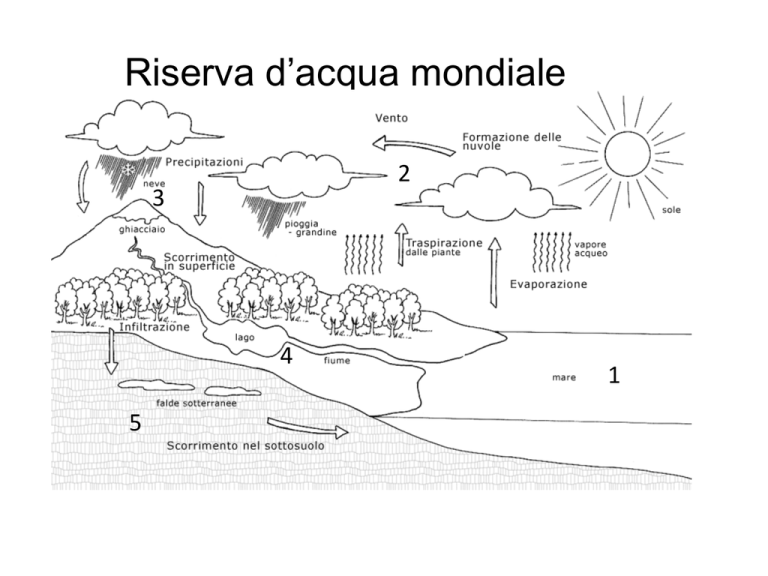
Riserva d’acqua mondiale
2
3
4
5
1
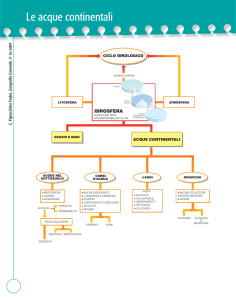
Ciclo idrologico
Caratterizzato dai processi di:
•
•
•
•
Evaporazione
Traspirazione
Precipitazione
Deflusso
ATMOSFERA (vapore ⇄ liquido ⇄ solido)
↑↓
SUPERFICIE (liquido ⇄ solido)
↑↓
FALDA
(vapore ⇄ liquido)
L’umanità utilizza fra il 40% ed il 50% delle acque accessibili
A causa della rapida crescita della popolazione
della Terra, la disponibilità d’acqua dolce pro
capite è diminuita da 12.900 m3 per anno nel
1970 a 9.000 m3 nel 1990. Nel 2000 era a
meno di 7.000 m3
La disponibilità di acqua dolce continuerà a
diminuire arrivando a 5.100 m3 pro capite per
anno nel 2025.
Un miliardo di persone ha sete: un miliardo di persone nel mondo non ha
accesso all'acqua potabile.
Due miliardi di persone (compresi gli abitanti dell'Italia meridionale) non
possono contare su un rifornimento adeguato
Per produrre 1 kg di carne di manzo sono necessari 15000 L/kg di acqua
Acqua usata dall’uomo
• Acqua dolce superficiale
• Acqua dolce sotterranea
• Oceani (piccola frazione)
• Disponibilità totale 4500 milioni m3/giorno
Uso di acqua negli USA (milioni m3 al giorno)
ANNO
PRELIEVO TOTALE
USO DISTRUTTIVO
1960
1000
200
1980
2100
700
2000
3400
900
Classificazione delle Acque
Acque Naturali
Acque meteoriche
Acque telluriche
Superficiali
Potabili
Acque di
superficie
Profonde
Minerali
Termali
Acque Superficie
Dolci
(0.1-1 g/L)
Stagnanti
Salate
(33-35 g/L)
Correnti
Tipi particolari di acque superficiali
•
Laghi salmastri
• Lagune
•Foci
•Immissario
Stratificazione delle acque
• Sistema eterogeneo
(soluzione acquosa, corpo di fondo insolubile, materiale in
sospensione, microorganismi, gas disciolti)
Sedimento
I sedimenti sono gli strati di minerali e particelle organiche, spesso a grana
fine, presenti sul fondo dei corpi idrici naturali.
Acqua interstiziale o di porosità consente il trasferimento di inquinanti e
sostanze dalla fase solida alla fase liquida
Ossigeno in acqua
•Fonti di ossigeno:
– Atmosfera
– Attività fotosintetica
•Perdita di ossigeno:
– Processi respirazione
– Decomposizione sostanza organica
– Biossidazione di composti azotati
– Ossidazioni chimiche e biochimiche
Solubilità dei gas in acqua naturale
Gas (g) ⇄ Gas (aq)
• Pressione parziale del gas in atmosfera
• Temperatura
• Contenuto salino
Solubilità dei gas in acqua naturale
• Legge di Henry
[Gas (aq)] = K ∙ Pgas
non tiene conto delle eventuali interazioni in acqua
a 298 K
K/(mol L-1atm-1)
O2
1,28·10-3
CO2
3,38·10-2
H2
7,90·10-4
CH4
1,34·10-3
N2
6,48·10-4
NO
2,00·10-4
PO = (1,0000 atm – 0,0313)·0,2095 =
2
0,2029 atm
[O2(aq)] = K· PO =
1,28 ·10-3 · mol L-1atm-1 · 0,2029 atm =
2,60 ·10-4 mol L-1
[O (aq)] = SO = 8,32 mg L-1 a 298 K e 1
2
2
Solubilità dei gas in acqua naturale
• Legge di Clausius Clapeyron
c1
ΔH 1 1
−
log
=
c 2 2,303 R T1 T2
SO2 a 0 °C 14,75 mg/L
SO2 a 25 °C 8,32 mg/L
SO2 a 35 °C 7,03 mg/L
Ossigeno in acqua
• SO2 a 25 °C = 8,32 mg/L
{CH2O} + O2 CO2 + H2O Fragilità acqua
• SO2 ≠ DO
– DO << SO2 acqua inquinata, eutrofizzata
– DO = SO2 acqua distillata
– DO > SO2 acqua soprassatura
• DO dipende anche da:
– turbolenza
– dimensione bolle
– temperatura
Misura del DO
• Misura in situ
sensore di Clark
dispositivo elettrochimico preventivamente
tarato costituito da
– membrana gas permeabile
– catodo Pt (dove ho riduzione di O2)
– anodo Ag/AgCl
DO determinato per via amperometrica
i ∝ [O 2 ]
Misura del DO
• Metodo di Winkler
titolazione
riduzione di O2 con Mn2+ e successiva
titolazione iodometrica delle specie Mn(IV)
e Mn(III) formate
1 mole O2 = 2 moli I2
Criteri di qualità dell’acqua
• Sono dei metodi:
• COD domanda chimica di ossigeno
• BOD domanda biochimica di ossigeno
• TOC carbonio organico totale
COD Chemical Oxygen Demand
• Indice che misura il grado di inquinamento da
parte di sostanze ossidabili
• mg/L O2 necessari per la completa ossidazione
di composti organici e inorganici presenti in
acqua
Misura del COD
• Aggiunta di K2Cr2O7 in eccesso in ambiente
acido
• Retrotitolazione con (NH4)2Fe(SO4)2·6 H2O
• Interferenza: cloruri
(non ossidati in condizioni naturali)
eliminati con aggiunta di Ag2SO4 e
HgSO4
TOC Total organic carbon
• Indice che misura in modo non specifico il
grado di inquinamento da materiale organico
• mg/L CO2 sviluppata ossidando completamente
il carbonio organico
Misura del TOC
-
Si rimuove CO2 formata da HCO3 e CO32- aggiungendo
H3PO4 in flusso di azoto
Ossidazione catalitica con K2S2O8 e radiazione UV
La CO2 sviluppata è misurata con apposito rivelatore
Interferenze: cloruri, la filtrazione può comportare una
diminuzione/aumento del disciolto per adsorbimento o
desorbimento su filtro se presenti particelle carboniose
BOD Biochemical Oxygen Demand
• Indice che misura indirettamente il contenuto di
materiale organico biodegradabile presente in
acqua
• mg/L O2 necessari per la biodegradazione di
composti organici presenti in acqua da parte di
microrganismi a una certa temperatura e in un
dato intervallo di tempo
Misura BOD5
• Saturare campione con ossigeno e inoculare
microrganismi (fanghi attivi diluiti)
• Conservare campione a temperatura costante
(20 °C) e pH tamponato (basi acido fosforico) al
buio per 5 gg
• BOD = DOt=0 – DOt=5 gg
• Acqua non
inquinata 0,7 mg/L
• Acqua reflua circa 100 mg/L
Lo ione calcio, insieme al magnesio e, alle volte, allo ione ferro(II), costituisce la
durezza dell’acqua.
La durezza viene generalmente espressa in gradi francesi (°F), dove un grado rappresenta 10 mg di
carbonato di calcio (CaCO3) per litro di acqua (1°F = 10 mg/l = 10 ppm - parti per milione).
In genere, le acque vengono classificate in base alla loro durezza come segue
•fino a 7°F : molto dolci
•da 7°F a 15°F : dolci
•da 15°F a 20°F : poco dure
•da 20°F a 30°F : mediamente dure
•da 30°F a 50°F : dure
•oltre 50°F : molto dure
La durezza di un'acqua può venire abbassata facendola passare su una resina a scambio ionico, che
consiste di un polimero recante ioni sodio (Na+) che vengono scambiati al passaggio con gli ioni calcio e
magnesio dell'acqua. Gli ioni calcio e magnesio risultano quindi trattenuti dalla resina, che viene poi
successivamente rigenerata per trattamento con acqua salata concentrata.
La misura della durezza viene fatta titolando il campione di acqua con una soluzione di acido
etilendiamminotetraacetico (EDTA) a concentrazione esattamente nota in presenza di nero eriocromo T
(NET), un indicatore che assume colore rosa in presenza di ioni di calcio e magnesio liberi.
All'interno di un intervallo di valori di pH ben definito, l'EDTA forma con gli ioni calcio e magnesio un
complesso molto stabile; quando tutti gli ioni di calcio e magnesio sono complessati, il nero eriocromo T
vira da rosa a blu scuro. Il pH viene portato ai valori ottimali per aggiunta di una soluzione tampone a base
di ammoniaca.
La durezza temporanea è dovuta alla presenza di calcio e ioni bicarbonato e può
essere eliminata tramite ebollizione
Ca 2+ + 2HCO 3− ↔ CaCO 3 (s) + CO 2 (g) + H 2 O
L’aumento di temperatura sposta l’equilibrio a destra a causa dell’eliminazione di
CO2, con formazione di un precipitato bianco di carbonato di calcio.
Viceversa, un alto livello di CO2 disciolto porta facilmente in soluzione il calcio dai
suoi minerali carbonato.
La quantità di biossido di carbonio che un corpo d’acqua può prendere
dall’atmosfera in equilibrio con esso non è sufficiente a spiegare i livelli di Ca
osservati (cosa che accade specialmente nelle acque sotterranee) occorre
considerare la respirazione dei microrganismi in acqua, nei sedimenti e nel
suolo.
Per le acque dolci, l’ordine di grandezza tipicamente accettato per le
concentrazioni di HCO3- e Ca2+ è di 1x10-3 M (vedi discussione seguente).
Correzione delle acque
Deacidificazione: riduzione di CO2; si elimina aggressività dell’acqua e la corrosione delle
tubature. Aereazione o introduzione sostanze basiche
Indurimento aumento della durezza facendo circolare l’acqua in serbatoi con polvere di
marmo
Deferizzazione
Demanganizzazione
Deodorazione
Desapidazione
Anidride carbonica in acqua
•Fonti di CO2:
–
–
–
–
Atmosfera
Sorgenti sotterranee contenenti H2CO3
Respirazioni
Decomposizione sostanza organica
•Perdita di anidride carbonica:
– Processi fotosintetici
– Precipitazione di sali
– Agitazione delle acque
Anidride carbonica in acqua
• Proviene soprattutto da
– degradazione materiale organico
– attività metabolica notturna delle alghe
• Legge di Henry
[CO2(aq)] = KCO ·PCO =
• Ma CO2 reagisce con l’acqua!!
Solubilità dipende dal pH
2
2
Sebbene CO2 in acqua sia spesso rappresentato come H2CO3, la costante di
equilibrio della reazione CO2+H2O ↔ H2CO3 vale solo circa 2×10-3 a 25 ºC,
cosicché solo una piccola frazione di CO2 disciolto è presente come H2CO3.
Pertanto, il biossido di carbonio disciolto non ionizzato sarà indicato
semplicemente come CO2 che indicherà la totalità di CO2 molecolare disciolto e
H2CO3 indissociato.
Il sistema CO 2 /HCO 3− /CO 32− in acqua può essere descritto dalle equazioni:
CO 2 + H 2 O ↔ HCO 3− + H +
[H + ][HCO 3− ]
K a1 =
= 4.45 ×10 −7
[CO 2 ]
pK a1 = 6.35
HCO 3− ↔ CO 32− + H +
[H + ][CO 32− ]
−11
K a2 =
4.69
10
=
×
[HCO 3− ]
pK a2 = 10.33
Introducendo le frazioni
[CO 2 ]
≡α
=
2−
−
[CO 2 ] + [HCO 3 ] + [CO 3 ]
α CO 2
α HCO −
[HCO 3− ]
≡β
=
2−
−
[CO 2 ] + [HCO 3 ] + [CO 3 ]
α CO 2−
[CO 32− ]
=
≡γ
2−
−
[CO 2 ] + [HCO 3 ] + [CO 3 ]
3
3
Riscriviamo le costanti di equilibrio come
β
α
+ γ
K a2 = [H ]
β
K a1 = [H + ]
che assieme alla condizione
α +β + γ =1
K a1 − [H + ] 0 α 0
+
0
K a2 − [H ] β = 0
γ 1
1
1
1
Pertanto si ottiene:
K a2 K a1
γ=
K a2 K a1 + [H + ](K a1 + [H + ])
[H + ](K a1 + [H + ])
K a2 K a1
⋅
β=
+
K a2 (K a1 + [H ]) K a2 K a1 + [H + ](K a1 + [H + ])
[H + ]K a1
β=
K a2 K a1 + [H + ](K a1 + [H + ])
[H + ]2
α=
K a2 K a1 + [H + ](K a1 + [H + ])
grafico
Dal calcolo segue che:
•Per pH significativamente inferiori a pKa1, αCO2 è essenzialmente 1;
•Quando pH=pKa1, αCO2= αHCO3-;
•Quando pH=1/2(pKa1+pKa2), αHCO3- è al suo massimo valore di 0.98;
•Quando pH=pKa2, αHCO3-= αCO3--;
•Per pH significativamente superiori a pKa2, αCO3-- è essenzialmente 1.
Il diagramma di distribuzione delle specie mostra che lo ione idrogeno
carbonato (bicarbonato, HCO3-) è la specie predominante nell’intervallo di
pH che caratterizza la maggioranza delle acque, mentre la CO2 predomina
nelle acque acide.
Alcalinità
• Capacità di un corpo d’acqua di
acquistare protoni
• Acque altamente alcaline spesso contengono
elevati livelli di solidi disciolti. Inadatta per i
consumi domestici
• I biologi usano l’alcalinità come misura della
fertilità dell’acqua
Alcalinità
• Specie responsabili dell’alcalinità:
–
–
–
–
HCO32CO3
OH
NH3 , basi coniugate acidi fosforico,
silicico e borico e di altri acidi organici
−
3
[alk] = [HCO ] + 2[CO
[alk]
carbonatic a
2−
3
= [HCO 3− ] + 2[CO 23 − ]
– Misura espressa in eq/L
+
] + [OH ] − [ H ]
-
Alcalinità e Basicità
• Elevata alcalinità elevata capacità di
accettare protoni
• Elevata basicità elevato pH
• Alcalinità proprietà capacitiva
• Basicità proprietà intensiva
Alcalinità e Basicità
• All’aumentare del pH aumenta SCO2 aum
[HCO3-] e [CO32-], ma non è così semplice…
• 1 L soluzione NaOH 10-3 M
– pH = 11
– [alk] = 10-3 eq/L
• 1 L soluzione NaHCO3 10-1 M
– pH = 8,34
– [alk] = 10-1 eq/L
Alcalinità e Basicità
• Acque con la stessa alcalinità non
necessariamente hanno le stesse [HCO3 ]
e [CO32-] dipende dal pH!
• Acqua naturale a pH 7 e [alk] 10-3 eq/L
• Acqua naturale a pH 10 e [alk] 10-3 eq/L
Acqua naturale a pH 10, [alk] 10-3 eq/L
2−
3
K a2 9×10 −4
2−
3
4,69 ×9
−5
× 10
1+ 2 ×0,469
[CO ] = [H + ] +2K = 1×10 −10 +2×4,69 ×10 −11
a2
•
[CO ] =
•
[HCO ] = 9 × 10
•
4,69 ×10 −11 ×9×10 −4
3
[CO 2 ] =
-4
= 2,18 × 10 − 4 M
2−
− 2[CO 3 ]
[H + ][HCO 3− ]
K a1
=
= 4,64 × 10
10 −10 × 4,64 ×10 −3
4,45 ×10 −7
−4
M
= 1,04 × 10 −6 M
Impossibile visualizzare l'immagine. La memoria del computer potrebbe essere insufficiente per aprire l'immagine oppure l'immagine potrebbe essere danneggiata. Riavviare il computer e aprire di nuovo il file. Se viene visualizzata di nuovo la x rossa, potrebbe essere necessario eliminare l'immagine e inserirla di nuovo.
Acqua pura in equilibrio con atmosfera
non inquinata
CO 2 + H 2 O ↔ HCO 3− + H +
[H + ][HCO 3− ]
K a1 =
= 4,45 × 10 −7
[CO 2 ]
[H + ] = [HCO 3− ] = 4,45 × 10 −7 × 1,146 × 10 -5
[H + ] = 2,25 × 10 -6
pH = 5,65
SCO 2 = [CO 2 (aq)] + [HCO 3− ] + [CO 23 − ]
= 1,146 × 10 −5 + 2,25 × 10 -6 = SCO 2 = 1,37 × 10 −5 mol/L
Acqua naturale in equilibrio con
atmosfera non inquinata
CO 2 + H 2 O ↔ HCO 3− + H + ; K a1 = 4,45 × 10 −7
[CO 2 ] = 1,146 × 10 -5 ; [HCO 3− ] = 10 -3
K a1 × [CO 2 ]
=
[H ] =
−
[HCO 3 ]
+
4,45 ×10 −7 ×1,146 ×10 -5
10 -3
= 5,1 × 10 - 9
pH = 8,29
SCO 2 = [CO 2 (aq)] + [HCO 3− ] + [CO 23 − ]
= 1,146 × 10 −5 + 10 -3 = SCO 2 = 10 −3 mol/L
Alcalinità e carbonio inorganico
disciolto in acqua
-
2-
• [C]=[CO2]+[HCO3 ]+[CO3 ]
• A parità di alcalinità dipende dal pH
[alk ] = 10 −3
[C] pH =7 = 2,25 × 10 −4
+ 1 × 10
[C] pH =10 = 0 + 2,18 × 10 −4
−3
+0
= 1,23 × 10 −3 M
+ 4,64 × 10
−4
= 6,82 × 10 − 4 M
pH influenza la quantità di carbonio acquatico
disponibile per usi fotosintetici
Alcalinità e Produttività
• L’alcalinità è usata anche come misura della
fertilità di un’acqua
• Funge da riserva di carbonio inorganico e fa da
supporto per la crescita della flora acquatica
Riconsiderando il valore di [CO2(aq)] a 25 ºC in equilibrio con aria contenente
350 ppm di CO2, ossia 1.146×10-5 mol L-1, possiamo calcolare il pH della
soluzione:
CO 2 + H 2 O ↔ HCO 3− + H +
[H + ][HCO3− ]
= 4.45 ×10 −7
K a1 =
[CO 2 ]
pK a1 = 6.35
[H + ] = [HCO 3− ] = (4.45 ×10 −7 ×1.146 ×10-5 )1/2
[H + ] = 2.25 ×10- 6
pH = 5.65
L’acqua pura in equilibrio con un’atmosfera non inquinata è
leggermente acida con un valore di pH poco più basso di 7.
ALCALINITA’ DELL’ACQUA
Alcalinità dell’acqua = capacità dell’acqua ad accettare ioni H+.
Acque altamente alcaline spesso contengono elevati livelli di solidi disciolti.
Questa caratteristica può essere dannosa per i consumi domestici.
Generalmente le specie basiche responsabili dell’alcalinità di un corpo d’acqua
sono: gli ioni bicarbonato, carbonato e idrossido, in quanto:
HCO3- + H+ → CO2 + H2O
CO3-- + H+ → HCO3OH- + H+ → H2O
Altre specie, di solito minori, che contribuiscono all’alcalinità sono
l’ammoniaca, e le basi coniugate degli acidi organici e degli acidi fosforico,
silicico e borico.
L’equazione completa per l’alcalinità in un mezzo acquoso in cui le uniche specie che
contribuiscono sono HCO3-, CO3-- e OH- è
[alc]= [HCO3-]+[CO3--]+[OH-]-[H+]
A cui si toglie l’eventuale [H+] presente.
L’alcalinità generalmente si esprime come alcalinità alla fenolftaleina corrispondente
alla titolazione con acido fino a pH 8.3, per il quale la specie ione bicarbonato è
predominante.
L’alcalinità totale corrisponde alla titolazione con acido fino al viraggio del metilarancio
(pH=4.3), dove sia il carbonato che il bicarbonato sono convertite in CO2.
E’ importante distinguere tra alta basicità (alto pH) e alta alcalinità (alta capacità di
accettare H+). Ad esempio:
1) Un litro di soluzione 10-3 M di NaOH (pH 11) neutralizza 10-3 moli di acido.
2) Un litro di soluzione 0.1 M di NaHCO3 (pH 8.34) neutralizza 0.1 moli di acido.
L’alcalinità di 2) è 100 volte maggior di 1)
In termini ingegneristici, l’alcalinità si esprime spesso in mg/L di CaCO3, unità
basata sulla reazione di neutralizzazione
CaCO3+2H+Ca2++CO2+H2O.
Più comunemente [alc] si esprime in equivalenti/L cioè in numero di moli di H+
neutralizzate da un litro di soluzione alcalina.
Di norma le acque naturali hanno una alcalinità vicina a 0.001 eq/L ed il contributo
delle varie specie ad [alc] dipende dal pH.
[alc]= [HCO3-]+[CO3--]+[OH-]-[H+]
A pH=7 possiamo trascurare [OH-] e dal grafico si vede che [HCO3-]>>[CO3--]. Allora
[HCO3-]=0.001 M e l’espressione
Quasi 20 volte maggiore
del valore che si ha per
+
−
[H ][HCO 3 ]
un acqua in equilibrio
= 4.45 ×10 −7
K a1 =
con l’aria. Si ottiene
[CO 2 ]
dalla degradazione
+
−
−7
−3
[H ][HCO 3 ] 10 ×10
−4
batteria nell’acqua e nei
=
=
×
[CO 2 ] =
2
.
25
10
sedimenti.
K a1
4.45 ×10 −7
A pH=10 l’alcalinità (notare il 2 e la mancanza di [H+])
[alc]= [HCO3-]+2[CO3--]+[OH-]=0.001 eq/L
può essere decomposta nel modo seguente:
[OH − ] = 1× 10 −4
[HCO 3− ] + 2[CO 32− ] = 10 −3 − 10 − 4 = 9 × 10 − 4
[HCO 3− ] = 9 × 10 − 4 − 2[CO 32− ]
[CO 32− ][H + ] = K a2 [HCO 3− ] = K a2 (9 × 10 − 4 − 2[CO 32− ])
K a2 9 ×10 − 4
4.69 ×10 −11 × 9 ×10 − 4
[CO ] = +
=
[H ] + 2K a2 1× 10 −10 + 2 × 4.69 × 10 −11
2−
3
[CO 32− ] =
4.69 × 9
×10 −5 = 2.18 ×10 − 4
1 + 2 × 0.469
per [OH − ] ⇒ 1×10 −4
eq/L
Ricapitolando per [HCO 3− ] ⇒ 4.64 ×10 − 4 eq/L
per [CO 32− ] ⇒ 4.36 ×10 − 4 eq/L
Contributi all’alcalinità
Carbonio inorganico disciolto e alcalinità
I calcoli appena sviluppati dimostrano che la concentrazione totale di carbonio
inorganico disciolto
[C]=[CO2]+[HCO3-]+[CO3--]
varia col pH. Infatti per la medesima alcalinità di 1x10-3 eq/L si ha
[C]pH =7 = 2.25 ×10 −4 + 1×10 −3 + 0 = 1.23 ×10 −3 M
[C]pH =10 = 0 + 2.18 ×10 − 4 + 4.64 ×10 − 4 = 6.82 ×10 − 4 M
Cioè a pH=10 la concentrazione di carbonio inorganico disciolto è solo circa la
metà rispetto a quello che si ha a pH=7.
Questo significa che a parità di alcalinità il pH influenza la quantità di carbonio
acquatico disponibile per usi fotosintetici.
Quando il carbonio inorganico disciolto è utilizzato per produrre biomassa,
attraverso la reazione:
HCO3-+H2O+ hν→{CH2O}+O2+OHil pH dell’acqua aumenta.
La quantità di carbonio che può essere consumata prima che l’acqua diventi
troppo basica per consentire la riproduzione algale, è proporzionale all’alcalinità.
Passando da pH=7 a pH=10 la quantità di Carbonio inorganico disciolto consumata
da 1 L d’acqua avente alcalinità 0.001 eq/L è pari a
1.22x10-3 mol – 0.682x10-3 mol = 0.54x10-3 mol
che corrisponde a 16 mg/L di biomassa prodotta per ogni litro di acqua.
Assumendo che non entri nuova CO2 nel sistema, per una stessa variazione di pH
una maggiore alcalinità produce più biomassa, una minore alcalinità produce
meno biomassa.
Materiale
organico
POM (zooplankton, fitoplankton, batteri)
DOM (acidi umici, fulvici, carboidrati, acidi grassi, amminoacidi)
Sostanza Labile (facilmente aggredibile dai microorganismi)
Sostanza Refrattaria (non subisce degradazione)
Minore è la velocità di sedimentazione maggiore è la frazione refrattaria
Filtrazione: tipi di filtri e problematiche
In generale i fosfati a catena sono dei buoni agenti complessanti e formano
complessi stabili persino con gli ioni dei metalli alcalini.
La più importante classe di agenti complessanti naturali è costituita dalle
sostanze umiche.
Le sostanze umiche sono sostanze resistenti alla degradazione che si
formano durante la decomposizione della vegetazione, che avviene
nel suolo, nei sedimenti marci, torba, lignite, carbone o in qualsiasi
altro luogo in cui grandi quantità di vegetazione si siano decomposte.
Comunemente, vengono classificate in base alla solubilità: si estraggono
con una base forte, poi, la soluzione risultante viene acidificata, i
prodotti sono:
a) Umina residuo vegetale non estraibile;
b) Acido umico un materiale organico che precipita dopo acidificazione;
c) Acido fulvico un materiale organico che resta in soluzione dopo
acidificazione.
Le sostanze umiche sono macromolecole polielettrolitiche ad alto peso
molecolare.
Struttura ipotetica dell’acido fulvico
O
OH
OH
O
C O C
H C
C
H
H
H C
C
OH
H
O
OH
O
HO C
C OH
O CH3 O
H
H
C
C
C
CH2
C
OH
H
OH
H C H C OH
H
OH O
Una delle più importanti qualità ambientali delle sostanze umiche è la loro
capacità di legare gli ioni metallici.
O
O
C
O
O
Me
C
C
O
O
Me
C
O
Me
O
Si legano fortemente con Fe e Al, debolmente con Mg, con forza intermedia con
Ni, Pb, Ca e Zn.
Il ruolo dei complessi solubili di acidi fulvici e metalli non è ancora ben noto.
Molto probabilmente portano in soluzione alcuni dei metalli di transizione
biologicamente più importanti, in particolare sono coinvolti nella
solubilizzazione e nel trasporto del Fe.
Le sostanze umiche insolubili scambiano efficacemente i cationi con l’acqua e
possono accumulare grandi quantità di metalli.
Durante i processi di disinfezione per clorazione delle acque municipali si
possono formare per reazione tra cloro e sostanze umiche i trialometani (THM)
Come il cloroformio e il dibromoclorometano, che sono sostanze sospette
cancerogene. La loro formazione può essere ridotta rimuovendo la maggior
quantità di sostanza umica prima della clorazione.