Chimica Organica II
Reazioni di eliminazione
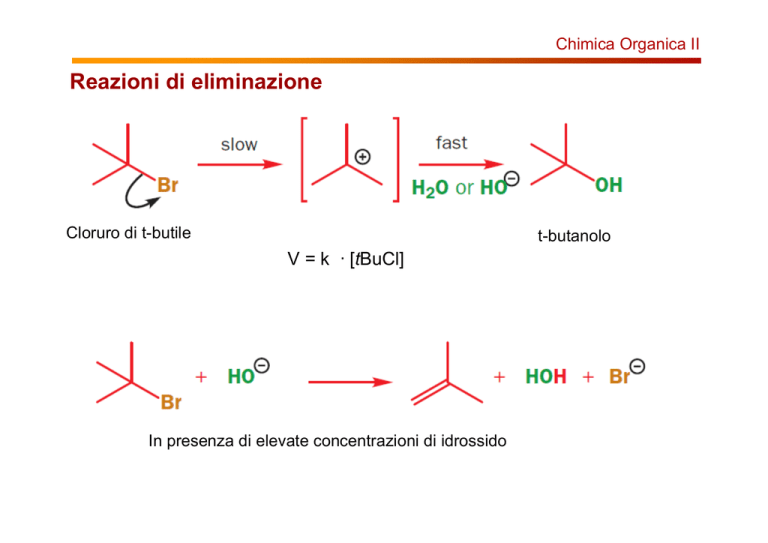
Cloruro di t-butile
t-butanolo
V = k · [tBuCl]
In presenza di elevate concentrazioni di idrossido
Chimica Organica II
Reazione di eliminazione
Lo ione idrossido non agisce da nucleofilo ma da base
Se il nucleofilo presente è così poco reattivo fa non attaccare il carbocatione,
una base può strappare il protone e produrre un’eliminazione
Chimica Organica II
Sostituzione o eliminazione
Basicità
Una base debole favorisce la sostituzione
I nucleofili duri favorisco l’eliminazione
Una base forte favorisce l’eliminazione
Chimica Organica II
Sostituzione o eliminazione
Ingombro sterico
Un nucleofilo piccolo
favorisce la sostituzione
Un nucleofilo grande
favorisce l’eliminazione
Chimica Organica II
Sostituzione o eliminazione
Temperatura
Nu
X
Nu
H
H
∆S ~ 0
X
X
B
H
BH+
Aumentare la temperatura favorisce l’eliminazione
X
∆S > 0
Chimica Organica II
Meccanismi E1 ed E2
V = k[RX]
Stadio lento
V = k[B][RX]
Basi concentrate e
basi forti favoriscono
il meccanismo E2
Chimica Organica II
Basi forti
OH
RO
O
Basi forti, nucleofili
Basi forti, cattivi nucleofili
Chimica Organica II
Il substrato
Il meccanismo E1 richiede la
formazione di un carbocatione: la
reazione è favorita da quei substrati
che formano un catione stabile.
Chimica Organica II
Il solvente
Il meccanismo E1 richiede la formazione di un carbocatione: la reazione è favorita da solventi
polari che stabilizzano la carica.
Molto efficaci sono le eliminazioni in alcoli con catalizzatori acidi (disidratazione)
Chimica Organica II
Il gruppo uscente
Sono buoni gruppi uscenti alogenuri, alcoli protonati (condizioni acide), sali di ammonio
quaternario, tosilati e mesilati.
Il gruppo OH (ossidrile) non è mai un buon gruppo uscente: gli alcoli primari devono essere
convertiti in tosilati o mesilati per subire sostituzione.
Chimica Organica II
Stereoselettività e regioselettività
Chimica Organica II
Stereoselettività delle reazioni E1
Nelle
Nellereazioni
reazioniE1
E1sisiforma
forma
preferenzialmente
il
prodotto
preferenzialmente il prodottoEE(trans)
(trans)
Chimica Organica II
Regioselettività delle reazioni E1
Nelle
Nellereazioni
reazioniE1
E1sisiforma
forma
preferenzialmente
preferenzialmenteilil
prodotto
prodottopiù
piùsostituito
sostituito
Chimica Organica II
Stabilità degli alcheni
Iperconiugazione
Chimica Organica II
Stereoselettività delle reazioni E2
σ
X
B
H
B
X
H σ∗
L’idrogeno e il gruppo uscente devono essere in conformazione anti-peripiana
Chimica Organica II
Stereoselettività delle reazioni E2
Reazioni stereospecifiche, da ogni reagente si ottiene un solo prodotto
Chimica Organica II
Stereoselettività delle reazioni E2
Cicloesani
La conformazione antiperiplanare si raggiunge solo con il gruppo uscente in posizione assiale
veloce
lenta
Chimica Organica II
Preparazione di alchini
Chimica Organica II
Regioselettività delle reazioni E2
E1
E2
Chimica Organica II
Regioselettività delle reazioni E2
• Reazioni E1: alchene più sostituito
• Reazioni E2: alchene più sostituiro con basi piccole, alchene meno sostituito
con basi grandi
Chimica Organica II
Il meccanismo E1cB
• Base forte: E2
• Gruppo uscente: OH ???
Stadio lento
Chimica Organica II
Il meccanismo E1cB
•
Ci può essere E1cB quando la formazione di un anione subsisce
qualche effetto stabilizzante.
•
E’ probabile che ci sia E1cBquando il prodotto è coniugato
Chimica Organica II
Il meccanismo E1cB
V = k[B][RX]
Chimica Organica II
Eliminazioni