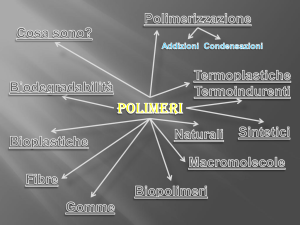
POLIMERI
•
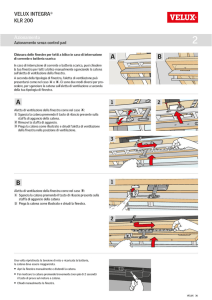
Tutti i composti che hanno come caratteristica la grande dimensione molecolare sono
detti composti macromolecolari o macromolecole.
•
Le macromolecole possono generalmente essere sezionate in unità più piccole delle
quali sono costituite: la piccola unità che reagisce iterativamente con se stessa per
dare la macromolecola è chiamata monomero e la grande molecola che si forma da
queste unità è conosciuta come polimero.
I polimeri formati da più di un tipo di unità ripetitiva sono chiamati copolimeri.
•
•
•
•
I polimeri possono essere anche classificati in accordo con la struttura delle loro
molecole. Ad esempio, la gomma, la cellulosa, le proteine e gli acidi nucleici sono
tutti polimeri lineari: ciò sta a dire che lo scheletro della macromolecola consiste di
una lunga catena di monomeri tenuti insieme da legami covalenti.
In un polimero lineare, una volta formatasi la catena, subentrano vari tipi di
interazioni, quali i legami idrogeno nelle proteine e nei polisaccaridi e le interazioni
di van der Waals nelle catene idrocarburiche del caucciù, che contribuiscono a dare
alla macromolecola la sua forma complessiva.
Le lignine, invece, rappresentano un tipo diverso di polimeri, in cui sono presenti
legami covalenti addizionali tra le varie catene: i monomeri, in effetti, non solo
formano le lunghe catene polimeriche, ma scambiano anche legami covalenti tra
catene adiacenti. Tali polimeri sono noti come polimeri con legami trasversali
(cross-linked).
Macromolecole di importanza industriale
•
•
•
Fu solo agli inizi del ventesimo secolo che i chimici cominciarono volutamente a sintetizzare i
polimeri, progettando innanzitutto reazioni che permettessero il controllo del peso molecolare
medio della macromolecola, e quindi delle proprietà del materiale polimerico finale.
Un pioniere in questo campo fu il tedesco Hermann Staudinger che per primo comprese che il
controllo delle condizioni di polimerizzazione era essenziale per sintetizzare sostanze di una
qualche utilità. Per il suo lavoro in questo settore fu insignito del Premio Nobel per la chimica
nel 1953.
Nelle fasi iniziali, i chimici che lavoravano in questo settore tentarono di mimare le
macromolecole naturali: per esempio, la prima fibra di successo fu il nylon, una poliammide
creata nel 1930 dal chimico americano Wallace Carothers. La struttura del nylon somiglia a
quella di una proteina perché ha molti legami ammidici, ma è molto più regolare nella
ripetizione delle unità monomeriche.
Macromolecole naturali: la gomma e la
guttaperca
Il polimero che costituisce
il caucciù si rinviene in un
fluido (lattice) prodotto da
cellule che sono al di sotto
della corteccia dell’albero.
Il lattice si ricava per
incisione della corteccia e
l’Hevea brasiliensis lo
produce così rapidamente
che la stessa pianta può
essere incisa per la raccolta
anche ogni paio di giorni.
Un altro polimero,
isomero del caucciù,
costituito anch’esso
di unità di isoprene
ma con doppi legami
trans, è la
guttaperca. Essa si
ottiene da piante del
genere Dichopsis che
sono anche presenti
nel sud-est dell’Asia
ed ha proprietà
totalmente diverse da
quelle della gomma.
Formule di struttura di alcuni polimeri e dei monomeri corrispondenti
Proprietà particolari delle grandi
molecole
• Il peso molecolare, naturalmente, riflette le dimensioni molecolari: le
molecole di un polimero devono raggiungere una certa dimensione
minima, prima che si possano avere quelle interazioni che sono importanti
nel conferire determinate proprietà al composto. Queste interazioni
possono aver luogo fra parti diverse della stessa molecola o fra molecole
diverse.
• I polimeri possono esistere come stereoisomeri con stereochimica
differente sui doppi legami o sugli atomi di carbonio tetraedrici.
• Un dato polimero può anche esistere in un grande numero di isomeri
conformazionali che si producono dalla libera rotazione degli atomi che
formano lo scheletro della catena.
Ancora, fra le proprietà più importanti di un polimero, ai fini
delle applicazioni pratiche, è il suo comportamento alle diverse
temperature.
elastomeri, materie plastiche
fibre
La regolarità stereochimica nelle strutture polimeriche
Un polimero può esistere anche in forme fisiche
diverse
al
variare
della
temperatura:
• Cristallino
• Vetroso
temperatura di fusione
Tg: temperatura di transizione vetrosa
Meccanismi di polimerizzazione
Le reazioni che danno origine ai polimeri
sono raggruppabili in due classi principali:
• la polimerizzazione per crescita a catena
• la polimerizzazione per crescita a stadi
polimerizzazione per crescita a
catena
• Nella polimerizzazione per crescita a catena si forma inizialmente
un intermedio reattivo che reagisce velocemente con una molecola
di monomero per dare un nuovo intermedio reattivo che, a sua
volta, reagisce con un’ulteriore molecola monomerica e così via. Il
monomero si consuma rapidamente e si addiziona di continuo a
una catena che diventa via via più lunga, avendo ogni volta
all’estremità un nuovo centro reattivo grazie al quale la reazione si
evolve fino a che tutte le molecole monomeriche hanno reagito, o
fino a che il centro reattivo viene distrutto da una qualche reazione
di terminazione.
• Le reazioni di polimerizzazione per crescita a catena danno
polimeri di addizione, così chiamati perché sono generati da un
processo iterativo di addizione di una molecola monomerica alla
matrice polimerica in crescita.
• ADDIZIONI RADICALICHE, ANIONICHE, CATIONICHE
Addizione RADICALICA
• Un tipico esempio di reazione di polimerizzazione radicalica è
la polimerizzazione dello stirene che si effettua in presenza di
una piccola quantità di perossido di benzoile.
La reazione ha luogo in tre stadi: nel primo, che è quello di inizio, il
perossido di benzoile si dissocia in due benzoilossi radicali, elettrofili,
reagiscono con gli elettroni л del doppio legame, generando un nuovo
radicale più stabile, il radicale benzilico.
Quest’ultimo si lega ad un’altra molecola di stirene, generando così
un ulteriore intermedio radicalico.
Ogni nuovo radicale continua a reagire con una molecola
monomerica, in una serie di passaggi che costituiscono lo stadio detto
di propagazione della catena. La crescita della catena di polistirene è
veloce ed è stato calcolato che, approssimativamente, in un secondo si
addizionano alla catena ben 1500 unità monomeriche.
La reazione continua fino a quando tutte le molecole monomeriche hanno
reagito, o fino a quando l’intermedio radicalico viene distrutto da una delle
tante reazioni che impediscono la formazione di altre specie reattive e
costituiscono, quindi, lo stadio di terminazione. La combinazione di due
radicali blocca il processo di polimerizzazione: la combinazione di due
radicali polistirenici fa sì che molte catene di polistirene interrompano la loro
crescita, in quanto viene prodotta una specie priva di siti reattivi, chiamata
polimero “morto”.
Il radicale polimerico può anche strappare un atomo di idrogeno da
un’altra catena, formando così un nuovo radicale: reazione di
trasferimento di catena.
Questo nuovo radicale si trova nel mezzo della catena, non alla fine, e
reagendo con una ulteriore unità monomerica dà luogo a una
ramificazione della catena stessa.
ADDIZIONI ANIONICHE
Alcune reazioni di polimerizzazione sono catalizzate da metalli alcalini o
da composti organometallici: in questi casi, la specie reattiva che
partecipa alla crescita della catena è un carbanione. Il 2-fenilpropene,
comunemente detto α-metilstirene, polimerizza attraverso una reazione
di questo tipo.
La reazione ha luogo in tetraidrofurano ed è catalizzata dal
radicaleanione del naftalene che trasferisce un elettrone (e la relativa
carica negativa) all’α-metilstirene.
Si noti che all’alchene è stato addizionato un elettrone: per chiarezza
quest’elettrone e i due elettroni del legame л sono mostrati come se fossero
localizzati, in modo da formare nel radicale-anione un centro radicalico e un
centro carbanionico distinti. Due radicali si combinano dando luogo ad un
dianone.
La catena cresce da
entrambi le
estremità,
fin quando si
aggiunge alla
miscela di reazione
un reagente che
reagisce con un
carbanione.
ADDIZIONI CATIONICHE
Gli atomi di ossigeno di altre molecole eteree si comportano poi da nucleofili, in reazioni
di sostituzione nucleofila bimolecolare (SN2), e sono convertiti, l’uno dopo l’altro, in
intermedi reattivi che promuovono la propagazione della reazione a catena.
La polimerizzazione per crescita a stadi: polimeri di
condensazione
A. Le poliammidi
B. I poliesteri
C. I poliuretani
D. Polimeri prodotti da reazioni di condensazione
con aldeide formica: Bakelite.
E. Le resine epossidiche
Questo tipo di resine si ottiene mescolando due soluzioni, una di un polimero che
contiene anelli ossiranici, in grado di formarel legami trasversali tra le catene
polimeriche quando reagiranno con un nucleofilo, e una seconda che, contenendo un
composto poliamminico che funge da reagente nucleofilo, inizia il processo e forma
parte dei legami trasversali. Il componente polimerico contiene gruppi che formano
legami idrogeno e si coordinano strettamente con le superfici di vetro, di ceramica e di
metallo: perciò le resine epossidiche aderiscono perfettamente a tali superfici.
I legami trasversali nascono quando un gruppo amminico reagisce con gli ossirani
presenti all’estremità delle catene polimeriche. I legami trasversali sono perciò costituiti
dai gruppi amminici o dagli ioni alcossido che vengono generati per apertura dell’anello
ossiranico. Proprio perché la reticolazione avviene velocemente, l’ammina e il polimero
lineare vanno mescolati solo immediatamente prima di essere applicati alle superfici da
incollare tra loro. Il legame è così forte che gli oggetti riparati spesso si rompono in altre
parti, più che spezzarsi nel punto in cui è stata fatta la riparazione.